Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die anionische Polymerisation eines amphiphilen Copolymer zur Herstellung von Blockcopolymermicellen Stabilisiert durch π-π-Stapelwechselwirkungen
In diesem Artikel
Zusammenfassung
Die Schlüsselschritte der lebenden anionischen Polymerisation von Phenylglycidylether (PheGE) auf Methoxypolyethylenglykol (MPEG - b -PPheGE) beschrieben. Die resultierenden Blockcopolymermizellen (BCMs) wurden unter physiologisch relevanten Bedingungen wurde mit Doxorubicin 14% (wt%) und eine verzögerte Freisetzung des Arzneimittels über 4 Tage geladen erhalten.
Zusammenfassung
In dieser Studie wurde ein amphiphiles Copolymer , das einen Kern bildenden Block mit Phenylgruppen enthält wurde durch lebende anionische Polymerisation von Phenylglycidylether (PheGE) auf Methoxypolyethylenglykol (MPEG - b -PPheGE) synthetisiert. Charakterisierung des Copolymers ergab eine enge Molekularverteilung (PDI <1,03) und bestätigt den Polymerisationsgrad von mPEG 122 - b - (PheGE) 15. Die kritische Mizellenkonzentration des Copolymers wurde unter Verwendung eines etablierten Fluoreszenzmethode mit dem Aggregationsverhalten durch dynamische Lichtstreuung, und Transmissionselektronenmikroskopie bewertet ausgewertet. Das Potential des Copolymers zur Verwendung in Drug - Delivery - Anwendungen wurde in einer vorläufigen Weise bewertet , einschließlich In - vitro - Biokompatibilität, Beladung und Freisetzung des hydrophoben Antikrebsmittel Doxorubicin (DOX). Eine stabile Mizellen Formulierung von DOX wurde mit Wirkstoffbeladung Ebenen bis vorbereitet auf 14% (wt%), Wirkstoffbeladung effici-Folien> 60% (w / w) und anhaltende Freisetzung des Arzneimittels über 4 Tage unter physiologisch relevanten Bedingungen (sauren und neutralen pH-Wert, Vorhandensein von Albumin). Die hohe Wirkstoffbeladung Niveau und mit verzögerter Freisetzung wird zur Stabilisierung der π-π-Wechselwirkungen zwischen DOX und dem Kern bildenden Block der Mizellen zurückgeführt.
Einleitung
In wässrigen Medien, montieren amphiphile Blockcopolymere nano-sized Blockcopolymermicellen (BCMs), die aus einem hydrophoben Kern, der von einer hydrophilen Schale oder corona umgeben zu bilden. Der Micellkern kann für den Einbau von hydrophoben Arzneimitteln als Reservoir dienen; während der hydrophile corona stellt eine Schnittstelle zwischen dem Kern und dem äußeren Medium. Poly (ethylenglykol) (PEG) und ihre Derivate sind eine der wichtigsten Klassen von Polymeren und eines der am häufigsten in der Arzneimittelformulierung verwendet. 1-3 BCMs bewährt haben dazu einen würdigen Arzneimittelabgabeplattform zu sein mit mehreren Formulierungen angewiesen Technologie , die jetzt im späten Stadium der klinischen Entwicklung. 4 Am häufigsten wird der hydrophobe Block des Copolymers aus Polycaprolacton, Poly (D, L-lactid), Poly (propylenoxid) oder Poly (β-benzyl-L-aspartat) besteht. 5 -9
Kataoka Gruppe untersucht kugelförmige Mizellen aus PEO - b gebildet -PBLA Und Poly (ethylenoxid) - b -. (Polyasparaginsäure-konjugierte Doxorubicin) für die Lieferung von Doxorubicin (DOX) 10,11 In ihren Berichten stellen sie fest, dass π-π - Wechselwirkungen vorwärts zwischen dem Polymer-konjugierten Medikament oder PBLA und frei DOX wirken, um die Micellkern was zu Erhöhungen von Wirkstoffbeladung und Retention zu stabilisieren. Nachgewiesen wird , dass die Kompatibilität oder Interaktionen zwischen einem Arzneimittel und dem Kern bildenden Block sind Determinanten von Key Performance bezogenen Parameter. 12 Zusätzlich zu DOX eine Reihe von Krebstherapeutika umfassen aromatische Ringe innerhalb ihrer Kernstruktur (zB Methotrexat, olaparib, SN -38).
Als Ergebnis besteht erhebliches Interesse an der Synthese von Copolymeren, die benzyl Ringe in ihren kernbildenden Blöcke aufweisen. Anionische Ringöffnungspolymerisation von PEG und seine Derivate ermöglichen die Kontrolle über das Molekulargewicht und führen in Materialien mit geringer Uneinheitlichkeit in guter Ausbeute. 13,14 Ethylene Oxid mit Phenylglycidylether (PheGE) oder Styroloxid (SO) kann (co) polymerisiert werden Blockcopolymere zu bilden , die Mizellen zur Solubilisierung von hydrophoben Arzneimitteln bilden. 15-18 Der vorliegende Bericht beschreibt die notwendigen Schritte für eine lebende anionische Polymerisation von Phenyl Glycidylether - Monomer auf mPEG-OH als Makroinitiator (Abbildung 1). Das resultierende Blockcopolymer und seine Aggregate werden dann in Bezug auf die Eigenschaften von Relevanz dadurch gekennzeichnet, Arzneimittelabgabe zu verwenden.
Access restricted. Please log in or start a trial to view this content.
Protokoll
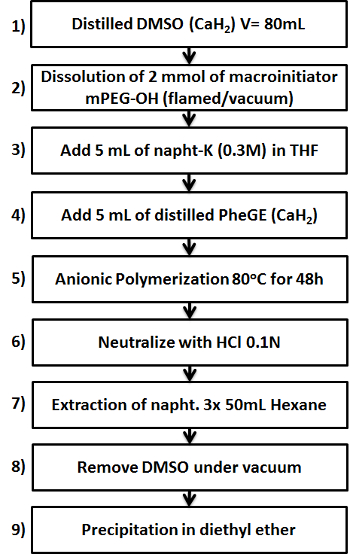
Abbildung 1. Schematische die neun wichtigsten Schritte bei der Herstellung des MPEG- b -PPheGE Copolymer zeigt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
1. Herstellung der Reagenzien unter trockenen Bedingungen
- Herstellung der Reagenzien.
- Wiegen 15 g mPEG-5K (M n = 5.400 g / mol, PDI 1,03) und bei 50 ° C in einem Ofen unter Vakuum für 48 Stunden vor der Verwendung.
- Dry 200 ml Dimethylsulfoxid (DMSO) über Calciumhydrid (CaH 2) (~ 1 g), unter Vakuum für 30 min, Spülung unter Argon und unter Rühren für 48 Stunden vor der Verwendung.
- Legen Sie 50 ml des PheGE Monomer in einem trockenen und sauberen Kolben (100 ml), fügen Sie 1 g CaH 2, Dichtung unter Vakuum für 15 Minuten auf Eis, Säuberung unter Argonund lassen Sie für 24 Stunden unter Argon vor der Verwendung zu rühren.
2. Herstellung des Kaliumnaphthalin
- Vorsichtig schneiden kleine Stücke Natrium (~ 1,5 g) mit Hexan getrocknet überschüssigem Mineralöl zu entfernen und in den Rundkolben, der Tetrahydrofuran (THF) (V = 500 ml), die hinzuzufügen.
HINWEIS: Die Stücke von Natrium darf nicht für lange der Luft ausgesetzt werden, wegen Brandgefahr. - In Benzophenon (~ 5 g), Spülung mit Argon und dichten den Rundkolben (2 Hälse) mit Glasstopfen.
- Nach Rühren unter Argon 24 h, schließen Sie den Rundkolben in eine Destillationsapparatur (Abbildung 2), destillieren die dunkle Lösung unter Argon unter Rückfluß (dh Rückfluß etwa 2 Stunden Zeit , nachdem die Lösung wird blau). Beginnen Sie das gewünschte Volumen ~ 150 ml THF zu sammeln, indem Sie das linke Ventil geschlossen (in der Mitte der Destillationsapparatur gefunden).
HINWEIS: Wenn diese Lösung nicht blau drehen, stoppen Sie die destillierenlation, kühlen bei Raumtemperatur (RT) nach unten und mehr Benzophenon oder Natrium und starten Sie den Destillation hinzuzufügen. Dies ist ein Indiz dafür, dass THF noch Wasser enthält. - In einem trockenen Erlenmeyerkolben mit destilliertem THF (v = 100 ml) und 3,9 g Naphthalin aufzulösen.
HINWEIS: Stoppen Sie die Destillation, Kühlung bei RT nach unten und öffnen Sie das richtige Ventil das Volumen an THF zu übertragen. - mit dem Naphthalin (Endkonzentration ~ 0,3 mol / L) Wie unter Ziffer 2.1 beschrieben, schneiden kleine Stücke von Kalium (1,1 g) und zu der Lösung hinzuzufügen. Verschließen Sie den Erlenmeyer mit einem Spüladapter (T) (on / off) mit einem Septum an der Spitze und spülen mit Argon.
- Nach Rühren unter Argon 24 h, beobachten die resultierende Lösung des Kaliumnaphthalin Basis als eine homogene dunkelgrüne Farbe.
- Unter inerten Bedingungen, ein 5 ml-Aliquot der basischen Lösung aus dem Kolben mit Hilfe einer Spritze zu entfernen und zu 10 ml destilliertem Wasser. Anschließend fügen Sie 1-2 Tropfen Phenolphthalein-Indikator zu dieser Lösung,das wird die Lösung eine pinkfarbene Farbe.
- Verwenden einer Bürette die Kaliumnaphthalin Lösung mit einer Standard-Salzsäurelösung titriert (0,1 N), bis die Lösung farblos macht.
3. Materialien und die notwendigen Vorsichtsmaßnahmen für eine wirksame lebende anionische Polymerisation
- System Argon / Vakuumverteiler.
HINWEIS: Wie in Abbildung 2 beschrieben, wird ein Doppelglasblock mit Glashohl Absperrhähne verwendet , um zwischen Argon Lieferung und Vakuumbedingungen in den Gläsern.- Schließen Sie den Tank von Argon (mit Manometer) zu einem trockenen Trockensäule und an der Verteilerleitung inerten Gummischlauch mit. Am anderen Ende der Argon Linie, schließen ein Sprudler (mit Mineralöl).
- Um den Glas Absperrhähne verbinden flexible inerte Röhren und Nadeln. Um die andere Leitung des Verteilers, schließen Sie eine Glasfalle in einem kalten Dewar-Gefäß getaucht (gefüllt mit Eis / Wasser oder flüssigem Stickstoff) zu einer Hochvakuumpumpe.
- Vorrichtung zur Destillation von Monomeren und DMSO.
HINWEIS: Eine bequeme (dh alle in einem) Vorrichtung zur Hochvakuumdestillation verwendet wird (Abbildung 2). Die trockene Glas wird mit Hochvakuumventile und Einbau-Kondensatoren mit einem inneren Kühlkopf aus.- Verbinden Wasserströmung durch den Einlass (A) und Ausgang (B) der Kühleinheit (Buchstabe). Schließen Sie das andere Ein- / Ausgang (C) zum dualen Verteiler für Argon / Vakuum. Hinzufügen und Dichtung ein Septum (Metalldrähte) bei der Lieferung / Entnahmeöffnung und schließen Sie eine Kanüle aus rostfreiem Stahl für die Übertragung von Luft empfindliche Flüssigkeiten (D) (Oben / Schleife).
- Vor der Polymerisation abzudestillieren PheGE und DMSO auf halbkugeligen Heizmäntel bei 100 ° C und 70 ° C, jeweils für 2 Stunden unter Vakuum unter Rühren. Der Siedepunkt des PheGE Monomer beträgt 254 ° C, während der Siedepunkt für DMSO beträgt 189 ° C bei (1 atm).
- Glaswaren für anionische polymerizatIon.
- Zusätzlich zu dem Destillationssystem, verwenden Sie nur Hochvakuum beständige Glaswaren einschließlich Rundkolben (vom Hersteller zertifiziert), Messzylinder (für die Übertragung von Volumina Lösungsmittel, Base und Monomere), Kanülen, Septen und Metalldrähte der Septen zu versiegeln.
HINWEIS: Für lebende Polymerisation, Wärme sorgfältig (unter Vakuum) und abkühlen alle Gläser unter Argon-Strom vor der Verwendung. Halten Sie die Heißluftpistole in einem Abstand ~ 10 cm von der Glaswaren.
- Zusätzlich zu dem Destillationssystem, verwenden Sie nur Hochvakuum beständige Glaswaren einschließlich Rundkolben (vom Hersteller zertifiziert), Messzylinder (für die Übertragung von Volumina Lösungsmittel, Base und Monomere), Kanülen, Septen und Metalldrähte der Septen zu versiegeln.
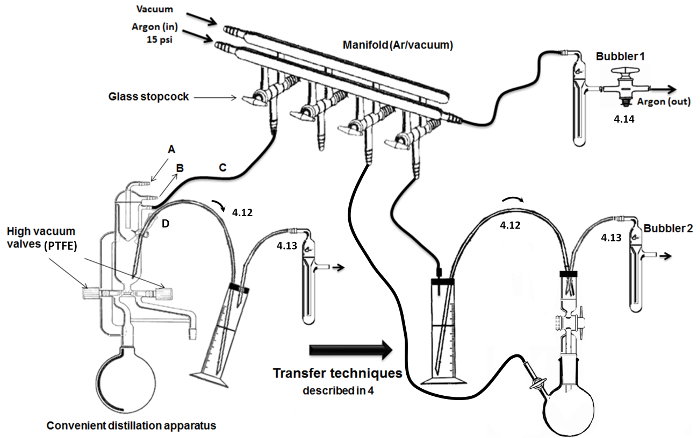
Abbildung 2. Montage und Schlüssel Destillation / Transferschritte. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
4. Beschreibung der wichtigsten Schritte der Lebens- anionische Polymerisation: Destillation und Übertragung
- Wiegen mPEG-5K (2 mmol, 10 g) in einer trockenen flask / Schlenk (Backofen), die einen Rührstab und dichten den Spüladapter (T) (on / off) mit einem Septum an der Spitze.
- Der Kolben wird an den Verteiler und zu spülen, Kolben für 2-3 min mit Argon spült. Drehen das Ventil in die Vakuumstellung den Kolben zu spülen.
- Drehen Sie den Kolben von Hand und trocknen Sie das Reaktionsgefäß homogen mit einem Fön (Heißluftfön) bis mPEG-5K schmilzt.
HINWEIS: Halten Sie die Heißluftpistole in einem Abstand ~ 10 cm aus dem Kolben. - Nach 1 min, das Vakuum brechen, indem Sie das Ventil auf dem Verteiler in Richtung der Argon Position mit mehreren schnellen Schnappschüsse drehen.
HINWEIS: Eine kontinuierliche Argonstrom hat in Wäscher zu beobachten. Wenn die Strömung kontinuierlich ist, bleibt das Ventil auf der Argonposition. Wiederholen Heiz- und Kühlschritte zweimal alle Spuren von Feuchtigkeit zu entfernen. - Halten Sie das polymere Makroinitiator unter Vakuum für ~ 2 h und unter Argon, bevor die Reaktion beginnt.
- Berg zwei Hochvakuumdestillationsvorrichtungen unter der Haube (Abbure 2); eine für die Destillation von DMSO und eine für die Destillation des Monomers (PheGE).
- Verbinden der separaten Kolben, die das DMSO und Monomer zu den beiden Vorrichtungen und installieren jeweils auf einem halbkugeligen Heizmantel (oder in einem Ölbad). Schließen Sie kaltes Wasser an die Spitze der Vorrichtung (in / out) und dem Verteiler (Argon / Vakuum).
- Stellen Sie sicher, dass jedes Gerät sicher und gut verschlossen. Engage das Vakuum über das Ventil.
. HINWEIS: Wie in Schritt 3.3 beschrieben, wiederholen Heiz- und Kühlschritte zweimal alle Spuren von Feuchtigkeit zu entfernen. - Stellen Sie die Heizung über einen Temperaturregler und starten Sie die Lösungen gerührt wurde. Nach 2 Stunden der Zirkulation / Destillation von DMSO, schließen Sie das Hochvakuumventil (in der Mitte der Destillationsapparatur gefunden) etwa 20 ml Lösung zu sammeln (das Innere der Vorrichtung zu waschen). Dann lassen Sie den Anteil in den Kolben und wiederholen Sie den Vorgang noch einmal die Reinheit der gewünschten Fraktion, um sicherzustellen, dass cspäter ollected.
- Heizen Sie den Kolben, der das mPEG-5K (unter Vakuum) mit dem Heißluftfön bis das Polymer (mPEG-5K) enthält, schmilzt. Spülen Sie wieder mit Argon.
HINWEIS: Das Verfahren zur Auflösung nach der Übertragung des DMSO helfen. - Nach 2 Stunden, schließen Sie das Volumen des Lösungsmittels (V DMSO = ~ 100 ml) , um das Hochvakuumventil und zu sammeln. Heizung ausschalten und das Vakuum brechen aus dem Verteiler. Release Argon (durch Schnappverschlüsse) in die Kammer wie oben beschrieben.
- Unter einem positiven Druck von Argon (am Hahn der Vorrichtung halten) zu einem Meßzylinder einer Seite der Kanüle angeschlossen oder direkt in den Kolben die mPEG-5K, die (wenn die Destillationsvorrichtung weist Graduierung) und tauchen das andere Ende vorsichtig in die frisch destillierte Fraktion.
- Verwendung von Argondruck treiben die DMSO durch die Kanüle in den Reaktionskolben. Schließen Sie einen zusätzlichen Wäscher in den Kolben (oder Zylinder, wenn für die Messung erforderlich), schließen Sie den Glashahn verbunden zu the Bubbler auf der gegenüberliegenden Seite des Verteilers.
HINWEIS: Wenn eine Seite einer Kanüle für die Übertragung entfernt wird, stellen Sie sicher, dass die positiven Argondruck angelegt wird. - Zur Vermeidung von Unfällen durch Argondruck verursacht, öffnen Sie das Glashahn für 1-2 sec und wieder schließen, den Fluss von DMSO, um fortzufahren (wiederholt einmal pro 0,5 min) bis zur vollständigen Übertragung abgeschlossen ist. Öffnen Sie den Hahn, wenn Sie fertig.
HINWEIS: Das gleiche Verfahren ist nun für die Destillation und Sammlung des Monomers folgen. Das Lösungsmittel und das Monomer kann nicht zur gleichen Zeit gesammelt werden. - Transfer 5 ml von 0,3 M Kalium-Naphthalin über Kanülierung in einem Meßzylinder durch ein Septum mit Kanüle eingeführt abgedichtet (loop).
HINWEIS: Der gleiche Vorsichtsmaßnahme, wie in Anmerkung 4.13 beschrieben. Positivem Argondruck muß zuerst aus dem Naphthalin Kalium Kolben auf den Zylinder und dann von dem Zylinder in den Reaktionskolben aufrechterhalten werden, Luft / Wasser-Verunreinigung zu vermeiden. - Legen Sie eine andere Nadel aus dem manifold in den Zylinder (Argon). Entfernen Sie die Kanüle in das Destillationssystem verbunden sorgfältig und schnell in den Reaktionskolben ein.
HINWEIS: Verwenden Sie diese Technik für die Übertragung von Basis und Monomer. - Fügen Sie den Basistropfen, bis die Lösung dunkel wird. Nach dem langsamen Verschwinden der Farbe, fügen Sie einen anderen Teil, bis die dunkle Farbe wieder erscheint, und wiederholen, bis die vollständige Übertragung.
- Übertragen , um das gewünschte Volumen an Monomer (V PheGE = 5 ml) mit einem Polymerisationsgrad von PPheGE ~ n = 18-20 zu erreichen.
- Verlassen die Reaktion für 48 h bei 80 ° C unter einer Argonatmosphäre unter ständigem Rühren eine vollständige Polymerisation sicherzustellen.
- Quenche die Reaktion durch die Zugabe von Tropfen von HCl 1 N in Methanol (gemessen mittels Lackmuspapier (neutraler pH)), und durch eine Farb Verschwinden beobachtet.
- Extrahieren das Naphthalin aus der DMSO-Lösung mit Hexan (3 × 50 ml). Entfernen Sie die DMSO durch Destillation unter Vakuum ~ 70 ml (gleiche Vorrichtung). Gurrenl auf der Slurry-Lösung und 50 ml THF hinzu.
- Entfernen des Salzes aus der Aufschlämmung Lösung durch Zentrifugation bei 5.000 xg für 10 min. Den Überstand und fügen tropfenweise zu 500 ml kaltem Diethylether.
- Der Niederschlag wird durch Filtration oder Zentrifugation (zweimal wiederholen) und trocken unter Vakuum bei 30 ° C für 24-48 h (Ausbeute 85%).
HINWEIS: Das Copolymer nun bereit für die Charakterisierung ist.
5. Charakterisierung der Copolymere
- Wiegen 5-10 mg Copolymer (Aufzeichnung der tatsächlichen Masse) in einem Aluminiumprobenschale und Dichtung hermetisch mit dem Aluminiumdeckel. Lastprobenschale und Referenzpfanne (leer) in das Differential-Scanning-Kalorimeter.
- Programm ein Verfahren ( "Heizen / Kühlen / Heizen") Zyklus: 1) Wärme von 40 ° C bis 100 ° C bei 10 ° C / min, 2) Abkühlen auf -70 ° C bei 10 ° C / min, 3) Wärme bis 100 ° C bei 10 ° C / min. Wiederholen 2) und 3) zweimal. Bestimmen Sie Schmelzpunkt (T m), Kriallization (T c) und Glasübergangstemperaturen (Tg) und Schmelzwärme (& Delta; H f) von den thermischen Spuren aus dem dritten Zyklus (falls zutreffend).
- Auflösen der Polymere in THF (2 mg / ml) und filtriert durch ein 0,2-um-PTFE-Filter. Injizieren der Probe in einer Gel - Permeations - Chromatographie - System (50 ul) und verwenden , um die Retentionszeit für die Probe und eine Kalibrierungskurve erzeugt eine Reihe von Polystyrol - Standards mit dem Molekulargewicht des Polymers zu bestimmen. 19
- Man löst die (Co) polymerisate (15 mg / ml) in DMSO d 6 1 H - NMR - Spektroskopie - Analyse. 19
- Bestimmung der kritischen Mizellenkonzentration (CMC) des Copolymers unter Verwendung von 1,6-Diphenyl-1,3,5-hexatrien (DPH) als Fluoreszenzsonde. 9
- Bereiten Sie eine DPH-Stammlösung in THF (2,32 mg / l) im Dunkeln und mit 100 ul dieser Stammlösung zu jeder einer Reihe von Vials.
- Prepare einem Copolymer-Stammlösung in THF und fügen Aliquots gleichen Volumens (2 ml) zu der Reihe von Ampullen (jeweils ein Aliquot der Stammlösung, die DPH), was zu Endcopolymer Konzentrationen, die von 0,01 bis 1.000 & mgr; g Copolymer / ml liegen.
- Anschließend Wirbel das Copolymer-DPH-Lösungen und tropfenweise zu 10 ml doppelt destilliertem Wasser mit Rührstab. Die Lösungen müssen dann 48 h unter einem Stickstoffstrom kräftig im Dunkeln gerührt werden langsame Verdampfung von THF zu ermöglichen. Die Endkonzentration von DPH in jeder Lösung ist 0,232 mg / L.
- Messen Sie die Fluoreszenzemission der Proben bei 430 nm (λ ex = 350 nm) mit einem Dual-Scan - Mikro Spectrofluorometer und Plot - Fluoreszenz unter Verwendung gegen log [Polymer]. Der Schnittpunkt zwischen den beiden linearen Steigungen bietet die CMC-Wert für das Copolymer.
6. Verfahren für Doxorubicin in BCMs Laden
- Man löst 12 mg DOX in 1 ml aceacetonitril, mit 10 ul Triethylamin und lassen Sie die Lösung unter Rühren im Dunkeln für 2 Stunden.
- Man löst das Copolymer (45 mg) in 1 ml THF und rührt für den gleichen Zeitraum. Fügen Sie die Copolymer-Lösung der DOX-Lösung und spülen Sie das Fläschchen Rest-Copolymer mit einem zusätzlichen Volumen von THF enthält (0,5 ml).
- Fügen Sie die Copolymer-Wirkstoff-Mischung (2,5 ml) tropfenweise zu einer Phiole (20 ml) mit 15 ml Kochsalzlösung 0,9% (NaCl) unter Rühren.
- Die Lösung wird in einen Dialysebeutel (3,5 kDa abgeschnitten) und dialysiert gegen Kochsalzlösung 0,9% (500 ml).
HINWEIS: Ändern Sie den externen Salz nach 6 Stunden und lassen Sie die Dialyse für 24 Stunden weiter im Dunkeln bei RT unter Rühren. - Übertragen, das Dialysat auf eine 50 ml-Röhrchen und zentrifugiert bei 5.000 xg für 15 min.
- Den Überstand auf einer Ultrafiltrationsanlage (mit einer 10 ml Fassungsvermögen), die eine Dialysemembran enthält (cut off 10 kDa). Setzen Sie das Rühren Adapter in das Ultrafiltrationssystem, den Deckel schließen und öffnen alstream Stickstoff.
- Konzentriere das BCM-Lösung auf ein Volumen von 4 ml und 6 ml der frischen Kochsalzlösung und zweimal wiederholen den Vorgang.
- Konzentriere die BCM-Lösung auf 4 ml, spülen Sie die Kammer mit 0,5 ml Kochsalzlösung und zu der Lösung. Shop in braunen Fläschchen bei RT im Dunkeln vor der weiteren Verwendung.
7. Bewertung von Doxorubicin Laden in DOX-BCMs
- Man löst DOX-BCM in Dimethylformamid (100 ul in 400 ul), um die Mizellen stören und verdünnen in HCl-Lösung (0,1 N) vor der Auswertung (100 ul in 900 ul HCl 0,1 N).
- Messen Sie Wirkstoffbeladung bei 490 nm ein Benchtop-Mikrotiterplatten spektrophotometrischen System. Verwenden Sie die folgenden Gleichungen, die die Droge Ladekapazität (DLC) und Wirkstoffbeladung Effizienz (DLE) zu bestimmen:
DLC (wt%) = (Gewicht der Wirkstoff beladen / Gesamtgewicht von BCMs) x 100%
DLE (%) = (Gewicht der wirkstoffbeladenen / Gewicht des Wirkstoffs in Beschickung) x 100%
8. Bewertungvon In - vitro - Freisetzung von DOX von DOX-BCMs
- die Freisetzung von DOX von BCMs untersuchen bei 37 ° C in 0,1 M phosphatgepufferter Kochsalzlösung (PBS, pH 7,4) gegen PBS pH 7,4, enthaltend 0,1% (w / v) Tween 80, BCMs + BSA (50 mg / ml) gegen PBS pH 7,4 und 0,1 M Acetat-Puffer bei pH = 5,5. 20,21
- Verdünne die BCM-DOX-Formulierung (700 ul) in den ausgewählten Puffer (2,3 ml) in einer Gesamtmenge von ≈ 0,6-0,7 mg DOX in dem Dialysebeutel führen.
- Legen Sie die Lösung in der Dialysebeutel, Siegel mit Clips und tauchen Sie den Beutel in 200 ml der jeweiligen externen Medien.
- Entfernen Sie die 2 ml der Lösung außerhalb des Dialysebeutel zu vorgegebenen Zeitpunkten und ersetzen mit dem gleichen Volumen an frischem Puffer.
- Speichern der bei -20 ° C entfernt Aliquots vor der Analyse durch UV-Vis - Spektrophotometrie (Abs 490 nm). Der kumulative Prozentsatz der Wirkstoff freigesetzt (E r) kann mit der folgenden Gleichung berechnet werden:

ANMERKUNG: wo m DOX die Menge an DOX in den BCMs repräsentiert, V 0 ist das Gesamtvolumen des Trennmedium (200 ml), V t ist das Volumen der ersetzten Medien (V t = 2 ml), Ci die Konzentration vor der Korrektur, und stellt C n die Konzentration von DOX in der Probe.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
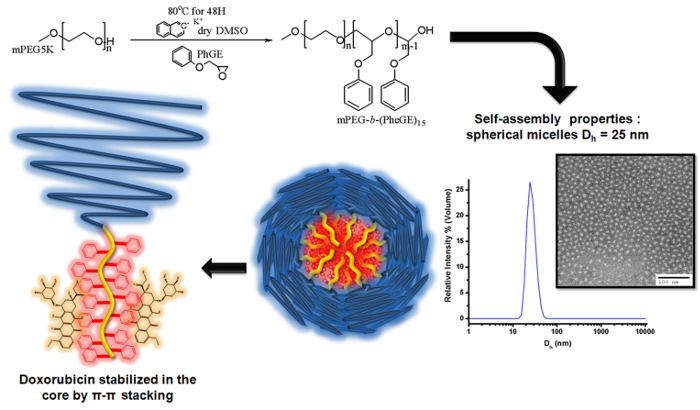
Abbildung 3. Abbildung der anionische Polymerisation von Phenylglycidylether auf mPEG Makroinitiator MPEG- b zu produzieren - (PheGE) 15 zur Herstellung von Blockcopolymermizellen für die Beladung von Doxorubicin Das Schema zeigt die Deprotonierung der Hydroxylgruppe von mPEG mit Naphthalin
Access restricted. Please log in or start a trial to view this content.
Diskussion
Aufgrund der guten Steuerung, die anionische Polymerisation über Molekulargewicht bereitstellt, ist es eines der am meisten angewandten Prozesse in der Industrie zur Herstellung von Polymeren auf Basis von Monomeren Oxiran (PEG und PPG). Optimal und stringenten Bedingungen verwendet werden muss für eine erfolgreiche Polymerisation erreicht werden. Konsequente Reinigung aller Reagenzien und geeignete Vorrichtungen sind für den lebendigen Charakter der Synthese von wesentlicher Bedeutung. Einschränkungen der aktuellen...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
CA acknowledges a Discovery grant from the Natural Sciences and Engineering Research Council of Canada. CA acknowledges a Chair in Pharmaceutics and Drug Delivery from GSK. The authors declare no competing financial interest.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM/HAMF12 | Gibco, Life Technologies | 12500 | Supplemented with 10% FBS. Warm in 37 °C water bath. |
| Trypsin-EDTA (0.25%) | Sigma-Aldrich | T4049 | Warm in 37 °C water bath |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F1051 | Canada origin |
| MDA-MB-468 cell line | ATCC | HTB-132 | |
| MTS tetrazolium reagent | PROMEGA | G111B | |
| Phenazine ethosulfate (PES) | Sigma-Aldrich | P4544 | >95% |
| mPEG5K (Mn 5,400 g/mol) | Sigma-Aldrich | 81323 | PDI=1.02 |
| Dimethylsolfoxide (DMSO) | Sigma-Aldrich | D4540 | >99.5% |
| Naphthalene | Sigma-Aldrich | 147141 | >99% |
| Phenyl glycidyl ether | Sigma-Aldrich | A32608 | >85% |
| Benzophenone | Sigma-Aldrich | 427551 | >99% |
| Potassium | Sigma-Aldrich | 451096 | >98% |
| Tetrahydrofuran | Caledon Laboratory Chemicals | 8900 1 | ACS |
| Hexane | Caledon Laboratory Chemicals | 5500 1 | ACS |
| Calcium hydride (CaH2) | ACP | C-0460 | >99.5% |
| Diethyl Ether | Caledon Laboratory Chemicals | 1/10/4800 | ACS |
| Microplate reader | BioTek Instruments | ||
| Differential scanning calorimetry (DSC) | TA Instruments Inc | DSC Q100 | |
| Gel permeation chromatography (GPC) | Waters | 2695 separation moldule / 2414 detector | 2 Columns: Agilent Plgel 5 µm Mixed-D |
| NMR spectroscopy | Varian Mercury 400MHz | ||
| Chloroform-d | Sigma-Aldrich | 151858 | 99.96% |
| DMSO-d | Sigma-Aldrich | 156914 | 99.96% |
| Vaccum pump | Gardner Denver Welch Vacuum Tech, Inc. | Ultimate pressure 1x10-4 torr | |
| Drierit with indicator, 8 mesh | Sigma-Aldrich | 238988 | Regenerated at 230 °C for 2 hr |
Referenzen
- Dickerson, T. J., Reed, N. N., Janda, K. D. Soluble Polymers as Scaffolds for Recoverable Catalysts and Reagents. Chemical Reviews. 102, 3325-3344 (2002).
- van Heerbeek, R., Kamer, P. C. J., van Leeuwen, P. W. N. M., Reek, J. N. H. Dendrimers as Support for Recoverable Catalysts and Reagents. Chemical Reviews. 102 (10), 3717-3756 (2002).
- Knop, K., Hoogenboom, R., Fischer, D., Schubert, U. S. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 49 (36), 6288-6308 (2010).
- Eetezadi, S., Ekdawi, S. N., Allen, C. The challenges facing block copolymer micelles for cancer therapy: In vivo barriers and clinical translation. Advanced Drug Delivery Reviews. 91, 7-22 (2015).
- Attwood, D., Booth, C., Yeates, S. G., Chaibundit, C., Ricardo, N. Block copolymers for drug solubilisation: Relative hydrophobicities of polyether and polyester micelle-core-forming blocks. International Journal of Pharmaceutics. 345 (1-2), 35-41 (2007).
- Matsumura, Y., Kataoka, K. Preclinical and clinical studies of anticancer agent-incorporating polymer micelles. Cancer Science. 100 (4), 572-579 (2009).
- Chan, A. S., Chen, C. H., Huang, C. M., Hsieh, M. F. Regulation of particle morphology of pH-dependent poly(epsilon-caprolactone)-poly(gamma-glutamic acid) micellar nanoparticles to combat breast cancer cells. Journal of Nanoscience and Nanotechnology. 10 (10), 6283-6297 (2010).
- Diao, Y. Y., et al. Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells. International Journal of Nanomedicine. 6, 1955-1962 (2011).
- Mikhail, A. S., Allen, C. Poly(ethylene glycol)-b-poly(ε-caprolactone) Micelles Containing Chemically Conjugated and Physically Entrapped Docetaxel: Synthesis, Characterization, and the Influence of the Drug on Micelle Morphology. Biomacromolecules. 11 (5), 1273-1280 (2010).
- Kataoka, K., Harada, A., Nagasaki, Y. Block copolymer micelles for drug delivery: design, characterization and biological significance. Advanced Drug Delivery Reviews. 47 (1), 113-131 (2001).
- Nakanishi, T., et al. Development of the polymer micelle carrier system for doxorubicin. Journal of Controlled Release. 74 (1-3), 295-302 (2001).
- Liu, J., Xiao, Y., Allen, C. Polymer-drug compatibility: A guide to the development of delivery systems for the anticancer agent, ellipticine. Journal of Pharmaceutical Sciences. 93 (1), 132-143 (2004).
- Flory, P. J. Molecular Size Distribution in Ethylene Oxide Polymers. Journal of the American Chemical Society. 62 (6), 1561-1565 (1940).
- Kazanskii, K. S., Solovyanov, A. A., Entelis, S. G. Polymerization of ethylene oxide by alkali metal-naphthalene complexes in tetrahydrofuran. European Polymer Journal. 7 (10), 1421-1433 (1971).
- Crothers, M., et al. Micellization and Gelation of Diblock Copolymers of Ethylene Oxide and Styrene Oxide in Aqueous Solution. Langmuir. 18 (22), 8685-8691 (2002).
- Taboada, P., et al. Block Copolymers of Ethylene Oxide and Phenyl Glycidyl Ether: Micellization, Gelation, and Drug Solubilization. Langmuir. 21 (12), 5263-5271 (2005).
- Taboada, P., et al. Micellization and Drug Solubilization in Aqueous Solutions of a Diblock Copolymer of Ethylene Oxide and Phenyl Glycidyl Ether. Langmuir. 22 (18), 7465-7470 (2006).
- Attwood, D., Booth, C. Colloid Stability. , Wiley-VCH Verlag GmbH & Co. KGaA. 61-78 (2010).
- Le Devedec, F., et al. Postalkylation of a Common mPEG-b-PAGE Precursor to Produce Tunable Morphologies of Spheres, Filomicelles, Disks, and Polymersomes. ACS Macro Letters. 5 (1), 128-133 (2016).
- Chtryt, V., Ulbrich, K. Conjugate of Doxorubicin with a Thermosensitive Polymer Drug Carrier. Journal of Bioactive and Compatible Polymers. 16 (6), 427-440 (2001).
- Kataoka, K., et al. Doxorubicin-loaded poly(ethylene glycol)-poly(β-benzyl-l-aspartate) copolymer micelles: their pharmaceutical characteristics and biological significance. Journal of Controlled Release. 64 (1-3), 143-153 (2000).
- Cammas, S., Matsumoto, T., Okano, T., Sakurai, Y., Kataoka, K. Design of functional polymeric micelles as site-specific drug vehicles based on poly (α-hydroxy ethylene oxide-co-β-benzyl l-aspartate) block copolymers. Materials Science and Engineering: C. 4 (4), 241-247 (1997).
- Lv, S., et al. Doxorubicin-loaded amphiphilic polypeptide-based nanoparticles as an efficient drug delivery system for cancer therapy. Acta Biomaterialia. 9 (12), 9330-9342 (2013).
- Kim, J. O., Oberoi, H. S., Desale, S., Kabanov, A. V., Bronich, T. K. Polypeptide nanogels with hydrophobic moieties in the cross-linked ionic cores: synthesis, characterization and implications for anticancer drug delivery. Journal of Drug Targeting. 21 (10), 981-993 (2013).
- Zhao, C. L., Winnik, M. A., Riess, G., Croucher, M. D. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers. Langmuir. 6 (2), 514-516 (1990).
- Wilhelm, M., et al. Poly(styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules. 24 (5), 1033-1040 (1991).
- Cammas, S., Kataoka, K. Functional poly[(ethylene oxide)-co-(β-benzyl-L-aspartate)] polymeric micelles: block copolymer synthesis and micelles formation. Macromolecular Chemistry and Physics. 196 (6), 1899-1905 (1995).
- Kwon, G., et al. Micelles based on AB block copolymers of poly(ethylene oxide) and poly(.beta.-benzyl L-aspartate). Langmuir. 9 (4), 945-949 (1993).
- Ahmed, F., Discher, D. E. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles. Journal of Controlled Release. 96 (1), 37-53 (2004).
- Uhrig, D., Mays, J. W. Experimental techniques in high-vacuum anionic polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 43 (24), 6179-6222 (2005).
- Parker, A. J. The effects of solvation on the properties of anions in dipolar aprotic solvents. Quarterly Reviews, Chemical Society. 16 (2), 163-187 (1962).
- Cram, D. J. Fundamentals o] Carbanion Chemistry. , (1965).
- Szwarc, M. ACS Symposium Series. 166, American chemistry society. 1-15 (1981).
- Cho, Y. W., Lee, J., Lee, S. C., Huh, K. M., Park, K. Hydrotropic agents for study of in vitro paclitaxel release from polymeric micelles. Journal of Controlled Release. 97, 249-257 (2004).
- Dewhurst, P. F., Lovell, M. R., Jones, J. L., Richards, R. W., Webster, J. R. P. Organization of Dispersions of a Linear Diblock Copolymer of Polystyrene and Poly(ethylene oxide) at the Air−Water Interface. Macromolecules. 31 (22), 7851-7864 (1998).
- Opanasopit, P., et al. Block Copolymer Design for Camptothecin Incorporation into Polymeric Micelles for Passive Tumor Targeting. Pharmaceutical Research. 21 (11), 2001-2008 (2004).
- Allen, G., Booth, C., Price, C. VI-The physical properties of poly(epoxides). Polymer. 8, 414-418 (1967).
- Jada, A., Hurtrez, G., Siffert, B., Riess, G. Structure of polystyrene-block-poly(ethylene oxide) diblock copolymer micelles in water. Macromolecular Chemistry and Physics. 197 (11), 3697-3710 (1996).
- Attwood, D., Florence, A. T. Surfactant systems : their chemistry, pharmacy, and biology. , Chapman and Hall. (1983).
- Rekatas, C. J., et al. The effect of hydrophobe chemical structure and chain length on the solubilization of griseofulvin in aqueous micellar solutions of block copoly(oxyalkylene)s. Physical Chemistry Chemical Physics. 3 (21), 4769-4773 (2001).
- Encyclopædia Britannica Online. , http://www.britannica.com/EBchecked/topic/479680/protein/72559/Proteins-of-the-blood-serum (2015).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten