A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Anionic פילמור של קופולימר amphiphilic עבור הכנת Micelles קופולימר בלוק מיוצב על ידי אינטראקציות הנחת π-π
In This Article
Summary
השלבים העיקריים של החיים פילמור anionic של אתר פניל glycidyl (PheGE) על גליקול methoxy-פוליאתילן (-PPheGE ב mPEG-) מתוארים. מיצלות קופולימר לחסום שתעוררנה (BCMs) היו עמוסות דוקסורוביצין 14% (% wt) ו לשחרור מושהה של תרופה מעל 4 ימים בתנאים רלוונטיים מבחינה פיזיולוגית הושגו.
Abstract
במחקר זה, קופולימר amphiphilic הכוללת בלוק ויוצרים ליבות עם פניל היה מסונתז על ידי חיים פילמור anionic של אתר פניל glycidyl (PheGE) על גליקול-פוליאתילן methoxy (-PPheGE ב mPEG-). אפיון של קופולימר גילה התפלגות מולקולרית צרה (PDI <1.03) ואשר את מידת פילמור של MPEG 122 - ב - (PheGE) 15. ריכוז micelle הביקורתי של קופולימר הוערך בשיטת קרינה הוקמה עם התנהגות הצבירה המוערכת על ידי פיזור אור דינאמי מיקרוסקופיה אלקטרונית שידור. הפוטנציאל של קופולימר לשימוש ביישומי משלוח סמים הוערך באופן ראשוני כולל במבחנת התאמה ביולוגית, העמסה שחרורו של דוקסורוביצין הסמים הידרופובי אנטי-הסרטני (DOX). ניסוח micelle יציב של DOX הוכן עם רמות טעינת תרופה עד 14% (% wt), טעינת סמי efficiencies> 60% (w / w) ומתמשך שחרור התרופה מעל 4 ימים בתנאים רלוונטיים מבחינה פיזיולוגית (pH חומצי הניטראלי, בנוכחות אלבומין). רמת הטעינה התרופה גבוהה לשחרור מושהה מיוחסת לייצוב אינטראקציות π π בין DOX ואת גוש יוצרי הליבה של מיצלות.
Introduction
בשנת תקשורת מימית, קופולימרים לחסום amphiphilic להרכיב כדי ליצור מיצלות קופולימר הגוש בגודל ננו (BCMs), מורכבות ליבה הידרופובי מוקפת פגז או קורונה הידרופילי. ליבת micelle יכול לשמש כמאגר עבור שילוב של תרופות הידרופובי; בעוד, העטרה הידרופילי מספקת ממשק בין הליבה לבין הבינוני החיצוני. פולי (אתילן גליקול) (PEG) ונגזרותיו הם אחד השיעורים החשובים ביותר של פולימרים ואחד בשימוש הנרחב ביותר ניסוח סמים. 1-3 BCMs הוכיח להיות פלטפורמת משלוח סמים ראויה עם כמה ניסוחים להסתמך על זה הטכנולוגיה כיום בפיתוח קליני בשלב מאוחר. 4 ברוב המקרים הגוש ההידרופובי של קופולימר מורכבת polycaprolactone, פולי (D, L-lactide), פולי (פרופילן אוקסיד) או פולי (β-בנזיל-L-aspartate). 5 -9
קבוצתו של Kataoka נחקרה מיצלות כדורית נוצרה PEO- ב -PBLA ו פולי (אתילן אוקסיד) - ב -. (דוקסורוביצין חומצה מצומדות polyaspartic) למסירת דוקסורוביצין (DOX) 10,11 בדוחות שלהם, הם העלו כי π-π אינטראקציות בין התרופה פולימר מצומדות או PBLA וחופשי DOX לפעול כדי לייצב את הליבה micelle וכתוצאה מכך עליית טעינת סמים ושימור. הוא קבע כי תאימות או אינטראקציות בין התרופה לבין בלוק יוצרי הליבה הם הקובעים פרמטרים הקשורים לביצועי מפתח. 12 בנוסף DOX, מספר בריפוי הסרטן כוללים טבעות ארומטיות בתוך מבנה הליבה שלהם (למשל, מטוטרקסט, olaparib, SN -38).
כתוצאה מכך יש עניין משמעותי סינתזה של קופולימרים הכוללים טבעות בנזילות בבלוקי ליבת יוצרים שלהם. פילמור טבעת מאירת anionic של PEG ונגזרותיו מאפשר שליטה על משקל מולקולרי לגרום חומרים של polydispersity הנמוך תשואה טובה. 13,14 Ethyleתחמוצת ne עם אתר פניל glycidyl (PheGE) או תחמוצת סטירן (SO) יכול להיות (שיתוף) polymerized לגבש קופולימרים לחסום היוצרות מיצלות עבור solubilization של תרופות הידרופובי. 15-18 הדו"ח הנוכחי מתאר את הצעדים הדרושים על החיים פילמור anionic של פניל glycidyl מונומר האתר על MPEG-OH כמו macroinitiator (איור 1). קופולימר לחסום וכתוצאה אגרגטים שלה מאופיינים אז במונחים של תכונות רלוונטיות להשתמש ב משלוח סמים.
Access restricted. Please log in or start a trial to view this content.
Protocol
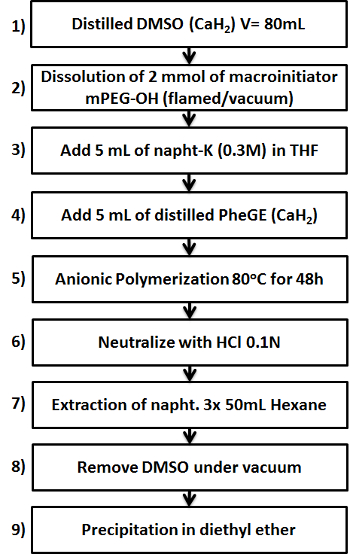
איור 1. סכמטי המציג תשעת השלבים העיקריים בהכנת קופולימר ב -PPheGE mPEG-. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
1. הכנה של ריאגנטים בתנאים יבשים
- הכנת ריאגנטים.
- לשקול 15 גרם של MPEG-5K (M n = 5,400 g / mol, PDI 1.03) ומניחים על 50 מעלות צלזיוס בתנור תחת ואקום במשך 48 שעות לפני השימוש.
- יבש 200 מ"ל של dimethylsulfoxide (DMSO) מעל הידריד סידן (CAH 2) (~ 1 ז), במקום תחת ואקום במשך 30 דקות, טיהור תחת ארגון ומערבבים במשך 48 שעות לפני השימוש.
- מניחים 50 מ"ל של מונומר PheGE בבקבוק יבש ונקי (100 מ"ל), להוסיף 1 גרם של CAH 2, חותם תחת ואקום במשך 15 דקות על הקרח, טיהור תחת ארגוןולהשאיר ומערבבים במשך 24 שעות תחת ארגון לפני השימוש.
2. הכנת אשלגן הנפטלין
- בזהירות, לחתוך חתיכות קטנות של נתרן (~ 1.5 גרם) מיובשים עם הקסאן להסיר שמן מינרלי עודף ולהוסיף את הבקבוק עגול המכיל את tetrahydrofuran (THF) (v = 500 מ"ל).
הערה: נתחי נתרן אסור להיות חשוף לאוויר לאורך זמן בשל סכנת שריפה. - להוסיף benzophenone (g ~ 5), טיהור עם ארגון ולאטום את הבקבוק העגול (2 צוואר) עם פקקי זכוכית.
- בעקבות תנודות מתחת ארגון למשך 24 שעות, לחבר את הבקבוק מסביב לתחתית כדי מנגנון זיקוק (איור 2), לזקק הפתרון השחור מתחת ארגון תוך refluxing (כלומר, ריפלוקס בערך תקופת 2 שעות לאחר הפתרון הופך לכחול). מתחילים לאסוף את העוצמה הרצויה ~ 150 מ"ל של THF על ידי סגירת שסתום שמאל (נמצא באמצע של המנגנון זיקוק).
הערה: אם פתרון זה אינו להכחיל, לעצור את לזקקהאוכלוסייה, להתקרר בטמפרטורת חדר (RT) ולהוסיף יותר benzophenone או נתרן מחדש את הזיקוק. זוהי אינדיקציה כי THF עדיין מכיל מים. - בעוד Erlenmeyer יבש, מוסיפים THF מזוקקים (v = 100 מ"ל) ו להתמוסס 3.9 גרם של נפטלין.
הערה: עצור את הזיקוק, להתקרר ב RT ופתח את השסתום זכות להעביר את היקף THF. - כפי שתואר בנקודה 2.1, לחתוך חתיכות קטנות של אשלגן (1.1 גרם) ולהוסיף הפתרון המכיל את נפתלין (ריכוז סופי ~ 0.3 mol / L). חותם את Erlenmeyer עם מתאם שטיפה (T) (on / off) עם מחצה בראש ולטהר עם ארגון.
- בעקבות תנודות מתחת ארגון למשך 24 שעות, להתבונן הפתרון שהתקבל בסיס נפתלין אשלגן כצבע ירוק כהה הומוגנית.
- בתנאים אינרטי, להסיר aliquot 5 מ"ל של הפתרון הבסיסי מהבקבוק בעזרת מזרק ולהוסיף 10 מ"ל מים מזוקקים. בהמשך להוסיף 1-2 טיפות של אינדיקטור פנולפתלאין לפתרון זה,ההופך את פתרון צבע פוקסיה.
- השתמש ביורטה לכיל הפתרון נפתלין אשלגן עם פתרון חומצה הידרוכלורית סטנדרטי (0.1 N) עד הפתרון הופך חסר צבע.
3. חומרי אמצעי זהירות נדרשים עבור פילמור האפקטיבי Living anionic
- מערכת ארגון / סעפת ואקום.
הערה: כמתואר באיור 2, סעפת עם זיגוג כפול עם והברזים למיניהם זכוכית חלולים משמשת למעבר בין ארגון משלוח ותנאי ואקום זכוכית.- חבר את הטנק של ארגון (עם מד לחץ) לעמודה יבוש יבש לקו סעפת באמצעות צינור גומי אינרטי. בקצהו האחר של הקו ארגון, לחבר bubbler (המכיל שמן מינרלי).
- כדי הזכוכית והברזים למיניהם, להתחבר צינורות ומחטים אינרטי גמישים. כדי בקו השני של הסעפת, להתחבר מלכודת זכוכית השקועה בתוך בקבוק דיואר קר (מלא קרח / מים או חנקן נוזלי) משאבת ואקום גבוהה.
- מכשירי זיקוק של מונומר DMSO.
הערה: נוחה (כלומר, כל אחד) מכשיר לזיקוק ואקום גבוה מועסקת (איור 2). את כלי הזכוכית היבשה הוא עשה עם שסתומי ואקום גבוהים, מובנה מעבה עם ראש בקירור פנימי.- מי חבר זרימה דרך הכניסה (א) ו לשקע (B) של יחידת הקירור (מכתב). חבר את הכניסה / היציאה (C) אחרים הסעפת הכפולה עבור ארגון / ואקום. להוסיף ולאטום מחץ (חוטי מתכת) בנמל המשלוח / החילוץ ולהתחבר צינורית נירוסטה להעברת נוזלים רגישים אוויר (ד) (בחלק העליון / הלולאה).
- לפני פילמור, לזקק PheGE ו DMSO על מעילים חימום חצי כדור ב 100 מעלות צלזיוס ו -70 מעלות צלזיוס, בהתאמה, עבור 2 שעות תחת ואקום עם ערבוב. נקודת הרתיחה של מונומר PheGE היא 254 ° C ואילו נקודת הרתיחה עבור DMSO היא 189 מעלות צלזיוס ב (1 ATM).
- כלי זכוכית עבור polymerizat anionicיוֹן.
- בנוסף מערכת הזיקוק, משתמש זכוכית עמידה ואקום גבוהה רק כולל עגול צלוחיות תחתונות (מוסמכים על ידי היצרן), בוגר צילינדרים (עבור העברת הכרכים של ממס, בסיס מונומרים), קנולות, מחיצה וחוטי מתכת לאטום את septa.
הערה: על החיים פילמור, חום בזהירות (תחת ואקום) להתקרר כל כלי זכוכית תחת זרם ארגון לפני השימוש. שמור על אקדח החום ממרחק ~ 10 סנטימטרים מן הזכוכית.
- בנוסף מערכת הזיקוק, משתמש זכוכית עמידה ואקום גבוהה רק כולל עגול צלוחיות תחתונות (מוסמכים על ידי היצרן), בוגר צילינדרים (עבור העברת הכרכים של ממס, בסיס מונומרים), קנולות, מחיצה וחוטי מתכת לאטום את septa.
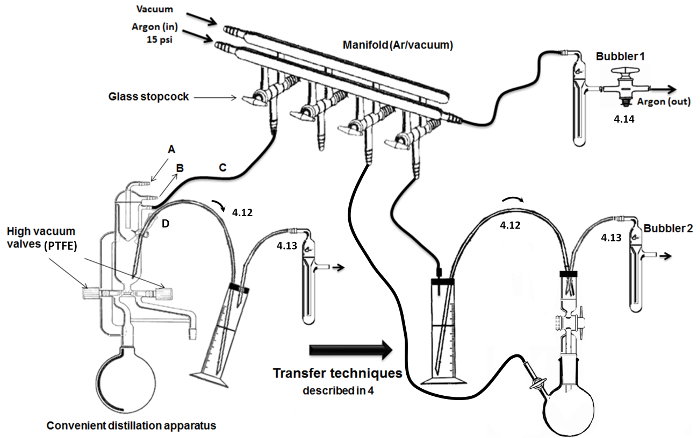
איור 2. אסיפה וצעדי זיקוק / העברת מפתח. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
תיאור 4. השלבים העיקריים של פילמור Living anionic: לזיקוק העברה
- לשקול MPEG-5K (2 מילימול, 10 גרם) בתוך f יבשLask / Schlenk (תנור) המכיל בר ומערבבים ולאטום את מתאם שטיפה (T) (on / off) עם מחצה בראש.
- חבר את הבקבוק כדי הסעפת ולטהר את הבקבוק במשך 2-3 דקות עם גלי ארגון. סובב את השסתום לתפקיד הוואקום לטהר את הבקבוק.
- סובב את הבקבוק ידני ולייבש את כלי התגובה הומוגנית עם מייבש שיער (אקדח חום) עד MPEG-5K נמס.
הערה: שמור על אקדח חום ממרחק ~ 10 ס"מ מהבקבוק. - לאחר דקות 1, לשבור את הוואקום על ידי סיבוב שסתום על הסעפת לעבר העמדת הארגון עם כמה מצליפה מהירה.
הערה: זרימת ארגון מתמשכת צריכה להיות שנצפתה bubbler. כאשר הזרימה היא רציפה, השסתום נשאר על עמדת הארגון. צעדים חימום וקירור וחזור פעמיים כדי להסיר כל עקבות של לחות. - שמור את macroinitiator פולימריים תחת ואקום עבור ~ 2 שעות ותחת ארגון לפני התגובה מתחילה.
- הר שני מנגנוני זיקוק ואקום גבוה מתחת למכסה המנוע (איוריור 2); אחד עבור הזיקוק של DMSO ואחד עבור הזיקוק של מונומר (PheGE).
- חבר את הצלוחיות הנפרדות המכילות את DMSO ו מונומר שני המנגנונים ולהתקין כל אחד על מעטפת חימום חצי כדור (או באמבט שמן). חבר מים קרים לחלק העליון של המנגנון (ב / החוצה) ואל (ואקום ארגון /) סעפת.
- ודא כי בכל מנגנון מאובטח אטום היטב. Engage את הוואקום באמצעות שסתום.
הערה:. כפי שתואר בשלב 3.3, לחזור חימום וצעדים קירור פעמיים כדי להסיר כל עקבות של לחות. - הגדר את החימום באמצעות בקר טמפרטורה ולהתחיל ערבוב הפתרונות. אחרי שעת 2 של מחזור / זיקוק של DMSO, לסגור את שסתום ואקום הגבוה (נמצא באמצע של מנגנון הזיקוק) לאסוף כ 20 מיליליטר של תמיסה (לשטוף את החלק הפנימי של המנגנון). ואז, לשחרר את החלק היחסי לתוך הבקבוק וחזר על הפעולה פעם נוספת על מנת להבטיח את הטוהר של השבר הרצוי כי הוא גollected מאוחר יותר.
- מחממים את הבקבוק המכיל את-5K MPEG (תחת ואקום) עם אקדח חום עד פולימר (MPEG-5K) נמס. טהר שוב עם ארגון.
הערה: ההליך יעזור הפירוק לאחר העברת DMSO. - לאחר 2 שעות, לסגור את שסתום ואקום גבוה ולאסוף היקף ממס (V DMSO = ~ 100 מ"ל). עצור חימום ולשבור את החלל מן הסעפת. שחרר ארגון (על ידי מצליפה) לתוך התא כמתואר לעיל.
- תחת לחץ חיובי של ארגון, להתחבר לצד אחד של הצינורית (להחזיק בבית הברזלים של המנגנון) כדי גליל סיים או ישירות אל הבקבוק המכיל את MPEG-5K (אם מנגנון הזיקוק יש סיום) ו, לטבול את הקצה השני בזהירות לתוך השבר המזוקק הטרי.
- שימוש בלחץ ארגון, להסיע את DMSO דרך הצינורית לתוך בקבוק התגובה. חבריו bubbler נוסף כדי הבקבוק (או צילינדר במידת צורך למדידה) ו, סגור את שסתום הזכוכית מחובר thbubbler דואר בצד הנגדי של הסעפת.
הערה: כאשר צד אחד של צינורית מוסר להעברה, לוודא כי לחץ ארגון חיובי מוחל. - כדי למנוע תאונות שנגרמו על ידי לחץ ארגון, פתח את שסתום הזכוכית במשך 1-2 שניות reclose להמשיך את זרימת DMSO (חזרה פעם אחת לכל 0.5 דקות) עד ההעברה המלאה הושלמה. פתח מחדש את השסתום בסיום.
הערה: אותה ההליך חייב עכשיו להיות אחריו לזיקוק אוסף של מונומר. הממס ואת מונומר לא ניתן לאסוף בעת ובעונה אחת. - העברה 5 מיליליטר של 0.3 M נפתלין אשלגן באמצעות cannulation ב גליל סיים חתום על ידי מחצה עם צינורית המוכנסת (לולאה).
הערה: זהירות אותו כמתואר הערה 4.13. לחץ ארגון חיובי חייבים להישמר ראשון מבקבוק אשלגן נפתלין אל הגליל ואז ממכל בקבוק התגובה כדי למנוע זיהום אוויר / מים. - הכנס מחט נוספת מן manifold לתוך הצילינדר (ארגון). הסר את הצינורית המחוברת למערכת הזיקוק בזהירות ולהכניס במהירות לתוך בקבוק התגובה.
הערה: השתמש בטכניקה זו להעברת בסיס מונומר. - מוסיפים את הירידה בסיס אחר טיפה עד הפתרון הופך לכהה. בעקבות היעלמותו של צבע האיטי, להוסיף עוד מנה עד שהצבע הכהה מופיע שוב, וחזור עד החילופים המלאים.
- מעבירים את העוצמה הרצויה של מונומר (V PheGE = 5 מ"ל) להגיע מידת פילמור של PPheGE ~ n = 18-20.
- השאר את התגובה במשך 48 שעות ב 80 ° C תחת אווירת ארגון עם ערבוב מתמיד כדי להבטיח פילמור מלא.
- להרוות את התגובה על ידי תוספת של טיפות HCl 1 N מתנול (נמדד באמצעות נייר לקמוס (pH ניטרלי)) ו שנצפו על ידי היעלמות הצבע.
- חלץ את נפתלין מפתרון DMSO עם הקסאן (3 × 50 מ"ל). הסר את DMSO ידי זיקוק תחת ואקום ~ 70 מ"ל (אותו המנגנון). Cool למטה הפתרון סלארי ולהוסיף 50 מ"ל של THF.
- הסר את המלח מפתרון slurry על ידי צנטריפוגה ב 5000 XG במשך 10 דקות. מעביר את supernatant, ולהוסיף טיפה חכמה 500 מיליליטר של אתר diethyl הקר.
- אסוף את המשקע על ידי סינון או צנטריפוגה (וחזור פעמיים) ויבש תחת ואקום ב 30 מעלות צלזיוס במשך 24-48 שעות (תשואה 85%).
הערה: קופולימר מוכן כעת אפיון.
אפיון 5. קופולימרים
- לשקול 5-10 מ"ג של קופולימר (שיא המסה בפועל) בסיר מדגם אלומיניום לאטום הרמטית עם מכסה האלומיניום. פאן טענו מדגם והפאן הפניה (ריק) לתוך קלורימטר סריקת הפרש.
- חום 1) חום 40 מעלות צלזיוס עד 100 מעלות צלזיוס ב 10 ° C / min, 2) מגניב -70 ° C ב 10 ° C / min, 3): תוכנית שיטה ( "חום / מגניב / חום") מחזור עד 100 מעלות צלזיוס ב 10 ° C / min. חזור על 2) ו -3) פעמיים. לקבוע נקודת ההתכה (T מ '), crystallization (ג T) וטמפרטורות מעבר זכוכית (g T), ואת החום של היתוך (ו ΔH) מן עקבות תרמית מהמעגל השלישי (אם זה אפשרי).
- ממיסים את פולימרים ב THF (2 מ"ג / מ"ל) ולסנן דרך פילטר PTFE -0.2 מיקרומטר. להזריק את המדגם לתוך מערכת כרומטוגרפיה ג'ל חלחול (50 μl) ולהשתמש זמן השמירה למדגם ואת עקומת כיול הופק באמצעות מגוון של סטנדרטים קלקר כדי לקבוע את המשקל המולקולרי של הפולימר. 19
- ממיסים את פולימרים (שיתוף) (15 מ"ג / מ"ל) ב DMSO ד 6 1 ניתוח ספקטרוסקופיה H NMR. 19
- קבע את ריכוז micelle הביקורתי (CMC) של קופולימר באמצעות 1,6-diphenyl-1,3,5-hexatriene (DPH) כמו בדיקת קרינה. 9
- כן פתרון מניות DPH ב THF (2.32 מ"ג / L) בחושך ולהוסיף 100 μl של פתרון מניות זו לכל אחד בסדרה של מבחנות.
- Prepaמחדש פתרון המניות קופולימר ב THF ולהוסיף aliquots של נפח שווה (2 מ"ל) לסדרה של בקבוקונים (שכל אחת מהן מכילה aliquot של פתרון המניות DPH) וכתוצאה מכך ריכוזים קופולימר הסופי אשר נע בין 0.01 ל -1,000 מיקרוגרם קופולימר / מ"ל.
- בהמשך לכך, מערבולת קופולימר-DPH פתרונות ולהוסיף dropwise עד 10 מ"ל מים מזוקקים פעמיים עם ערבוב בר. הפתרונים חייבים מכן וערבבו במרץ בחושך במשך 48 שעות תחת זרם של חנקן כדי לאפשר אידוי איטי של THF. הריכוז הסופי של DPH בכל פתרון הוא 0.232 מ"ג / L.
- מדוד את פליטת הקרינה של הדגימות ב 430 ננומטר (ננומטר לשעבר λ = 350) באמצעות spectrofluorometer microplate כפול סריקת קרינת עלילה לעומת להתחבר [פולימר]. ליירט בין שני מדרונות ליניארית מספק את הערך CMC עבור קופולימר.
נוהל 6. לטעינה דוקסורוביצין לתוך BCMs
- ממיסים 12 מ"ג של DOX ב 1 מ"ל של אסtonitrile, להוסיף 10 μl של triethylamine ולתת ומערבבים פתרון בחושך במשך שעה 2.
- ממיסים את קופולימר (45 מ"ג) ב 1 מ"ל של THF ומערבבים עבור אותו פרק זמן. מוסיפים את פתרון קופולימר לפתרון DOX ולשטוף את בקבוקון המכיל קופולימר שיורית עם נפח נוסף של THF (0.5 מ"ל).
- מוסיפים את תערובת קופולימר סמים (2.5 מ"ל) dropwise ל בקבוקון (20 מ"ל) המכיל 15 מ"ל של תמיסת מלח 0.9% (NaCl) עם ערבוב.
- עבר פתרון שקית דיאליזה (3.5 kDa מנותקים) ו dialyze נגד מלוח 0.9% (500 מיליליטר).
הערה: שנו את מלוחים חיצוני לאחר 6 שעות ולתת דיאליזה להמשיך למשך 24 שעות עם ערבוב בחושך ב RT. - מעבירים את dialysate לצינור צנטריפוגות 50 מ"ל ב 5000 XG במשך 15 דקות.
- מעבירים את supernatant מערכת אולטרה סינון (בהספק 10 מ"ל) המכיל קרום דיאליזה (מנותקת 10 KDA). שים את מתאם ערבוב לתוך מערכת אולטרה סינון, לסגור את המכסה פתוח כמוtream של חנקן.
- תתרכז פתרון BCM עד נפח של 4 מ"ל ולהוסיף 6 מיליליטר של תמיסת מלח טרי לחזור על התהליך פעמים.
- תתרכז הפתרון BCM עד 4 מ"ל, לשטוף את החדר עם 0.5 מ"ל של תמיסת מלח ולהוסיף את הפתרון. חנות צלוחיות חומות ב RT בשימוש הכהה לפני נוסף.
7. הערכה טוענת דוקסורוביצין ב DOX-BCMs
- ממיסים DOX-BCM ב dimethylformamide (100 μl 400 μl) לשבש את מיצלות לדלל בתמיסה מימית HCl (0.1 N) קודם להערכה (100 μl 900 μl HCl 0.1 N).
- מדוד טעינת סמים ב 490 ננומטר באמצעות מערכת spectrophotometric microplate המעבדתיים. השתמש המשוואות הבאות כדי לקבוע את קיבולת טעינת סמים (DLC) ויעילות טעינת סמים (DLE):
DLC (% wt) = (משקל של תרופה טעונה / משקל כולל של BCMs) x 100%
DLE (%) = (משקל של תרופה טעונה / משקל של תרופה שבעדכון) x 100%
הערכת 8.של במבחנה שחרור DOX מ DOX-BCMs
- חקור את שחרורו של DOX מ BCMs על 37 מעלות צלזיוס ב 0.1 M פוספט שנאגרו מלוחים (PBS, pH 7.4) נגד PBS pH 7.4 0.1% המכיל (w / v) Tween 80, BCMs + BSA (50 מ"ג / מ"ל) נגד PBS 7.4 pH 0.1 אצטט M-חיץ ב- pH = 5.5. 20,21
- לדלל את ניסוח BCM-DOX (700 μl) במאגר שנבחר (2.3 מ"ל) כדי לגרום בסכום כולל של ≈ 0.6-0.7 מ"ג של DOX בשקית דיאליזה.
- מניחים את הפתרון בשקית דיאליזה, לאטום עם קליפים לטבול את השקית לתוך 200 מ"ל של מדיה חיצונית בהתאמה.
- הסר 2 מ"ל של הפתרון החיצוני של התיק דיאליזה בנקודות זמן קבוע מראש ולהחליף עם נפח זהה של חיץ טרי.
- אחסן את aliquots הוסר ב -20 ° C לפני ניתוח על ידי לספקטרופוטומטריה UV-Vis (Abs 490 ננומטר). האחוז המצטבר של תרופה שוחרר (E r) יכול להיות מחושב באמצעות המשוואה הבאה:

הערה: כאשר m DOX מייצג את כמות DOX ב BCMs, V 0 הוא הנפח הכולל של התקשורת שחרור (200 מ"ל), V t הוא נפח התקשורת מוחלף (V t = 2 מ"ל), Ci הוא ריכוז לפני התיקון, ו- C n מייצג את הריכוז של DOX במדגם.
Access restricted. Please log in or start a trial to view this content.
תוצאות
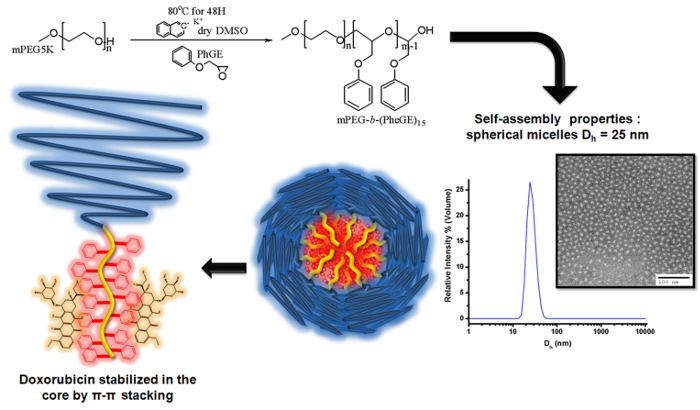
איור איור 3. של פילמור anionic של אתר glycidyl פניל על macroinitiator MPEG לייצר ב mPEG- - (PheGE) 15 להכנת מיצלות קופולימר לחסום לטעינה של דוקסורוביצין סכמטית ממח...
Access restricted. Please log in or start a trial to view this content.
Discussion
בשל שליטה הטובה כי פילמור anionic מספק מעל משקל מולקולרי הוא אחד התהליכים השימושיים ביותר בתעשייה לעריכת הפולימרים המבוססים על מונומרים oxirane (PEG ו PPG). תנאים אופטימליים ומחמירות חייבים לשמש כדי שניתן יהיה להשיג פילמור מוצלח. טיהור קפדנית של כל ריאגנטים והמכשירים נאותים ח...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
CA acknowledges a Discovery grant from the Natural Sciences and Engineering Research Council of Canada. CA acknowledges a Chair in Pharmaceutics and Drug Delivery from GSK. The authors declare no competing financial interest.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/HAMF12 | Gibco, Life Technologies | 12500 | Supplemented with 10% FBS. Warm in 37 °C water bath. |
| Trypsin-EDTA (0.25%) | Sigma-Aldrich | T4049 | Warm in 37 °C water bath |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F1051 | Canada origin |
| MDA-MB-468 cell line | ATCC | HTB-132 | |
| MTS tetrazolium reagent | PROMEGA | G111B | |
| Phenazine ethosulfate (PES) | Sigma-Aldrich | P4544 | >95% |
| mPEG5K (Mn 5,400 g/mol) | Sigma-Aldrich | 81323 | PDI=1.02 |
| Dimethylsolfoxide (DMSO) | Sigma-Aldrich | D4540 | >99.5% |
| Naphthalene | Sigma-Aldrich | 147141 | >99% |
| Phenyl glycidyl ether | Sigma-Aldrich | A32608 | >85% |
| Benzophenone | Sigma-Aldrich | 427551 | >99% |
| Potassium | Sigma-Aldrich | 451096 | >98% |
| Tetrahydrofuran | Caledon Laboratory Chemicals | 8900 1 | ACS |
| Hexane | Caledon Laboratory Chemicals | 5500 1 | ACS |
| Calcium hydride (CaH2) | ACP | C-0460 | >99.5% |
| Diethyl Ether | Caledon Laboratory Chemicals | 1/10/4800 | ACS |
| Microplate reader | BioTek Instruments | ||
| Differential scanning calorimetry (DSC) | TA Instruments Inc | DSC Q100 | |
| Gel permeation chromatography (GPC) | Waters | 2695 separation moldule / 2414 detector | 2 Columns: Agilent Plgel 5 µm Mixed-D |
| NMR spectroscopy | Varian Mercury 400MHz | ||
| Chloroform-d | Sigma-Aldrich | 151858 | 99.96% |
| DMSO-d | Sigma-Aldrich | 156914 | 99.96% |
| Vaccum pump | Gardner Denver Welch Vacuum Tech, Inc. | Ultimate pressure 1x10-4 torr | |
| Drierit with indicator, 8 mesh | Sigma-Aldrich | 238988 | Regenerated at 230 °C for 2 hr |
References
- Dickerson, T. J., Reed, N. N., Janda, K. D. Soluble Polymers as Scaffolds for Recoverable Catalysts and Reagents. Chemical Reviews. 102, 3325-3344 (2002).
- van Heerbeek, R., Kamer, P. C. J., van Leeuwen, P. W. N. M., Reek, J. N. H. Dendrimers as Support for Recoverable Catalysts and Reagents. Chemical Reviews. 102 (10), 3717-3756 (2002).
- Knop, K., Hoogenboom, R., Fischer, D., Schubert, U. S. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 49 (36), 6288-6308 (2010).
- Eetezadi, S., Ekdawi, S. N., Allen, C. The challenges facing block copolymer micelles for cancer therapy: In vivo barriers and clinical translation. Advanced Drug Delivery Reviews. 91, 7-22 (2015).
- Attwood, D., Booth, C., Yeates, S. G., Chaibundit, C., Ricardo, N. Block copolymers for drug solubilisation: Relative hydrophobicities of polyether and polyester micelle-core-forming blocks. International Journal of Pharmaceutics. 345 (1-2), 35-41 (2007).
- Matsumura, Y., Kataoka, K. Preclinical and clinical studies of anticancer agent-incorporating polymer micelles. Cancer Science. 100 (4), 572-579 (2009).
- Chan, A. S., Chen, C. H., Huang, C. M., Hsieh, M. F. Regulation of particle morphology of pH-dependent poly(epsilon-caprolactone)-poly(gamma-glutamic acid) micellar nanoparticles to combat breast cancer cells. Journal of Nanoscience and Nanotechnology. 10 (10), 6283-6297 (2010).
- Diao, Y. Y., et al. Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells. International Journal of Nanomedicine. 6, 1955-1962 (2011).
- Mikhail, A. S., Allen, C. Poly(ethylene glycol)-b-poly(ε-caprolactone) Micelles Containing Chemically Conjugated and Physically Entrapped Docetaxel: Synthesis, Characterization, and the Influence of the Drug on Micelle Morphology. Biomacromolecules. 11 (5), 1273-1280 (2010).
- Kataoka, K., Harada, A., Nagasaki, Y. Block copolymer micelles for drug delivery: design, characterization and biological significance. Advanced Drug Delivery Reviews. 47 (1), 113-131 (2001).
- Nakanishi, T., et al. Development of the polymer micelle carrier system for doxorubicin. Journal of Controlled Release. 74 (1-3), 295-302 (2001).
- Liu, J., Xiao, Y., Allen, C. Polymer-drug compatibility: A guide to the development of delivery systems for the anticancer agent, ellipticine. Journal of Pharmaceutical Sciences. 93 (1), 132-143 (2004).
- Flory, P. J. Molecular Size Distribution in Ethylene Oxide Polymers. Journal of the American Chemical Society. 62 (6), 1561-1565 (1940).
- Kazanskii, K. S., Solovyanov, A. A., Entelis, S. G. Polymerization of ethylene oxide by alkali metal-naphthalene complexes in tetrahydrofuran. European Polymer Journal. 7 (10), 1421-1433 (1971).
- Crothers, M., et al. Micellization and Gelation of Diblock Copolymers of Ethylene Oxide and Styrene Oxide in Aqueous Solution. Langmuir. 18 (22), 8685-8691 (2002).
- Taboada, P., et al. Block Copolymers of Ethylene Oxide and Phenyl Glycidyl Ether: Micellization, Gelation, and Drug Solubilization. Langmuir. 21 (12), 5263-5271 (2005).
- Taboada, P., et al. Micellization and Drug Solubilization in Aqueous Solutions of a Diblock Copolymer of Ethylene Oxide and Phenyl Glycidyl Ether. Langmuir. 22 (18), 7465-7470 (2006).
- Attwood, D., Booth, C. Colloid Stability. , Wiley-VCH Verlag GmbH & Co. KGaA. 61-78 (2010).
- Le Devedec, F., et al. Postalkylation of a Common mPEG-b-PAGE Precursor to Produce Tunable Morphologies of Spheres, Filomicelles, Disks, and Polymersomes. ACS Macro Letters. 5 (1), 128-133 (2016).
- Chtryt, V., Ulbrich, K. Conjugate of Doxorubicin with a Thermosensitive Polymer Drug Carrier. Journal of Bioactive and Compatible Polymers. 16 (6), 427-440 (2001).
- Kataoka, K., et al. Doxorubicin-loaded poly(ethylene glycol)-poly(β-benzyl-l-aspartate) copolymer micelles: their pharmaceutical characteristics and biological significance. Journal of Controlled Release. 64 (1-3), 143-153 (2000).
- Cammas, S., Matsumoto, T., Okano, T., Sakurai, Y., Kataoka, K. Design of functional polymeric micelles as site-specific drug vehicles based on poly (α-hydroxy ethylene oxide-co-β-benzyl l-aspartate) block copolymers. Materials Science and Engineering: C. 4 (4), 241-247 (1997).
- Lv, S., et al. Doxorubicin-loaded amphiphilic polypeptide-based nanoparticles as an efficient drug delivery system for cancer therapy. Acta Biomaterialia. 9 (12), 9330-9342 (2013).
- Kim, J. O., Oberoi, H. S., Desale, S., Kabanov, A. V., Bronich, T. K. Polypeptide nanogels with hydrophobic moieties in the cross-linked ionic cores: synthesis, characterization and implications for anticancer drug delivery. Journal of Drug Targeting. 21 (10), 981-993 (2013).
- Zhao, C. L., Winnik, M. A., Riess, G., Croucher, M. D. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers. Langmuir. 6 (2), 514-516 (1990).
- Wilhelm, M., et al. Poly(styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules. 24 (5), 1033-1040 (1991).
- Cammas, S., Kataoka, K. Functional poly[(ethylene oxide)-co-(β-benzyl-L-aspartate)] polymeric micelles: block copolymer synthesis and micelles formation. Macromolecular Chemistry and Physics. 196 (6), 1899-1905 (1995).
- Kwon, G., et al. Micelles based on AB block copolymers of poly(ethylene oxide) and poly(.beta.-benzyl L-aspartate). Langmuir. 9 (4), 945-949 (1993).
- Ahmed, F., Discher, D. E. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles. Journal of Controlled Release. 96 (1), 37-53 (2004).
- Uhrig, D., Mays, J. W. Experimental techniques in high-vacuum anionic polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 43 (24), 6179-6222 (2005).
- Parker, A. J. The effects of solvation on the properties of anions in dipolar aprotic solvents. Quarterly Reviews, Chemical Society. 16 (2), 163-187 (1962).
- Cram, D. J. Fundamentals o] Carbanion Chemistry. , (1965).
- Szwarc, M. ACS Symposium Series. 166, American chemistry society. 1-15 (1981).
- Cho, Y. W., Lee, J., Lee, S. C., Huh, K. M., Park, K. Hydrotropic agents for study of in vitro paclitaxel release from polymeric micelles. Journal of Controlled Release. 97, 249-257 (2004).
- Dewhurst, P. F., Lovell, M. R., Jones, J. L., Richards, R. W., Webster, J. R. P. Organization of Dispersions of a Linear Diblock Copolymer of Polystyrene and Poly(ethylene oxide) at the Air−Water Interface. Macromolecules. 31 (22), 7851-7864 (1998).
- Opanasopit, P., et al. Block Copolymer Design for Camptothecin Incorporation into Polymeric Micelles for Passive Tumor Targeting. Pharmaceutical Research. 21 (11), 2001-2008 (2004).
- Allen, G., Booth, C., Price, C. VI-The physical properties of poly(epoxides). Polymer. 8, 414-418 (1967).
- Jada, A., Hurtrez, G., Siffert, B., Riess, G. Structure of polystyrene-block-poly(ethylene oxide) diblock copolymer micelles in water. Macromolecular Chemistry and Physics. 197 (11), 3697-3710 (1996).
- Attwood, D., Florence, A. T. Surfactant systems : their chemistry, pharmacy, and biology. , Chapman and Hall. (1983).
- Rekatas, C. J., et al. The effect of hydrophobe chemical structure and chain length on the solubilization of griseofulvin in aqueous micellar solutions of block copoly(oxyalkylene)s. Physical Chemistry Chemical Physics. 3 (21), 4769-4773 (2001).
- Encyclopædia Britannica Online. , http://www.britannica.com/EBchecked/topic/479680/protein/72559/Proteins-of-the-blood-serum (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved