Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La polimerización aniónica de un copolímero anfífilo para la Preparación de micelas de copolímeros de bloques estabilizados por interacciones de apilamiento π-pi
En este artículo
Resumen
Se describen los pasos clave de polimerización aniónica viviente de fenilglicidiléter (PheGE) de metoxi-polietilenglicol (mPEG b -PPheGE). Las micelas de copolímero de bloque resultante (BCMS) fueron cargados con doxorrubicina 14% (% en peso) y la liberación sostenida de fármaco durante 4 días bajo fisiológicamente se obtuvieron condiciones pertinentes.
Resumen
En este estudio, un copolímero anfifílico que incluye un bloque de formación del núcleo con grupos fenilo se sintetizó por polimerización aniónica viviente de éter fenil glicidílico (PheGE) en metoxi-polietilenglicol (mPEG b -PPheGE). Caracterización del copolímero reveló una estrecha distribución molecular (PDI <1,03) y confirmó el grado de polimerización de 122 mPEG - b - (PheGE) 15. Se evaluó la concentración micelar crítica del copolímero usando un método de fluorescencia establecido con el comportamiento de agregación evaluadas por dispersión de luz dinámica y la microscopía electrónica de transmisión. El potencial del copolímero para uso en aplicaciones de administración de fármacos se evaluó de manera preliminar incluyendo biocompatibilidad in vitro, la carga y la liberación de la doxorrubicina, un medicamento anticancerígeno hidrófobo (DOX). Una formulación micelar estable de DOX fue preparado con niveles de carga de drogas hasta el 14% (% en peso), la carga de fármaco efficicias> 60% (w / w) y de liberación sostenida de fármaco durante 4 días bajo condiciones fisiológicamente pertinentes (pH ácido y neutro, la presencia de albúmina). El nivel de carga de fármaco de liberación sostenida y se atribuye a la estabilización de las interacciones pi-π entre DOX y el bloque de formación del núcleo de las micelas.
Introducción
En medios acuosos, los copolímeros de bloques anfifílicos se reúnen para formar micelas de copolímeros de bloque de tamaño nanométrico (BCMS) que consisten en un núcleo hidrofóbico rodeado por una envoltura hidrofílica o corona. El núcleo de la micela puede servir como un depósito para la incorporación de fármacos hidrófobos; mientras que, la corona hidrófilo proporciona una interfaz entre el núcleo y el medio externo. El poli (etilenglicol) (PEG) y sus derivados son una de las clases más importantes de los polímeros y uno de los más ampliamente utilizados en la formulación del fármaco. 1-3 BCM han demostrado ser una plataforma de administración de fármacos digno con varias formulaciones de confiar en este tecnología ahora en desarrollo clínico etapa tardía. 4 por lo general, el bloque hidrófobo del copolímero se compone de policaprolactona, poli (D, L-lactida), poli (óxido de propileno) o poli (β-bencil-L-aspartato). 5 -9
El grupo de Kataoka investigó micelas esféricas formadas a partir de PEO b -PBLA Y poli (óxido de etileno) - b -. (Ácido poliaspártico conjugado con doxorrubicina) para la entrega de la doxorrubicina (DOX) 10,11 En sus informes, que proponen que las interacciones π-pi entre el fármaco conjugado con polímero o PBLA y libre de DOX actuar para estabilizar el núcleo de la micela resulta en aumentos de la carga de fármaco y la retención. Se establece que la compatibilidad o la interacción entre un fármaco y el bloque de formación del núcleo son factores determinantes de los parámetros clave relacionados con el rendimiento. 12 Además de DOX, un número de la terapéutica del cáncer incluyen anillos aromáticos dentro de su estructura de núcleo (por ejemplo, metotrexato, olaparib, SN -38).
Como resultado, existe un interés significativo en la síntesis de copolímeros que incluyen anillos de bencilo en sus bloques que forman el núcleo. Polimerización por apertura de anillo aniónica de PEG y sus derivados permiten el control sobre el peso molecular y el resultado en materiales de baja polidispersidad con buen rendimiento. 13,14 éthylene con óxido de fenilglicidiléter (PheGE) u óxido de estireno (SO) puede ser (co) polimeriza para formar copolímeros de bloque que forman micelas para la solubilización de fármacos hidrófobos. 15-18 El presente informe se describen los pasos necesarios para vivir polimerización aniónica de fenil glicidilo monómero de éter de mPEG-OH como macroiniciador (Figura 1). El copolímero de bloque resultante y sus agregados se caracterizan a continuación en términos de propiedades de relevancia para su uso en la administración de fármacos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
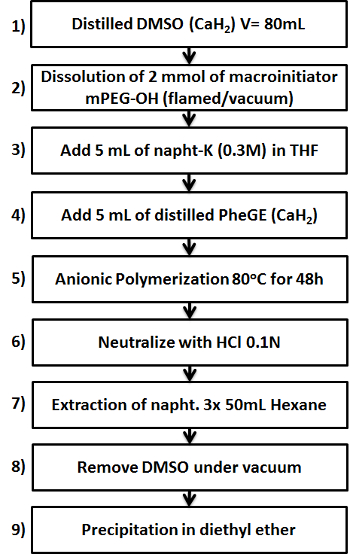
Figura 1. Esquema que muestra las nueve pasos clave en la preparación del copolímero b -PPheGE mPEG. Por favor, haga clic aquí para ver una versión más grande de esta figura.
1. Preparación de los reactivos en condiciones secas
- Preparación de los reactivos.
- Pesar 15 g de mPEG-5K (M n = 5400 g / mol, PDI 1,03) y el lugar a 50 ° C en un horno a vacío durante 48 horas antes de su uso.
- Seco 200 ml de dimetilsulfóxido (DMSO) sobre hidruro de calcio (CaH 2) (~ 1 g), lugar bajo vacío durante 30 min, purga en atmósfera de argón y se agita durante 48 h antes de usar.
- Introducir 50 ml de monómero PheGE en un frasco limpio y seco (100 ml), se añade 1 g de CaH2, sellado al vacío durante 15 minutos en hielo, en atmósfera de argón purgay dejar en agitación durante 24 h bajo argón antes de su uso.
2. Preparación del naftaleno de potasio
- Con cuidado, cortar pequeños trozos de sodio (~ 1,5 g) se secó con hexano para eliminar el exceso de aceite mineral y añadir al matraz redondo que contiene el tetrahidrofurano (THF) (V = 500 ml).
NOTA: Los trozos de sodio no deben exponerse al aire por mucho tiempo debido al riesgo de incendio. - Añadir benzofenona (~ 5 g), se purga con argón y sellar el matraz redondo (2 cuellos) con tapones de vidrio.
- Después de agitación bajo atmósfera de argón durante 24 h, el matraz de fondo redondo a un aparato de destilación (Figura 2), destilar la solución oscura en atmósfera de argón mientras reflujo (es decir, reflujo durante aproximadamente un período de 2 horas después de la solución se vuelve azul). Comenzar a recoger el volumen deseado ~ 150 ml de THF mediante el cierre de la válvula izquierda (que se encuentra en el medio del aparato de destilación).
NOTA: Si esta solución no se vuelve azul, detener la distilmento, se enfríe a temperatura ambiente (TA) y añadir más benzofenona o sodio y reiniciar la destilación. Esto es una indicación de que THF todavía contiene agua. - En un Erlenmeyer seco, añadir THF destilado (V = 100 ml) y se disuelven 3,9 g de naftaleno.
NOTA: Detener la destilación, se enfríe a temperatura ambiente y abra la válvula de derecho de transferir el volumen de THF. - Como se describe en el punto 2.1, cortar pequeños trozos de potasio (1,1 g) y se añade a la solución que contiene el naftaleno (concentración final ~ 0,3 mol / L). Sellar el erlenmeyer con un adaptador de lavado (T) (on / off) con un tapón en la parte superior y se purga con argón.
- Después de agitación bajo atmósfera de argón durante 24 horas, observar la solución resultante de la base de naftaleno de potasio como un color verde oscuro homogéneo.
- En condiciones inertes, retirar una alícuota de 5 ml de la solución básica del matraz con una jeringuilla y añadir a 10 ml de agua destilada. Posteriormente añadir 1-2 gotas de indicador de fenolftaleína a esta solución,que convierte la solución de un color fucsia.
- Utilice una bureta para valorar la solución de naftaleno de potasio con una solución estándar de ácido clorhídrico (0,1 N) hasta que la solución se vuelve incolora.
3. Materiales y precauciones necesarias para una efectiva estar polimerización aniónica
- Sistema de argón / colector de vacío.
NOTA: Como se describe en la Figura 2, un colector de doble vidrio con llaves de paso de vidrio huecas se utiliza para cambiar entre las condiciones de entrega de argón y de vacío en el material de vidrio.- Conectar el depósito de argón (con manómetro) a una columna desecante seco y con la línea de enlace mediante un tubo de goma inerte. En el otro extremo de la línea de argón, conectar un burbujeador (que contiene aceite mineral).
- Para las llaves de paso de vidrio, conectar tubos flexibles inertes y agujas. Para la otra línea del colector, conectar una trampa de vidrio sumergido en un matraz Dewar frío (lleno de hielo / agua o nitrógeno líquido) a una bomba de alto vacío.
- Aparato de destilación de monómero y DMSO.
NOTA: Una conveniente (es decir, todo en uno) aparato de destilación al alto vacío se emplea (Figura 2). El material de vidrio seco se hace con válvulas de alto vacío y condensadores incorporados con un cabezal refrigerado interior.- Conectar el flujo de agua a través de la entrada (A) y la salida (B) de la unidad de refrigeración (letra). Conectar el otro de entrada / salida (C) a la doble colector para argón / vacío. Agregar y sellar un tabique (alambres de metal) en el puerto de suministro / extracción y conectar una cánula de acero inoxidable para la transferencia de líquidos sensibles al aire (D) (en la parte superior / loop).
- Antes de la polimerización, destilar PheGE y DMSO en mantas calefactoras semiesféricas a 100 ° C y 70 ° C, respectivamente, durante 2 horas a vacío con agitación. punto de ebullición del monómero PheGE es 254 ° C mientras que el punto de ebullición de DMSO es de 189 ° C en (1 atm).
- Cristalería para polymerizat aniónicoion.
- Además del sistema de destilación, aparatos de vidrio resistente a alto vacío incluyendo ronda matraces de fondo (certificados por el fabricante), cilindros graduados (para la transferencia de volúmenes de disolvente, la base y monómeros), cánulas, septos y alambres de metal para sellar los septos.
NOTA: Para la polimerización, el calor de estar cuidadosamente (en vacío) y enfriar el material de vidrio bajo un flujo de argón antes de su uso. Mantenga la pistola de calor a una distancia ~ 10 cm de la cristalería.
- Además del sistema de destilación, aparatos de vidrio resistente a alto vacío incluyendo ronda matraces de fondo (certificados por el fabricante), cilindros graduados (para la transferencia de volúmenes de disolvente, la base y monómeros), cánulas, septos y alambres de metal para sellar los septos.
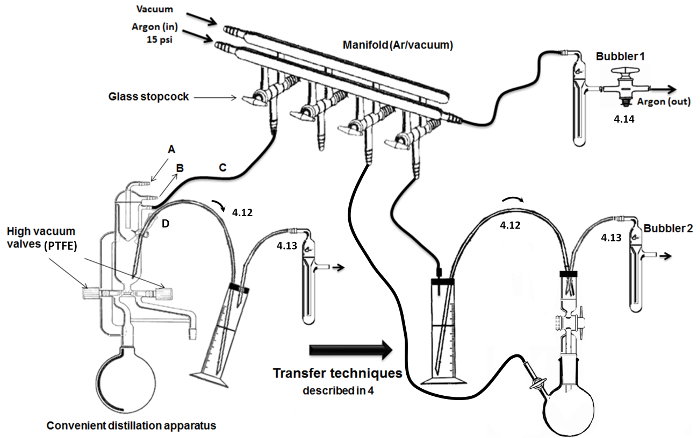
Figura 2. Montaje y principales etapas de destilación / transferencia. Por favor, haga clic aquí para ver una versión más grande de esta figura.
4. Descripción de los pasos clave de estar aniónicos de polimerización: Destilación y Transferencia
- Pesar mPEG-5K (2 mmol, 10 g) en una f secalask / Schlenk (horno) que contiene una barra de agitación y sellar el adaptador de lavado (T) (on / off) con un tapón en la parte superior.
- Conectar el matraz al colector y purgar el matraz durante 2-3 minutos con argón rubores. Girar la válvula a la posición de vacío para purgar el matraz.
- Girar el matraz de forma manual y secar el recipiente de reacción homogénea con un secador de pelo (pistola de aire caliente) hasta que mPEG-5K se derrite.
NOTA: Mantenga la pistola de calor a una distancia de 10 cm ~ del matraz. - Después de 1 min, romper el vacío girando la válvula en el colector hacia la posición de argón con varios broches de presión rápidas.
NOTA: Un flujo de argón continua tiene que ser observado en el burbujeador. Cuando el flujo es continuo, la válvula permanece en la posición de argón. de calefacción y refrigeración Repita los pasos dos veces para eliminar todo rastro de humedad. - Mantenga el macroiniciador polimérico al vacío durante ~ 2 horas y en atmósfera de argón antes de que comience la reacción.
- Monte dos aparatos de destilación de alto vacío bajo el capó (Figure 2); uno para la destilación de DMSO y uno para la destilación del monómero (PheGE).
- Conectar los matraces separados que contienen el DMSO y el monómero a los dos aparatos e instalar cada uno en una manta de calefacción semiesférica (o en un baño de aceite). Conectar agua fría a la parte superior del aparato (entrada / salida) y al colector (argón / vacío).
- Asegúrese de que cada aparato es seguro y bien sellada. Involucrar al vacío a través de la válvula.
NOTA:. Como se describe en el paso 3.3, repetir la calefacción y la refrigeración de los pasos dos veces para eliminar todo rastro de humedad. - Ajuste la calefacción a través de un controlador de temperatura y empezar a agitar las soluciones. Después de 2 h de circulación / destilación de DMSO, cerrar la válvula de vacío de alta (que se encuentra en el medio del aparato de destilación) para recoger aproximadamente 20 ml de la solución (para lavar el interior del aparato). A continuación, suelte la fracción en el matraz y repetir la operación una vez más para asegurar la pureza de la fracción deseada que es collected más tarde.
- Calentar el matraz que contiene el estándar MPEG-5K (al vacío) con la pistola de calor hasta que el polímero (MPEG-5K) se derrite. Purgar de nuevo con argón.
NOTA: El procedimiento ayudará a la disolución después de la transferencia del DMSO. - Después de 2 horas, cierre la válvula de alto vacío y se recoge el volumen de disolvente (DMSO V = ~ 100 ml). Detener el calentamiento y romper el vacío del colector. Soltar argón (por broches de presión) en la cámara como se describió anteriormente.
- Bajo una presión positiva de argón, conectar un lado de la cánula (retención en la llave de paso del aparato) a un cilindro graduado o directamente en el matraz que contiene el mPEG-5K (si el aparato de destilación tiene graduación) y, sumergir el otro extremo cuidadosamente en la fracción recién destilado.
- El uso de presión de argón, conducir el DMSO a través de la cánula en el matraz de reacción. Conectar un pelele extra para el frasco (o cilindro si es necesario para la medición) y, cerrar la llave de vidrio conectado a the burbujeador en el lado opuesto del colector.
NOTA: Cuando se elimina un lado de una cánula para la transferencia, asegúrese de que se aplica una presión positiva de argón. - Para evitar accidentes causados por presión de argón, abra la llave de vidrio de 1-2 segundos y volver a cerrar para continuar el flujo de DMSO (se repite una vez por cada 0,5 minutos) hasta que se complete la transferencia completa. Vuelva a abrir la llave de paso cuando haya terminado.
NOTA: El mismo procedimiento ahora se debe seguir para la destilación y la recogida del monómero. El disolvente y el monómero no se pueden recoger al mismo tiempo. - Transferir 5 ml de potasio 0,3 M a través de la canalización de naftaleno en una probeta sellada por un tabique con cánula insertada (circular).
NOTA: La misma precaución como se describe en la Nota 4.13. presión de argón positiva debe mantenerse primero del matraz naftaleno de potasio al cilindro y luego desde el cilindro al matraz de reacción para evitar la contaminación de aire / agua. - Insertar otra aguja de la manifold en el cilindro (argón). Retire la cánula conectado al sistema de destilación cuidadosamente e insertar rápidamente en el matraz de reacción.
NOTA: El uso de esta técnica para la transferencia de base y monómero. - Añadir la caída de base a gota hasta que la solución se vuelve oscura. Tras la lenta desaparición de color, añadir otra parte hasta que el color oscuro aparece de nuevo, y repetir hasta que la transferencia completa.
- Transferir el volumen deseado de monómero (V PheGE = 5 ml) para alcanzar un grado de polimerización de PPheGE ~ n = 18-20.
- Deja la reacción durante 48 horas a 80 ° C en atmósfera de argón con agitación constante para asegurar la polimerización completa.
- Se detiene la reacción mediante la adición de gotas de HCl 1 N en metanol (medidos usando papel de tornasol (pH neutro)) y observado por una desaparición del color.
- Extraer el naftaleno de la solución de DMSO con hexano (3 x 50 ml). Retire el DMSO por destilación al vacío ~ 70 ml (mismo aparato). Arrullol por la disolución de suspensión y añadir 50 ml de THF.
- Eliminar la sal de la solución en suspensión por centrifugación a 5000 xg durante 10 min. Transferir el sobrenadante, y añadir gota a gota a 500 ml de éter dietílico frío.
- Recoger el precipitado por filtración o centrifugación (repetir dos veces) y se seca bajo vacío a 30 ° C durante 24 a 48 horas (rendimiento 85%).
NOTA: El copolímero está ahora listo para su caracterización.
5. Caracterización de los copolímeros
- Pesar 5-10 mg de copolímero (registro de la masa real) en un plato de muestras de aluminio y sellar herméticamente con la tapa de aluminio. Carga del bombo y platillo de referencia de la muestra (vacío) en el calorímetro diferencial de barrido.
- Programa de un método ( "calor / frío / calor") Ciclo: 1) el calor de 40 ° C a 100 ° C a 10 ° C / min, 2) frío hasta -70 ° C a 10 ° C / min, 3) de calor a 100 ° C a 10 ° C / min. Repita 2) y 3) dos veces. Determinación del punto de fusión (Tm), criallization (T c) y temperaturas de transición vítrea (Tg), y el calor de fusión (? H f) a partir de las huellas térmicas desde el tercer ciclo (si es aplicable).
- Disolver los polímeros en THF (2 mg / ml) y se filtra a través de un filtro de PTFE de 0,2 micras. Se inyecta la muestra en un sistema de cromatografía de permeación de gel (50 l) y usar el tiempo de retención de la muestra y una curva de calibración producida usando una serie de patrones de poliestireno para determinar el peso molecular del polímero. 19
- Disolver los (co) polímeros (15 mg / ml) en DMSO d6 para el análisis de espectroscopía 1 H RMN. 19
- Determinar la concentración micelar crítica (CMC) del copolímero utilizando 1,6-difenil-1,3,5-hexatrieno (DPH) como una sonda de fluorescencia. 9
- Se prepara una solución de stock DPH en THF (2,32 mg / L) en la oscuridad y añadir 100 l de esta solución madre a cada uno de una serie de viales.
- AEEre una solución de copolímero de valores en THF y añadir partes alícuotas de igual volumen (2 ml) a la serie de viales (cada uno que contiene una parte alícuota de la solución madre DPH), resultando en concentraciones finales de copolímero que van desde 0,01 a 1,000 g de copolímero / ml.
- Posteriormente, vórtice soluciones del copolímero-DPH y añadir gota a gota a 10 ml de agua bidestilada con agitación bar. Las soluciones deben entonces ser agitó vigorosamente en la oscuridad durante 48 h bajo una corriente de nitrógeno para permitir la evaporación lenta de THF. La concentración final de DPH en cada solución es 0.232 mg / L.
- Medir la emisión de fluorescencia de las muestras a 430 nm (λ ex = 350 nm) utilizando un espectrofluorímetro de microplacas de doble escaneo y la fluorescencia parcela frente a log [polímero]. La intersección entre las dos pistas lineales proporciona el valor de la CMC para el copolímero.
6. Procedimiento para la carga de doxorrubicina en BCM
- Disolver 12 mg de DOX en 1 ml de acetonitrile, añadir 10 l de trietilamina y se dejó que la solución de agitación en la oscuridad durante 2 horas.
- Se disuelve el copolímero (45 mg) en 1 ml de THF y se agita durante el mismo período de tiempo. Añadir la solución de copolímero a la solución de DOX y enjuague el vial que contiene copolímero residual con un volumen adicional de THF (0,5 ml).
- Añadir la mezcla de copolímero de drogas (2,5 ml) gota a gota a un vial (20 ml) que contiene 15 ml de solución salina 0,9% (NaCl) con agitación.
- Transferir la solución a una bolsa de diálisis (3,5 kDa cortada) y dializar contra solución salina 0,9% (500 ml).
NOTA: Cambiar la solución salina externo después de 6 horas y dejar que la diálisis continuar durante 24 horas con agitación en la oscuridad a temperatura ambiente. - Transferir el líquido de diálisis a un tubo de 50 ml y centrifugar a 5000 xg durante 15 min.
- Transferir el sobrenadante a un sistema de ultrafiltración (con una capacidad de 10 ml) que contiene una membrana de diálisis (corte 10 kDa). Ponga el adaptador de agitación en el sistema de la ultrafiltración, cierre la tapa y abierto a loTREAM de nitrógeno.
- Se concentra la solución de BCM a un volumen de 4 ml y añadir 6 ml de solución salina fresca y repetir el procedimiento dos veces.
- Se concentra la solución de BCM a 4 ml, enjuagar la cámara con 0,5 ml de solución salina y añadir a la solución. Conservar en frascos de color marrón a temperatura ambiente en el antes de su uso aún más oscuro.
7. Evaluación de doxorrubicina Carga de DOX-BCM
- Disolver DOX-BCM en dimetilformamida (100 l en 400 l) para interrumpir las micelas y se diluye en solución acuosa de HCl (0,1 N) antes de la evaluación (100 l en 900 l de HCl 0,1 N).
- Medir la carga de fármaco en 490 nm utilizando un sistema de sobremesa de microplacas espectrofotométrico. Use las siguientes ecuaciones para determinar la capacidad de carga de fármaco (DLC) y la eficiencia de carga de fármaco (DLE):
DLC (% en peso) = (peso de fármaco cargado / peso total de BCM) x 100%
DLE (%) = (peso de fármaco cargado / peso de fármaco en la alimentación) x 100%
8. Evaluaciónde liberación in vitro de DOX de DOX-BCM
- Investigar la liberación de DOX de BCM a 37 ° C en solución salina 0,1 M tamponada con fosfato (PBS, pH 7,4) frente a PBS pH 7,4 que contiene 0,1% (w / v) de Tween 80, BCM + BSA (50 mg / ml) frente a PBS pH 7,4 y acetato de tampón 0,1 M a pH = 5,5. 20,21
- Se diluye la formulación BCM-DOX (700 l) en el tampón seleccionado (2,3 ml) para dar como resultado una cantidad total de ≈ 0,6-0,7 mg de DOX en la bolsa de diálisis.
- Coloque la solución en la bolsa de diálisis, sellar con pinzas y sumergir la bolsa en 200 ml de los respectivos medios externos.
- Retire 2 ml de la solución fuera de la bolsa de diálisis en los puntos de tiempo predeterminados y reemplazar con el mismo volumen de tampón fresco.
- Almacenar las alícuotas retiradas a -20 ° C antes de su análisis por espectrofotometría UV-Vis (Abs 490 nm). El porcentaje acumulado de fármaco liberado (E r) se puede calcular utilizando la siguiente ecuación:

NOTA: Donde m DOX representa la cantidad de DOX en el BCM, V 0 es el volumen total de los medios de liberación (200 ml), V t es el volumen de los medios de comunicación sustituidos (V t = 2 ml), Ci es la concentración antes de la corrección, y C n representa la concentración de DOX en la muestra.
Access restricted. Please log in or start a trial to view this content.
Resultados
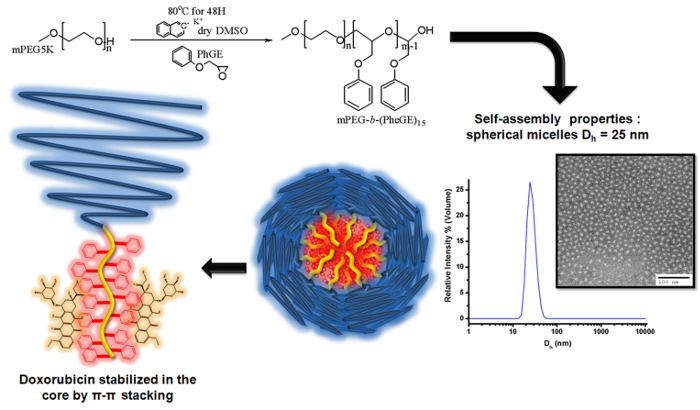
Figura 3. Ilustración de la polimerización aniónica de fenil glicidil éter en mPEG macroiniciador para producir mPEG b - (PheGE) 15 para la preparación de micelas de copolímeros de bloque para la carga de doxorubicina El esquema ilustra la desprotonación del grupo hidroxilo de mPEG utilizando potasio naftaleno.
Access restricted. Please log in or start a trial to view this content.
Discusión
Debido al buen control de la polimerización aniónica que ofrece más de peso molecular que es uno de los procesos más aplicados en la industria para la preparación de polímeros basados en monómeros de oxirano (PEG y PPG). Las condiciones óptimas y estrictas deben ser utilizados para que se logre la polimerización éxito. rigurosa purificación de todos los reactivos y aparatos apropiados son esenciales para el carácter vivo de la síntesis. Limitaciones de la configuración actual se asocian generalmente ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
CA acknowledges a Discovery grant from the Natural Sciences and Engineering Research Council of Canada. CA acknowledges a Chair in Pharmaceutics and Drug Delivery from GSK. The authors declare no competing financial interest.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM/HAMF12 | Gibco, Life Technologies | 12500 | Supplemented with 10% FBS. Warm in 37 °C water bath. |
| Trypsin-EDTA (0.25%) | Sigma-Aldrich | T4049 | Warm in 37 °C water bath |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F1051 | Canada origin |
| MDA-MB-468 cell line | ATCC | HTB-132 | |
| MTS tetrazolium reagent | PROMEGA | G111B | |
| Phenazine ethosulfate (PES) | Sigma-Aldrich | P4544 | >95% |
| mPEG5K (Mn 5,400 g/mol) | Sigma-Aldrich | 81323 | PDI=1.02 |
| Dimethylsolfoxide (DMSO) | Sigma-Aldrich | D4540 | >99.5% |
| Naphthalene | Sigma-Aldrich | 147141 | >99% |
| Phenyl glycidyl ether | Sigma-Aldrich | A32608 | >85% |
| Benzophenone | Sigma-Aldrich | 427551 | >99% |
| Potassium | Sigma-Aldrich | 451096 | >98% |
| Tetrahydrofuran | Caledon Laboratory Chemicals | 8900 1 | ACS |
| Hexane | Caledon Laboratory Chemicals | 5500 1 | ACS |
| Calcium hydride (CaH2) | ACP | C-0460 | >99.5% |
| Diethyl Ether | Caledon Laboratory Chemicals | 1/10/4800 | ACS |
| Microplate reader | BioTek Instruments | ||
| Differential scanning calorimetry (DSC) | TA Instruments Inc | DSC Q100 | |
| Gel permeation chromatography (GPC) | Waters | 2695 separation moldule / 2414 detector | 2 Columns: Agilent Plgel 5 µm Mixed-D |
| NMR spectroscopy | Varian Mercury 400MHz | ||
| Chloroform-d | Sigma-Aldrich | 151858 | 99.96% |
| DMSO-d | Sigma-Aldrich | 156914 | 99.96% |
| Vaccum pump | Gardner Denver Welch Vacuum Tech, Inc. | Ultimate pressure 1x10-4 torr | |
| Drierit with indicator, 8 mesh | Sigma-Aldrich | 238988 | Regenerated at 230 °C for 2 hr |
Referencias
- Dickerson, T. J., Reed, N. N., Janda, K. D. Soluble Polymers as Scaffolds for Recoverable Catalysts and Reagents. Chemical Reviews. 102, 3325-3344 (2002).
- van Heerbeek, R., Kamer, P. C. J., van Leeuwen, P. W. N. M., Reek, J. N. H. Dendrimers as Support for Recoverable Catalysts and Reagents. Chemical Reviews. 102 (10), 3717-3756 (2002).
- Knop, K., Hoogenboom, R., Fischer, D., Schubert, U. S. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 49 (36), 6288-6308 (2010).
- Eetezadi, S., Ekdawi, S. N., Allen, C. The challenges facing block copolymer micelles for cancer therapy: In vivo barriers and clinical translation. Advanced Drug Delivery Reviews. 91, 7-22 (2015).
- Attwood, D., Booth, C., Yeates, S. G., Chaibundit, C., Ricardo, N. Block copolymers for drug solubilisation: Relative hydrophobicities of polyether and polyester micelle-core-forming blocks. International Journal of Pharmaceutics. 345 (1-2), 35-41 (2007).
- Matsumura, Y., Kataoka, K. Preclinical and clinical studies of anticancer agent-incorporating polymer micelles. Cancer Science. 100 (4), 572-579 (2009).
- Chan, A. S., Chen, C. H., Huang, C. M., Hsieh, M. F. Regulation of particle morphology of pH-dependent poly(epsilon-caprolactone)-poly(gamma-glutamic acid) micellar nanoparticles to combat breast cancer cells. Journal of Nanoscience and Nanotechnology. 10 (10), 6283-6297 (2010).
- Diao, Y. Y., et al. Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells. International Journal of Nanomedicine. 6, 1955-1962 (2011).
- Mikhail, A. S., Allen, C. Poly(ethylene glycol)-b-poly(ε-caprolactone) Micelles Containing Chemically Conjugated and Physically Entrapped Docetaxel: Synthesis, Characterization, and the Influence of the Drug on Micelle Morphology. Biomacromolecules. 11 (5), 1273-1280 (2010).
- Kataoka, K., Harada, A., Nagasaki, Y. Block copolymer micelles for drug delivery: design, characterization and biological significance. Advanced Drug Delivery Reviews. 47 (1), 113-131 (2001).
- Nakanishi, T., et al. Development of the polymer micelle carrier system for doxorubicin. Journal of Controlled Release. 74 (1-3), 295-302 (2001).
- Liu, J., Xiao, Y., Allen, C. Polymer-drug compatibility: A guide to the development of delivery systems for the anticancer agent, ellipticine. Journal of Pharmaceutical Sciences. 93 (1), 132-143 (2004).
- Flory, P. J. Molecular Size Distribution in Ethylene Oxide Polymers. Journal of the American Chemical Society. 62 (6), 1561-1565 (1940).
- Kazanskii, K. S., Solovyanov, A. A., Entelis, S. G. Polymerization of ethylene oxide by alkali metal-naphthalene complexes in tetrahydrofuran. European Polymer Journal. 7 (10), 1421-1433 (1971).
- Crothers, M., et al. Micellization and Gelation of Diblock Copolymers of Ethylene Oxide and Styrene Oxide in Aqueous Solution. Langmuir. 18 (22), 8685-8691 (2002).
- Taboada, P., et al. Block Copolymers of Ethylene Oxide and Phenyl Glycidyl Ether: Micellization, Gelation, and Drug Solubilization. Langmuir. 21 (12), 5263-5271 (2005).
- Taboada, P., et al. Micellization and Drug Solubilization in Aqueous Solutions of a Diblock Copolymer of Ethylene Oxide and Phenyl Glycidyl Ether. Langmuir. 22 (18), 7465-7470 (2006).
- Attwood, D., Booth, C. Colloid Stability. , Wiley-VCH Verlag GmbH & Co. KGaA. 61-78 (2010).
- Le Devedec, F., et al. Postalkylation of a Common mPEG-b-PAGE Precursor to Produce Tunable Morphologies of Spheres, Filomicelles, Disks, and Polymersomes. ACS Macro Letters. 5 (1), 128-133 (2016).
- Chtryt, V., Ulbrich, K. Conjugate of Doxorubicin with a Thermosensitive Polymer Drug Carrier. Journal of Bioactive and Compatible Polymers. 16 (6), 427-440 (2001).
- Kataoka, K., et al. Doxorubicin-loaded poly(ethylene glycol)-poly(β-benzyl-l-aspartate) copolymer micelles: their pharmaceutical characteristics and biological significance. Journal of Controlled Release. 64 (1-3), 143-153 (2000).
- Cammas, S., Matsumoto, T., Okano, T., Sakurai, Y., Kataoka, K. Design of functional polymeric micelles as site-specific drug vehicles based on poly (α-hydroxy ethylene oxide-co-β-benzyl l-aspartate) block copolymers. Materials Science and Engineering: C. 4 (4), 241-247 (1997).
- Lv, S., et al. Doxorubicin-loaded amphiphilic polypeptide-based nanoparticles as an efficient drug delivery system for cancer therapy. Acta Biomaterialia. 9 (12), 9330-9342 (2013).
- Kim, J. O., Oberoi, H. S., Desale, S., Kabanov, A. V., Bronich, T. K. Polypeptide nanogels with hydrophobic moieties in the cross-linked ionic cores: synthesis, characterization and implications for anticancer drug delivery. Journal of Drug Targeting. 21 (10), 981-993 (2013).
- Zhao, C. L., Winnik, M. A., Riess, G., Croucher, M. D. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers. Langmuir. 6 (2), 514-516 (1990).
- Wilhelm, M., et al. Poly(styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules. 24 (5), 1033-1040 (1991).
- Cammas, S., Kataoka, K. Functional poly[(ethylene oxide)-co-(β-benzyl-L-aspartate)] polymeric micelles: block copolymer synthesis and micelles formation. Macromolecular Chemistry and Physics. 196 (6), 1899-1905 (1995).
- Kwon, G., et al. Micelles based on AB block copolymers of poly(ethylene oxide) and poly(.beta.-benzyl L-aspartate). Langmuir. 9 (4), 945-949 (1993).
- Ahmed, F., Discher, D. E. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles. Journal of Controlled Release. 96 (1), 37-53 (2004).
- Uhrig, D., Mays, J. W. Experimental techniques in high-vacuum anionic polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 43 (24), 6179-6222 (2005).
- Parker, A. J. The effects of solvation on the properties of anions in dipolar aprotic solvents. Quarterly Reviews, Chemical Society. 16 (2), 163-187 (1962).
- Cram, D. J. Fundamentals o] Carbanion Chemistry. , (1965).
- Szwarc, M. ACS Symposium Series. 166, American chemistry society. 1-15 (1981).
- Cho, Y. W., Lee, J., Lee, S. C., Huh, K. M., Park, K. Hydrotropic agents for study of in vitro paclitaxel release from polymeric micelles. Journal of Controlled Release. 97, 249-257 (2004).
- Dewhurst, P. F., Lovell, M. R., Jones, J. L., Richards, R. W., Webster, J. R. P. Organization of Dispersions of a Linear Diblock Copolymer of Polystyrene and Poly(ethylene oxide) at the Air−Water Interface. Macromolecules. 31 (22), 7851-7864 (1998).
- Opanasopit, P., et al. Block Copolymer Design for Camptothecin Incorporation into Polymeric Micelles for Passive Tumor Targeting. Pharmaceutical Research. 21 (11), 2001-2008 (2004).
- Allen, G., Booth, C., Price, C. VI-The physical properties of poly(epoxides). Polymer. 8, 414-418 (1967).
- Jada, A., Hurtrez, G., Siffert, B., Riess, G. Structure of polystyrene-block-poly(ethylene oxide) diblock copolymer micelles in water. Macromolecular Chemistry and Physics. 197 (11), 3697-3710 (1996).
- Attwood, D., Florence, A. T. Surfactant systems : their chemistry, pharmacy, and biology. , Chapman and Hall. (1983).
- Rekatas, C. J., et al. The effect of hydrophobe chemical structure and chain length on the solubilization of griseofulvin in aqueous micellar solutions of block copoly(oxyalkylene)s. Physical Chemistry Chemical Physics. 3 (21), 4769-4773 (2001).
- Encyclopædia Britannica Online. , http://www.britannica.com/EBchecked/topic/479680/protein/72559/Proteins-of-the-blood-serum (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados