A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
منهجيات لدراسة
In This Article
Summary
This study presents the development of reproducible methodologies to study biofilm inhibitors and their effects on Bacillus subtilis multicellularity.
Abstract
This work assesses different methodologies to study the impact of small molecule biofilm inhibitors, such as D-amino acids, on the development and resilience of Bacillus subtilis biofilms. First, methods are presented that select for small molecule inhibitors with biofilm-specific targets in order to separate the effect of the small molecule inhibitors on planktonic growth from their effect on biofilm formation. Next, we focus on how inoculation conditions affect the sensitivity of multicellular, floating B. subtilis cultures to small molecule inhibitors. The results suggest that discrepancies in the reported effects of such inhibitors such as D-amino acids are due to inconsistent pre-culture conditions. Furthermore, a recently developed protocol is described for evaluating the contribution of small molecule treatments towards biofilm resistance to antibacterial substances. Lastly, scanning electron microscopy (SEM) techniques are presented to analyze the three-dimensional spatial arrangement of cells and their surrounding extracellular matrix in a B. subtilis biofilm. SEM facilitates insight into the three-dimensional biofilm architecture and the matrix texture. A combination of the methods described here can greatly assist the study of biofilm development in the presence and absence of biofilm inhibitors, and shed light on the mechanism of action of these inhibitors.
Introduction
المجتمعات البكتيرية متعددة الخلايا تلعب أدوارا هامة في البيئات الطبيعية والبشرية، ويمكن أن تكون مفيدة أو ضارة للغاية. ومن المعروف أن هذه المستعمرات متعددة الخلايا كما الأغشية الحيوية، حيث يتم تضمين الخلايا الفردية في المواد البوليمرية خارج الخلية الذات المنتجة (EPS) المصفوفة. العائد على السهم تلتزم بقوة الخلايا على سطح أنها استعمار. أنها بمثابة درع ضد القوات الميكانيكية والكيميائية وإنشاء اتصال وثيق بين الخلايا المجاورة، وتسهيل الاتصالات الخلوية 1. يمكن مشاهدة بيوفيلم كمجتمع متباينة، حيث تستخدم الخلايا درجة عالية من التنظيم، منسقة عمليات لتنسيق أنشطتها داخل المجتمع، وكذلك عبر الأنواع 2-5. وكثيرا ما يرتبط الانتقال من العوالق، ووضع حرة المعيشة للنمو إلى حالة بيوفيلم مع العمليات التنموية. وخير مثال هو بكتيريا التربة العصوية الرقيقة موجبة الجرام، وبالتالي على undomeيخدم سلالة sticated كما كائن نموذج قوي لدراسة مراحل النمو مما يؤدي إلى تشكيل بيوفيلم. في هذه البكتيريا وخلايا متحركة تنظيم أنفسهم في هياكل متعددة الخلايا واضح لتنفيذ مهام متخصصة 4. مجموعة واحدة من الخلايا، المنتجين مصفوفة تفرز exopolysaccharides 6، بروتين اميلويد الطاسه 7،8، والبروتين للا مائية سطح BslA 9،10. وكلها مشاركة في الجمعية العامة للEPS 11-13.
وبالنظر إلى وفرة من الأغشية الحيوية في المنافذ الطبيعية والبشرية والضرر القاتل المفترض أنها يمكن أن تسبب، هناك حاجة ملحة لايجاد سبل لمنع تكونها. يمكن مثبطات جزيء صغير مساعدة في اكتشاف مسارات تنظيمية جديدة، والانزيمات والبروتينات الهيكلية تشارك في تشكيل بيوفيلم، وبالتالي تعزيز الرؤى في العمليات المعقدة التجمع مجتمع متعدد الخلايا. كما B. الرقيقة هو نموذج المدروس لالحيويتشكيل الفيلم 14،15، ويمكن استخدامه لتقييم آثار مختلف مثبطات بيوفيلم. تتناول هذه الدراسة أربعة أساليب الأساسية التي هي مفتاح لتقييم استجابة من الأغشية الحيوية لمثبطات جزيء صغير. أولا، للتأكد من أن هذه المثبطات لديها هدف محدد بيوفيلم، والفصل بين تأثير على نمو العوالق من التأثير على تشكيل بيوفيلم أمر بالغ الأهمية. معظم وكلاء المضادة للبكتيريا تستهدف الخلايا في مرحلة النمو العوالق، ولكن الجزيئات التي تستهدف حياة بيوفيلم نادرة. بالإضافة إلى ذلك، كما الجزيئات التي لا تؤثر على نمو العوالق ليست سامة، يمكن أن تقلل من الضغط الانتقائي لصالح المسوخ المقاومة للمضادات الحيوية 16. على سبيل المثال، عندما يتم التعامل مع الأغشية الحيوية مع الأحماض الأمينية-D أو بعض الجزيئات الأخرى خلية التدخل الجدار، إما بالانزعاج هم أو تفكيكها، ولكن هذه المثبطات فقط تؤثر أقل ما يقال 12،17 نمو العوالق. في المقابل، العديد من المضادات الحيوية يضعف بشكل كبير نمو العوالق، مع لإيتل أو أي تأثير على تشكيل بيوفيلم 17.
ثانيا، وضع إطار تجريبي ثابت وقوي لدراسة تأثير الجزيئات الصغيرة أمر بالغ الأهمية. لاحظنا أن نطاق تركيز نشط من مثبطات جزيء صغير حساس للشروط مسبقة الثقافة والإعداد التجريبية المستخدمة لدراسة تأثير هذه المثبطات جزيء صغير. تقارير مختلفة، لا سيما أولئك الذين يدرسون B. الرقيقة، وكشف الاختلافات في مدى التركيز الذي الأحماض الأمينية-D تمنع تشكيل pellicles - العائمة الأغشية الحيوية البكتيرية 12،17-19. وتشير النتائج المعروضة هنا أن العوامل التالية تمثل اختلافات في مدى تركيز نشاط: من شروط مسبقة ثقافة (لوغاريتمي 12،17 مقابل مرحلة نمو 20 في وقت متأخر من ثابتة)، ومتوسط النمو المستخدمة في حالة ما قبل الثقافة (الأغنياء، غير معروف [لوريا مرق، LB] مقابل يعرف [الغلوتامات أحادية الصوديوم-glycerol، MSgg])، ونسبة التلقيح وخصوصا إزالة المتوسطة قبل الثقافة قبل التلقيح. وأظهرت درجة حرارة النمو جليدة ثابت دورا أقل أهمية في نطاق نشاط صغير جزيء المانع D-ليسين، وهو حمض تمثيلي-D الأمينية المستخدمة في هذه الدراسة.
وأخيرا، مرة واحدة يتم التعامل مع الأغشية الحيوية مع مثبطات بيوفيلم محددة، يطلب من وسائل قوية ومفيدة لوصف آثار هذه المثبطات على اللياقة البدنية بيوفيلم. هنا، يتم وصف طريقتين لوصف مستقل تأثير مثبطات جزيء صغير بالتفصيل: (1) تأثير على الخلايا وحيدة داخل مستعمرة بيوفيلم ومقاومتها للمضادات الحيوية. الخلايا في الأغشية الحيوية تكون في العادة أكثر مقاومة للمضادات الحيوية بالمقارنة مع البكتيريا التي تعيش خالية من 21-23. رغم أن هذه الظاهرة هي سياقاتها، وغالبا ما تعتبر قدرة EPS للحد من تغلغل المضادات الحيوية كتفسير جذابة 24 . هذه الطريقة يقيم بقاء خلايا بيوفيلم محددة سلفا بعد التعرض للمواد مضادة للجراثيم. (2) أثر على بنية مستعمرة بيوفيلم، من كبيرة إلى صغيرة الحجم. تتميز المستعمرات بيوفيلم بواسطة هيكلها ثلاثي الأبعاد وجود EPS. باستخدام المجهر الإلكتروني، والتغييرات في شكل الخلية، بنية مستعمرة بيوفيلم والهندسة المعمارية وفرة من EPS يمكن تصور من كبير (ملم) على نطاق صغير (ميكرون).
Protocol
1. تقييم تأثير الصغيرة جزيء المانعون على جليدة وبيوفيلم مستعمرة تشكيل
- يعد حل 2X من المعرفة الذي يحفز بيوفيلم MSgg المتوسطة 25 دون كلوريد الكالسيوم والحديد (III) هيدرات كلوريد. بعد تصفية التعقيم، إضافة كلوريد الكالسيوم. وسيلة جاهزة للاستخدام مباشرة أو يمكن تخزينها في 4 درجات مئوية في الظلام.
- إعداد تخفيف 1X MSgg في يوم التجربة.
- تمييع المتوسطة 2X MSgg ل1x أخرى مع الماء المعقم المقطر (pellicles) أو 3٪ الساخن (80 درجة مئوية) أجار معقم (الأغشية الحيوية) وإضافة الحديد (III) هيدرات كلوريد إلى تركيز النهائي من 50 ميكرومتر (pellicles) أو 250 ميكرومتر ( الأغشية الحيوية). إضافة المضادات الحيوية أو مثبطات جزيء صغير إلى التركيز المطلوب وتخلط جيدا. على سبيل المثال، للحصول على التركيز النهائي من 0.5 ملي D-ليسين في 30 مل لإنشاء pellicles أو الأغشية الحيوية، إضافة 196.6 ميكرولتر من 76.3 ملم (10 ملغ / مل)-D يسين حل الأسهم.
لاالشركة المصرية للاتصالات: يوصف التركيب 1X MSgg النهائي في الجدول 1 مقارنة الوصفة الأصلية 25، تضمن المتوسطة تم زيادة 50 ميكروغرام / مل ثريونين وتركيز الحديد في النمو المستعمرات بيوفيلم في المتوسط MSgg الصلبة 2.5x و لتحسين مورفولوجيا مستعمرة التجاعيد .
- تمييع المتوسطة 2X MSgg ل1x أخرى مع الماء المعقم المقطر (pellicles) أو 3٪ الساخن (80 درجة مئوية) أجار معقم (الأغشية الحيوية) وإضافة الحديد (III) هيدرات كلوريد إلى تركيز النهائي من 50 ميكرومتر (pellicles) أو 250 ميكرومتر ( الأغشية الحيوية). إضافة المضادات الحيوية أو مثبطات جزيء صغير إلى التركيز المطلوب وتخلط جيدا. على سبيل المثال، للحصول على التركيز النهائي من 0.5 ملي D-ليسين في 30 مل لإنشاء pellicles أو الأغشية الحيوية، إضافة 196.6 ميكرولتر من 76.3 ملم (10 ملغ / مل)-D يسين حل الأسهم.
- بعد تصلب أجار، تجفيف لوحات MSgg الصلبة في غطاء البيولوجي ل30-45 دقيقة قبل التلقيح.
- لتحديد مثبطات المحددة التي تتداخل مع آليات تشكيل جليدة (الشكل 1)، يستبعد أن التركيزات المستخدمة تؤثر العوالق ونمو ثابت.
- تحديد نمو العوالق (الزيادة في الكثافة الضوئية على مر الزمن في الثقافة السائلة) في منحنى نمو بسيط عن طريق قياس الكثافة البصرية في 600 نانومتر كل ساعة حتى مرحلة نمو ثابتة.
- للتأكد من أن تعكر ثقافة تقاس يمثل عدد الخلايا الحية، وتحديد عدد وحدات تشكيل مستعمرة (كفو)من الخلايا في مرحلة النمو العوالق من ثقافة الهز بعد عدة نقاط الوقت.
- لتقييم تأثير مثبطات جزيء صغير على النمو جليدة ثابت، وخلايا الحصاد في نهاية الحضانة لمدة 3 أيام في 23 درجة مئوية من خلية ثقافة 24-جيدا جيدا، تلقيح في ظل نفس الظروف كما هو موضح في أقسام 1،7-1،9 وتحديد كفو. لعنصر التحكم هذا، استخدم سلالة جليدة قاصرة تفتقر إلى operons ترميز لمكونات المصفوفة خارج الخلية (أي، B. الرقيقة Δ epsH، Δ الطاسه).
ملاحظة: هذه السلالة قادرة على النمو في ظل ظروف ثابتة، ولكن على النقيض من النوع البري تشكيل جليدة، فمن نقص في القدرة على تطفو إلى واجهة السائل في الهواء، حيث يفضل النمو نتيجة لزيادة مستويات الاوكسجين 26. وهكذا، وهذا المصفوفة خارج الخلية وسلالة جليدة ناقصة هو سلالة المرجعية الموصى بها لتقييم النمو في ظل ظروف ثابتة.
ملاحظة: للحصول على السابقين محددوافرة من غير متعارف عليه-D الأحماض الأمينية D-ليسين هو موضح أدناه، لها تأثير على العوالق ونمو ثابت في تركيزات أن تتدخل تم استبعاد تشكيل جليدة من 12،17. وصفت وسائل لتحديد العوالق ونمو ثابت في التفاصيل 17.
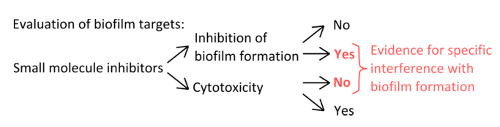
الشكل 1. نظرة عامة المفاهيمية لتحديد الإعداد التجريبي القوي لتقييم تثبيط محددة من تشكيل بيوفيلم. معايير الاختيار لمثبطات جزيء صغير التي تشير إلى تدخل معين مع تشكيل بيوفيلم دون تأثير واضح على نمو العوالق. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- خط من B. الرقيقة من -80 ° C الأسهم (LB cultuإعادة 10 9 خلية / مل المجمدة في الجلسرين 20٪) لعزل المستعمرات واحد على٪ لوحة أجار 1.5 LB مع طرف عقيمة أو عصا قضيب.
- تنمو بين عشية وضحاها في 30 درجة مئوية.
- خطوة حاسمة: لتثبيط جليدة قوية من الأحماض غير متعارف عليه D-الأمينية مثل D-ليسين، تنمو مستعمرة واحدة التقطت من٪ لوحة أجار 1.5 LB في 3 مل مرق LB عند 37 درجة مئوية لمدة 4 ساعات في هز حاضنة (تهز سرعة 200 دورة في الدقيقة). استبدال مرق LB مع يحفز بيوفيلم MSgg المتوسطة قبل التلقيح بواسطة الطرد المركزي ثقافة 1.5 مل بداية لمدة 4 دقائق في 6000 x ج، وإزالة بعناية طاف وإعادة تعليق-بيليه في 1.5 مل MSgg المتوسطة. ما تبقى من ثقافة يمكن التخلص منها.
هام: لضمان متانة النظام، وينبغي أن تكون الكثافة البصرية في 600 نانومتر (OD 600) من ثقافة بداية غسلها بين 0.6 و 1. - خلال نمو ثقافة بداية، وإعداد 12-جيدا لزراعة الخلايا لوحة multidish containinز 3 مل من MSgg وسيط وبدون أو مع مجموعة تركيز جزيء صغير مثبطات (على سبيل المثال، 0.3، 0.5، 1 ملم مد يسين 17). استبعاد آثار الحافة، توزيع موقع تركيزات مختلفة عبر لوحة multidish. بدلا من ذلك، استخدم 24-جيدا لزراعة الخلايا لوحات multidish تحتوي على 1.5 مل من MSgg المتوسطة.
- تطعيم الآبار من 12 لوحة جيدا multidish لزراعة الخلايا مع 3 ميكرولتر من الثقافة بداية غسلها (1: 1000 تمييع).
ملاحظة: انخفاض نسبة التخفيف، أي 1: 500 يمكن استخدامها. هذا يقلل من الوقت اللازم لتطوير من pellicles. - زراعة pellicles في 23 درجة مئوية تحت ظروف ثابتة لمدة ثلاثة أيام. لا تحرك pellicles خلال هذا الوقت، لأنها يمكن أن تؤثر على مورفولوجية سطح النهائي للجليدة.
- الحصول على الصور مع التعرض مجهر ومتجانس من البرق. بدلا من ذلك، التقاط صورة من pellicles مع كاميرا ذات دقة عالية. لتجنب القطع الأثرية التي تسببها inconsisزوايا ضوء خيمة والظلال، والتقاط صور من أعلى إلى أسفل مع الكاميرا ثابتة على ترايبود واستخدام مصدر ضوء لينة وكبيرة في 45 درجة من كلا الجانبين.
ملاحظة: أسلوب بديل لدراسة B. الرقيقة multicellularity هي بيوفيلم مستعمرة الفحص على الصلب، الذي يحفز بيوفيلم MSgg المتوسطة. مثل pellicles، هذا الاختبار يسمح للدراسة العمليات الزمانية المكانية. مرة واحدة يتم تحديد مجموعة نشطة من مثبطات جزيء صغير، تأثيرها على تشكيل مستعمرة بيوفيلم يمكن دراستها. - أن تنمو المستعمرات بيوفيلم، متناظر بقعة 1.5 ميكرولتر من غير مغسولة قبل الثقافة (الخطوة 1.7) على MSgg 1.5٪ لوحة أجار المجففة مع مساعدة من القالب - 4 قطرات في طبق بيتري من 8.5 سم القطر. دع قطرات كثف لوحة قبل نقلها.
ملاحظة: القالب يساعد على الحصول على المساواة في توزيع المستعمرات بيوفيلم داخل المنطقة حيث تزرع الخلايا. لإعداد القالب، ورسم المساحة الكلية للنمو في جداول الأصلية، نقسمه على قدم المساواة الطائفةالأملاح وبمناسبة المركز. لطبق بيتري جولة من 8.5 سم القطر، وهذا يعين مستعمرة بيوفيلم 14 سم 2 إلى واحد. - احتضان لوحات عند 30 درجة مئوية لمدة ثلاثة أيام. خلال هذا الوقت، المستعمرات بيوفيلم تتطور وتشكل ثلاثي الأبعاد، هيكل التجاعيد.
- التقاط الصور كما في الخطوة 1.11.
2. الإيثانول المقاومة الفحص
- تنمو الأغشية الحيوية كما هو موضح في الخطوات 1،1-1،7 و1،12-1،14.
- بعد 68 ساعة من النمو عند 30 درجة مئوية، وقطع المستعمرات بيوفيلم إلى قسمين متساويين مع مساعدة من شفرة الحلاقة والقالب.

الشكل 2. مثال لتصميم تجريبي لتقييم مقاومة الخلايا مستعمرة بيوفيلم إلى وكلاء تعقيم. (A) قالب المستخدمة في المساواة في توزيع المستعمرات بيوفيلم عبر طبق بتري ولقطع. (B)صور من أعلى إلى أسفل من غير المعالجة من النوع البري بيوفيلم نمت 68 ساعة على الصلب، الذي يعرف MSgg المتوسطة الذي يحفز بيوفيلم عند 30 درجة مئوية. يظهر توسيع كيف مستعمرة بيوفيلم يمكن أن تقطع إلى نصفين متساويين. (ج) يتم التعامل مع نصفين بيوفيلم متساوية على قدم المساواة (السيطرة، PBS) أو مع أي برنامج تلفزيوني أو تعقيم وكيل ومعالجتها كما هو موضح. شريط مقياس: 1 سم الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- رفع بعناية كل شوط من مستعمرة بيوفيلم من لوحة أجار مع ملعقة صغيرة ونقله إلى أنبوب microcentrifuge 1.5 مل تحتوي على 500 ميكرولتر من الفوسفات مخزنة المالحة (PBS). إذا لزم الأمر، تتخلص من الخلايا المتبقية من لوحة ونقلها إلى أنبوب microcentrifuge كذلك.
ملاحظة: يتم التعامل مع النصف الثاني من مستعمرة بيوفيلم تفاضليا، اعتمادا على ما إذا كان هو السيطرة أو لاختبار مقاومة ستيريوكلاء LIZING. - من أجل السيطرة، واحتضان النصف الثاني من مستعمرة بيوفيلم في 500 ميكرولتر برنامج تلفزيوني كما في الخطوة 2.3. لتقييم مقاومة للعوامل تعقيم، ونقل النصف الثاني من مستعمرة بيوفيلم إلى 500 ميكرولتر 50٪ (ت / ت) الإيثانول.
ملاحظة: البديل تعقيم وكلاء مثل هيبوكلوريت الصوديوم يمكن استخدامها. لجميع وكلاء تعقيم المستخدمة، وتحديد تركيز وحضانة وقت نشط في التجربة الأولية. - احتضان المستعمرات بيوفيلم لمدة 10 دقيقة على مقاعد البدلاء أعلى في درجة حرارة الغرفة.
- أجهزة الطرد المركزي المستعمرات بيوفيلم لمدة 5 دقائق في 18000 x ج وإزالة بعناية طاف مع ماصة. إضافة 300 ميكرولتر من برنامج تلفزيوني.
- يصوتن الخلايا أقل ما يقال (السعة 10٪، نبض 5 ثانية) مع microtip من sonicator.
ملاحظة: يجب أن تكون الطاقة صوتنة كافية لالمجاميع بيوفيلم منفصلة. ومع ذلك، صوتنة قاسية جدا قد ليز الخلايا. تأكيد مقدما بواسطة المجهر الضوئي أن الطاقة صوتنةالمستخدمة لا ليز الخلايا وأن جميع المجاميع تذوب. - إضافة 700 ميكرولتر من برنامج تلفزيوني إلى الحجم النهائي من 1 مل. إجراء التخفيف المتسلسل (10 -7) في برنامج تلفزيوني ونشر 100 ميكرولتر من 3 التخفيفات على لوحة أجار٪ 1.5 LB باستخدام الخرز الزجاجي معقمة.
ملاحظة: التخفيفات الأمثل أن يكون مطلي ينبغي أن تحدد في التجربة الأولية، وهذا يتوقف على كمية من الخلايا في مستعمرة بيوفيلم من الفائدة ومعدل البقاء على قيد الحياة من الخلايا في الاستجابة إلى وكيل تعقيم. - احتضان لوحات بين عشية وضحاها في 30 درجة مئوية، والاعتماد على كفو وتحديد كفو / مل. من النهائي كفو / مل من كل المستعمرات بيوفيلم نصف، وحساب النسبة المئوية للناجين.
ملاحظة: عندما يقوم وتحليلها كما وصفها، نصفي مستعمرة تحكم بيوفيلم ودون علاج مقابل نصف المعالجة الإيثانول من مستعمرة بيوفيلم غير المعالجة ينبغي أن تسفر الاختلافات أقل من 10٪ في عدد خلايا قابلة للحياة، والتحقق من التماثل أو المقاومة للمستعمرة ، respectively. بدلا من ذلك، فإن النتائج يمكن أن تكون ممثلة في مجموع كفو. وينبغي أن يظل عدد الخلايا من السيطرة ومستعمرة بيوفيلم غير المعالجة في نفس الترتيب من حيث الحجم. في المقابل، من المتوقع أن ينخفض بنسبة لا تقل عن اثنين من حيث الحجم في المطالبة بزيادة حساسية للوكيل تعقيم عدد الخلايا في النصف المعالجة الإيثانول من مستعمرة بيوفيلم صغيرة المعالجة الجزيء.
3. بيوفيلم مستعمرة إعداد نموذج لالمجهر الإلكتروني
- تنمو المستعمرات بيوفيلم كما هو موضح في الخطوات 1،1-1،7 و1،12-1،14.
- إعداد دفعة جديدة من 2٪ (ت / ت) غلوتارالدهيد، 3٪ (ت / ت) حل لامتصاص العرق في 100 ملي كاكوديلات الصوديوم، 5 ملي العازلة كلوريد الكالسيوم، ودرجة الحموضة 7.3. إعداد 5 مل من تثبيتي لكل طبق بيتري من 8.5 سم القطر.
تنبيه: غلوتارالدهيد وامتصاص العرق تشكل خطرا. التعامل معها معدات السلامة داخل غطاء الكيميائية. تجاهل الحلول والمواد الملوثة إلى هازالنفايات ardous. - بعناية إضافة تثبيتي إلى المستعمرات بيوفيلم، دون الاستغناء مباشرة على الجزء العلوي من الأغشية الحيوية.
ملاحظة: نظرا للطابع مسعور من مستعمرة بيوفيلم، المستعمرات فصل ببطء من أجار والبدء في تعويم. - بعناية ختم لوحات مع شريط من بارافيلم. احتضان على شاكر دوارة لمدة 2 ساعة في درجة حرارة الغرفة، وبعد ذلك نقل لوحات إلى 4 درجة مئوية لمدة ليلة وضحاها.
- في اليوم التالي، وإزالة بعناية السائل مع ماصة باستير الزجاج متصلة مضخة فراغ.
- بعناية إضافة 10 مل 100 ملي كاكوديلات الصوديوم، كلوريد الكالسيوم عازلة 5 ملي لغسل بيوفيلم واحتضان لمدة 5 دقائق. إزالة بلطف السائل مع ماصة باستير الزجاج من زاوية لوحة لتجنب إتلاف بيوفيلم وإضافة محلول الغسيل جديدة من قبل pipetting لطيف. كرر هذه الخطوة مرة واحدة.
- للجفاف المستعمرات بيوفيلم، المضي قدما في الخطوات التالية: 2X 5 دقائق في [ده 2 O؛ 2X 20 دقيقة في 30٪ من الإيثانول. 2X 20 دقيقة في 50٪ من الإيثانول. 2X 20 دقيقة في 70٪ من الإيثانول. 2X 20 دقيقة في 96٪ من الإيثانول. 2X 30 دقيقة في الإيثانول بنسبة 100٪.
- إضافة 15 مل من السائل لكل طبق بيتري من 8.5 سم القطر في كل خطوة وإزالة السائل بعناية بعد كل الحضانة.
- استخدام واحدة من طريقتين مختلفتين لتجفيف العينات من الإيثانول.
- لتجفيف الهواء من الإيثانول:
- قطع ورقة فلتر السليلوز (قطر 9 سم) في الفصول. لفترة وجيزة غمر ربع في الإيثانول بنسبة 100٪، ومن ثم نقل بعناية واحد العائمة مستعمرة بيوفيلم على ذلك. وضع ورقة الترشيح الرطب في طبق بيتري اصطف مع ورق الترشيح. تغطية طبق بتري والسماح للمستعمرات بيوفيلم بين عشية وضحاها الجاف في غطاء الكيميائية.
- لنقطة حرجة (CP) -drying باستخدام ثاني أكسيد الكربون (CO 2)، والسائل الانتقال:
- ملء 75٪ من نقطة تجفيف غرفة الماكينة المهمة مع الإيثانول بنسبة 100٪. نقل العينات إلى حامل، كل عينة إلى ج الخاصةهامبر. إذا لزم الأمر، وقطع بيوفيلم مع مقص إلى أجزاء أصغر. ترك العينات المغمورة في الإيثانول خلال كل المناولة. ثم، ونقل حامل في غرفة وإغلاق الغرفة بإحكام.
- تبريد الغرفة إلى 7 درجة مئوية والبدء في التحريك. تملأ الغرفة تماما مع ثاني أكسيد الكربون السائل 2. خلال فترة الحضانة 7 دقائق، والسماح للخليط الايثانول مع CO 2. ثم، وتفريغ 25٪ من الحل.
ملاحظة: لا إفراغ غرفة تحت مستوى العينة. - كرر الخطوة 3.8.2.2 أربع مرات.
- كرر الخطوة 3.8.2.2 خمس مرات مع فترة حضانة لمدة 5 دقائق فقط. وأخيرا، ينبغي الاستعاضة عن الايثانول تماما من CO 2.
- خلال الجولة الأخيرة، فارغة 5٪ فقط من الغرفة. إيقاف التحريك والتبريد. بدء تسخين الغرفة إلى 42 درجة مئوية. عند درجة حرارة 31.1 درجة مئوية وضغط من 73.9 بار، السائل CO 2 تصل إلى نقطة حرجة، الدولة التي الرقم الهيدروجيني الغازيبورصة عمان لديها نفس الكثافة كما الطور السائل من المذيبات 27. وبمجرد وصول درجة حرارة 42 درجة مئوية، واحتضان لمدة 10 دقيقة. في 42 درجة مئوية، وCO 2 في غرفة كما هو معمول به الغاز فوق الحرجة.
ملاحظة: تحقق باستمرار الضغط من الغرفة. يجب أن لا يتجاوز ضغط 120 بار في 42 درجة مئوية. - بدء لاطلاق سراح ببطء الغاز مع التدفئة مستمرة. هذا يحافظ على عينات في المرحلة CO 2 -gas ويمنع تشوه التشكل عينة من خلال توتر سطح السائل. تعيين مقياس الجريان إلى 5 لتر / ساعة عن طريق ضبط صمام القياس السيطرة على مقياس الجريان. انتظر حتى يتم تحرير كل الضغوط في الغرفة. الآن فتح غرفة وإزالة العينات بعناية من حامل.
- لتجفيف الهواء من الإيثانول:
- معطف من المجهري كعب الإلكترون مع الشريط الكربون. مع مساعدة من ملاقط، ونقل بعناية المستعمرات بيوفيلم على كعب. ربط كل مستعمرة إلى كعب بإضافة جسر رقيقة من سيارةبون الشريط، وهو أمر حاسم للقضاء تهمة تحت شعاع الالكترون. في هذه المرحلة، والتعامل مع المستعمرات بيوفيلم مع الرعاية كما أنها هشة جدا. تخزين العينات في المجفف لمدة 24 ساعة على الأقل أو حتى فحص.
- يوم الامتحان مع الميكروسكوب الالكتروني، تفل معطف المستعمرات بيوفيلم لمدة 2 دقيقة في زاوية 60 درجة في الذهب والبلاديوم تفل المغطي. كرر هذه الخطوة مرتين وتدوير عينات من 120 درجة في ما بين. في النهاية، تفل معطف العينات مرة واحدة لمدة 3 دقائق من أعلى. طبقة 20 نانومتر رقيقة من الذهب والبلاديوم يحسن الموصلية ويعزز النقيض من العينة للتصوير في SEM.
- تخزين العينات في مجفف لتجنب معالجة الجفاف من العينة 28 حتى التصوير مع المجهر الالكتروني الماسح 29،30.
النتائج
فحص جليدة هو أسلوب واحد لدراسة العمليات درجة عالية من التنظيم والحيوية من B. الرقيقة multicellularity. وبالاضافة الى هذا، هي مناسبة لفحص جليدة لاختبار مجموعة وإما شروط مسبقة بداية أو تركيزات جزيء صغير في لوحة multidish واحدة لزراعة الخلايا في تجربة واحدة. ومع ذلك، B. الرقيق...
Discussion
العصوية الرقيقة أشكال قوية ومنظم للغاية الأغشية الحيوية في كل من السائل (pellicles) وعلى وسط صلب (المستعمرات). وبالتالي، فإنه بمثابة كائن نموذجا مثاليا لوصف طريقة عمل مثبطات بيوفيلم محددة. على وسائل الاعلام الصلبة، الخلايا تشكل هياكل متعددة الخلايا مع السمات المميز?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
Electron microscope imaging was conducted at the Electron Microscopy Unit of the Weizmann Institute of Science, supported in part by the Irving and Cherna Moskowitz Center for Nano and Bio-Nano Imaging. This research was also supported by the ISF I-CORE grant 152/1, Mr. and Mrs. Dan Kane, Ms. Lois Rosen, by a Yeda-Sela research grant, by the Larson Charitable Foundation, by Ruth and Herman Albert Scholars Program for New Scientists, by the Ilse Katz Institute for Materials Sciences and Magnetic Resonance Research grant, by the Ministry of Health grant for alternative research methods, and by the France-Israel Cooperation - Maimonide-Israel Research Program. IKG is a recipient of the Rowland and Sylvia Career Development Chair.
Materials
| Name | Company | Catalog Number | Comments |
| Luria Broth, Lennox | Difco | 240230 | |
| Bacto Agar | Difco | 214010 | |
| potassium phosphate monobasic | Sigma, 136.09 g/mol | P0662-500G | |
| potassium phosphate dibasic | Fisher Scientific, 174.18 g/mol | BP363-1 | |
| 3-(N-morpholino)propanesulfonic acid | Fisher Scientific, 209.27 g/mol | BP308-500 | |
| magnesium chloride hexahydrate | Merck, 203.30 g/mol | 1.05833.0250 | |
| calcium chloride anhydrous | J.T. Baker, 110.98 g/mol | 1311-01 | |
| manganese(II) chloride tetrahydrate | Sigma, 197.91 g/mol | 31422-250G-R | |
| iron(III) chloride hexahydrate | Sigma, 270.30 g/mo) | F2877-500G | |
| zinc chloride anhydrous | Acros Organics, 136.29 g/mol | 424592500 | |
| thiamine hydrochloride | Sigma, 337.27 g/mol | T1270-100G | |
| L-tryptophan | Fisher Scientific, 204.1 g/mol | BP395-100 | |
| L-phenylalanine | Sigma, 165.19 g/mol | P5482-100G | |
| L-threonine | Sigma, 119.12 g/mol | T8625-100G | |
| glycerol anhydrous | Bio-Lab Itd | 712022300 | |
| L-glutamic acid monosodium salts hydrate | Sigma, 169.11 g/mol | G1626-1KG | |
| D-leucine | Sigma, 169.11 g/mol | 855448-10G | |
| ethanol anhydrous | Gadot | 830000054 | |
| razor blade | Eddison | NA | |
| circular cellulose filter papers | Whatman, 90 mm | 1001-090 | |
| glutaraldehyde | EMS (Electron Micoscopy Science), 25% in water | 16220 | |
| paraformaldehyde | EMS, 16% in water | 15710 | |
| sodium cacodylate | Merck, 214.05 g/mol | 8.2067 | |
| calcium chloride 2-hydrate | Merck, 147.02 g/mol | 1172113 | |
| stub-aluminium mount | EMS, sloted head | 75230 | |
| carbon adhesive tape | EMS | 77825-12 | |
| Shaker 37 °C | New Brunswick Scientific Innowa42 | NA | |
| Centrifuge | Eppendorf table top centrifuge 5424 | NA | |
| Digital Sonifier, Model 250, used with Double Step Microtip | Branson | NA | |
| Incubator 30 °C | Binder | NA | |
| Incubator 23 °C | Binder | NA | |
| Filter System, 500 ml, polystyrene | Cornig Incorporated | NA | |
| Rotary Shaker - Orbitron Rotatory II | Boekel | NA | |
| S150 Sputter Coater | Edwards | NA | |
| CPD 030 Critical Point Dryer | BAL-TEC | NA | |
| Environmental Scanning Electron Microscope | XL30 ESEM FEG Philips (FEI) | NA |
References
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu Rev Microbiol. 56, 187-209 (2002).
- Miller, M. B., Bassler, B. L. Quorum sensing in bacteria. Annu Rev Microbiol. 55, 165-199 (2001).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr Opin Microbiol. 10, 638-643 (2007).
- Kolter, R., Greenberg, E. P. Microbial sciences: the superficial life of microbes. Nature. 441, 300-302 (2006).
- Kearns, D. B., Chu, F., Branda, S. S., Kolter, R., Losick, R. A master regulator for biofilm formation by Bacillus subtilis. Mol Microbiol. 55, 739-749 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol Microbiol. 59, 1229-1238 (2006).
- Romero, D., Aguilar, C., Losick, R., Kolter, R. Amyloid fibers provide structural integrity to Bacillus subtilis biofilms. Proc Natl Acad Sci USA. 107, 2230-2234 (2010).
- Kobayashi, K., Iwano, M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms. Mol Microbiol. 85, 51-66 (2012).
- Hobley, L., et al. BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm. Proc Natl Acad Sci USA. 110, 13600-13605 (2013).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol Microbiol. 80, 1155-1168 (2011).
- Kolodkin-Gal, I., et al. D-amino acids trigger biofilm disassembly. Science. 328, 627-629 (2010).
- Chan, Y. G., Kim, H. K., Schneewind, O., Missiakas, D. The capsular polysaccharide of Staphylococcus aureus is attached to peptidoglycan by the LytR-CpsA-Psr (LCP) family of enzymes. J Biol Chem. 289, 15680-15690 (2014).
- Mielich-Suss, B., Lopez, D. Molecular mechanisms involved in Bacillus subtilis biofilm formation. Environ Microbiol. 17, 555-565 (2014).
- Cairns, L. S., Hobley, L., Stanley-Wall, N. R. Biofilm formation by Bacillus subtilis: new insights into regulatory strategies and assembly mechanisms. Mol Microbiol. 93, 587-598 (2014).
- Chen, M., Yu, Q., Sun, H. Novel strategies for the prevention and treatment of biofilm related infections. Int J Mol Sci. 14, 18488-18501 (2013).
- Bucher, T., Oppenheimer-Shaanan, Y., Savidor, A., Bloom-Ackermann, Z., Kolodkin-Gal, I. Disturbance of the bacterial cell wall specifically interferes with biofilm formation. Environ Microbiol Rep. 7, 990-1004 (2015).
- Sarkar, S., Pires, M. M. D-Amino acids do not inhibit biofilm formation in Staphylococcus aureus. PLoS One. 10, e0117613 (2015).
- Wei, W., Bing, W., Ren, J., Qu, X. Near infrared-caged D-amino acids multifunctional assembly for simultaneously eradicating biofilms and bacteria. Chem Commun (Camb). 51, 12677-12679 (2015).
- Leiman, S. A., et al. D-amino acids indirectly inhibit biofilm formation in Bacillus subtilis by interfering with protein synthesis. J Bacteriol. 195, 5391-5395 (2013).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Davies, D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov. 2, 114-122 (2003).
- Olsen, I. Biofilm-specific antibiotic tolerance and resistance. Eur J Clin Microbiol Infect Dis. 34, 877-886 (2015).
- Tseng, B. S., et al. The extracellular matrix protects Pseudomonas aeruginosa biofilms by limiting the penetration of tobramycin. Environ Microbiol. 15, 2865-2878 (2013).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc Natl Acad Sci USA. 98, 11621-11626 (2001).
- Holscher, T., et al. Motility, Chemotaxis and Aerotaxis Contribute to Competitiveness during Bacterial Pellicle Biofilm Development. J Mol Biol. 427, 3695-3708 (2015).
- Bray, D. . Methods in Biotechnology. 13, 235-243 (2000).
- Ensikat, H. J., Ditsche-Kuru, P., Barthlott, W. . Scanning electron microscopy of plant surfaces: simple but sophisticated methods for preparation and examination. 1, 248-255 (2010).
- Hayat, M. A. . Principles and techniques of scanning electron microscopy: Biological applications. 2, (1976).
- Schatten, H. . Scanning Electron Microscopy for the Life Sciences. , (2013).
- Bridier, A., Meylheuc, T., Briandet, R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM, ESEM and FESEM). Micron. 48, 65-69 (2013).
- Boyde, A., MacOnnachie, E. Volume changes during preparation of mouse embryonic tissue for scanning electron microscopy. SCANNING. 2, 149-163 (1979).
- Yao, Z., Kahne, D., Kishony, R. Distinct single-cell morphological dynamics under beta-lactam antibiotics. Mol Cell. 48, 705-712 (2012).
- Epstein, A. K., Pokroy, B., Seminara, A., Aizenberg, J. Bacterial biofilm shows persistent resistance to liquid wetting and gas penetration. Proc Natl Acad Sci USA. 108, 995-1000 (2011).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11, 157-168 (2013).
- Shemesh, M., Chai, Y. A combination of glycerol and manganese promotes biofilm formation in Bacillus subtilis via histidine kinase KinD signaling. J Bacteriol. 195, 2747-2754 (2013).
- Kolodkin-Gal, I., et al. Respiration control of multicellularity in Bacillus subtilis by a complex of the cytochrome chain with a membrane-embedded histidine kinase. Genes Dev. 27, 887-899 (2013).
- Oppenheimer-Shaanan, Y., et al. Spatio-temporal assembly of functional mineral scaffolds within microbial biofilms. npj Biofilms and Microbiomes. 2, 15031 (2016).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. , e3796 (2012).
- Bogino, P. C., Oliva Mde, L., Sorroche, F. G., Giordano, W. The role of bacterial biofilms and surface components in plant-bacterial associations. Int J Mol Sci. 14, 15838-15859 (2013).
- Fratamico, P. M., Annous, B. A., Guenther, N. W. . Biofilms in the Food and Beverage Industires. 1, (2009).
- Gao, G., et al. Effect of biocontrol agent Pseudomonas fluorescens 2P24 on soil fungal community in cucumber rhizosphere using T-RFLP and DGGE. PLoS One. 7, e31806 (2012).
- Chen, Y., et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation. Environ Microbiol. 15, 848-864 (2013).
- Bryers, J. D. Medical biofilms. Biotechnol Bioeng. 100, 1-18 (2008).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7, 375-381 (2009).
- Nevin, K. P., Woodard, T. L., Franks, A. E., Summers, Z. M., Lovley, D. R. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. MBio. 1, (2010).
- Torres, C. I., et al. A kinetic perspective on extracellular electron transfer by anode-respiring bacteria. FEMS Microbiol Rev. 34, 3-17 (2010).
- Li, J., Wang, N. Foliar application of biofilm formation-inhibiting compounds enhances control of citrus canker caused by Xanthomonas citri subsp. citri. Phytopathology. 104, 134-142 (2014).
- Okegbe, C., Price-Whelan, A., Dietrich, L. E. Redox-driven regulation of microbial community morphogenesis. Curr Opin Microbiol. 18, 39-45 (2014).
- Mann, E. E., Wozniak, D. J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev. 36, 893-916 (2012).
- Bouffartigues, E., et al. Sucrose favors Pseudomonas aeruginosa pellicle production through the extracytoplasmic function sigma factor SigX. FEMS Microbiol Lett. 356, 193-200 (2014).
- Wu, C., Lim, J. Y., Fuller, G. G., Cegelski, L. Quantitative analysis of amyloid-integrated biofilms formed by uropathogenic Escherichia coli at the air-liquid interface. Biophys J. 103, 464-471 (2012).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an Architectural Element in Spatially Structured Escherichia coli Biofilms. J Bacteriol. 195, 5540-5554 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved