需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
方法学研究
摘要
This study presents the development of reproducible methodologies to study biofilm inhibitors and their effects on Bacillus subtilis multicellularity.
摘要
This work assesses different methodologies to study the impact of small molecule biofilm inhibitors, such as D-amino acids, on the development and resilience of Bacillus subtilis biofilms. First, methods are presented that select for small molecule inhibitors with biofilm-specific targets in order to separate the effect of the small molecule inhibitors on planktonic growth from their effect on biofilm formation. Next, we focus on how inoculation conditions affect the sensitivity of multicellular, floating B. subtilis cultures to small molecule inhibitors. The results suggest that discrepancies in the reported effects of such inhibitors such as D-amino acids are due to inconsistent pre-culture conditions. Furthermore, a recently developed protocol is described for evaluating the contribution of small molecule treatments towards biofilm resistance to antibacterial substances. Lastly, scanning electron microscopy (SEM) techniques are presented to analyze the three-dimensional spatial arrangement of cells and their surrounding extracellular matrix in a B. subtilis biofilm. SEM facilitates insight into the three-dimensional biofilm architecture and the matrix texture. A combination of the methods described here can greatly assist the study of biofilm development in the presence and absence of biofilm inhibitors, and shed light on the mechanism of action of these inhibitors.
引言
多细胞细菌群落的自然和人为环境中发挥显著作用,可以是有益或有害的高度。这些多细胞集落被称为生物膜,其中所述个体的细胞包埋在自产生的细胞外聚合物(EPS)基质中。 EPS的强烈坚持的细胞,他们殖民表面。它们作为对机械和化学力盾,并创建相邻小区之间的紧密联系,促进蜂窝通信1。生物膜可以被看作是一个分化的社会,在那里细胞利用高度管制,编排流程在社区内协调其活动,以及跨品种2-5。从生长的浮游,自由生活模式到生物膜状态的转变通常与发育过程相关联。一个很好的例子是革兰氏阳性土壤细菌枯草芽孢杆菌 ,因此一个undomesticated应变作为一个强大的模式生物研究发展阶段,导致生物膜的形成。在这种细菌,游动细胞组织起来成执行特殊任务4显眼的多细胞结构。细胞的一组中,基质生产者分泌胞外多糖6中 ,淀粉样蛋白塔萨7,8,和表面疏水性蛋白质BSLA 9,10;所有这些参加EPS 11-13的组装。
考虑到自然和人为壁龛丰富生物膜和公认的致命伤害,他们可能会导致,有迫切需要找到办法,以防止它们的形成。小分子抑制剂可以在新的监管途径,酶和参与生物膜形成的结构蛋白的发现帮助,从而促进多社区装配的复杂过程的见解。作为B.枯草芽孢杆菌是一个生物充分研究模型成膜14,15,它可以被用来评估各种生物膜抑制剂的效果。这项研究铲球是评估生物膜的小分子抑制剂的反应键四种基本方法。首先,以确保这些抑制剂具有特定生物膜目标,从上生物膜形成的影响上浮游生长的作用的分离是至关重要的。大多数抗菌药物靶向的浮游生长期细胞,但该目标生物膜的生活方式分子是罕见的。另外,如不影响浮游生长的分子是没有毒性,它们能减少选择压力利于抗生素抗性突变体16。例如,当生物膜与D-氨基酸或某些其它细胞壁干扰分子治疗,他们要么干扰或拆卸,但这些抑制剂仅轻度影响浮游生长12,17。与此相反,许多抗生素大大削弱浮游生长,与L-ittle或生物膜形成17没有影响。
第二,建立一致的和健壮的试验框架研究小分子的作用是至关重要的。我们观察到的小分子抑制剂的活性浓度范围是对预培养条件,并用于研究这些小分子抑制剂的效果的实验装置的敏感。各种报告,特别是那些学习B.枯草芽孢杆菌,揭示了在浓度范围内的变化在该D-氨基酸抑制药膜的形成-浮细菌生物膜12,17-19。此处呈现的结果表明,下列因素考虑在活性浓度范围不同:预培养条件(对数12,17与晚平稳20生长阶段),在该预培养条件中使用的生长培养基(丰富,未定义[卢里亚肉汤,LB]对定义[味精- 甘油,MSgg]),接种率,特别是在接种前除去预培养基的。静态防护膜生长的温度显示出在小分子抑制剂D-亮氨酸,在这项研究中使用的代表性的D-氨基酸的活性范围不太重要的作用。
最后,一旦生物膜与特定的生物膜抑制剂,需要坚固的信息的方法来表征生物膜健身这些抑制剂的效果处理。 (1)的影响生物膜集落及其与抗菌剂抗性内对单个细胞:在这里,两种方法来独立地表征小分子抑制剂的效果进行详细说明。相对于自由生活的细菌21-23时生物膜细胞通常对抗生素更耐。虽然这种现象是多因素的EPS,以减少抗生素的渗透能力通常被认为是一个有吸引力的解释24 。此方法评估预建立生物膜细胞暴露于抗菌物质后的存活。 (2)向小规模上生物膜集落结构的影响,从大。生物膜菌落可以通过三维结构和所述EPS的存在表征。利用扫描电子显微镜,在细胞形态,生物膜集落结构和EPS的结构和数量的变化可以从大(毫米)被可视化的小规模(微米)。
研究方案
1.评估小分子抑制剂的影响薄皮生物膜集落形成
- 制备定义生物膜诱导MSgg介质25的2倍的溶液未经氯化钙和氯化铁(III)六水合物。除菌过滤后,加入氯化钙。介质是准备直接使用,或者它可以被存储在4℃在黑暗中。
- 准备在实验当天的1倍MSgg稀释。
- 稀释2倍MSgg介质用无菌蒸馏水(药膜)或无菌的3%热(80℃)琼脂(生物膜)为1x和添加铁(III)六水合氯化至50微米(药膜)或250μM的终浓度(生物膜)。添加抗生素或小分子抑制剂至所需浓度,搅拌均匀。例如,为了获得0.5mM的D-亮氨酸的终浓度在30毫升建立药膜或生物膜,添加196.6微升76.3毫米(10毫克/毫升)D-亮氨酸原液。
没有TE:最终1倍MSgg组合物在表1中描述相比于原来的配方25中 ,培养基中含有50微克/毫升的苏氨酸和铁浓度为固体MSgg培养基上生长的生物膜的菌落增加到2.5倍,以优化皱菌落形态。
- 稀释2倍MSgg介质用无菌蒸馏水(药膜)或无菌的3%热(80℃)琼脂(生物膜)为1x和添加铁(III)六水合氯化至50微米(药膜)或250μM的终浓度(生物膜)。添加抗生素或小分子抑制剂至所需浓度,搅拌均匀。例如,为了获得0.5mM的D-亮氨酸的终浓度在30毫升建立药膜或生物膜,添加196.6微升76.3毫米(10毫克/毫升)D-亮氨酸原液。
- 琼脂凝固后,干燥的生物罩固体MSgg板为前接种30-45分钟。
- 以选择与薄膜形成( 图1)的机制干扰特异性抑制剂,排除使用的浓度影响浮游和静态的增长。
- 由每一小时测量的光密度在600nm直到静止生长期确定在一个简单的生长曲线浮游生长(超过在液体培养时间增加光密度)。
- 以确认测得的培养的浊度表示活细胞计数,测定菌落形成单位数(CFU)细胞从振荡培养浮游增长阶段之后的几个时间点。
- 要很好,在相同条件下接种在部分1.7-1.9描述的24孔细胞培养评估在23℃静态薄膜生长,收获细胞在3天的培养结束小分子抑制剂的作用并确定CFU。对于该控制,使用防护膜缺损株缺乏对细胞外基质成分编码操纵子( 即 , 枯草杆菌 ΔepsH,Δ 塔萨 )。
注意:此菌株能够在静态条件下生长的,但在对比一个薄膜形成用野生型,它是在浮到液体-空气界面,在那里生长由于氧含量26增加青睐的能力不足。因此,该细胞外基质 - 和防护膜缺损株是建议的参考菌株,以评估在静态条件下的生长。
注:对于特定的前充足非规范D-氨基酸D-亮氨酸的以下描述,对浮游和静态生长的效果,其浓度与薄膜的形成被排除12,17干涉。确定浮游和静态生长方法详细17进行说明。
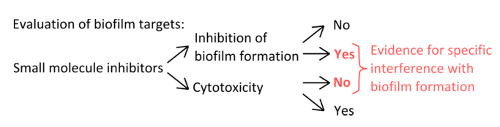
图1.一个强大的实验装置的识别概念性概述评估生物膜形成特异性抑制。对于小分子抑制剂,表明与生物膜形成不会对浮游增长显着的影响干扰特定选择标准。 请点击此处查看大图这一数字。
- 连胜了B.从-80℃股票杆菌 (LB文化前进在20%甘油冷冻重10 9细胞/ ml),以用无菌尖端或涂药棒上的LB-1.5%琼脂平板上分离单菌落。
- 在30℃下生长过夜。
- 关键步骤:对于由非规范D-氨基酸如D-亮氨酸健壮防护薄膜组件的抑制,成长单菌落从LB-1.5%琼脂平板上挑取3毫升LB培养基在37℃下4小时的振荡培养箱(振荡速度200rpm)下。通过在6000 XG离心1.5毫升首发培养4分钟,小心除去上清液和再悬浮在1.5ml MSgg介质颗粒在接种前更换LB培养基生物膜诱导MSgg网上平台。培养的剩余部分可以被丢弃。
重要的是:为了保证系统的鲁棒性,在洗涤起子培养物在600nm(OD 600)的光密度应为0.6和1之间。 - 在发酵剂培养物生长,准备12孔细胞培养板multidish containin克3毫升MSgg培养基没有或小分子抑制剂( 例如 ,0.3,0.5,1mM的D-亮氨酸17)的浓度范围。为了排除边缘效应,横跨multidish板分配不同浓度的位置。另外,使用含有1.5毫升MSgg介质中的24孔细胞培养multidish板。
- 接种12孔细胞培养multidish板的孔用3微升洗涤起子培养(1:1000稀释)。
注:较低的稀释比, 即 ,1:500都可以使用。这降低了药膜的开发时间。 - 生长的菌膜在23℃的静态条件下三天。在此期间不要移动菌膜,因为它会影响薄膜的最终表面形貌。
- 获得闪电的双眼和均匀曝光的照片。另外,取药膜的图片用高清晰度摄像机。以避免由于inconsis假象帐篷灯角度和阴影,采取自上而下的照片与固定在三脚架拍摄,并在双方的45°,用柔软的大光源。
注:另一种方法来研究B.枯草多细胞是固体,生物膜诱导MSgg介质上的生物膜菌落检测。像菌膜,此法可以让时空过程的研究。一旦小分子抑制剂的活性范围是确定的,其上生物膜集落形成的影响进行研究。 - 生长生物膜菌落,对称地发现1.5微升未洗预培养上与模板的帮助下干燥MSgg 1.5%琼脂平板上(步骤1.7) - 每8.5厘米直径的培养皿4滴。让液滴吸附到板移动之前。
注意:模板有助于获得区域内的生物膜集落,其中细胞生长的相等分布。为了制备模板,绘制在原始尺度生长的总面积,将其划分为等于节ORS和纪念中心。 8.5厘米口径的圆形培养皿中,这种分配14厘米2一个生物膜殖民地。 - 孵育在30℃下将板三天。在此期间,生物膜集落发展形成一个三维的,皱结构。
- 拍照如步骤1.11。
2.乙醇抗性测试
- 如步骤1.1-1.7和1.12-1.14描述生长生物膜。
- 在30℃下68小时生长后,切生物膜菌落成两个相等的部分用剃刀刀片和模板的帮助。

图2.示例实验设计,生物膜集落细胞性评估消毒剂。用于生物膜菌落整个培养皿中的平等分配和切割(A)模板。 (B)未处理的野生型生物膜的自上而下的图像中生长,在30℃下为固体,限定生物膜诱导MSgg培养基上68小时。扩大了如何生物膜殖民地在相等的两半被削减。 (C)两个相等生物膜半部同样处理(对照,PBS)或PBS或灭菌剂和所述方法处理。比例尺:1厘米请点击此处查看该图的放大版本。
- 小心提起生物膜集落的每一半由用小铲琼脂板,并将其移至含有500微升磷酸盐缓冲盐水(PBS)的1.5ml微量离心管中。如果需要的话,从板刮去剩余的细胞,并将其转移到微离心管,以及。
注:生物膜集落的后半部分被差分处理,这取决于它是否是控制或进行测试以免缝的阻力LIZING代理商。 - 对于对照,孵育于500μlPBS中的生物膜集落的后半部分如在步骤2.3。为了评估耐灭菌剂,生物膜集落的后半部分转移到500μl的50%(体积/体积)乙醇。
可被采用的灭菌剂如次氯酸钠:注。对于所使用的所有消毒剂,确定了初步的实验中活性浓度和培养时间。 - 孵育生物膜菌落在室温下的台式10分钟。
- 离心5分钟,生物膜集落18,000 xg离心, 小心地用移液管去除上清。加入300微升的PBS。
- 超声处理用超声波仪的微尖的细胞轻度(振幅10%,脉冲5秒)。
注:超声能量必须足以分离生物膜聚集体。但是,过于苛刻超声可裂解细胞。请事先确认减光镜的超声能量使用不溶解细胞,并且所有的聚集体溶解。 - 加入700μl的PBS以1毫升的最终体积。在PBS中进行系列稀释(到10 -7),传播100微升3稀释使用无菌玻璃珠的LB-1.5%琼脂平板上。
注:待镀的最佳稀释度应在一个初步实验来确定,因为这取决于在感兴趣,细胞的存活率生物膜集落细胞的量响应于灭菌剂。 - 孵育板在30℃过夜,算上CFU并确定CFU /毫升。从最终的CFU / ml的每个半生物膜集落,计算存活的百分比。
注意:当进行分析如所描述的,控制生物膜集落的两个半部和未处理相对于未处理的生物膜集落应该产生在活菌数在10%以下的差异的乙醇处理的一半,验证对称性或集落的电阻,respe沉着应对。或者,所述结果可以在总CFU表示。控制和未处理的生物膜集落的细胞计数应该保持在相同的数量级顺序。相反,小分子处理的生物膜集落的乙醇处理的一半的细胞计数,预计由最小两个数量级的权利要求用于向灭菌剂的敏感性增加下降。
3.香港生物膜样品制备扫描电镜
- 如步骤1.1-1.7 1.12-1.14和成长描述生物膜殖民地。
- 制备一批新的2%(V / V)戊二醛,3%在100mM二甲胂酸钠(体积/体积)低聚甲醛溶液,5mM的氯化钙缓冲液,pH 7.3。准备5毫升固定液8.5厘米直径的每一个培养皿。
注意:戊二醛和多聚甲醛是危险的。用化学罩内的安全设备处理它们。丢弃的解决方案和污染材料的HAZardous浪费。 - 小心地将固定剂添加到生物膜殖民地,而不是直接在生物膜顶部配药。
注:由于生物膜集落的疏水特性,菌落慢慢从琼脂分离并开始浮动。 - 仔细密封板用封口膜的条带。孵育在旋转摇床上在室温下2小时,并随后将板转移到4℃过夜。
- 第二天,小心与连接到真空泵的巴斯德玻璃吸管除去液体。
- 小心加入10 mL的100mM二甲胂酸钠,5mM的氯化钙缓冲洗生物膜并孵育5分钟。轻轻从板的角上的巴斯德玻璃吸管除去液体,以避免损坏生物膜并通过温和移液添加新鲜的洗涤溶液。重复此步骤一次。
- 对于生物膜殖民地的脱水,继续进行下面的步骤:在DDH 2 O 2个5分钟;在3 2X 20分钟0%的乙醇; 2×20分钟以50%的乙醇; 2×20分钟以70%的乙醇; 2×20分钟以96%的乙醇; 2×100%乙醇30分钟。
- 加入15mL液体8.5厘米直径的在每一步每一个培养皿中,每个孵化后,小心地取出液体。
- 使用两种不同的方法之一用于从乙醇干燥的样品。
- 对于乙醇空气干燥:
- 切宿舍纤维素滤纸(9厘米口径)。简而言之淹没四分之一在100%的乙醇,然后一个浮动生物膜菌落仔细转移到它。放湿滤纸的陪替氏培养皿用滤纸衬里。盖培养皿,让殖民地生物膜在化学罩干通宵。
- 对于使用二氧化碳(CO 2)作为过渡流体-drying临界点(CP):
- 填充临界点干燥机械室用100%乙醇的75%。转移样品到一个保持器,每个采样到自身的Chamber。如果需要的话,用剪刀剪生物膜成更小的碎片。所有的处理过程中留在乙醇浸没样品。然后,保持器传送到腔室并紧紧关闭腔室。
- 冷却室7°C,并开始搅拌。用液态二氧化碳完全填充室。期间7分钟温育时间,让与CO 2的乙醇混合。然后,排出该溶液的25%。
注意:不要空下样品的水平室。 - 重复步骤3.8.2.2四次。
- 重复步骤3.8.2.2仅为5分钟的温育时间五倍。最后,乙醇应完全由二氧化碳代替。
- 在最后一轮中,腔室的仅5空%。关掉搅拌和冷却。启动腔室加热至42℃。在31.1℃的温度和73.9巴的压力,液体的 CO 2达到其临界点时,该状态下的气态ph值酶具有相同的密度作为溶剂27的液相中。一旦温度达到42℃,孵育10分钟。在42℃下,在腔室中的CO 2的形式存在的超临界气体。
注意:经常检查室的压力。压力应不超过42°C 120条。 - 开始慢慢地持续加热释放气体。这样可以使中的CO 2气相试样,并防止样品形态的变形通过液体表面张力。通过微调将流量计5升/小时计量阀控制流量计。等到在腔室中的所有的压力被释放。现在打开室,并从支架小心地取出样品。
- 对于乙醇空气干燥:
- 涂层的电子显微镜存根与碳胶带。用镊子的帮助下,小心地转移生物膜菌落到存根。通过增加从汽车薄桥连接各殖民地存根盂兰盆胶带,这是在电子束下消除电荷至关重要。在这个阶段,小心处理生物膜菌落,它们是很脆弱的。存储样品在干燥器中至少24小时,或直到检查。
- 用扫描电子显微镜检查的那天,溅射涂层2分钟生物膜集落中在金 - 钯溅射镀膜机60°角。重复此步骤两次,并通过120°之间旋转样品。最后,溅射涂层样品一次从顶部3分钟。金 - 钯的20纳米薄层提高了导电性和提高了样品的用于在SEM成像对比度。
- 存储样品在干燥器中避免样品28的再水化之前,用扫描型电子显微镜29,30成像。
结果
该薄膜法是一种方法来研究B的严格监管和动态过程枯草多细胞。除此之外,薄膜法适合于测试的范围内任一起动机前置条件或小分子的浓度在单细胞培养multidish板在一项实验。然而,B.枯草薄膜的形成是在培养前的条件是敏感的( 例如 ,预培养的生长培养基和其生长阶段),接种比率并在除去预培养基的。因此,我们首先筛选了一个实验装置,使我们能够再现由D-亮氨...
讨论
枯草杆菌形式健壮和高度结构化的生物膜无论在液体(药膜)和固体培养基上(集落)。因此,它可作为一种理想的模式生物表征特定生物膜抑制剂的作用方式。在固体培养基中,细胞形成具有独特的功能,不在药膜明显,像皱纹从中心到边缘的辐射的多细胞结构。因此,菌膜和菌落互补系统学习B.枯草多细胞。
这项研究的目标是开发一个B.生物膜(药膜...
披露声明
The authors have nothing to disclose.
致谢
Electron microscope imaging was conducted at the Electron Microscopy Unit of the Weizmann Institute of Science, supported in part by the Irving and Cherna Moskowitz Center for Nano and Bio-Nano Imaging. This research was also supported by the ISF I-CORE grant 152/1, Mr. and Mrs. Dan Kane, Ms. Lois Rosen, by a Yeda-Sela research grant, by the Larson Charitable Foundation, by Ruth and Herman Albert Scholars Program for New Scientists, by the Ilse Katz Institute for Materials Sciences and Magnetic Resonance Research grant, by the Ministry of Health grant for alternative research methods, and by the France-Israel Cooperation - Maimonide-Israel Research Program. IKG is a recipient of the Rowland and Sylvia Career Development Chair.
材料
| Name | Company | Catalog Number | Comments |
| Luria Broth, Lennox | Difco | 240230 | |
| Bacto Agar | Difco | 214010 | |
| potassium phosphate monobasic | Sigma, 136.09 g/mol | P0662-500G | |
| potassium phosphate dibasic | Fisher Scientific, 174.18 g/mol | BP363-1 | |
| 3-(N-morpholino)propanesulfonic acid | Fisher Scientific, 209.27 g/mol | BP308-500 | |
| magnesium chloride hexahydrate | Merck, 203.30 g/mol | 1.05833.0250 | |
| calcium chloride anhydrous | J.T. Baker, 110.98 g/mol | 1311-01 | |
| manganese(II) chloride tetrahydrate | Sigma, 197.91 g/mol | 31422-250G-R | |
| iron(III) chloride hexahydrate | Sigma, 270.30 g/mo) | F2877-500G | |
| zinc chloride anhydrous | Acros Organics, 136.29 g/mol | 424592500 | |
| thiamine hydrochloride | Sigma, 337.27 g/mol | T1270-100G | |
| L-tryptophan | Fisher Scientific, 204.1 g/mol | BP395-100 | |
| L-phenylalanine | Sigma, 165.19 g/mol | P5482-100G | |
| L-threonine | Sigma, 119.12 g/mol | T8625-100G | |
| glycerol anhydrous | Bio-Lab Itd | 712022300 | |
| L-glutamic acid monosodium salts hydrate | Sigma, 169.11 g/mol | G1626-1KG | |
| D-leucine | Sigma, 169.11 g/mol | 855448-10G | |
| ethanol anhydrous | Gadot | 830000054 | |
| razor blade | Eddison | NA | |
| circular cellulose filter papers | Whatman, 90 mm | 1001-090 | |
| glutaraldehyde | EMS (Electron Micoscopy Science), 25% in water | 16220 | |
| paraformaldehyde | EMS, 16% in water | 15710 | |
| sodium cacodylate | Merck, 214.05 g/mol | 8.2067 | |
| calcium chloride 2-hydrate | Merck, 147.02 g/mol | 1172113 | |
| stub-aluminium mount | EMS, sloted head | 75230 | |
| carbon adhesive tape | EMS | 77825-12 | |
| Shaker 37 °C | New Brunswick Scientific Innowa42 | NA | |
| Centrifuge | Eppendorf table top centrifuge 5424 | NA | |
| Digital Sonifier, Model 250, used with Double Step Microtip | Branson | NA | |
| Incubator 30 °C | Binder | NA | |
| Incubator 23 °C | Binder | NA | |
| Filter System, 500 ml, polystyrene | Cornig Incorporated | NA | |
| Rotary Shaker - Orbitron Rotatory II | Boekel | NA | |
| S150 Sputter Coater | Edwards | NA | |
| CPD 030 Critical Point Dryer | BAL-TEC | NA | |
| Environmental Scanning Electron Microscope | XL30 ESEM FEG Philips (FEI) | NA |
参考文献
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu Rev Microbiol. 56, 187-209 (2002).
- Miller, M. B., Bassler, B. L. Quorum sensing in bacteria. Annu Rev Microbiol. 55, 165-199 (2001).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr Opin Microbiol. 10, 638-643 (2007).
- Kolter, R., Greenberg, E. P. Microbial sciences: the superficial life of microbes. Nature. 441, 300-302 (2006).
- Kearns, D. B., Chu, F., Branda, S. S., Kolter, R., Losick, R. A master regulator for biofilm formation by Bacillus subtilis. Mol Microbiol. 55, 739-749 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol Microbiol. 59, 1229-1238 (2006).
- Romero, D., Aguilar, C., Losick, R., Kolter, R. Amyloid fibers provide structural integrity to Bacillus subtilis biofilms. Proc Natl Acad Sci USA. 107, 2230-2234 (2010).
- Kobayashi, K., Iwano, M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms. Mol Microbiol. 85, 51-66 (2012).
- Hobley, L., et al. BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm. Proc Natl Acad Sci USA. 110, 13600-13605 (2013).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol Microbiol. 80, 1155-1168 (2011).
- Kolodkin-Gal, I., et al. D-amino acids trigger biofilm disassembly. Science. 328, 627-629 (2010).
- Chan, Y. G., Kim, H. K., Schneewind, O., Missiakas, D. The capsular polysaccharide of Staphylococcus aureus is attached to peptidoglycan by the LytR-CpsA-Psr (LCP) family of enzymes. J Biol Chem. 289, 15680-15690 (2014).
- Mielich-Suss, B., Lopez, D. Molecular mechanisms involved in Bacillus subtilis biofilm formation. Environ Microbiol. 17, 555-565 (2014).
- Cairns, L. S., Hobley, L., Stanley-Wall, N. R. Biofilm formation by Bacillus subtilis: new insights into regulatory strategies and assembly mechanisms. Mol Microbiol. 93, 587-598 (2014).
- Chen, M., Yu, Q., Sun, H. Novel strategies for the prevention and treatment of biofilm related infections. Int J Mol Sci. 14, 18488-18501 (2013).
- Bucher, T., Oppenheimer-Shaanan, Y., Savidor, A., Bloom-Ackermann, Z., Kolodkin-Gal, I. Disturbance of the bacterial cell wall specifically interferes with biofilm formation. Environ Microbiol Rep. 7, 990-1004 (2015).
- Sarkar, S., Pires, M. M. D-Amino acids do not inhibit biofilm formation in Staphylococcus aureus. PLoS One. 10, e0117613 (2015).
- Wei, W., Bing, W., Ren, J., Qu, X. Near infrared-caged D-amino acids multifunctional assembly for simultaneously eradicating biofilms and bacteria. Chem Commun (Camb). 51, 12677-12679 (2015).
- Leiman, S. A., et al. D-amino acids indirectly inhibit biofilm formation in Bacillus subtilis by interfering with protein synthesis. J Bacteriol. 195, 5391-5395 (2013).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Davies, D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov. 2, 114-122 (2003).
- Olsen, I. Biofilm-specific antibiotic tolerance and resistance. Eur J Clin Microbiol Infect Dis. 34, 877-886 (2015).
- Tseng, B. S., et al. The extracellular matrix protects Pseudomonas aeruginosa biofilms by limiting the penetration of tobramycin. Environ Microbiol. 15, 2865-2878 (2013).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc Natl Acad Sci USA. 98, 11621-11626 (2001).
- Holscher, T., et al. Motility, Chemotaxis and Aerotaxis Contribute to Competitiveness during Bacterial Pellicle Biofilm Development. J Mol Biol. 427, 3695-3708 (2015).
- Bray, D. . Methods in Biotechnology. 13, 235-243 (2000).
- Ensikat, H. J., Ditsche-Kuru, P., Barthlott, W. . Scanning electron microscopy of plant surfaces: simple but sophisticated methods for preparation and examination. 1, 248-255 (2010).
- Hayat, M. A. . Principles and techniques of scanning electron microscopy: Biological applications. 2, (1976).
- Schatten, H. . Scanning Electron Microscopy for the Life Sciences. , (2013).
- Bridier, A., Meylheuc, T., Briandet, R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM, ESEM and FESEM). Micron. 48, 65-69 (2013).
- Boyde, A., MacOnnachie, E. Volume changes during preparation of mouse embryonic tissue for scanning electron microscopy. SCANNING. 2, 149-163 (1979).
- Yao, Z., Kahne, D., Kishony, R. Distinct single-cell morphological dynamics under beta-lactam antibiotics. Mol Cell. 48, 705-712 (2012).
- Epstein, A. K., Pokroy, B., Seminara, A., Aizenberg, J. Bacterial biofilm shows persistent resistance to liquid wetting and gas penetration. Proc Natl Acad Sci USA. 108, 995-1000 (2011).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11, 157-168 (2013).
- Shemesh, M., Chai, Y. A combination of glycerol and manganese promotes biofilm formation in Bacillus subtilis via histidine kinase KinD signaling. J Bacteriol. 195, 2747-2754 (2013).
- Kolodkin-Gal, I., et al. Respiration control of multicellularity in Bacillus subtilis by a complex of the cytochrome chain with a membrane-embedded histidine kinase. Genes Dev. 27, 887-899 (2013).
- Oppenheimer-Shaanan, Y., et al. Spatio-temporal assembly of functional mineral scaffolds within microbial biofilms. npj Biofilms and Microbiomes. 2, 15031 (2016).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. , e3796 (2012).
- Bogino, P. C., Oliva Mde, L., Sorroche, F. G., Giordano, W. The role of bacterial biofilms and surface components in plant-bacterial associations. Int J Mol Sci. 14, 15838-15859 (2013).
- Fratamico, P. M., Annous, B. A., Guenther, N. W. . Biofilms in the Food and Beverage Industires. 1, (2009).
- Gao, G., et al. Effect of biocontrol agent Pseudomonas fluorescens 2P24 on soil fungal community in cucumber rhizosphere using T-RFLP and DGGE. PLoS One. 7, e31806 (2012).
- Chen, Y., et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation. Environ Microbiol. 15, 848-864 (2013).
- Bryers, J. D. Medical biofilms. Biotechnol Bioeng. 100, 1-18 (2008).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7, 375-381 (2009).
- Nevin, K. P., Woodard, T. L., Franks, A. E., Summers, Z. M., Lovley, D. R. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. MBio. 1, (2010).
- Torres, C. I., et al. A kinetic perspective on extracellular electron transfer by anode-respiring bacteria. FEMS Microbiol Rev. 34, 3-17 (2010).
- Li, J., Wang, N. Foliar application of biofilm formation-inhibiting compounds enhances control of citrus canker caused by Xanthomonas citri subsp. citri. Phytopathology. 104, 134-142 (2014).
- Okegbe, C., Price-Whelan, A., Dietrich, L. E. Redox-driven regulation of microbial community morphogenesis. Curr Opin Microbiol. 18, 39-45 (2014).
- Mann, E. E., Wozniak, D. J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev. 36, 893-916 (2012).
- Bouffartigues, E., et al. Sucrose favors Pseudomonas aeruginosa pellicle production through the extracytoplasmic function sigma factor SigX. FEMS Microbiol Lett. 356, 193-200 (2014).
- Wu, C., Lim, J. Y., Fuller, G. G., Cegelski, L. Quantitative analysis of amyloid-integrated biofilms formed by uropathogenic Escherichia coli at the air-liquid interface. Biophys J. 103, 464-471 (2012).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an Architectural Element in Spatially Structured Escherichia coli Biofilms. J Bacteriol. 195, 5540-5554 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。