このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
研究のための方法論
要約
This study presents the development of reproducible methodologies to study biofilm inhibitors and their effects on Bacillus subtilis multicellularity.
要約
This work assesses different methodologies to study the impact of small molecule biofilm inhibitors, such as D-amino acids, on the development and resilience of Bacillus subtilis biofilms. First, methods are presented that select for small molecule inhibitors with biofilm-specific targets in order to separate the effect of the small molecule inhibitors on planktonic growth from their effect on biofilm formation. Next, we focus on how inoculation conditions affect the sensitivity of multicellular, floating B. subtilis cultures to small molecule inhibitors. The results suggest that discrepancies in the reported effects of such inhibitors such as D-amino acids are due to inconsistent pre-culture conditions. Furthermore, a recently developed protocol is described for evaluating the contribution of small molecule treatments towards biofilm resistance to antibacterial substances. Lastly, scanning electron microscopy (SEM) techniques are presented to analyze the three-dimensional spatial arrangement of cells and their surrounding extracellular matrix in a B. subtilis biofilm. SEM facilitates insight into the three-dimensional biofilm architecture and the matrix texture. A combination of the methods described here can greatly assist the study of biofilm development in the presence and absence of biofilm inhibitors, and shed light on the mechanism of action of these inhibitors.
概要
多細胞細菌群集は、自然と人為的な環境で重要な役割を果たし、かつ有益であるか、または非常に有害であり得ます。これらの多細胞コロニーを、個々の細胞が自己生産細胞外ポリマー物質(EPS)マトリックス中に埋め込まれている前記バイオフィルムとして知られています。 EPSは強く、彼らが植民地化の表面に細胞を接着します。彼らは、機械的および化学的な力に対するシールドとして機能し、セルラー通信1を容易に 、隣接するセルの間の密接な接触を作成します。バイオフィルムは、細胞が高度に制御使用差別コミュニティ、と見ることができる、コミュニティ内だけでなく、種2-5全体で彼らの活動を調整するためのプロセスを画策。バイオフィルム状態への成長のプランクトン、自由生活モードからの移行は、多くの場合、発達過程と関連しています。良い例は、グラム陽性土壌細菌の枯草菌(Bacillus subtilis)、したがってundomeですsticated株は、バイオフィルム形成につながる発達段階を研究するための堅牢なモデル生物としての役割を果たす。この細菌では、運動性の細胞は、特殊なタスク4を実行目立つ多細胞構造に自分自身を整理します。細胞の一つのグループは、マトリックス・プロデューサーはエキソポリサッカライド6を分泌し 、アミロイドタンパク質TASA 7,8、および表面疎水性タンパク質BslA 9,10;これらの全ては、EPS 11-13の組み立てに参加しています。
自然と人為的ニッチでのバイオフィルムの豊かさと、彼らが引き起こす可能性が推定される致命的なダメージを考えると、それらの形成を防止するための方法を見つけることが急務です。小分子阻害剤は、バイオフィルム形成に関与する新たな調節経路、酵素および構造タンパク質の発見を補助し、それによって多コミュニティアセンブリの複雑なプロセスにおける洞察を促進することができます。 B.として枯草菌バイオのためのよく研究モデルであります成膜14,15は、様々なバイオフィルム阻害剤の効果を評価するために使用することができます。この研究は、小分子阻害剤に対するバイオフィルムの反応を評価するための主要な4つの基本的な方法に取り組みます。まず、これらの阻害剤はバイオフィルム特有の目標を持っていることを確認するために、バイオフィルム形成に及ぼす影響からプランクトンの成長への影響の分離が重要です。ほとんどの抗菌剤は、それらのプランクトン増殖期の細胞を標的とするが、バイオフィルムのライフスタイルをターゲット分子はまれです。プランクトンの成長に影響を及ぼさない分子は毒性がないとして加えて、彼らは抗生物質耐性変異体16に有利な選択圧を減らすことができます。バイオフィルムは、D-アミノ酸または他の特定の細胞壁干渉分子で処理した場合、例えば、それらは、いずれの乱れまたは分解が、これらの阻害剤は、軽度に浮遊成長12,17に影響を及ぼす。これとは対照的に、多くの抗生物質は劇的リットルで、プランクトンの成長を損ないますittleまたはバイオフィルム形成17に影響はありません。
第二に、小分子の効果を研究するための一貫性と堅牢な実験的な枠組みを確立することが重要です。我々は、小分子阻害剤の有効濃度範囲は、前培養条件およびこれらの小分子阻害剤の効果を研究するために使用される実験に感受性であったことを観察しました。各種レポート、Bを勉強特に浮遊細菌のバイオフィルム12,17-19 - 枯草菌は、D-アミノ酸がペリクルの形成を阻害する濃度範囲の変化を明らかにしました。ここに示された結果は、以下の要因が活性濃度範囲の差を考慮することを示唆している:前培養条件(後期静止20増殖期対対数12,17)、前培養の条件で使用される増殖培地は、(リッチ、定義された対未定義[ルリアブロス、LB] [グルタミン酸ナトリウム- グリセロール、MSgg])、接種率、特に接種前に前培養培地を除去します。静的ペリクル成長の温度は、小分子阻害剤D-ロイシン、本研究で使用した代表D-アミノ酸の活性範囲においてそれほど重要な役割を示しました。
最後に、一度バイオフィルムは、特定のバイオフィルム阻害剤は、堅牢かつ有益な方法は、バイオフィルムのフィットネスにこれらの阻害剤の効果を特徴付けるために必要とされるで処理されます。ここでは、独立して小分子阻害剤の効果を特徴づけるための2つの方法が詳細に記載されている:(1)バイオフィルムコロニー中で単一細胞に作用し、抗菌剤に対する耐性。自由生活細菌21-23と比較した場合、バイオフィルム中の細胞は、典型的には、抗生物質に対してより耐性があります。この現象は多因子ですが、抗生物質の侵入を低減するためのEPSの能力は、多くの場合、魅力的な説明を24としました。この方法は、抗菌性物質への曝露後の予め確立されたバイオフィルム細胞の生存率を評価します。 (2)バイオフィルムコロニーアーキテクチャへの影響を、大から小スケールへ。バイオフィルムコロニーは、それらの三次元構造およびEPSの存在によって特徴付けられます。小スケール(μm)とし、走査型電子顕微鏡を利用して、細胞形態、バイオフィルムコロニー構造とEPSのアーキテクチャ及び存在量の変化が大きい(ミリメートル)から可視化することができます。
プロトコル
1.ペリクルおよびバイオフィルムコロニー形成への小分子阻害剤の影響を評価します
- 塩化カルシウムと鉄を含まない培地定義されたバイオフィルム誘発MSgg 25の2×溶液を調製する(III)六水和物。フィルター滅菌した後、塩化カルシウムを加えます。培地を直接使用する準備ができているか、暗所で4℃で保存することができます。
- 実験の日に、1×MSgg希釈液を準備します。
- (滅菌蒸留水(ペリクル)または滅菌3%熱い(80℃)寒天(バイオフィルム)で1倍、50μM(ペリクル)または250μMの最終濃度に塩化鉄(III)六水和物を追加するには、2倍MSgg媒体を希釈バイオフィルム)。所望の濃度に抗生物質または小分子阻害剤を加え、よく混ぜます。たとえば、76.3ミリ(10 mg / mlで)D-ロイシンストック溶液196.6μLを加える、ペリクルまたはバイオフィルムを確立するために、30ml中に0.5mMのD-ロイシンの最終濃度を得ました。
NOTE:最終1×MSgg組成物は、表1に記載されている元のレシピ25と比較すると、媒体は、固体MSgg媒体上のバイオフィルムコロニーを成長させるために50トレオニン/ mlのμgの鉄濃度を含有したが、しわコロニー形態を最適化するために、2.5倍に増加しました。 。
- (滅菌蒸留水(ペリクル)または滅菌3%熱い(80℃)寒天(バイオフィルム)で1倍、50μM(ペリクル)または250μMの最終濃度に塩化鉄(III)六水和物を追加するには、2倍MSgg媒体を希釈バイオフィルム)。所望の濃度に抗生物質または小分子阻害剤を加え、よく混ぜます。たとえば、76.3ミリ(10 mg / mlで)D-ロイシンストック溶液196.6μLを加える、ペリクルまたはバイオフィルムを確立するために、30ml中に0.5mMのD-ロイシンの最終濃度を得ました。
- 寒天が固化した後、接種前に30-45分のための生物学的フード内で固体MSggプレートを乾燥させます。
- 薄膜形成( 図1)のメカニズムを妨害する特異的阻害剤を選択するには、使用される濃度は、プランクトンや静的な成長に影響を与えることを排除します。
- 定常増殖期まで、600 nmで毎時間、光学密度を測定することにより、単純な成長曲線におけるプランクトンの成長(液体培養時間にわたる光学密度の増加)を決定します。
- 、測定された培養物の濁度は、生細胞の数を表すことを確認する単位(CFU)を形成するコロニーの数を決定しますいくつかの時点後の振盪培養物からの浮遊増殖期にある細胞の。
- 24ウェル細胞培養物から23℃で3日間のインキュベーションの終了時に静的な薄膜成長、収穫細胞の小分子阻害剤の効果を評価するために、セクション1.7〜1.9に記載したのと同じ条件下で接種そしてCFUを決定します。この制御のために、細胞外マトリックス成分( すなわち 、 枯草菌 ΔepsH、ΔTASA)をコードするオペロンを欠いているペリクル欠損株を使用します。
注:この株は、静的条件下で成長させることが可能であるが、ペリクルを形成する野生型とは対照的に、それは成長が増加による酸素レベル26に支持される、液体-空気界面に浮遊する能力を欠損しています。したがって、この細胞外の行列 - ペリクル欠損株は、静的な条件下での成長を評価するための推奨基準株です。
注:特定の元について以下に記載される非正規のD-アミノ酸のD-ロイシンの豊富な、ペリクルの形成を妨害する濃度ではプランクトンと静的な成長への影響は12,17除外されました。プランクトン及び静的成長を決定するための方法が詳細17に記載されています。
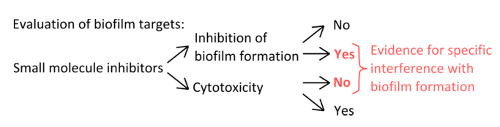
図1.バイオフィルム形成の特異的阻害を評価するための堅牢な実験を識別するための概念的な概要。プランクトンの成長に顕著な効果のないバイオフィルム形成との特異的な干渉を示す小分子阻害剤の選択基準。 拡大版をご覧になるにはこちらをクリックしてください。この図の。
- B.アウトストリーク-80℃ストックから枯草菌 (LBのcultu20%グリセロール中で凍結10 9細胞/ ml)の再滅菌先端又はアプリケータスティックを用いてLB-1.5%寒天プレート上に単一コロニーを単離します。
- 30℃で一晩増殖。
- 重要なステップ:例えばD-ロイシンなどの非標準的なDアミノ酸による強固なペリクル阻害のためには、単一コロニーを、4時間、37℃で3 mlのLBブロス中でLB-1.5%寒天プレートから採取して増殖します振盪インキュベーター(速度200rpmで振とう)。慎重に上清を除去し、1.5ミリリットルMSgg培地でペレットを再懸濁し、6,000×gで4分間、1.5ミリリットルスターター培養物を遠心分離することにより、接種前にバイオフィルム誘導MSgg培地でLBブロスを交換してください。培養物の残りは廃棄することができます。
重要:システムの堅牢性を確保するために、洗浄スターター培養の600 nmの(OD 600)での光学密度は0.6と1の間であるべきです。 - スターター培養物の増殖中に、12ウェル細胞培養multidishプレートcontaininを準備せずに、または小分子阻害剤( 例えば 、0.3、0.5、1 mMのD-ロイシン17)の濃度範囲でMSgg培地G 3 mlです。エッジ効果を除外するために、multidishプレート全体に異なる濃度の場所を配布します。また、MSgg培地の1.5ミリリットルを含む24ウェル細胞培養multidishプレートを使用しています。
- (:1,000希釈1)洗浄スターターカルチャーの3μlの12ウェル細胞培養multidishプレートのウェルに接種。
注:より低い希釈率、 すなわち 、1:500を使用することができます。これは、ペリクルの開発時間を減少させます。 - 3日間静的条件下で、23℃でペリクルを成長させます。それはペリクルの最終的な表面形態に影響を与えることができるように、この時間の間にペリクルを動かさないでください。
- 雷の両眼と均質な露出で画像を取得します。また、高解像度のカメラでペリクルの写真を撮ります。 inconsisに起因するアーチファクトを回避するために、テント光角度と影、カメラ三脚に固定し、両側から45°で柔らかく、大きな光源を使用して、トップダウンの写真を撮ります。
注:B.を研究するための代替方法枯草菌の多細胞は、固体、バイオフィルム誘導MSgg媒体上のバイオフィルムコロニーアッセイです。ペリクルと同様に、このアッセイは、時空間プロセスの研究を可能にします。小分子阻害剤の有効範囲が決定されると、バイオフィルムコロニー形成に及ぼす影響を研究することができます。 - 8.5センチメートル直径のペトリ皿当たり4滴 - バイオフィルムコロニーを成長させるために、対称的に洗っていない前培養1.5μlのテンプレートの助けを借りて、乾燥MSgg 1.5%寒天プレート上で(ステップ1.7)を見つけます。滴は、それらを移動する前にプレートに吸着してみましょう。
注:テンプレートは、細胞が成長しているエリア内のバイオフィルムコロニーの平等な分配を取得するのに役立ちます。テンプレートを準備するには、元のスケールでの成長の総面積を描き同じ宗派にそれを分けますORSと中心をマーク。 8.5センチメートル径の丸シャーレの場合、この14 cm 2で1バイオフィルムコロニーを割り当てます。 - 3日間30℃で培養します。この間、バイオフィルムコロニーを開発し、3次元、しわ構造を形成します。
- ステップ1.11のように撮影してください。
2.エタノール耐性アッセイ
- ステップ1.1から1.7と1.12から1.14に記載されているようにバイオフィルムを成長させます。
- 30℃での成長の68時間後、カミソリの刃とテンプレートの助けを借りて2等分バイオフィルムコロニーをカット。

図2の例滅菌剤にバイオフィルムコロニー細胞の抵抗性を評価するための実験デザイン。シャーレ全体の生物膜コロニーの平等な分配のためにおよび切断するためのもの(A)のテンプレート。 (B)30℃で固体で、定義されたバイオフィルム誘導MSgg媒体上に68時間増殖させ、未処置の野生型バイオフィルムのトップダウン画像。拡大は、バイオフィルムコロニーは2等分にカットすることができる方法を示しています。 (C)2つの等しいバイオフィルムの半分は、またはPBSまたは滅菌剤と記載されているように処理のいずれかで(PBS、コントロールを)同等に扱われています。スケールバー:1センチメートルこの図の拡大版をご覧になるにはこちらをクリックしてください。
- 慎重に小さなへらで寒天プレートからバイオフィルムコロニーの各半分を持ち上げ、リン酸緩衝生理食塩水(PBS)の500μLを含む1.5 mlのマイクロ遠心チューブに移動します。必要に応じて、プレートから残りの細胞をこすり、同様にマイクロ遠心チューブに移します。
注:バイオフィルムコロニーの後半は、それが制御されたりsteriに対する耐性をテストするかどうかに応じて、差動的に処理されますlizingエージェント。 - 制御のために、ステップ2.3のように500μlのPBS中のバイオフィルムコロニーの後半をインキュベートします。滅菌剤に対する耐性を評価するために、500μlの50%(v / v)のエタノール、バイオフィルムコロニーの後半を転送します。
注:このような次亜塩素酸ナトリウムのような代替的な殺菌剤を使用することができます。使用されているすべての滅菌剤の場合は、予備実験で活性濃度およびインキュベーション時間を決定します。 - 室温でベンチトップ上で10分間、バイオフィルムコロニーをインキュベートします。
- 18,000×gで5分間、バイオフィルムコロニーを遠心し、 慎重にピペットで上清を除去します。 300μlのPBSを追加します。
- 超音波処理器のマイクロチップで穏やかに細胞(振幅10%、パルス5秒)を超音波処理します。
注:超音波処理エネルギーは、個別のバイオフィルムの集合体に十分でなければなりません。しかし、あまりにも過酷な超音波処理は、細胞を溶解することができます。光学顕微鏡、超音波処理エネルギーによって事前に確認してください細胞を溶解しない使用し、すべての凝集物が溶解していること。 - 1ミリリットルの最終容量にPBS700μlのを追加します。 PBS(10 -7)で連続希釈を行い、滅菌ガラスビーズを用いて、LB-1.5%寒天プレート上に3希釈100μlの広がり。
注:これは、関心のバイオフィルムコロニーと滅菌剤に応答した細胞の生存率の細胞の量に依存するようにメッキされる最適な希釈は、予備実験において決定されるべきです。 - CFUをカウントし、CFU / mlと決定し、30℃で一晩培養します。各半分バイオフィルムコロニーの最終CFU / mlの、生存者の割合を計算します。
注:実行され、分析記載されているように、対称またはコロニーの耐性を検証コントロールバイオフィルムコロニーの2つの半分と生存細胞数の10%以下の相違点を得なければならない未処理のバイオフィルムコロニーのエタノールで処理した半分の対未処理、 、respectively。代替的に、結果は、全CFUで表すことができます。制御および未処理のバイオフィルムコロニーの細胞数は、同じ大きさの順に残るべきです。これとは対照的に、小分子で処理したバイオフィルムコロニーのエタノールで処理した半分の細胞数は、滅菌剤に対する感受性の増大を請求するために二桁の最小値によって落下することが期待されます。
走査電子顕微鏡観察のため3.バイオフィルムコロニーサンプル調製
- ステップ1.1から1.7と1.12から1.14に記載されているように、バイオフィルムコロニーを成長させます。
- 2%の100mMカコジル酸ナトリウム、5mMの塩化カルシウム緩衝液、pH 7.3中の(v / v)のグルタルアルデヒド、3%(v / v)のパラホルムアルデヒド溶液の新鮮なバッチを調製します。 8.5センチメートル直径のすべてのペトリ皿のための固定液5ミリリットルを準備します。
注意:グルタルアルデヒドおよびパラホルムアルデヒドは危険です。化学フード内部の安全装置とそれらを扱います。 HAZにソリューションや汚染物質を廃棄ardous廃棄物。 - 慎重にバイオフィルムの上に直接分配することなく、バイオフィルムコロニーに固定液を追加します。
注:バイオフィルムコロニーの疎水性により、コロニーをゆっくりと寒天から切り離し、フロートを開始します。 - 慎重にパラフィルムのストリップとプレートをシール。室温で2時間、ロータリーシェーカー上でインキュベートし、続いて一晩4℃にプレートを転送します。
- 翌日、慎重に真空ポンプに接続されたパスツールガラスピペットを用いて液体を除去します。
- 慎重に、バイオフィルムを洗浄し、5分間インキュベート10 100mlのミリモルのカコジル酸ナトリウム、5mMの塩化カルシウム緩衝液を加えます。静かにバイオフィルムを損傷しないように、穏やかにピペッティングすることによって、新鮮な洗浄溶液を追加するために、プレートの隅からパスツールガラスピペットを用いて液体を除去します。一度、この手順を繰り返します。
- バイオフィルムコロニーの脱水のために、次の手順に進みますのddH 2 Oで2回5分。 3で2回20分0%エタノール。 50%エタノール中で20分間2倍、 70%エタノール中で20分間2倍、 96%エタノール中で20分間2倍、 2×100%エタノールで30分間。
- 各ステップ8.5センチ径のすべてのペトリ皿のための液体の15ミリリットルを追加し、各インキュベーション後に慎重に液体を除去します。
- エタノールからサンプルを乾燥させるための2つの異なる方法のいずれかを使用します。
- エタノールからの空気乾燥の場合:
- 四半期中のセルロース濾紙(直径9cm)をカットします。簡単に言えば100%エタノールで1四半期水没し、その後慎重に1浮遊バイオフィルムコロニーを移します。ろ紙を敷いたペトリ皿に湿った濾紙を入れてください。ペトリ皿を覆い、バイオフィルムコロニーは、化学フード内で一晩乾燥してみましょう。
- 臨界点(CP)のための遷移流体として二酸化炭素(CO 2)を使用して-drying。
- 100%エタノールで臨界点乾燥機チャンバの75%を満たします。独自のCに、ホルダーに各サンプルを、サンプルを転送hamber。必要に応じて、小さな断片にハサミでバイオフィルムをカット。すべての処理中にエタノールに沈めたサンプルを残します。その後、チャンバー内にホルダーを転送し、しっかり室を閉じます。
- 7°Cに室を冷却し、攪拌を開始します。液体CO 2で完全にチャンバーを埋めます。 7分間のインキュベーション時間の間、CO 2とエタノールミックスをしましょう。その後、溶液の25%を放出します。
注:サンプルのレベルより下のチャンバーを空にしないでください。 - 手順を繰り返し3.8.2.2 4回。
- 手順を繰り返し3.8.2.2のみ5分間のインキュベーション時間で5回。最後に、エタノールを完全にCO 2に置き換えてください。
- 最終ラウンド、室内の空のわずか5%の間。撹拌及び冷却をオフにします。 42℃にチャンバーを加熱開始します。 31.1℃の温度および73.9バールの圧力で、液体CO 2は 、臨界点、気体のpH状態になりますASEは、溶媒27の液相と同一の密度を有します。温度が42℃に達すると、10分間インキュベートします。 42℃で、チャンバー内のCO 2は超臨界ガスとして存在します。
注:常に室の圧力を確認してください。圧力は、42℃で120バールを超えてはなりません。 - ゆっくりと連続加熱してガスを放出するために開始します。これは、CO 2ガス相にサンプルを保持し、液体の表面張力を介してサンプルの形態の変形を防止することができます。微調整によって流量計を制御する計量弁を5リットル/ hrの流量計を設定します。チャンバー内のすべての圧力が解放されるまで待ってください。今すぐ室を開いて、ホルダーから慎重にサンプルを削除します。
- エタノールからの空気乾燥の場合:
- コートカーボンテープで電子顕微鏡スタブ。ピンセットの助けを借りて、慎重にスタブ上にバイオフィルムコロニーを移します。車から細い橋を追加することで、スタブに各コロニーを接続します電子ビームの下で除電のために重要であるボンテープ、。彼らは非常に壊れやすいように、この段階では、注意してバイオフィルムコロニーを扱います。少なくとも24時間、又は検査までデシケーターでサンプルを保管してください。
- 走査型電子顕微鏡で検査の日は、金 - パラジウムスパッタコーター中で60°の角度で2分間、バイオフィルムコロニーを-スパッタコート。このステップを2回繰り返し、その間に120°ずつサンプルを回転させます。終わりに、スパッタコートサンプルを一度、上から3分間。金 - パラジウムの20 nmの薄い層は、導電性を向上させ、SEMでのイメージングのための試料のコントラストを向上させます。
- 走査型電子顕微鏡29,30で画像化するまで、サンプル28の再水和を避けるために、デシケーター内のサンプルを保管してください。
結果
ペリクルアッセイは、Bの高度に制御し、動的プロセスを研究するための1つの方法であります枯草菌の多細胞。この他にも、ペリクルアッセイは、1つの実験において、単一の細胞培養multidishプレートに予め始動条件または小分子のいずれかの濃度の範囲を試験するのに適しています。しかし、B.枯草菌ペリクルの形成は前培養条件に敏感である( 例えば 、前培養の...
ディスカッション
枯草菌フォーム堅牢で高度に構造化されたバイオフィルムの両方の液体中(ペリクル)と固体培地上(コロニー)。したがって、特定のバイオフィルム阻害剤の作用の様式を特徴付けるための理想的なモデル生物として働きます。固形培地に、細胞は、エッジに、中心から放射状にシワのようなペリクルにおいて明らかではない独特の機能を持ったものと多細胞構造を形成します。し...
開示事項
The authors have nothing to disclose.
謝辞
Electron microscope imaging was conducted at the Electron Microscopy Unit of the Weizmann Institute of Science, supported in part by the Irving and Cherna Moskowitz Center for Nano and Bio-Nano Imaging. This research was also supported by the ISF I-CORE grant 152/1, Mr. and Mrs. Dan Kane, Ms. Lois Rosen, by a Yeda-Sela research grant, by the Larson Charitable Foundation, by Ruth and Herman Albert Scholars Program for New Scientists, by the Ilse Katz Institute for Materials Sciences and Magnetic Resonance Research grant, by the Ministry of Health grant for alternative research methods, and by the France-Israel Cooperation - Maimonide-Israel Research Program. IKG is a recipient of the Rowland and Sylvia Career Development Chair.
資料
| Name | Company | Catalog Number | Comments |
| Luria Broth, Lennox | Difco | 240230 | |
| Bacto Agar | Difco | 214010 | |
| potassium phosphate monobasic | Sigma, 136.09 g/mol | P0662-500G | |
| potassium phosphate dibasic | Fisher Scientific, 174.18 g/mol | BP363-1 | |
| 3-(N-morpholino)propanesulfonic acid | Fisher Scientific, 209.27 g/mol | BP308-500 | |
| magnesium chloride hexahydrate | Merck, 203.30 g/mol | 1.05833.0250 | |
| calcium chloride anhydrous | J.T. Baker, 110.98 g/mol | 1311-01 | |
| manganese(II) chloride tetrahydrate | Sigma, 197.91 g/mol | 31422-250G-R | |
| iron(III) chloride hexahydrate | Sigma, 270.30 g/mo) | F2877-500G | |
| zinc chloride anhydrous | Acros Organics, 136.29 g/mol | 424592500 | |
| thiamine hydrochloride | Sigma, 337.27 g/mol | T1270-100G | |
| L-tryptophan | Fisher Scientific, 204.1 g/mol | BP395-100 | |
| L-phenylalanine | Sigma, 165.19 g/mol | P5482-100G | |
| L-threonine | Sigma, 119.12 g/mol | T8625-100G | |
| glycerol anhydrous | Bio-Lab Itd | 712022300 | |
| L-glutamic acid monosodium salts hydrate | Sigma, 169.11 g/mol | G1626-1KG | |
| D-leucine | Sigma, 169.11 g/mol | 855448-10G | |
| ethanol anhydrous | Gadot | 830000054 | |
| razor blade | Eddison | NA | |
| circular cellulose filter papers | Whatman, 90 mm | 1001-090 | |
| glutaraldehyde | EMS (Electron Micoscopy Science), 25% in water | 16220 | |
| paraformaldehyde | EMS, 16% in water | 15710 | |
| sodium cacodylate | Merck, 214.05 g/mol | 8.2067 | |
| calcium chloride 2-hydrate | Merck, 147.02 g/mol | 1172113 | |
| stub-aluminium mount | EMS, sloted head | 75230 | |
| carbon adhesive tape | EMS | 77825-12 | |
| Shaker 37 °C | New Brunswick Scientific Innowa42 | NA | |
| Centrifuge | Eppendorf table top centrifuge 5424 | NA | |
| Digital Sonifier, Model 250, used with Double Step Microtip | Branson | NA | |
| Incubator 30 °C | Binder | NA | |
| Incubator 23 °C | Binder | NA | |
| Filter System, 500 ml, polystyrene | Cornig Incorporated | NA | |
| Rotary Shaker - Orbitron Rotatory II | Boekel | NA | |
| S150 Sputter Coater | Edwards | NA | |
| CPD 030 Critical Point Dryer | BAL-TEC | NA | |
| Environmental Scanning Electron Microscope | XL30 ESEM FEG Philips (FEI) | NA |
参考文献
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu Rev Microbiol. 56, 187-209 (2002).
- Miller, M. B., Bassler, B. L. Quorum sensing in bacteria. Annu Rev Microbiol. 55, 165-199 (2001).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr Opin Microbiol. 10, 638-643 (2007).
- Kolter, R., Greenberg, E. P. Microbial sciences: the superficial life of microbes. Nature. 441, 300-302 (2006).
- Kearns, D. B., Chu, F., Branda, S. S., Kolter, R., Losick, R. A master regulator for biofilm formation by Bacillus subtilis. Mol Microbiol. 55, 739-749 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol Microbiol. 59, 1229-1238 (2006).
- Romero, D., Aguilar, C., Losick, R., Kolter, R. Amyloid fibers provide structural integrity to Bacillus subtilis biofilms. Proc Natl Acad Sci USA. 107, 2230-2234 (2010).
- Kobayashi, K., Iwano, M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms. Mol Microbiol. 85, 51-66 (2012).
- Hobley, L., et al. BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm. Proc Natl Acad Sci USA. 110, 13600-13605 (2013).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol Microbiol. 80, 1155-1168 (2011).
- Kolodkin-Gal, I., et al. D-amino acids trigger biofilm disassembly. Science. 328, 627-629 (2010).
- Chan, Y. G., Kim, H. K., Schneewind, O., Missiakas, D. The capsular polysaccharide of Staphylococcus aureus is attached to peptidoglycan by the LytR-CpsA-Psr (LCP) family of enzymes. J Biol Chem. 289, 15680-15690 (2014).
- Mielich-Suss, B., Lopez, D. Molecular mechanisms involved in Bacillus subtilis biofilm formation. Environ Microbiol. 17, 555-565 (2014).
- Cairns, L. S., Hobley, L., Stanley-Wall, N. R. Biofilm formation by Bacillus subtilis: new insights into regulatory strategies and assembly mechanisms. Mol Microbiol. 93, 587-598 (2014).
- Chen, M., Yu, Q., Sun, H. Novel strategies for the prevention and treatment of biofilm related infections. Int J Mol Sci. 14, 18488-18501 (2013).
- Bucher, T., Oppenheimer-Shaanan, Y., Savidor, A., Bloom-Ackermann, Z., Kolodkin-Gal, I. Disturbance of the bacterial cell wall specifically interferes with biofilm formation. Environ Microbiol Rep. 7, 990-1004 (2015).
- Sarkar, S., Pires, M. M. D-Amino acids do not inhibit biofilm formation in Staphylococcus aureus. PLoS One. 10, e0117613 (2015).
- Wei, W., Bing, W., Ren, J., Qu, X. Near infrared-caged D-amino acids multifunctional assembly for simultaneously eradicating biofilms and bacteria. Chem Commun (Camb). 51, 12677-12679 (2015).
- Leiman, S. A., et al. D-amino acids indirectly inhibit biofilm formation in Bacillus subtilis by interfering with protein synthesis. J Bacteriol. 195, 5391-5395 (2013).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Davies, D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov. 2, 114-122 (2003).
- Olsen, I. Biofilm-specific antibiotic tolerance and resistance. Eur J Clin Microbiol Infect Dis. 34, 877-886 (2015).
- Tseng, B. S., et al. The extracellular matrix protects Pseudomonas aeruginosa biofilms by limiting the penetration of tobramycin. Environ Microbiol. 15, 2865-2878 (2013).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc Natl Acad Sci USA. 98, 11621-11626 (2001).
- Holscher, T., et al. Motility, Chemotaxis and Aerotaxis Contribute to Competitiveness during Bacterial Pellicle Biofilm Development. J Mol Biol. 427, 3695-3708 (2015).
- Bray, D. . Methods in Biotechnology. 13, 235-243 (2000).
- Ensikat, H. J., Ditsche-Kuru, P., Barthlott, W. . Scanning electron microscopy of plant surfaces: simple but sophisticated methods for preparation and examination. 1, 248-255 (2010).
- Hayat, M. A. . Principles and techniques of scanning electron microscopy: Biological applications. 2, (1976).
- Schatten, H. . Scanning Electron Microscopy for the Life Sciences. , (2013).
- Bridier, A., Meylheuc, T., Briandet, R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM, ESEM and FESEM). Micron. 48, 65-69 (2013).
- Boyde, A., MacOnnachie, E. Volume changes during preparation of mouse embryonic tissue for scanning electron microscopy. SCANNING. 2, 149-163 (1979).
- Yao, Z., Kahne, D., Kishony, R. Distinct single-cell morphological dynamics under beta-lactam antibiotics. Mol Cell. 48, 705-712 (2012).
- Epstein, A. K., Pokroy, B., Seminara, A., Aizenberg, J. Bacterial biofilm shows persistent resistance to liquid wetting and gas penetration. Proc Natl Acad Sci USA. 108, 995-1000 (2011).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11, 157-168 (2013).
- Shemesh, M., Chai, Y. A combination of glycerol and manganese promotes biofilm formation in Bacillus subtilis via histidine kinase KinD signaling. J Bacteriol. 195, 2747-2754 (2013).
- Kolodkin-Gal, I., et al. Respiration control of multicellularity in Bacillus subtilis by a complex of the cytochrome chain with a membrane-embedded histidine kinase. Genes Dev. 27, 887-899 (2013).
- Oppenheimer-Shaanan, Y., et al. Spatio-temporal assembly of functional mineral scaffolds within microbial biofilms. npj Biofilms and Microbiomes. 2, 15031 (2016).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. , e3796 (2012).
- Bogino, P. C., Oliva Mde, L., Sorroche, F. G., Giordano, W. The role of bacterial biofilms and surface components in plant-bacterial associations. Int J Mol Sci. 14, 15838-15859 (2013).
- Fratamico, P. M., Annous, B. A., Guenther, N. W. . Biofilms in the Food and Beverage Industires. 1, (2009).
- Gao, G., et al. Effect of biocontrol agent Pseudomonas fluorescens 2P24 on soil fungal community in cucumber rhizosphere using T-RFLP and DGGE. PLoS One. 7, e31806 (2012).
- Chen, Y., et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation. Environ Microbiol. 15, 848-864 (2013).
- Bryers, J. D. Medical biofilms. Biotechnol Bioeng. 100, 1-18 (2008).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7, 375-381 (2009).
- Nevin, K. P., Woodard, T. L., Franks, A. E., Summers, Z. M., Lovley, D. R. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. MBio. 1, (2010).
- Torres, C. I., et al. A kinetic perspective on extracellular electron transfer by anode-respiring bacteria. FEMS Microbiol Rev. 34, 3-17 (2010).
- Li, J., Wang, N. Foliar application of biofilm formation-inhibiting compounds enhances control of citrus canker caused by Xanthomonas citri subsp. citri. Phytopathology. 104, 134-142 (2014).
- Okegbe, C., Price-Whelan, A., Dietrich, L. E. Redox-driven regulation of microbial community morphogenesis. Curr Opin Microbiol. 18, 39-45 (2014).
- Mann, E. E., Wozniak, D. J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev. 36, 893-916 (2012).
- Bouffartigues, E., et al. Sucrose favors Pseudomonas aeruginosa pellicle production through the extracytoplasmic function sigma factor SigX. FEMS Microbiol Lett. 356, 193-200 (2014).
- Wu, C., Lim, J. Y., Fuller, G. G., Cegelski, L. Quantitative analysis of amyloid-integrated biofilms formed by uropathogenic Escherichia coli at the air-liquid interface. Biophys J. 103, 464-471 (2012).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an Architectural Element in Spatially Structured Escherichia coli Biofilms. J Bacteriol. 195, 5540-5554 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved