É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Metodologias para o estudo
Neste Artigo
Resumo
This study presents the development of reproducible methodologies to study biofilm inhibitors and their effects on Bacillus subtilis multicellularity.
Resumo
This work assesses different methodologies to study the impact of small molecule biofilm inhibitors, such as D-amino acids, on the development and resilience of Bacillus subtilis biofilms. First, methods are presented that select for small molecule inhibitors with biofilm-specific targets in order to separate the effect of the small molecule inhibitors on planktonic growth from their effect on biofilm formation. Next, we focus on how inoculation conditions affect the sensitivity of multicellular, floating B. subtilis cultures to small molecule inhibitors. The results suggest that discrepancies in the reported effects of such inhibitors such as D-amino acids are due to inconsistent pre-culture conditions. Furthermore, a recently developed protocol is described for evaluating the contribution of small molecule treatments towards biofilm resistance to antibacterial substances. Lastly, scanning electron microscopy (SEM) techniques are presented to analyze the three-dimensional spatial arrangement of cells and their surrounding extracellular matrix in a B. subtilis biofilm. SEM facilitates insight into the three-dimensional biofilm architecture and the matrix texture. A combination of the methods described here can greatly assist the study of biofilm development in the presence and absence of biofilm inhibitors, and shed light on the mechanism of action of these inhibitors.
Introdução
comunidades bacterianas multi-celulares desempenham papéis importantes em ambientes naturais e antropogênicas, e pode ser benéfica ou altamente prejudicial. Estas colónias multi-celulares são conhecidos como biofilmes, em que as células individuais são embutidos em um (EPS) de matriz extracelular substâncias poliméricas auto-produzido. Os EPS aderir fortemente as células à superfície, eles colonizam. Eles servem como um escudo contra as forças mecânicas e químicas e criar contacto próximo entre as células vizinhas, facilitando a comunicação celular 1. Um biofilme pode ser visto como uma comunidade diferenciada, em que as células usam altamente regulado, orquestrada processos para coordenar as suas actividades no seio da comunidade, bem como entre espécies 2-5. A transição de uma planctônicas, o modo de vida livre do crescimento a um estado de biofilme é frequentemente associada com os processos de desenvolvimento. Um bom exemplo é o Bacillus subtilis bactéria do solo Gram-positivas, e, portanto, uma undomeestirpe sticated serve como um organismo modelo robusto para estudar os estágios de desenvolvimento que conduzem a formação de biofilme. Nesta bactéria, células móveis se organizam em estruturas multicelulares conspícuos que realizam tarefas especializadas 4. Um grupo de células, a matriz-produtores secretam exopolissacáridos 6, a proteína amilóide tasa 7,8, e a proteína de hidrofobicidade da superfície BslA 9,10; todos os que participam da montagem dos EPS 11-13.
Dada a abundância de biofilmes em nichos naturais e antrópicos e os danos fatais putativo eles podem causar, há uma necessidade premente de encontrar formas de prevenir a sua formação. inibidores de moléculas pequenas podem auxiliar na descoberta de novas vias reguladoras, enzimas e proteínas estruturais envolvidas na formação de biofilme, e, assim, promover insights os complexos processos de montagem comunidade multicelular. Como B. subtilis é um modelo bem estudado para bioformação de película 14,15, ele pode ser usado para avaliar os efeitos de vários inibidores de biofilme. Este estudo aborda quatro métodos fundamentais que são a chave para avaliar a resposta de biofilmes a inibidores de pequenas moléculas. Em primeiro lugar, para assegurar que estes inibidores têm um alvo específico do biofilme, a separação do efeito sobre o crescimento planctônicas de o efeito sobre a formação de biofilme é crítica. A maioria dos agentes antibacterianos como alvo as células em sua fase de crescimento planctônicas, mas as moléculas que têm como alvo o estilo de vida biofilme são raros. Além disso, como as moléculas que não afectam o crescimento planctônicas não são tóxicos, podem reduzir a pressão selectiva favorecendo mutantes resistentes a antibióticos 16. Por exemplo, quando biofilmes são tratados com D-aminoácidos ou determinadas outras moléculas interferentes da parede celular, eles são ou perturbada ou desmontado, mas estes inibidores apenas afectam moderadamente 12,17 crescimento planctônicas. Em contraste, muitos antibióticos prejudicar drasticamente o crescimento planctônicas, com little ou nenhum efeito sobre a formação de biofilme 17.
Em segundo lugar, que estabelece um quadro experimental consistente e robusta para estudar o efeito de as moléculas pequenas é crucial. Observou-se que o intervalo de concentração activa de inibidores de moléculas pequenas era sensível às condições de pré-cultura e para a instalação experimental utilizada para estudar o efeito destes inibidores de moléculas pequenas. Vários relatórios, particularmente aqueles que estudam B. subtilis, revelou variações no intervalo de concentrações em que D-aminoácidos inibem a formação de películas - as flutuantes biofilmes bacterianas 12,17-19. Os resultados aqui apresentados sugerem que os seguintes fatores em conta as diferenças na faixa de concentração ativa: as condições pré-cultura (logarítmica 12,17 ante fase de 20 crescimento tardio-estacionária), o meio de crescimento utilizada na condição de pré-cultura (rico, indefinido [Caldo de Luria, LB] versus definido [glutamato monossódico-glicerol, MSgg]), a proporção da inoculação e, especialmente, a remoção do meio de pré-cultura antes da inoculação. A temperatura de crescimento da película estática mostrou um papel menos importante na gama do inibidor de molécula pequena de D-leucina, uma D-aminoácido representativa utilizada neste estudo a actividade.
Finalmente, uma vez que os biofilmes são tratados com inibidores específicos de biofilme, métodos robustos e informativas são necessários para caracterizar os efeitos destes inibidores sobre a aptidão do biofilme. Aqui, dois métodos para caracterizar de forma independente do efeito de inibidores de moléculas pequenas são descritos em detalhe: (1) O efeito sobre as células individuais dentro de uma colónia de biofilme e a sua resistência a agentes antimicrobianos. As células em biofilmes são tipicamente mais resistentes a antibióticos quando comparado com as bactérias de vida livre 21-23. Embora este fenómeno é multifactorial, a capacidade do EPS para reduzir a penetração de antibiótico foi muitas vezes considerado como uma explicação atraente 24 . Este método avalia a sobrevivência de células do biofilme pré-estabelecido após a exposição a substâncias antibacterianas. (2) O efeito sobre a arquitectura do biofilme colónia, a partir da grande para a pequena escala. colónias de biofilme são caracterizados pela sua estrutura tridimensional e a presença do EPS. Utilizando microscopia eletrônica de varredura, as alterações na morfologia celular, estrutura da colônia de biofilme e a arquitetura e abundância das EPS pode ser visualizado a partir do grande (mm) para a pequena escala (mm).
Protocolo
1. Avaliar o efeito de pequenas moléculas inibidores de Película e formação de biofilme Colony
- Prepara-se uma solução de meio de indução de biofilme MSgg definido 2x 25 sem o cloreto de cálcio e ferro (III), cloreto de hexa-hidrato. Após a esterilização do filtro, adicionar o cloreto de cálcio. O meio é pronto para usar directamente ou pode ser armazenado a 4 ° C no escuro.
- Preparar uma diluição 1x MSgg no dia da experiência.
- Dilui-se o meio 2x MSgg para 1x com água destilada estéril (películas) ou ágar estéril de 3% quente (80 ° C) (biofilmes) e adicionar ferro (III) hexa-hidratado cloreto a uma concentração final de 50 uM (películas) ou 250 uM ( biofilmes). Adicionar antibióticos ou inibidores de moléculas pequenas para a concentração desejada e misturar bem. Por exemplo, para se obter uma concentração final de mM de D-leucina em 30 ml de 0,5 para estabelecer películas ou biofilmes, adicionar 196,6 ul de uma 76,3 mM (10 mg / ml) solução de D-leucina.
NÃOTE:. A composição final 1x MSgg é descrito na Tabela 1, em comparação com a receita original 25, o meio continha 50 ug / ml de treonina e a concentração de ferro para crescer colónias de biofilme em meio MSgg sólido foi aumentada de 2,5 vezes para optimizar a morfologia de colónia rugosa .
- Dilui-se o meio 2x MSgg para 1x com água destilada estéril (películas) ou ágar estéril de 3% quente (80 ° C) (biofilmes) e adicionar ferro (III) hexa-hidratado cloreto a uma concentração final de 50 uM (películas) ou 250 uM ( biofilmes). Adicionar antibióticos ou inibidores de moléculas pequenas para a concentração desejada e misturar bem. Por exemplo, para se obter uma concentração final de mM de D-leucina em 30 ml de 0,5 para estabelecer películas ou biofilmes, adicionar 196,6 ul de uma 76,3 mM (10 mg / ml) solução de D-leucina.
- Após a solidificação do agar, secar as placas MSgg sólidos em uma capa biológica durante 30-45 minutos antes da inoculação.
- Para seleccionar inibidores específicos que interferem com os mecanismos de formação de película (Figura 1), exclui que as concentrações utilizadas e afectar planctônicas crescimento estática.
- Determinar crescimento planctônicas (aumento na densidade óptica com o tempo em cultura líquida) de uma curva de crescimento simples através da medição da densidade óptica a 600 nm a cada hora até que a fase estacionária de crescimento.
- Para confirmar que a turbidez da cultura medida representa as contagens de células vivas, determinar o número de unidades formadoras de colónias (CFU)de células em fase de crescimento planctônicas de uma cultura sob agitação após vários pontos no tempo.
- Para avaliar o efeito de inibidores de molécula pequena sobre o crescimento da película estática, células de colheita, no final de uma incubação de 3 dias a 23 ° C a partir de uma cultura de células de 24 poços bem, inoculadas nas mesmas condições tal como descrito nas secções 1,7-1,9 e determinar a CFU. Por este controle, usar uma estirpe deficiente em película que não possua os operões que codificam para os componentes da matriz extracelular (por exemplo, B. subtilis Δ EPSH, Δ tasa).
NOTA: Esta estirpe é capaz de crescer sob condições estáticas, mas em contraste com um tipo selvagem de formação de película, que é deficiente na capacidade de flutuar para a interface ar-líquido, em que o crescimento é favorecido devido ao aumento dos níveis de oxigénio 26. Assim, esta matriz-extracelular e tensão película com deficiência é uma estirpe de referência recomendado para avaliar o crescimento em condições estáticas.
NOTA: Para o ex específicaampla do D-amino ácido D-leucina não-canônico descrito abaixo, um efeito sobre planctônicas e crescimento estática em concentrações que interferiram com a formação de película foi descartada 12,17. Os métodos para determinar o crescimento planctônicas e estática são descritos em pormenor 17.
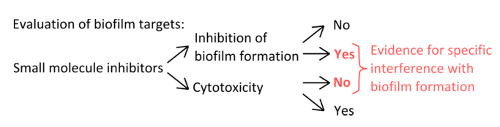
Figura 1. Visão Conceitual para a identificação de uma configuração experimental robusto para avaliar a inibição específica da formação de biofilme. Os critérios de seleção para os inibidores de pequenas moléculas que indicam a interferência específica à formação de biofilme sem efeito pronunciado sobre o crescimento planctônicas. Por favor clique aqui para ver uma versão maior desta figura.
- Streak fora B. subtilis de um estoque de -80 ° C (cultu LBre de 10 9 células / mL congelados em glicerol a 20%) para isolar colónias únicas em uma placa% agar-LB 1.5 com uma ponta estéril ou aplicador.
- Crescer durante a noite a 30 ° C.
- Passo crítico: Para uma inibição de película sólida por os ácidos não-canónica D-aminoácidos tais como D-leucina, crescer uma única colónia colhidos a partir da% placa de ágar-1,5 LB em 3 ml de caldo LB a 37 ° C durante 4 horas numa agitando incubadora (balançando velocidade de 200 rpm). Substituir o caldo de LB médio com MSgg indutor de biofilme antes da inoculação por centrifugação de 1,5 ml de cultura de arranque durante 4 min a 6000 xg, removendo cuidadosamente o sobrenadante e re-suspensão do sedimento em 1,5 ml de meio MSgg. O resto da cultura pode ser descartado.
Importante: Para assegurar a robustez do sistema, a densidade óptica a 600 nm (DO600) da cultura de arranque deve ser lavada entre 0,6 e 1. - Durante o crescimento da cultura de arranque, preparar uma placa de cultura de células multidish contend de 12 poçosg 3 ml de meio MSgg sem ou com uma gama de concentrações do inibidor de molécula pequena (por exemplo, 0,3, 0,5, 1 mM de D-leucina 17). Para excluir os efeitos de borda, distribuir a localização das diferentes concentrações do outro lado da placa multidish. Em alternativa, usar de 24 poços de cultura celular multidish placas contendo 1,5 ml de meio MSgg.
- Inocular os poços da cultura de células-placa de 12 poços multidish com 3 ul da cultura de arranque lavada (diluição 1: 1000).
NOTA: A razão de diluição inferior, isto é, 1: 500 pode ser utilizado. Isto diminui o tempo de desenvolvimento das películas. - Crescer as películas a 23 ° C, em condições estáticas, durante três dias. Não se mova as películas durante este tempo, uma vez que pode afectar a morfologia da superfície final da película.
- Adquirir imagens com uma exposição binocular e homogénea de um raio. Alternativamente, tirar uma foto das películas com uma câmera de alta resolução. Para evitar artefactos causados por inconsisângulos de luz tenda e sombras, dê top-down fotos com a câmera fixa num tripé e utilizar uma fonte de luz suave e grande em 45 ° de ambos os lados.
NOTA: Um método alternativo para estudar B. subtilis multicelularidade é o ensaio colônia biofilme em meio sólido, induzindo-biofilme MSgg. Tal como películas, este ensaio permite o estudo de processos de espaço-temporais. Uma vez que o intervalo activo de inibidores de moléculas pequenas é determinada, o seu efeito sobre a formação de colónias de biofilme pode ser estudada. - Para crescer colónias de biofilme, simetricamente detectar 1.5 ul de pré-cultura não lavado (Passo 1.7) sobre a 1,5% MSgg placa de agar seca com a ajuda de um modelo - 4 gotas por placa de Petri de diâmetro de 8,5 centímetros. Deixe as gotas adsorver à placa antes de movê-los.
NOTA: O modelo ajuda a obter uma distribuição igual das colônias biofilme dentro da área onde as células são cultivadas. Para preparar o modelo, desenhar a área total de crescimento em escalas originais, dividi-lo à igualdade de seitaRUP e marcar o centro. Para um prato redondo Petri de 8,5 cm de diâmetro, este atribui 14 cm2 a uma colónia de biofilme. - Incubar as placas a 30 ° C durante três dias. Durante este tempo, as colónias de biofilme se desenvolvem para formar uma estrutura tridimensional, enrugado.
- Tire fotos como no passo 1.11.
2. Etanol Resistência Assay
- Crescer biofilmes conforme descrito nas etapas 1,1-1,7 e 1.12-1.14.
- Após 68 horas de crescimento a 30 ° C, as colónias de biofilme cortar em duas partes iguais com a ajuda de uma lâmina de barbear e o molde.

Figura 2. Exemplo desenho experimental para avaliar a resistência das células do biofilme de colónias de agentes esterilizantes. (A) Molde utilizado para a distribuição igual de colónias de biofilme através de uma placa de Petri e para o corte. (B)imagens de cima para baixo não tratada do tipo selvagem biofilme cresceu por 68 horas em meio sólido, definido indutoras de biofilme MSgg a 30 ° C. O alargamento mostra como uma colônia de biofilme pode ser cortado em duas metades iguais. (C) As duas metades iguais de biofilme são tratados da mesma forma (o controlo, PBS) ou com PBS ou agente de esterilização e processados como descrito. Barra de escala:. 1 cm Por favor clique aqui para ver uma versão maior desta figura.
- Cuidadosamente levantar cada metade da colónia biofilme da placa de agar com uma pequena espátula e movê-lo para um tubo de microcentrífuga de 1,5 ml contendo 500 ul de solução salina tamponada com fosfato (PBS). Se necessário, raspar as restantes células a partir da placa e transferi-los para o tubo de microcentrífuga bem.
NOTA: A segunda metade da colónia biofilme é tratada diferencialmente, dependendo se é o controlo ou para testar a resistência à Steriagentes Lizing. - Para o controlo, incubar a segunda metade da colónia de biofilme em 500 ul de PBS como no passo 2.3. Para avaliar a resistência aos agentes esterilizantes, transferir a segunda metade da colónia biofilme a 500 ul 50% (v / v) de etanol.
NOTA: esterilização Alternativa agentes, tais como o hipoclorito de sódio pode ser utilizado. Para todos os agentes de esterilização utilizados, determinar o tempo de concentração e de incubação ativa de uma experiência preliminar. - Incubam-se as colónias de biofilme durante 10 min sobre a bancada à temperatura ambiente.
- Centrifugar as colônias biofilme durante 5 minutos a 18.000 xg e remova cuidadosamente o sobrenadante com uma pipeta. Adicionar 300 ul de PBS.
- Sonicar as células suavemente (amplitude de 10%, de pulso 5 s) com a microponta de um sonicador.
NOTA: A energia de ultra-sons deve ser suficiente para agregados biofilme separadas. No entanto, ultra-sons muito dura pode lisar as células. Confirme antecipadamente por microscopia de luz que a energia sonicaçãoutilizadas não lisar as células e que todos os agregados sejam dissolvidos. - Adicionar 700 ul de PBS a um volume final de 1 ml. Efectuar uma diluição em série (a 10 -7) em PBS e espalhar 100 ul de 3 diluições numa placa de agar LB a 1,5%, utilizando esferas de vidro estéreis.
NOTA: As diluições óptimas a ser revestida deve ser determinado numa experiência preliminar, uma vez que depende da quantidade de células do biofilme colónia de interesse e a taxa de sobrevivência das células em resposta ao agente de esterilização. - Incubar as placas durante a noite a 30 ° C, a contagem de CFU e determinar CFU / ml. A partir do final de UFC / ml de cada colônias meio de biofilme, calcular a percentagem de sobreviventes.
NOTA: Quando realizada e analisada tal como descrito, as duas metades da colónia de controlo do biofilme e o tratamento contra metade tratada com etanol da colónia de biofilme não tratada deve dar origem a diferenças inferiores a 10% na contagem de células viáveis, verificando a simetria ou a resistência da colónia , respectively. Alternativamente, os resultados podem ser representados no total de CFU. As contagens de células de controlo e da colónia não tratada biofilme deve permanecer na mesma ordem de grandeza. Em contraste, espera-se que as contagens de células da metade tratada com etanol de uma pequena colónia tratada biofilme molécula-a cair por um mínimo de duas ordens de grandeza a reivindicação para um aumento da sensibilidade para o agente de esterilização.
3. biofilme Colony Preparação de Amostras para Microscopia Eletrônica de Varredura
- Crescer colônias biofilme conforme descrito nas etapas 1,1-1,7 e 1.12-1.14.
- Prepara-se uma nova porção de 2% (v / v) de glutaraldeído, 3% (v / v) em solução de paraformaldeído a cacodilato de sódio 100 mM, tampão de cloreto de cálcio 5 mM, pH 7,3. Prepare 5 ml de fixador para cada placa de Petri de diâmetro de 8,5 centímetros.
CUIDADO: glutaraldeído e paraformaldeído são perigosos. Lidar com eles com equipamento de segurança dentro de um capuz químico. Descartar as soluções e os materiais contaminados para o hazresíduos ardous. - Adicionar cuidadosamente o fixador para as colônias biofilme, sem dispensar diretamente em cima dos biofilmes.
NOTA: Devido ao carácter hidrofóbico da colónia de biofilmes, as colónias lentamente destacar do agar e começar a flutuar. - Cuidadosamente selar as placas com uma tira de Parafilm. Incubar num agitador rotativo durante 2 horas à temperatura ambiente e subsequentemente transferir as placas a 4 ° C durante a noite.
- No dia seguinte, remover o líquido cuidadosamente com uma pipeta de Pasteur de vidro ligada a uma bomba de vácuo.
- Adiciona-se cuidadosamente 10 ml de 100 mM de cacodilato de sódio, tampão de cloreto de cálcio 5 mM, para lavar o biofilme e incubar durante 5 min. Remova cuidadosamente o líquido com a pipeta de vidro Pasteur a partir do canto da placa para evitar danificar o biofilme e adicionar solução de lavagem fresco por pipetagem suave. Repita este passo uma vez.
- Para a desidratação das colônias biofilme, prossiga com as seguintes etapas: 2x 5 min em DDH 2 O; 2 x 20 min em três0% de etanol; 2 x 20 min em etanol a 50%; 2 x 20 min em etanol a 70%; 2 x 20 min em etanol a 96%; 2x 30 min em 100% de etanol.
- Adicionar 15 ml de líquido por cada placa de Petri de diâmetro de 8,5 cm de cada passo e remover o líquido cuidadosamente após cada incubação.
- Utilizar um dos dois métodos diferentes para a secagem das amostras a partir de etanol.
- Por secagem ao ar a partir de etanol:
- Corte um papel de filtro de celulose (diâmetro de 9 cm) em trimestres. Resumidamente submergir quarto em 100% de etanol, e, em seguida, transferir cuidadosamente uma colónia flutuante biofilme sobre ele. Colocar o papel de filtro molhado numa placa de Petri forradas com papel de filtro. Cubra o prato Petri e deixar as colônias biofilme secar durante a noite em uma capa química.
- Para o ponto crítico (CP) -drying usando dióxido de carbono (CO2) como o fluido de transição:
- Encher 75% da câmara de máquina de ponto crítico de secagem com 100% de etanol. Transferir as amostras em um suporte, cada amostra em seu próprio cHamber. Se necessário, cortar o biofilme com uma tesoura em pedaços menores. Deixar as amostras submersas em etanol durante todas as manipulações. Em seguida, transferir o suporte para dentro da câmara e fecha hermeticamente a câmara.
- Arrefece-se a câmara até 7 ° C e começar a agitar. Encha a câmara completamente com o CO 2 líquido. Durante um período de incubação de 7 min, deixar a mistura de etanol com o CO 2. Em seguida, de descarga 25% da solução.
NOTA: Não esvazie a câmara abaixo do nível da amostra. - Repita o passo 3.8.2.2 quatro vezes.
- Repita o passo 3.8.2.2 cinco vezes com um tempo de incubação de apenas 5 min. Finalmente, o etanol deve ser completamente substituída por CO 2.
- Durante a última rodada, vazio apenas 5% da câmara. Desligue a agitação e o arrefecimento. Iniciar o aquecimento da câmara até 42 ° C. A uma temperatura de 31,1 ° C e uma pressão de 73,9 bar, o CO2 líquido atinge o seu ponto crítico, o estado em que o pH gasosoase tem a mesma densidade que a fase líquida do solvente 27. Uma vez que a temperatura atinge 42 ° C, incubar durante 10 min. A 42 ° C, o CO 2 na câmara existe como gás supercrítico.
NOTA: Verifique constantemente a pressão da câmara. A pressão não deve ser superior a 120 bar, a 42 ° C. - Começar a liberar lentamente o gás com aquecimento contínuo. Isto mantém as amostras na fase CO2 -gas e impede a deformação da morfologia da amostra através da tensão superficial do líquido. Defina o medidor de vazão para 5 L / hr por ajuste fino da válvula de medição de controle do medidor de vazão. Aguardar até que a toda a pressão na câmara é libertado. Agora abra a câmara e retire as amostras cuidadosamente do suporte.
- Por secagem ao ar a partir de etanol:
- Brasão de microscopia eletrônica de stub com fita de carbono. Com a ajuda de uma pinça, transferir cuidadosamente as colônias biofilme para o topo. Ligue cada colônia para o stub adicionando uma ponte fina de carrofita bon, que é crucial para a eliminação de carga sob o feixe de elétrons. Nesta fase, lidar com as colônias biofilme com cuidado, pois eles são muito frágeis. Armazenar as amostras num exsicador durante pelo menos 24 h ou até à sua análise.
- No dia do exame com o microscópio eletrônico de varredura, por pulverização catódica-coat as colônias biofilme para 2 min em um ângulo de 60 ° em um ouro-paládio sputter-coater. Repita esta etapa duas vezes e girar as amostras em 120 ° no meio. No final, sputter-revestir as amostras uma vez durante 3 minutos a partir do topo. A fina camada de 20 nm de ouro-paládio melhora a condutividade e melhora o contraste da amostra para a imagem no SEM.
- Armazenar as amostras em um dessecador para evitar a re-hidratação da amostra de 28 até imagiologia com um microscópio eletrônico de varredura 29,30.
Resultados
O ensaio de película é um método para estudar os processos altamente regulados e dinâmicas de B. multicelularidade subtilis. Além disso, o ensaio de película é adequado para testar uma gama de condições, quer pré-inicial ou concentrações de moléculas pequenas em uma placa de cultura de células multidish único numa experiência. No entanto, B. subtilis formação de película é sensível às condições de pré-cultura (por exemplo, o meio de crescimento de pré-cultura...
Discussão
Bacillus subtilis formas robustas e altamente estruturados biofilmes ambos no estado líquido (películas) e em meio sólido (colônias). Por isso, serve como um organismo modelo ideal para a caracterização do modo de acção dos inibidores específicos de biofilme. Em meio sólido, as células formam estruturas multicelulares com características distintas que não são evidentes em películas, como rugas que irradiam do centro para a borda. Assim, películas e colônias são sistemas complementares para est...
Divulgações
The authors have nothing to disclose.
Agradecimentos
Electron microscope imaging was conducted at the Electron Microscopy Unit of the Weizmann Institute of Science, supported in part by the Irving and Cherna Moskowitz Center for Nano and Bio-Nano Imaging. This research was also supported by the ISF I-CORE grant 152/1, Mr. and Mrs. Dan Kane, Ms. Lois Rosen, by a Yeda-Sela research grant, by the Larson Charitable Foundation, by Ruth and Herman Albert Scholars Program for New Scientists, by the Ilse Katz Institute for Materials Sciences and Magnetic Resonance Research grant, by the Ministry of Health grant for alternative research methods, and by the France-Israel Cooperation - Maimonide-Israel Research Program. IKG is a recipient of the Rowland and Sylvia Career Development Chair.
Materiais
| Name | Company | Catalog Number | Comments |
| Luria Broth, Lennox | Difco | 240230 | |
| Bacto Agar | Difco | 214010 | |
| potassium phosphate monobasic | Sigma, 136.09 g/mol | P0662-500G | |
| potassium phosphate dibasic | Fisher Scientific, 174.18 g/mol | BP363-1 | |
| 3-(N-morpholino)propanesulfonic acid | Fisher Scientific, 209.27 g/mol | BP308-500 | |
| magnesium chloride hexahydrate | Merck, 203.30 g/mol | 1.05833.0250 | |
| calcium chloride anhydrous | J.T. Baker, 110.98 g/mol | 1311-01 | |
| manganese(II) chloride tetrahydrate | Sigma, 197.91 g/mol | 31422-250G-R | |
| iron(III) chloride hexahydrate | Sigma, 270.30 g/mo) | F2877-500G | |
| zinc chloride anhydrous | Acros Organics, 136.29 g/mol | 424592500 | |
| thiamine hydrochloride | Sigma, 337.27 g/mol | T1270-100G | |
| L-tryptophan | Fisher Scientific, 204.1 g/mol | BP395-100 | |
| L-phenylalanine | Sigma, 165.19 g/mol | P5482-100G | |
| L-threonine | Sigma, 119.12 g/mol | T8625-100G | |
| glycerol anhydrous | Bio-Lab Itd | 712022300 | |
| L-glutamic acid monosodium salts hydrate | Sigma, 169.11 g/mol | G1626-1KG | |
| D-leucine | Sigma, 169.11 g/mol | 855448-10G | |
| ethanol anhydrous | Gadot | 830000054 | |
| razor blade | Eddison | NA | |
| circular cellulose filter papers | Whatman, 90 mm | 1001-090 | |
| glutaraldehyde | EMS (Electron Micoscopy Science), 25% in water | 16220 | |
| paraformaldehyde | EMS, 16% in water | 15710 | |
| sodium cacodylate | Merck, 214.05 g/mol | 8.2067 | |
| calcium chloride 2-hydrate | Merck, 147.02 g/mol | 1172113 | |
| stub-aluminium mount | EMS, sloted head | 75230 | |
| carbon adhesive tape | EMS | 77825-12 | |
| Shaker 37 °C | New Brunswick Scientific Innowa42 | NA | |
| Centrifuge | Eppendorf table top centrifuge 5424 | NA | |
| Digital Sonifier, Model 250, used with Double Step Microtip | Branson | NA | |
| Incubator 30 °C | Binder | NA | |
| Incubator 23 °C | Binder | NA | |
| Filter System, 500 ml, polystyrene | Cornig Incorporated | NA | |
| Rotary Shaker - Orbitron Rotatory II | Boekel | NA | |
| S150 Sputter Coater | Edwards | NA | |
| CPD 030 Critical Point Dryer | BAL-TEC | NA | |
| Environmental Scanning Electron Microscope | XL30 ESEM FEG Philips (FEI) | NA |
Referências
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu Rev Microbiol. 56, 187-209 (2002).
- Miller, M. B., Bassler, B. L. Quorum sensing in bacteria. Annu Rev Microbiol. 55, 165-199 (2001).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr Opin Microbiol. 10, 638-643 (2007).
- Kolter, R., Greenberg, E. P. Microbial sciences: the superficial life of microbes. Nature. 441, 300-302 (2006).
- Kearns, D. B., Chu, F., Branda, S. S., Kolter, R., Losick, R. A master regulator for biofilm formation by Bacillus subtilis. Mol Microbiol. 55, 739-749 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol Microbiol. 59, 1229-1238 (2006).
- Romero, D., Aguilar, C., Losick, R., Kolter, R. Amyloid fibers provide structural integrity to Bacillus subtilis biofilms. Proc Natl Acad Sci USA. 107, 2230-2234 (2010).
- Kobayashi, K., Iwano, M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms. Mol Microbiol. 85, 51-66 (2012).
- Hobley, L., et al. BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm. Proc Natl Acad Sci USA. 110, 13600-13605 (2013).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol Microbiol. 80, 1155-1168 (2011).
- Kolodkin-Gal, I., et al. D-amino acids trigger biofilm disassembly. Science. 328, 627-629 (2010).
- Chan, Y. G., Kim, H. K., Schneewind, O., Missiakas, D. The capsular polysaccharide of Staphylococcus aureus is attached to peptidoglycan by the LytR-CpsA-Psr (LCP) family of enzymes. J Biol Chem. 289, 15680-15690 (2014).
- Mielich-Suss, B., Lopez, D. Molecular mechanisms involved in Bacillus subtilis biofilm formation. Environ Microbiol. 17, 555-565 (2014).
- Cairns, L. S., Hobley, L., Stanley-Wall, N. R. Biofilm formation by Bacillus subtilis: new insights into regulatory strategies and assembly mechanisms. Mol Microbiol. 93, 587-598 (2014).
- Chen, M., Yu, Q., Sun, H. Novel strategies for the prevention and treatment of biofilm related infections. Int J Mol Sci. 14, 18488-18501 (2013).
- Bucher, T., Oppenheimer-Shaanan, Y., Savidor, A., Bloom-Ackermann, Z., Kolodkin-Gal, I. Disturbance of the bacterial cell wall specifically interferes with biofilm formation. Environ Microbiol Rep. 7, 990-1004 (2015).
- Sarkar, S., Pires, M. M. D-Amino acids do not inhibit biofilm formation in Staphylococcus aureus. PLoS One. 10, e0117613 (2015).
- Wei, W., Bing, W., Ren, J., Qu, X. Near infrared-caged D-amino acids multifunctional assembly for simultaneously eradicating biofilms and bacteria. Chem Commun (Camb). 51, 12677-12679 (2015).
- Leiman, S. A., et al. D-amino acids indirectly inhibit biofilm formation in Bacillus subtilis by interfering with protein synthesis. J Bacteriol. 195, 5391-5395 (2013).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Davies, D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov. 2, 114-122 (2003).
- Olsen, I. Biofilm-specific antibiotic tolerance and resistance. Eur J Clin Microbiol Infect Dis. 34, 877-886 (2015).
- Tseng, B. S., et al. The extracellular matrix protects Pseudomonas aeruginosa biofilms by limiting the penetration of tobramycin. Environ Microbiol. 15, 2865-2878 (2013).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc Natl Acad Sci USA. 98, 11621-11626 (2001).
- Holscher, T., et al. Motility, Chemotaxis and Aerotaxis Contribute to Competitiveness during Bacterial Pellicle Biofilm Development. J Mol Biol. 427, 3695-3708 (2015).
- Bray, D. . Methods in Biotechnology. 13, 235-243 (2000).
- Ensikat, H. J., Ditsche-Kuru, P., Barthlott, W. . Scanning electron microscopy of plant surfaces: simple but sophisticated methods for preparation and examination. 1, 248-255 (2010).
- Hayat, M. A. . Principles and techniques of scanning electron microscopy: Biological applications. 2, (1976).
- Schatten, H. . Scanning Electron Microscopy for the Life Sciences. , (2013).
- Bridier, A., Meylheuc, T., Briandet, R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM, ESEM and FESEM). Micron. 48, 65-69 (2013).
- Boyde, A., MacOnnachie, E. Volume changes during preparation of mouse embryonic tissue for scanning electron microscopy. SCANNING. 2, 149-163 (1979).
- Yao, Z., Kahne, D., Kishony, R. Distinct single-cell morphological dynamics under beta-lactam antibiotics. Mol Cell. 48, 705-712 (2012).
- Epstein, A. K., Pokroy, B., Seminara, A., Aizenberg, J. Bacterial biofilm shows persistent resistance to liquid wetting and gas penetration. Proc Natl Acad Sci USA. 108, 995-1000 (2011).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11, 157-168 (2013).
- Shemesh, M., Chai, Y. A combination of glycerol and manganese promotes biofilm formation in Bacillus subtilis via histidine kinase KinD signaling. J Bacteriol. 195, 2747-2754 (2013).
- Kolodkin-Gal, I., et al. Respiration control of multicellularity in Bacillus subtilis by a complex of the cytochrome chain with a membrane-embedded histidine kinase. Genes Dev. 27, 887-899 (2013).
- Oppenheimer-Shaanan, Y., et al. Spatio-temporal assembly of functional mineral scaffolds within microbial biofilms. npj Biofilms and Microbiomes. 2, 15031 (2016).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. , e3796 (2012).
- Bogino, P. C., Oliva Mde, L., Sorroche, F. G., Giordano, W. The role of bacterial biofilms and surface components in plant-bacterial associations. Int J Mol Sci. 14, 15838-15859 (2013).
- Fratamico, P. M., Annous, B. A., Guenther, N. W. . Biofilms in the Food and Beverage Industires. 1, (2009).
- Gao, G., et al. Effect of biocontrol agent Pseudomonas fluorescens 2P24 on soil fungal community in cucumber rhizosphere using T-RFLP and DGGE. PLoS One. 7, e31806 (2012).
- Chen, Y., et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation. Environ Microbiol. 15, 848-864 (2013).
- Bryers, J. D. Medical biofilms. Biotechnol Bioeng. 100, 1-18 (2008).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7, 375-381 (2009).
- Nevin, K. P., Woodard, T. L., Franks, A. E., Summers, Z. M., Lovley, D. R. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. MBio. 1, (2010).
- Torres, C. I., et al. A kinetic perspective on extracellular electron transfer by anode-respiring bacteria. FEMS Microbiol Rev. 34, 3-17 (2010).
- Li, J., Wang, N. Foliar application of biofilm formation-inhibiting compounds enhances control of citrus canker caused by Xanthomonas citri subsp. citri. Phytopathology. 104, 134-142 (2014).
- Okegbe, C., Price-Whelan, A., Dietrich, L. E. Redox-driven regulation of microbial community morphogenesis. Curr Opin Microbiol. 18, 39-45 (2014).
- Mann, E. E., Wozniak, D. J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev. 36, 893-916 (2012).
- Bouffartigues, E., et al. Sucrose favors Pseudomonas aeruginosa pellicle production through the extracytoplasmic function sigma factor SigX. FEMS Microbiol Lett. 356, 193-200 (2014).
- Wu, C., Lim, J. Y., Fuller, G. G., Cegelski, L. Quantitative analysis of amyloid-integrated biofilms formed by uropathogenic Escherichia coli at the air-liquid interface. Biophys J. 103, 464-471 (2012).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an Architectural Element in Spatially Structured Escherichia coli Biofilms. J Bacteriol. 195, 5540-5554 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados