Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Metodologías para el estudio
En este artículo
Resumen
This study presents the development of reproducible methodologies to study biofilm inhibitors and their effects on Bacillus subtilis multicellularity.
Resumen
This work assesses different methodologies to study the impact of small molecule biofilm inhibitors, such as D-amino acids, on the development and resilience of Bacillus subtilis biofilms. First, methods are presented that select for small molecule inhibitors with biofilm-specific targets in order to separate the effect of the small molecule inhibitors on planktonic growth from their effect on biofilm formation. Next, we focus on how inoculation conditions affect the sensitivity of multicellular, floating B. subtilis cultures to small molecule inhibitors. The results suggest that discrepancies in the reported effects of such inhibitors such as D-amino acids are due to inconsistent pre-culture conditions. Furthermore, a recently developed protocol is described for evaluating the contribution of small molecule treatments towards biofilm resistance to antibacterial substances. Lastly, scanning electron microscopy (SEM) techniques are presented to analyze the three-dimensional spatial arrangement of cells and their surrounding extracellular matrix in a B. subtilis biofilm. SEM facilitates insight into the three-dimensional biofilm architecture and the matrix texture. A combination of the methods described here can greatly assist the study of biofilm development in the presence and absence of biofilm inhibitors, and shed light on the mechanism of action of these inhibitors.
Introducción
comunidades bacterianas multicelulares juegan un papel importante en entornos naturales y antropogénicos, y pueden ser beneficiosos o perjudiciales altamente. Estas colonias multicelulares se conocen como las biopelículas, en donde las células individuales están incrustadas en un (EPS) matriz de sustancias poliméricas extracelulares de producción propia. Los EPS se adhieren fuertemente a las células a la superficie que colonizan. Ellos sirven como un escudo contra las fuerzas mecánicas y químicas y crean un estrecho contacto entre las células vecinas, lo que facilita la comunicación celular 1. Una biopelícula puede ser vista como una comunidad diferenciada, donde las células uso altamente regulados, procesos orquestada para coordinar sus actividades dentro de la comunidad, así como en todas las especies 2-5. La transición de un planctónicas, el modo de vida libre de crecimiento a un estado de biopelícula se asocia a menudo con los procesos de desarrollo. Un buen ejemplo es la bacteria del suelo Bacillus subtilis Gram-positivas, y por lo tanto, una undomecepa sticated sirve como un modelo sólido organismo para estudiar las etapas de desarrollo que conducen a la formación de biopelículas. En esta bacteria, células móviles se organizan en estructuras multicelulares visibles que llevan a cabo tareas especializadas 4. Un grupo de células, la matriz-productores secretan exopolisacáridos 6, la proteína amiloide TASA 7,8, y la proteína de hidrofobicidad de la superficie BSLA 9,10; todos los cuales participan en el montaje de las EPS 11-13.
Dada la abundancia de biopelículas en nichos naturales y antropogénicos y el daño fatal putativa que pueden causar, hay una necesidad urgente de encontrar formas de prevenir su formación. inhibidores de moléculas pequeñas pueden ayudar en el descubrimiento de nuevas rutas reguladoras, enzimas y proteínas estructurales que participan en la formación de biopelículas, y por lo tanto promover puntos de vista en los complejos procesos de montaje comunidad multicelular. Como B. subtilis es un modelo bien estudiado para bioformación de película 14,15, que puede ser utilizado para evaluar los efectos de varios inhibidores de biopelículas. Este estudio fuerza a cuatro métodos fundamentales que son clave para evaluar la respuesta de las biopelículas a los inhibidores de moléculas pequeñas. En primer lugar, para asegurar que estos inhibidores tienen un objetivo del biofilm específica, la separación del efecto sobre el crecimiento planctónicas del efecto sobre la formación de biopelículas es crítica. La mayoría de los agentes antibacterianos dirigen a las células en su fase de crecimiento del plancton, pero las moléculas que se dirigen a la forma de vida de biopelículas son raros. Adicionalmente, como moléculas que no afectan el crecimiento planctónica no son tóxicos, pueden reducir la presión selectiva que favorece mutantes resistentes a los antibióticos 16. Por ejemplo, cuando biofilms se tratan con D-aminoácidos o ciertas otras moléculas pared interferir celular, o bien son perturbados o desmontados, pero estos inhibidores sólo afectan ligeramente 12,17 crecimiento planctónicas. Por el contrario, muchos antibióticos alteran dramáticamente el crecimiento del plancton, con little o ningún efecto sobre la formación de biopelículas 17.
En segundo lugar, se establece un marco experimental consistente y robusta para estudiar el efecto de las moléculas pequeñas es crucial. Hemos observado que el intervalo de concentración activa de inhibidores de moléculas pequeñas era sensible a las condiciones de pre-cultivo y para la configuración experimental utilizada para estudiar el efecto de estos inhibidores de molécula pequeña. Varios informes, en particular los que estudian B. subtilis, reveló variaciones en el rango de concentración en la que D-aminoácidos inhiben la formación de unas películas - las biopelículas bacterianas flotantes 12,17-19. Los resultados presentados aquí sugieren que los siguientes factores explican las diferencias en el rango de concentración activa: las condiciones de pre-cultivo (12,17 logarítmica frente fase de crecimiento del 20-estacionaria tardía), el medio de cultivo utilizado en la condición de pre-cultivo (rico, indefinido [caldo Luria, LB] frente define [glutamato monosódicoglicerol, MSgg]), la relación de la inoculación y, especialmente, la eliminación del medio de pre-cultivo antes de la inoculación. La temperatura de crecimiento de película estática mostró un papel menos importante en la gama de actividad de la inhibidor de molécula pequeña D-leucina, un ácido D-amino representativo utilizado en este estudio.
Por último, una vez que las biopelículas son tratados con inhibidores específicos de biopelícula, se requieren métodos robustos e informativas para caracterizar los efectos de estos inhibidores sobre la aptitud de biopelículas. Aquí, se describen dos métodos para caracterizar de forma independiente el efecto de inhibidores de moléculas pequeñas en detalle: (1) El efecto sobre las células individuales dentro de una colonia biofilm y su resistencia a los agentes antimicrobianos. Las células en las biopelículas son típicamente más resistentes a los antibióticos en comparación con bacterias de vida libre 21-23. Aunque este fenómeno es multifactorial, la capacidad de los EPS para reducir la penetración de antibióticos se considera a menudo como una explicación atractiva 24 . Este método evalúa la supervivencia de las células del biofilm preestablecidos después de la exposición a las sustancias antibacterianas. (2) El efecto sobre la arquitectura colonia biofilm, de la gran a la pequeña escala. colonias Biofilm se caracterizan por su estructura tridimensional y la presencia de los EPS. Utilizando microscopía electrónica de barrido, los cambios en la morfología celular, estructura colonia biofilm y la arquitectura y la abundancia de los EPS se pueden visualizar desde la grande (mm) a la pequeña escala (micras).
Protocolo
1. Evaluar el efecto de los inhibidores de moléculas pequeñas en Pellicle y la formación de biopelículas Colonia
- Preparar una solución 2x de medio de 25 MSgg biofilm inductor definido sin el cloruro de calcio y de hierro (III) hexahidrato de cloruro. Después de la esterilización del filtro, añadir el cloruro de calcio. El medio está listo para usar directamente o se puede almacenar a 4 ° C en la oscuridad.
- Preparar la dilución 1x MSgg en el día del experimento.
- Diluir el medio 2x MSgg a 1x con agua destilada estéril (unas películas) o (80 ° C) de 3% agar caliente estéril (biofilms) y añadir de hierro (III) hexahidrato de cloruro a una concentración final de 50 mM (unas películas) o 250 mm ( biofilms). Añadir antibióticos o inhibidores de moléculas pequeñas a la concentración deseada y se mezcla bien. Por ejemplo, para obtener una concentración final de 0,5 mM D-leucina en 30 ml de establecer unas películas o biofilms, agregar 196,6 l de un 76,3 mM (10 mg / ml) solución madre de D-leucina.
NOTE:. La composición final 1x MSgg se describe en la Tabla 1 en comparación con la receta original 25, el medio contenía 50 mg / ml treonina y la concentración de hierro para crecer colonias de biopelícula en medio MSgg sólido se incrementó 2,5 veces para optimizar la morfología de las colonias arrugada .
- Diluir el medio 2x MSgg a 1x con agua destilada estéril (unas películas) o (80 ° C) de 3% agar caliente estéril (biofilms) y añadir de hierro (III) hexahidrato de cloruro a una concentración final de 50 mM (unas películas) o 250 mm ( biofilms). Añadir antibióticos o inhibidores de moléculas pequeñas a la concentración deseada y se mezcla bien. Por ejemplo, para obtener una concentración final de 0,5 mM D-leucina en 30 ml de establecer unas películas o biofilms, agregar 196,6 l de un 76,3 mM (10 mg / ml) solución madre de D-leucina.
- Después de la solidificación del agar, se secan las placas MSgg sólidos en una campana biológica de 30 a 45 min antes de la inoculación.
- Para seleccionar inhibidores específicos que interfieren con los mecanismos de formación de película (Figura 1), descartan que las concentraciones utilizadas afectan planctónicas y el crecimiento estática.
- Determinar el crecimiento planctónicas (aumento de la densidad óptica con el tiempo en cultivo líquido) en una curva de crecimiento sencilla mediante la medición de la densidad óptica a 600 nm cada hora hasta que la fase de crecimiento estacionario.
- Para confirmar que la turbidez del cultivo medido representa el recuento de células vivas, determinar el número de unidades formadoras de colonias (CFU)de las células en la fase de crecimiento planctónicas de un cultivo en agitación después de varios puntos de tiempo.
- Para evaluar el efecto de inhibidores de moléculas pequeñas en el crecimiento película estática, las células de la cosecha al final de una incubación de 3 días a 23 ° C a partir de una de 24 pocillos de cultivo celular bien, se inocularon en las mismas condiciones como se describe en las secciones 1,7-1,9 y determinar la CFU. Para este control, utilizar una cepa deficiente en película que carece de los operones que codifican para los componentes de la matriz extracelular (es decir, B. subtilis Δ EpsH, Δ TASA).
NOTA: Esta cepa es capaz de crecer en condiciones estáticas, pero en contraste con un tipo salvaje de formación de película-, es deficiente en la capacidad de flotar a la interfaz aire-líquido, donde el crecimiento es favorecido debido al aumento de los niveles de oxígeno 26. Por lo tanto, esta Matriz extracelular y la tensión película es deficiente en una cepa de referencia recomendado para evaluar el crecimiento en condiciones estáticas.
NOTA: Para el ex específicaamplia de la D-amino ácido D-leucina no canónica describe a continuación, un efecto sobre el crecimiento del plancton y estática en concentraciones que interferían con la formación de película se descartó 12,17. Los métodos para determinar planctónicas y el crecimiento estática se describen en detalle 17.
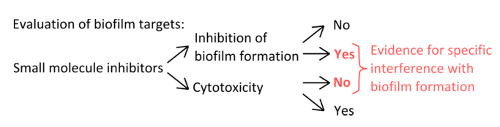
Figura 1. Visión general conceptual para la identificación de una configuración experimental sólida para evaluar la inhibición específica de la formación de biopelículas. Criterios de selección de inhibidores de moléculas pequeñas que indican interferencia específica con la formación de biopelículas sin efecto pronunciado sobre el crecimiento del plancton. Por favor, haga clic aquí para ver una versión más grande de esta cifra.
- Consecutivas a cabo B. subtilis de una reserva de C -80 ° (LB culture de 10 9 células / ml congelados en glicerol al 20%) para aislar colonias individuales sobre una placa de agar LB-1,5% con una punta estéril o aplicador.
- Crecer durante la noche a 30 ° C.
- Paso crítico: Para una inhibición película sólida por los D-aminoácidos no canónica tales como D-leucina, crecer una sola colonia recogió de la placa de agar LB-1.5% en 3 ml de caldo LB a 37 ° C durante 4 horas en una sacudiendo incubadora (velocidad de agitación 200 rpm). Reemplazar el caldo LB con medio MSgg biofilm inductor antes de la inoculación mediante la centrifugación de cultivo 1,5 ml de arranque durante 4 minutos a 6.000 xg, eliminando cuidadosamente el sobrenadante y resuspender el sedimento en 1,5 ml de medio MSgg. El resto de la cultura puede ser desechada.
Importante: Para garantizar la robustez del sistema, la densidad óptica a 600 nm (OD 600) del cultivo iniciador se lavó debe estar entre 0,6 y 1. - Durante el crecimiento del cultivo iniciador, preparar una placa de cultivo celular multiplaca de 12 pocillos containinG 3 ml de medio de MSgg sin o con un rango de concentración del inhibidor de molécula pequeña (por ejemplo, 0,3, 0,5, 1 mM D-leucina 17). Para descartar los efectos de borde, distribuir la ubicación de las diferentes concentraciones a través de la placa de multiplaca. Alternativamente, utilizar de 24 pocillos de cultivo celular placas multiplaca que contienen 1,5 ml de medio de MSgg.
- Inocular los pocillos de la placa multiplaca de cultivo celular de 12 pocillos con 3 l de cultivo iniciador se lavó (dilución 1: 1000).
NOTA: una relación de dilución inferior, es decir, 1: 500 puede ser utilizado. Esto disminuye el tiempo de desarrollo de las unas películas. - Cultivar las unas películas a 23 ° C bajo condiciones estáticas durante tres días. No mueva las unas películas durante este tiempo, ya que puede afectar a la morfología de la superficie final de la película.
- Adquirir imágenes con una exposición binocular y homogénea de un rayo. Como alternativa, tomar una imagen de las unas películas con una cámara de alta resolución. Para evitar artefactos causados por inconsisángulos y sombras luz de la tienda, toman de arriba hacia abajo imágenes con la cámara fija en un trípode y el uso de una fuente de luz suave y grande a 45 ° de ambos lados.
NOTA: Un método alternativo para estudiar B. subtilis pluricelularidad es el ensayo de colonias de biopelícula en medio sólido, biofilm inductor MSgg. Al igual que unas películas, este ensayo permite el estudio de los procesos espacio-temporales. Una vez que se determina el intervalo activo de los inhibidores de molécula pequeña, su efecto sobre la formación de colonias biofilm puede ser estudiado. - Para crecer colonias de biopelícula, simétricamente detectar 1,5 l de la pre-cultivo sin lavar (Paso 1.7) en la placa de agar 1,5% MSgg seca con la ayuda de una plantilla - 4 gotas por placa Petri de diámetro de 8,5 cm. Deje que las gotas se adsorben a la placa antes de moverlos.
NOTA: La plantilla de ayuda a conseguir una distribución equitativa de las colonias de biofilm dentro del área donde se cultivan las células. Para preparar la plantilla, dibujar la superficie total del crecimiento en las escalas originales, dividirlo a la igualdad de sectaORS y marque el centro. Para un plato redondo Petri de 8,5 cm de diámetro, este asigna 14 cm 2 a una colonia biofilm. - Incubar las placas a 30 ° C durante tres días. Durante este tiempo, las colonias de biopelículas se desarrollan y forman una estructura tridimensional, arrugada.
- Tomar fotografías como en el paso 1.11.
2. El etanol Ensayo de Resistencia
- Crecer biopelículas como se describe en los pasos 1,1-1,7 y 1.12-1.14.
- Después de 68 h de crecimiento a 30 ° C, cortar las colonias de biopelículas en dos partes iguales con la ayuda de una cuchilla de afeitar y la plantilla.

Figura 2. Ejemplo de diseño experimental para evaluar la resistencia de las células de colonias de biopelículas de agentes esterilizantes. Plantilla (A) utilizada para la distribución equitativa de las colonias de biopelícula a través de una placa de Petri y para el corte. (B)las imágenes de arriba hacia abajo sin tratar de biopelícula de tipo salvaje cultivadas durante 68 horas en un medio sólido, definido biopelícula que inducen MSgg a 30 ° C. La ampliación muestra cómo una colonia de biopelículas se puede cortar en dos mitades iguales. (C) Las dos mitades iguales biopelículas son tratados por igual (control, PBS) o con PBS o agente esterilizante y se procesa como se ha descrito. Barra de escala:. 1 cm Haga clic aquí para ver una versión más grande de esta figura.
- Levante con cuidado cada mitad de la colonia de la biopelícula de la placa de agar con una pequeña espátula y moverlo a un tubo de microcentrífuga de 1,5 ml que contiene 500 l de solución salina tamponada con fosfato (PBS). Si es necesario, raspar las células restantes de la placa y transferirlos al tubo de microcentrífuga también.
NOTA: El segundo medio de la colonia biofilm se trata diferencialmente, dependiendo de si es el control o para probar la resistencia a la Steriagentes Lizing. - Para el control, se incuba la segunda mitad de la colonia de biopelículas en 500 l de PBS como en el paso 2.3. Para evaluar la resistencia a los agentes esterilizantes, transferir la segunda mitad de la colonia biopelícula a 500 l 50% (v / v) de etanol.
NOTA: Alternative esterilización agentes tales como el hipoclorito de sodio se puede utilizar. Para todos los agentes de esterilización utilizados, determinar la concentración y tiempo de incubación activo en un experimento preliminar. - Incubar las colonias de biofilm por 10 min en el banco-tapa a temperatura ambiente.
- Centrifugar las colonias biofilm durante 5 minutos a 18.000 xg y retirar con cuidado el sobrenadante con una pipeta. Añadir 300 l de PBS.
- Sonicar las células ligeramente (amplitud 10%, pulso 5 seg), con la micropunta de un aparato de ultrasonidos.
NOTA: La energía de ultrasonidos debe ser suficiente para los agregados de biopelícula separadas. Sin embargo, demasiado duro sonicación puede lisar las células. Confirmar con antelación por microscopía de luz que la energía de ultrasonidosutilizadas no lisar las células y que todos los agregados se disuelven. - Añadir 700 l de PBS a un volumen final de 1 ml. Realizar una dilución en serie (a 10 -7) en PBS y se extendió 100 l de 3 diluciones en una placa de agar LB 1.5%-usando perlas de vidrio estériles.
NOTA: Las diluciones óptimas para ser plateado debe determinarse en un experimento preliminar, ya que esto depende de la cantidad de células en la colonia biofilm de interés y la tasa de supervivencia de las células en respuesta al agente de esterilización. - Incubar las placas durante la noche a 30 ° C, contar el CFU y determinar CFU / ml. Desde el final de UFC / ml de cada una de las colonias de la mitad de la biopelícula, se calcula el porcentaje de supervivientes.
NOTA: Cuando se realiza y se analizaron como se ha descrito, las dos mitades de la colonia de control de la biopelícula y el no tratado frente a un medio de etanol-tratada de la colonia de la biopelícula no tratada debe producir diferencias a continuación 10% en los recuentos de células viables, la verificación de la simetría o la resistencia de la colonia , respectively. Alternativamente, los resultados pueden ser representados en total CFU. Los recuentos de células de control y colonia biofilm sin tratar deben permanecer en el mismo orden de magnitud. Por el contrario, se espera que los recuentos de células de la mitad tratados con etanol de una pequeña colonia de biopelículas molécula tratados de pasar por un mínimo de dos órdenes de magnitud a reclamar por un aumento de la sensibilidad al agente esterilizante.
3. El biofilm colonia Preparación de muestras para microscopía electrónica de barrido
- Crecer colonias de biopelícula como se describe en los pasos 1,1-1,7 y 1.12-1.14.
- Preparar un nuevo lote de 2% (v / v) de glutaraldehido, 3% (v / v) de solución de paraformaldehído en cacodilato de sodio 100 mM, 5 mM de tampón de cloruro de calcio, pH 7,3. Preparar 5 ml de fijador para cada placa de Petri de 8,5 cm de diámetro.
PRECAUCIÓN: glutaraldehído y paraformaldehído son peligrosos. Manejarlos con el equipo de seguridad dentro de una campana química. Descartar las soluciones y los materiales contaminados a la ZACresiduos peligrosos. - añadir con cuidado el fijador a las colonias de biopelícula, sin dispensar directamente en la parte superior de las biopelículas.
NOTA: Debido al carácter hidrófobo de la colonia biofilm, las colonias se desprenden lentamente del agar y comienzan a flotar. - sellar cuidadosamente las placas con una tira de Parafilm. Incubar en un agitador rotatorio durante 2 horas a temperatura ambiente y, posteriormente, transferir las placas a 4 ° C durante la noche.
- Al día siguiente, retire con cuidado el líquido con una pipeta Pasteur de vidrio conectado a una bomba de vacío.
- Añadir cuidadosamente 10 ml 100 mM de cacodilato de sodio, tampón de cloruro de calcio 5 mM para lavar el biofilm y se incuba durante 5 min. Retire con cuidado el líquido con la pipeta Pasteur de vidrio desde la esquina de la placa para evitar dañar la biopelícula y añadir solución de lavado fresca por pipeteo suave. Repita este paso una vez.
- Para la deshidratación de las colonias de biopelícula, continúe con los siguientes pasos: 2x 5 min en ddH2O; 2x 20 min en 30% de etanol; 2x 20 min en 50% de etanol; 2x 20 min en 70% de etanol; 2x 20 min en 96% de etanol; 2x 30 min en 100% de etanol.
- Añadir 15 ml de líquido por cada placa de Petri de 8,5 cm de diámetro en cada paso y eliminar el líquido cuidadosamente después de cada incubación.
- Utilizar uno de dos métodos diferentes para el secado de las muestras en etanol.
- Para el secado al aire a partir de etanol:
- Cortar un papel de filtro de celulosa (diámetro de 9 cm) en cuartos. Brevemente sumergir una cuarta parte en etanol al 100%, y luego transferir cuidadosamente una colonia flotante de biopelículas en la misma. Ponga el papel de filtro húmedo en una placa de Petri forrada con un papel de filtro. Cubrir la placa de Petri y dejar que las colonias biofilm secar durante la noche en una campana química.
- Por punto crítico (CP) SECADO utilizando dióxido de carbono (CO 2) como fluido de transición:
- Llenar 75% de la cámara de la máquina punto de secado crítico con 100% de etanol. La transferencia de las muestras en un soporte, cada muestra en su propia cHamber. Si es necesario, cortar el biofilm con tijeras en trozos más pequeños. Deje las muestras sumergidas en etanol durante toda la manipulación. A continuación, transferir el soporte en la cámara y cerrar la cámara herméticamente.
- Se enfría la cámara a 7 ° C y empezar a agitar. Llenar la cámara completamente con CO2 líquido. Durante un tiempo de incubación de 7 minutos, dejar que la mezcla de etanol con el CO 2. A continuación, la descarga 25% de la solución.
NOTA: No vaciar la cámara por debajo del nivel de la muestra. - Repita el paso 3.8.2.2 cuatro veces.
- Repita el paso 3.8.2.2 cinco veces con un tiempo de incubación de tan sólo 5 min. Finalmente, el etanol debe ser completamente sustituido por CO 2.
- Durante la última ronda, vacío sólo el 5% de la cámara. Apagar la agitación y el enfriamiento. Iniciar el calentamiento de la cámara a 42 ° C. A una temperatura de 31,1 ° C y una presión de 73,9 bar, el CO2 líquido alcanza su punto crítico, el estado en el que el pH gaseosaASE tiene la misma densidad que la fase líquida del disolvente 27. Una vez que la temperatura alcanza 42 ° C, se incuba durante 10 min. A 42 ° C, las emisiones de CO 2 en la cámara existe como gas supercrítico.
NOTA: comprobar constantemente la presión de la cámara. La presión no debe superar los 120 bar a 42 ° C. - Comience lentamente para liberar el gas con calentamiento continuo. Esto mantiene las muestras en la fase de CO 2 -gas y previene la deformación de la morfología de la muestra a través de la tensión superficial del líquido. Ajuste el medidor de flujo a 5 L / hr por el ajuste fino de la válvula dosificadora controlar el medidor de caudal. Espere hasta que se suelta el que toda la presión en la cámara. Ahora abre la cámara y retirar las muestras cuidadosamente del soporte.
- Para el secado al aire a partir de etanol:
- Escudo una microscopía electrónica de talón con cinta de carbono. Con la ayuda de pinzas, transferir cuidadosamente las colonias biofilm sobre el trozo. Conectar cada colonia para el talón mediante la adición de un delgado puente de cocheBon cinta, que es crucial para la eliminación de carga bajo el haz de electrones. En esta etapa, manejar las colonias de biopelícula con cuidado, ya que son muy frágiles. Almacenar las muestras en un desecador durante al menos 24 horas o hasta que el examen.
- El día del examen con el microscopio electrónico de barrido, por pulverización catódica-capa de las colonias de biopelícula para 2 min en un ángulo de 60 ° en un oro-paladio por bombardeo iónico revestidor. Repita este paso dos veces y girar las muestras en 120 ° en el medio. Al final, por pulverización catódica abrigo de las muestras una vez durante 3 minutos desde la parte superior. La capa delgada 20 nm de oro-paladio mejora la conductividad y mejora el contraste de la muestra para la formación de imágenes en el SEM.
- Almacenar las muestras en un desecador para evitar la rehidratación de la muestra 28 hasta la formación de imágenes con un microscopio electrónico de barrido 29,30.
Resultados
El ensayo de película es un método para estudiar los procesos altamente regulados y dinámicas de B. pluricelularidad subtilis. Además de esto, el ensayo de película es adecuado para ensayar una serie de cualquiera de las condiciones pre-arranque o pequeñas concentraciones de moléculas en una placa única multiplaca de cultivo celular en un experimento. Sin embargo, B. formación de película subtilis es sensible a las condiciones de pre-cultivo (por ejemplo, medio de c...
Discusión
Bacillus subtilis formas robustas y altamente estructurados biopelículas tanto en estado líquido (unas películas) y en medio sólido (colonias). Por lo tanto, sirve como un organismo modelo ideal para caracterizar el modo de acción de los inhibidores de biopelículas específicas. En medio sólido, las células forman estructuras multicelulares con rasgos distintivos que no son evidentes en unas películas, como las arrugas que irradian desde el centro hasta el borde. Por lo tanto, unas películas y las col...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Electron microscope imaging was conducted at the Electron Microscopy Unit of the Weizmann Institute of Science, supported in part by the Irving and Cherna Moskowitz Center for Nano and Bio-Nano Imaging. This research was also supported by the ISF I-CORE grant 152/1, Mr. and Mrs. Dan Kane, Ms. Lois Rosen, by a Yeda-Sela research grant, by the Larson Charitable Foundation, by Ruth and Herman Albert Scholars Program for New Scientists, by the Ilse Katz Institute for Materials Sciences and Magnetic Resonance Research grant, by the Ministry of Health grant for alternative research methods, and by the France-Israel Cooperation - Maimonide-Israel Research Program. IKG is a recipient of the Rowland and Sylvia Career Development Chair.
Materiales
| Name | Company | Catalog Number | Comments |
| Luria Broth, Lennox | Difco | 240230 | |
| Bacto Agar | Difco | 214010 | |
| potassium phosphate monobasic | Sigma, 136.09 g/mol | P0662-500G | |
| potassium phosphate dibasic | Fisher Scientific, 174.18 g/mol | BP363-1 | |
| 3-(N-morpholino)propanesulfonic acid | Fisher Scientific, 209.27 g/mol | BP308-500 | |
| magnesium chloride hexahydrate | Merck, 203.30 g/mol | 1.05833.0250 | |
| calcium chloride anhydrous | J.T. Baker, 110.98 g/mol | 1311-01 | |
| manganese(II) chloride tetrahydrate | Sigma, 197.91 g/mol | 31422-250G-R | |
| iron(III) chloride hexahydrate | Sigma, 270.30 g/mo) | F2877-500G | |
| zinc chloride anhydrous | Acros Organics, 136.29 g/mol | 424592500 | |
| thiamine hydrochloride | Sigma, 337.27 g/mol | T1270-100G | |
| L-tryptophan | Fisher Scientific, 204.1 g/mol | BP395-100 | |
| L-phenylalanine | Sigma, 165.19 g/mol | P5482-100G | |
| L-threonine | Sigma, 119.12 g/mol | T8625-100G | |
| glycerol anhydrous | Bio-Lab Itd | 712022300 | |
| L-glutamic acid monosodium salts hydrate | Sigma, 169.11 g/mol | G1626-1KG | |
| D-leucine | Sigma, 169.11 g/mol | 855448-10G | |
| ethanol anhydrous | Gadot | 830000054 | |
| razor blade | Eddison | NA | |
| circular cellulose filter papers | Whatman, 90 mm | 1001-090 | |
| glutaraldehyde | EMS (Electron Micoscopy Science), 25% in water | 16220 | |
| paraformaldehyde | EMS, 16% in water | 15710 | |
| sodium cacodylate | Merck, 214.05 g/mol | 8.2067 | |
| calcium chloride 2-hydrate | Merck, 147.02 g/mol | 1172113 | |
| stub-aluminium mount | EMS, sloted head | 75230 | |
| carbon adhesive tape | EMS | 77825-12 | |
| Shaker 37 °C | New Brunswick Scientific Innowa42 | NA | |
| Centrifuge | Eppendorf table top centrifuge 5424 | NA | |
| Digital Sonifier, Model 250, used with Double Step Microtip | Branson | NA | |
| Incubator 30 °C | Binder | NA | |
| Incubator 23 °C | Binder | NA | |
| Filter System, 500 ml, polystyrene | Cornig Incorporated | NA | |
| Rotary Shaker - Orbitron Rotatory II | Boekel | NA | |
| S150 Sputter Coater | Edwards | NA | |
| CPD 030 Critical Point Dryer | BAL-TEC | NA | |
| Environmental Scanning Electron Microscope | XL30 ESEM FEG Philips (FEI) | NA |
Referencias
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu Rev Microbiol. 56, 187-209 (2002).
- Miller, M. B., Bassler, B. L. Quorum sensing in bacteria. Annu Rev Microbiol. 55, 165-199 (2001).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr Opin Microbiol. 10, 638-643 (2007).
- Kolter, R., Greenberg, E. P. Microbial sciences: the superficial life of microbes. Nature. 441, 300-302 (2006).
- Kearns, D. B., Chu, F., Branda, S. S., Kolter, R., Losick, R. A master regulator for biofilm formation by Bacillus subtilis. Mol Microbiol. 55, 739-749 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol Microbiol. 59, 1229-1238 (2006).
- Romero, D., Aguilar, C., Losick, R., Kolter, R. Amyloid fibers provide structural integrity to Bacillus subtilis biofilms. Proc Natl Acad Sci USA. 107, 2230-2234 (2010).
- Kobayashi, K., Iwano, M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms. Mol Microbiol. 85, 51-66 (2012).
- Hobley, L., et al. BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm. Proc Natl Acad Sci USA. 110, 13600-13605 (2013).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol Microbiol. 80, 1155-1168 (2011).
- Kolodkin-Gal, I., et al. D-amino acids trigger biofilm disassembly. Science. 328, 627-629 (2010).
- Chan, Y. G., Kim, H. K., Schneewind, O., Missiakas, D. The capsular polysaccharide of Staphylococcus aureus is attached to peptidoglycan by the LytR-CpsA-Psr (LCP) family of enzymes. J Biol Chem. 289, 15680-15690 (2014).
- Mielich-Suss, B., Lopez, D. Molecular mechanisms involved in Bacillus subtilis biofilm formation. Environ Microbiol. 17, 555-565 (2014).
- Cairns, L. S., Hobley, L., Stanley-Wall, N. R. Biofilm formation by Bacillus subtilis: new insights into regulatory strategies and assembly mechanisms. Mol Microbiol. 93, 587-598 (2014).
- Chen, M., Yu, Q., Sun, H. Novel strategies for the prevention and treatment of biofilm related infections. Int J Mol Sci. 14, 18488-18501 (2013).
- Bucher, T., Oppenheimer-Shaanan, Y., Savidor, A., Bloom-Ackermann, Z., Kolodkin-Gal, I. Disturbance of the bacterial cell wall specifically interferes with biofilm formation. Environ Microbiol Rep. 7, 990-1004 (2015).
- Sarkar, S., Pires, M. M. D-Amino acids do not inhibit biofilm formation in Staphylococcus aureus. PLoS One. 10, e0117613 (2015).
- Wei, W., Bing, W., Ren, J., Qu, X. Near infrared-caged D-amino acids multifunctional assembly for simultaneously eradicating biofilms and bacteria. Chem Commun (Camb). 51, 12677-12679 (2015).
- Leiman, S. A., et al. D-amino acids indirectly inhibit biofilm formation in Bacillus subtilis by interfering with protein synthesis. J Bacteriol. 195, 5391-5395 (2013).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Davies, D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov. 2, 114-122 (2003).
- Olsen, I. Biofilm-specific antibiotic tolerance and resistance. Eur J Clin Microbiol Infect Dis. 34, 877-886 (2015).
- Tseng, B. S., et al. The extracellular matrix protects Pseudomonas aeruginosa biofilms by limiting the penetration of tobramycin. Environ Microbiol. 15, 2865-2878 (2013).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc Natl Acad Sci USA. 98, 11621-11626 (2001).
- Holscher, T., et al. Motility, Chemotaxis and Aerotaxis Contribute to Competitiveness during Bacterial Pellicle Biofilm Development. J Mol Biol. 427, 3695-3708 (2015).
- Bray, D. . Methods in Biotechnology. 13, 235-243 (2000).
- Ensikat, H. J., Ditsche-Kuru, P., Barthlott, W. . Scanning electron microscopy of plant surfaces: simple but sophisticated methods for preparation and examination. 1, 248-255 (2010).
- Hayat, M. A. . Principles and techniques of scanning electron microscopy: Biological applications. 2, (1976).
- Schatten, H. . Scanning Electron Microscopy for the Life Sciences. , (2013).
- Bridier, A., Meylheuc, T., Briandet, R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM, ESEM and FESEM). Micron. 48, 65-69 (2013).
- Boyde, A., MacOnnachie, E. Volume changes during preparation of mouse embryonic tissue for scanning electron microscopy. SCANNING. 2, 149-163 (1979).
- Yao, Z., Kahne, D., Kishony, R. Distinct single-cell morphological dynamics under beta-lactam antibiotics. Mol Cell. 48, 705-712 (2012).
- Epstein, A. K., Pokroy, B., Seminara, A., Aizenberg, J. Bacterial biofilm shows persistent resistance to liquid wetting and gas penetration. Proc Natl Acad Sci USA. 108, 995-1000 (2011).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11, 157-168 (2013).
- Shemesh, M., Chai, Y. A combination of glycerol and manganese promotes biofilm formation in Bacillus subtilis via histidine kinase KinD signaling. J Bacteriol. 195, 2747-2754 (2013).
- Kolodkin-Gal, I., et al. Respiration control of multicellularity in Bacillus subtilis by a complex of the cytochrome chain with a membrane-embedded histidine kinase. Genes Dev. 27, 887-899 (2013).
- Oppenheimer-Shaanan, Y., et al. Spatio-temporal assembly of functional mineral scaffolds within microbial biofilms. npj Biofilms and Microbiomes. 2, 15031 (2016).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. , e3796 (2012).
- Bogino, P. C., Oliva Mde, L., Sorroche, F. G., Giordano, W. The role of bacterial biofilms and surface components in plant-bacterial associations. Int J Mol Sci. 14, 15838-15859 (2013).
- Fratamico, P. M., Annous, B. A., Guenther, N. W. . Biofilms in the Food and Beverage Industires. 1, (2009).
- Gao, G., et al. Effect of biocontrol agent Pseudomonas fluorescens 2P24 on soil fungal community in cucumber rhizosphere using T-RFLP and DGGE. PLoS One. 7, e31806 (2012).
- Chen, Y., et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation. Environ Microbiol. 15, 848-864 (2013).
- Bryers, J. D. Medical biofilms. Biotechnol Bioeng. 100, 1-18 (2008).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7, 375-381 (2009).
- Nevin, K. P., Woodard, T. L., Franks, A. E., Summers, Z. M., Lovley, D. R. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. MBio. 1, (2010).
- Torres, C. I., et al. A kinetic perspective on extracellular electron transfer by anode-respiring bacteria. FEMS Microbiol Rev. 34, 3-17 (2010).
- Li, J., Wang, N. Foliar application of biofilm formation-inhibiting compounds enhances control of citrus canker caused by Xanthomonas citri subsp. citri. Phytopathology. 104, 134-142 (2014).
- Okegbe, C., Price-Whelan, A., Dietrich, L. E. Redox-driven regulation of microbial community morphogenesis. Curr Opin Microbiol. 18, 39-45 (2014).
- Mann, E. E., Wozniak, D. J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev. 36, 893-916 (2012).
- Bouffartigues, E., et al. Sucrose favors Pseudomonas aeruginosa pellicle production through the extracytoplasmic function sigma factor SigX. FEMS Microbiol Lett. 356, 193-200 (2014).
- Wu, C., Lim, J. Y., Fuller, G. G., Cegelski, L. Quantitative analysis of amyloid-integrated biofilms formed by uropathogenic Escherichia coli at the air-liquid interface. Biophys J. 103, 464-471 (2012).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an Architectural Element in Spatially Structured Escherichia coli Biofilms. J Bacteriol. 195, 5540-5554 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados