Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методологии для изучения
В этой статье
Резюме
This study presents the development of reproducible methodologies to study biofilm inhibitors and their effects on Bacillus subtilis multicellularity.
Аннотация
This work assesses different methodologies to study the impact of small molecule biofilm inhibitors, such as D-amino acids, on the development and resilience of Bacillus subtilis biofilms. First, methods are presented that select for small molecule inhibitors with biofilm-specific targets in order to separate the effect of the small molecule inhibitors on planktonic growth from their effect on biofilm formation. Next, we focus on how inoculation conditions affect the sensitivity of multicellular, floating B. subtilis cultures to small molecule inhibitors. The results suggest that discrepancies in the reported effects of such inhibitors such as D-amino acids are due to inconsistent pre-culture conditions. Furthermore, a recently developed protocol is described for evaluating the contribution of small molecule treatments towards biofilm resistance to antibacterial substances. Lastly, scanning electron microscopy (SEM) techniques are presented to analyze the three-dimensional spatial arrangement of cells and their surrounding extracellular matrix in a B. subtilis biofilm. SEM facilitates insight into the three-dimensional biofilm architecture and the matrix texture. A combination of the methods described here can greatly assist the study of biofilm development in the presence and absence of biofilm inhibitors, and shed light on the mechanism of action of these inhibitors.
Введение
Многоклеточные бактериальные сообщества играют важную роль в природных и техногенных средах, а также может быть полезным или очень вредным. Эти многоклеточные колонии известны как биопленки, в которых отдельные клетки погруженных в матрицу собственного производства внеклеточных полимерных веществ (EPS). САЭ сильно слипание клеток к поверхности они колонизировать. Они служат в качестве защиты от механических и химических сил и создать тесный контакт между соседними клетками, что способствует сотовой связи 1. Биопленка можно рассматривать как дифференцированное сообщество, где клетки используют высоко регулируемом оркестровке процессы для координации их деятельности в рамках сообщества, а также разных видов 2-5. Переход от планктонных, свободно живущих режиме роста до состояния биопленки часто ассоциируется с процессами развития. Хорошим примером может служить грамположительных почвы бактерии Bacillus Сенная, и , следовательно, undomesticated штамм служит надежной модельного организма для изучения стадии развития, приводящие к образованию биопленки. В этой бактерии, подвижных клеток самоорганизуются в заметных многоклеточных структур , которые выполняют специализированные задачи 4. Одна группа клеток, матрично-производители секретируют экзополисахариды 6, амилоидный белок Tasa 7,8, а поверхность гидрофобность белка BslA 9,10; все из которых участвуют в сборке EPS 11-13.
Учитывая обилие биопленок в природных и техногенных нишах и предполагаемый фатальной ущерб, который они могут вызвать, существует настоятельная необходимость поиска путей предотвращения их образования. Малые молекулы ингибиторов могут помочь в обнаружении новых регуляторных путей, ферментов и структурных белков, участвующих в формировании биопленки, и тем самым способствовать понимание в сложных процессах сборки многоклеточного сообщества. Как B. Сенная является хорошо изученным модель для биоформирование пленки 14,15, он может быть использован для оценки влияния различных ингибиторов биопленки. Это исследование решает четыре основные методы, которые являются ключевыми для оценки реакции биопленок на низкомолекулярные ингибиторы. Во-первых, чтобы гарантировать, что эти ингибиторы имеют биопленки конкретной цели, разделение эффекта на планктонных роста от влияния на формирование биопленок имеет решающее значение. Большинство антибактериальных агентов в клетки-мишени в их планктонных фазе роста, но молекулы, которые нацелены на биопленки образ жизни встречаются редко. Кроме того, как молекулы , которые не влияют на рост планктона не являются токсичными, они могут уменьшить селективное давление , благоприятствующую устойчивых к антибиотикам мутантов 16. Например, когда биопленки обрабатывают D-аминокислот или некоторых других клеточных стенок, мешая молекул, они либо нарушены или в разобранном виде , но эти ингибиторы лишь слегка влияют на планктонные 12,17 роста. В противоположность этому, многие антибиотики резко ухудшает планктонный рост, с лittle или не оказывает влияния на формирование биопленок 17.
Во-вторых, создание последовательной и надежной экспериментальной базы для изучения влияния малых молекул имеет решающее значение. Мы наблюдали, что активный диапазон концентраций ингибиторов молекулы малых была чувствительна к условиям предварительной культуры и экспериментальной установки для изучения влияния этих низкомолекулярные ингибиторы. Различные отчеты, в частности , тех , кто изучает B. Сенная, выявлены различия в диапазоне концентраций , при которых D-аминокислоты ингибируют образование Плёночные - плавучие бактериальных биопленок 12,17-19. Результаты , представленные здесь , предполагают , что внимание следующие факторы различия в активном диапазоне концентраций: условия предварительной культуры (логарифмическая 12,17 по сравнению с поздней стационарной фазе роста 20), среда роста , использованный в состоянии предварительной культуры (богатых, не определено [Лурия Бульон, LB] по сравнению с определен [глутамат натрия-глицерол, MSgg]), отношение прививка и особенно удаление предварительно культуральной среде перед инокуляцией. Температура статического роста зубного налета показал менее важную роль в области деятельности малых молекулу ингибитора D-лейцина, репрезентативный D-аминокислоты, используемые в данном исследовании.
Наконец, когда биопленки обрабатывают специфическими ингибиторами биопленки, надежные и информативные методы необходимы, чтобы охарактеризовать влияние этих ингибиторов на биопленки пригодности. Здесь два способа независимо друг от друга характеризуют влияние малых молекулы ингибиторов подробно описаны: (1) Воздействие на отдельные клетки в биопленки колонии и их устойчивость к антимикробным агентам. Клетки в биопленки , как правило , более устойчивы к антибиотикам по сравнению с свободно живущих бактерий 21-23. В то время как это явление является многофакторной, способность САЭ , чтобы уменьшить проникновение антибиотика часто рассматривается в качестве привлекательной объяснения 24 . Этот метод оценивает выживание заранее установленных биопленки клеток после воздействия антибактериальных веществ. (2) Эффект от архитектуры биопленки колонии, от большого до малого масштаба. Биопленка колонии характеризуются их трехмерной структурой и наличием ЭПС. Использование сканирующей электронной микроскопии, изменения в морфологии клеток, структуру биопленки колонии и архитектуры и обилие САЭ могут быть визуализированы с большим (мм) до малого масштаба (мкм).
протокол
1. Оценка воздействия малых Молекулы ингибиторов на пелликулой и биопленки колонии Формирование
- Приготовьте раствор 2x определенной биопленки индуцирующего среды MSgg 25 без хлористого кальция и железа (III) гексагидрата хлорида. После стерилизации фильтров, добавляют хлорид кальция. Среда готова к использованию непосредственно или его можно хранить при температуре 4 ° С в темноте.
- Готовят разведение 1x MSgg на день эксперимента.
- Развести среду 2x MSgg до 1х стерильной дистиллированной водой (Плёночные) или стерильным 3% горячей (80 ° С), агар (биопленки), и добавить железа (III) гексагидрат хлорида до конечной концентрации 50 мкМ (Плёночные) или 250 мкМ ( биопленки). Добавить антибиотики или низкомолекулярные ингибиторы до желаемой концентрации и хорошо перемешивают. Например, чтобы получить конечную концентрацию 0,5 мМ D-лейцина в 30 мл установить Плёночные или биопленки, добавить 196,6 мкл 76,3 мМ (10 мг / мл), D-лейцина раствор.
НЕТТЕ:. Окончательный состав 1x MSgg описана в таблице 1 , по сравнению с оригинальной рецептуре 25, среда содержала 50 мкг / мл треонин и железа концентрация расти биопленки колонии на твердой среде MSgg увеличивали 2.5x для оптимизации морщинистой морфологии колоний ,
- Развести среду 2x MSgg до 1х стерильной дистиллированной водой (Плёночные) или стерильным 3% горячей (80 ° С), агар (биопленки), и добавить железа (III) гексагидрат хлорида до конечной концентрации 50 мкМ (Плёночные) или 250 мкМ ( биопленки). Добавить антибиотики или низкомолекулярные ингибиторы до желаемой концентрации и хорошо перемешивают. Например, чтобы получить конечную концентрацию 0,5 мМ D-лейцина в 30 мл установить Плёночные или биопленки, добавить 196,6 мкл 76,3 мМ (10 мг / мл), D-лейцина раствор.
- После застывания агара, высушить твердые пластины MSgg в биологической капюшоном в течение 30-45 мин до начала прививки.
- Чтобы выбрать специфические ингибиторы , которые мешают с механизмами формирования зубного налета (рисунок 1), исключает, что используемые концентрации влияют на планктонные и статического роста.
- Определить планктонный рост (увеличение оптической плотности с течением времени в жидкой культуре) в простой кривой роста путем не измерения оптической плотности при 600 нм каждый час до стационарной фазы роста.
- Для того, чтобы подтвердить, что измеренная культура мутности представляет собой подсчет живых клеток, определяют количество колониеобразующих единиц (КОЕ)клеток в планктонных фазе роста из качалке культуры после нескольких моментов времени.
- Для оценки влияния низкомолекулярные ингибиторы по статическому роста зубного налета, урожай клеток в конце 3-дневной инкубации при 23 ° С от 24-луночного клеточной культуре хорошо, засевают при тех же самых условиях, как описано в разделах 1.7-1.9 и определяют КОЕ. Для этого контроля, использовать пленочную-дефицитный штамм , который испытывает недостаток оперонов кодирования для компонентов внеклеточного матрикса (т.е. B. Сенная Δ EPSH, Δ Tasa).
Примечание: Этот штамм способен расти в статических условиях, но в отличие от пленочную формирования дикого типа, она испытывает дефицит в способности плавать на поверхности раздела жидкость-воздух, где рост благоприятствуют из - за повышенного уровня 26 кислорода. Таким образом, этот внеклеточный и пелликула различным материалам-дефицитный штамм является рекомендуемым эталонный штамм для оценки роста в статических условиях.
Примечание: Для конкретного эксвполне достаточный из неканонической D-аминокислоты D-лейцина описано ниже, влияние на планктонных и статического роста в концентрациях , которые вмешивались с образованием пелликула был исключен 12,17. Методы для определения планктонных и статического роста подробно описаны 17.
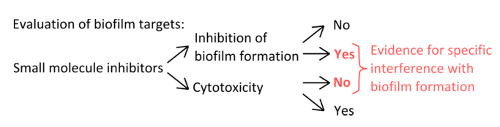
Рисунок 1. Концептуальная обзор для идентификации надежной экспериментальной установки для оценки специфическое ингибирование образования биопленки. Критерии отбора для низкомолекулярные ингибиторы , которые указывают на конкретное вмешательство с образованием биопленок без выраженного влияния на планктонных роста. Пожалуйста , нажмите здесь , чтобы увидеть увеличенную версию этой фигуры.
- Серия из B. Сенная от -80 ° C складе (LB cultuповторно из 10 9 клеток / мл , замороженные в 20% глицерина) для выделения отдельных колоний на% агаром LB-1,5 со стерильным наконечником или аппликатора.
- Расти в течение ночи при 30 ° С.
- Важным шагом: Для надежного торможения зубного налета по неканонической D-аминокислоты , такие как D-лейцина, выращивают одну колонию собирали с% агаром-1,5 LB в 3 мл LB - бульоне при температуре 37 ° С в течение 4 часов в встряхивая инкубатор (скорость встряхивания 200 оборотов в минуту). Заменить бульон LB с биопленки индуцирующих MSgg среды перед посевом центрифугированием 1,5 мл закваски в течение 4 мин при 6000 х г, осторожно удаляя супернатант и ресуспендирования осадка в 1,5 мл MSgg среды. Остальная часть культуры могут быть отброшены.
Важно: Для того, чтобы обеспечить надежность системы, оптическая плотность при 600 нм (OD 600) промытого закваски должна быть в пределах от 0,6 до 1. - Во время роста закваски, подготовить 12-луночного клеточной культуры multidish пластины containinг 3 мл MSgg среды без или с диапазоном концентраций от низкомолекулярный ингибитор (например, 0,3, 0,5, 1 мМ D-лейцин 17). Чтобы исключить краевые эффекты, распределить расположение различных концентраций через multidish пластины. Кроме того, использование 24-луночного культивирования клеток multidish пластины, содержащие 1,5 мл MSgg среды.
- Инокулируйте лунки 12-луночного культивирования клеток multidish пластины с 3 мкл промытой закваски (1: 1000 разведение).
Примечание: более низкий коэффициент разбавления, то есть 1: 500 может быть использован. Это уменьшает время разработки из Плёночные. - Расти Плёночные при 23 ° C в статических условиях в течение трех дней. Не перемещайте Плёночные в это время, так как это может повлиять на конечную морфологии поверхности плёнкой.
- Приобретать снимки с помощью бинокулярного и гомогенного воздействия молнии. В качестве альтернативы, возьмите картину Плёночные с камерой высокого разрешения. Чтобы избежать артефактов, вызванных inconsisпалаточные углы света и тени, возьмите сверху вниз снимки с помощью камеры, установленной на штатив и используйте мягкую и большой источник света под углом 45 ° с обеих сторон.
Примечание: альтернативный метод исследования Б. Сенная многоклеточность является анализ колонии биопленки на твердом, биопленки индуцирующего MSgg среды. Как Плёночные, этот анализ позволяет изучение пространственно-временных процессов. После того, как активный диапазон низкомолекулярные ингибиторы определяется, их влияние на образование биопленки колонии могут быть изучены. - Чтобы вырастить биопленки колонии, симметрично пятно 1,5 мкл непромытом предварительной культуры (шаг 1,7) на осушенном MSgg 1,5% агаром с помощью шаблона - 4 капли на чашку Петри диаметром 8,5 см. Пусть капли адсорбировать на тарелку перед их перемещением.
Примечание: Шаблон позволяет получить равномерное распределение биопленки колоний в зоне, где выращиваются клетки. Чтобы подготовить шаблон, нарисовать общую площадь роста в первоначальных масштабах, разделить его на равные сектыПРС и отметьте центр. Для круглого чашку Петри диаметром 8,5 см, Назначает 14 см 2 на одну биопленки колонию. - Инкубируйте пластин при 30 ° С в течение трех дней. За это время биопленка колонии развиваются и образуют трехмерную структуру, морщинистое.
- Сфотографируйте, как в шаге 1.11.
2. Этанол Сопротивление пробирного
- Grow биопленок, как описано в пунктах 1.1-1.7 и 1.12-1.14.
- После 68 ч роста при 30 ° С, разрезать биопленка колонии на две равные части с помощью лезвия бритвы и шаблон.

Рисунок 2. Пример эксперимента с целью оценки устойчивости биопленки колонии клеток к стерилизующих агентов. (А) используется в качестве шаблона для равномерного распределения биопленки колоний через чашку Петри и для резки. (В)Нисходящий изображения необработанного дикого типа биопленку выращивают в течение 68 ч на твердом, определенной биопленки индуцирующих MSgg среде при температуре 30 ° C. Расширение показывает, как биопленки колонии можно разрезать на две равные половины. (C) две равные половины биопленки рассматривают одинаково (контроль, PBS) или вводили фосфатный буферный раствор или стерилизующего агента и обрабатывали , как описано. Шкала бар: 1 см . Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Осторожно поднимите каждую половину биопленки колонии из чашки с агаром с небольшим шпателем и переместить его в 1,5 мл микроцентрифужных трубки, содержащей 500 мкл фосфатно-солевого буфера (PBS). При необходимости скрести оставшиеся клетки из пластины и передавать их в микроцентрифужных трубки, а также.
Примечание: вторая половина биопленки колонии обрабатывают дифференцированно, в зависимости от того, является ли он или контроль, чтобы проверить устойчивость к SteriЛИЗИНГ агенты. - Для контроля, инкубировать вторую половину биопленки колонии в 500 мкл PBS, как на стадии 2.3. Для оценки устойчивости к стерилизующих агентов, передавать вторую половину биопленки колонии до 500 мкл 50% (об / об) этанола.
могут использоваться альтернативные стерилизацией агенты, такие как гипохлорит натрия: Примечание. Для всех стерилизующих агентов, используемых, определяют концентрацию активного и инкубационный время в предварительном эксперименте. - Выдержите биопленка колонии в течение 10 мин на стендовом при комнатной температуре.
- Центрифуга биопленки колонии в течение 5 мин при 18000 мкг и осторожно удалить супернатант с помощью пипетки. Добавьте 300 мкл PBS.
- Разрушать ультразвуком клетки слабо (амплитуда 10%, пульс 5 сек) с микроострия из соникатор.
Примечание: Энергия озвучивания должна быть достаточной для отдельных агрегатов биопленки. Тем не менее, слишком суровым Озвучивание может лизировать клетки. Подтвердите заранее с помощью световой микроскопии, что энергия Озвучиваниеиспользуется не лизиса клеток и что все агрегаты растворяются. - Добавьте 700 мкл PBS до конечного объема 1 мл. Выполните серийные разведения (10 -7) в PBS и распространение 100 мкл 3 разведений на% агаром LB-1,5 с использованием стерильных стеклянных шариков.
Примечание: Оптимальные разведений металлизируемые должно быть определено в предварительном эксперименте, так как это зависит от количества клеток в биопленки колонии интереса и выживаемости клеток в ответ на стерилизующего агента. - Инкубируйте пластин в течение ночи при температуре 30 ° C, подсчитывают КОЕ и определяют КОЕ / мл. Из окончательной КОЕ / мл каждого половинных биопленки колоний, вычислить процент выживших.
Примечание: Когда выполняется и анализировали, как описано выше, две половины управления биопленки колонии и необработанных клеток по сравнению обработанной этанолом половину необработанной биопленки колонии должны давать различия ниже 10% в числа живых клеток, проверяя симметрию или сопротивление колонии , respectively. В качестве альтернативы, результаты могут быть представлены в общем КОЕ. Подсчеты клеток контроля и необработанной биопленки колонии должны оставаться в том же порядке величины. В противоположность этому, количество клеток этанола обработанной половины малой молекулы обработанной биопленки колонии, как ожидается, сократится на минимум на два порядка претендовать на повышенную чувствительность к стерилизующего агента.
3. Подготовка образца биопленки колонии для сканирующая электронная микроскопия
- Grow биопленки колонии, как описано в пунктах 1.1-1.7 и 1.12-1.14.
- Готовят свежую порцию 2% (об / об) глутаровый альдегид, 3% (об / об) раствор параформальдегида в 100 мМ какодилате натрия, 5 мМ буфера хлорида кальция, рН 7,3. Подготовка 5 мл закрепителя для каждого чашку Петри диаметром 8,5 см.
ВНИМАНИЕ: Глютаральдегид и параформальдегида опасны. Обращайтесь с ними оборудования для обеспечения безопасности внутри химической капотом. Откажитесь решения и загрязненные материалы в ЗТВотходов для здоровья и взрывоопасных. - Осторожно добавьте закрепитель в биопленки колонии, без дозирования непосредственно поверх биопленки.
Примечание: Из-за гидрофобного характера биопленки колонии, колонии медленно отделяться от агара и начинают плавать. - Тщательно запечатать пластины с полосой Parafilm. Инкубируют на роторной качалке в течение 2 ч при комнатной температуре, а затем передать пластины до 4 ° С в течение ночи.
- На следующий день, тщательно удалить жидкость с помощью стеклянной пипетки Пастера, соединенный с вакуумным насосом.
- Осторожно добавьте 10 мл 100 мМ какодилат натрия, 5 мМ буфера хлорида кальция для промывки биопленки и инкубировать в течение 5 мин. Осторожно удалите жидкость со стеклянной пипетки Пастера из угла пластины, чтобы избежать повреждения биопленки и добавить свежий промывочный раствор осторожно пипеткой. Повторите этот шаг один раз.
- Для обезвоживания биопленки колоний, выполните следующие шаги: 2x 5 мин в DDH 2 O; 2x 20 мин в 30% этанола; 2x 20 мин в 50% -ном этаноле; 2x 20 мин в 70% -ном этаноле; 2x 20 мин в 96% этанол; 2x 30 мин в 100% этаноле.
- Добавьте 15 мл жидкости для каждого чашку Петри диаметром 8,5 см на каждой стадии и удалить жидкость тщательно после каждой инкубации.
- Используйте один из двух различных методов для сушки образцов из этанола.
- Для воздушной сушки из этанола:
- Вырезать фильтр целлюлозной бумаги (диаметром 9 см) в четверти. Кратко погрузить одну четверть в 100% этаноле, а затем осторожно перенести одну плавающую биопленки колонию на него. Поместите фильтровальную бумагу мокрой в чашке Петри выровненной с фильтровальной бумагой. Накройте чашку Петри и пусть биопленки колониям сухой в течение ночи в химическом капюшоном.
- Для критической точки (CP) -drying с использованием диоксида углерода (СО 2) в качестве переходного жидкости:
- Fill 75% от критической машины камеры Точка сушки с 100% -ным этанолом. Передача образцов в держатель, каждый образец в свой собственный CHamber. При необходимости разрезать биопленку с ножницами на мелкие кусочки. Оставьте образцы погруженные в этаноле в течение всего обращения. Затем перенесите держатель в камеру и закройте камеру плотно.
- Охладить камеру до 7 ° С и начинают перемешивание. Заполните камеру полностью жидким CO 2. В течение времени инкубации 7 мин, пусть смесь этанола с CO 2. Затем разрядить 25% раствора.
ПРИМЕЧАНИЕ: Не выливать в камеру ниже уровня образца. - Повторите шаг 3.8.2.2 в четыре раза.
- Повторите шаг 3.8.2.2 пять раз с инкубирования в течение всего 5 мин. И, наконец, этанол должен быть полностью замещен CO 2.
- Во время последнего раунда, пустой лишь 5% от камеры. Выключите перемешивание и охлаждение. Начинали нагрев камеры до 42 ° С. При температуре 31,1 ° С и давлении 73,9 бар, жидкий СО 2 достигает критической точки, состояние , в котором газообразный pHASE имеет ту же плотность, что и в жидкой фазе растворителя 27. После того, как температура достигнет 42 ° C, инкубируют в течение 10 мин. При 42 ° С в СО 2 в камере существует в виде газа в сверхкритическом состоянии .
Примечание: Постоянно проверяйте давление камеры. Давление не должно превышать 120 бар при 42 ° C. - Начинают медленно выпустить газ с непрерывным нагревом. Это сохраняет образцы в фазе СО 2 -Газовый и предотвращает деформацию морфологии образца через поверхностное натяжение жидкостей. Установите расходомер до 5 л / ч с помощью тонкой настройки дозирующий клапан, управляющий расходомер. Подождите, пока все давление в камере не будет отпущен. Теперь откройте камеру и извлеките образцы тщательно из держателя.
- Для воздушной сушки из этанола:
- Coat электронный микроскопия заглушкой с углеродной лентой. С помощью пинцета, тщательно передать биопленки колонии на заглушке. Подключите каждую колонию к заглушке, добавив тонкий мост от автомобилябон лента, которая имеет решающее значение для устранения заряда под электронным пучком. На данном этапе, обрабатывать биопленка колонии с осторожностью, так как они очень хрупкие. Хранить образцы в эксикаторе в течение по крайней мере 24 ч или до обследования.
- В день обследования с помощью сканирующего электронного микроскопа, разбрызгивание пальто биопленки колонии в течение 2 мин при 60 ° угол в золото-палладий-распыл для нанесения покрытий. Повторите этот шаг дважды, и вращать образцы на 120 ° между ними. В конце концов, разбрызгивание халата образцы один раз в течение 3 мин с вершины. 20 нм тонким слоем золота-палладия улучшает проводимость и усиливает контраст образца для формирования изображения в РЭМ.
- Хранить образцы в эксикаторе, чтобы избежать регидратации образца 28 до получения изображения с помощью сканирующего электронного микроскопа 29,30.
Результаты
Анализ плева является одним из методов изучения сильно отрегулированной и динамических процессов В. Сенная многоклеточность. Кроме этого, анализ пелликула подходит для тестирования диапазона либо условий предварительного стартера или небольших концентрациях молекул в одной кл...
Обсуждение
Сенная палочка образует прочные и хорошо структурированный биопленки как в жидком (Плёночные) и на твердой среде (колонии). Таким образом, он служит в качестве идеальной модели организма, чтобы охарактеризовать способ действия специфических ингибиторов биопленки. На твердых сред?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Electron microscope imaging was conducted at the Electron Microscopy Unit of the Weizmann Institute of Science, supported in part by the Irving and Cherna Moskowitz Center for Nano and Bio-Nano Imaging. This research was also supported by the ISF I-CORE grant 152/1, Mr. and Mrs. Dan Kane, Ms. Lois Rosen, by a Yeda-Sela research grant, by the Larson Charitable Foundation, by Ruth and Herman Albert Scholars Program for New Scientists, by the Ilse Katz Institute for Materials Sciences and Magnetic Resonance Research grant, by the Ministry of Health grant for alternative research methods, and by the France-Israel Cooperation - Maimonide-Israel Research Program. IKG is a recipient of the Rowland and Sylvia Career Development Chair.
Материалы
| Name | Company | Catalog Number | Comments |
| Luria Broth, Lennox | Difco | 240230 | |
| Bacto Agar | Difco | 214010 | |
| potassium phosphate monobasic | Sigma, 136.09 g/mol | P0662-500G | |
| potassium phosphate dibasic | Fisher Scientific, 174.18 g/mol | BP363-1 | |
| 3-(N-morpholino)propanesulfonic acid | Fisher Scientific, 209.27 g/mol | BP308-500 | |
| magnesium chloride hexahydrate | Merck, 203.30 g/mol | 1.05833.0250 | |
| calcium chloride anhydrous | J.T. Baker, 110.98 g/mol | 1311-01 | |
| manganese(II) chloride tetrahydrate | Sigma, 197.91 g/mol | 31422-250G-R | |
| iron(III) chloride hexahydrate | Sigma, 270.30 g/mo) | F2877-500G | |
| zinc chloride anhydrous | Acros Organics, 136.29 g/mol | 424592500 | |
| thiamine hydrochloride | Sigma, 337.27 g/mol | T1270-100G | |
| L-tryptophan | Fisher Scientific, 204.1 g/mol | BP395-100 | |
| L-phenylalanine | Sigma, 165.19 g/mol | P5482-100G | |
| L-threonine | Sigma, 119.12 g/mol | T8625-100G | |
| glycerol anhydrous | Bio-Lab Itd | 712022300 | |
| L-glutamic acid monosodium salts hydrate | Sigma, 169.11 g/mol | G1626-1KG | |
| D-leucine | Sigma, 169.11 g/mol | 855448-10G | |
| ethanol anhydrous | Gadot | 830000054 | |
| razor blade | Eddison | NA | |
| circular cellulose filter papers | Whatman, 90 mm | 1001-090 | |
| glutaraldehyde | EMS (Electron Micoscopy Science), 25% in water | 16220 | |
| paraformaldehyde | EMS, 16% in water | 15710 | |
| sodium cacodylate | Merck, 214.05 g/mol | 8.2067 | |
| calcium chloride 2-hydrate | Merck, 147.02 g/mol | 1172113 | |
| stub-aluminium mount | EMS, sloted head | 75230 | |
| carbon adhesive tape | EMS | 77825-12 | |
| Shaker 37 °C | New Brunswick Scientific Innowa42 | NA | |
| Centrifuge | Eppendorf table top centrifuge 5424 | NA | |
| Digital Sonifier, Model 250, used with Double Step Microtip | Branson | NA | |
| Incubator 30 °C | Binder | NA | |
| Incubator 23 °C | Binder | NA | |
| Filter System, 500 ml, polystyrene | Cornig Incorporated | NA | |
| Rotary Shaker - Orbitron Rotatory II | Boekel | NA | |
| S150 Sputter Coater | Edwards | NA | |
| CPD 030 Critical Point Dryer | BAL-TEC | NA | |
| Environmental Scanning Electron Microscope | XL30 ESEM FEG Philips (FEI) | NA |
Ссылки
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu Rev Microbiol. 56, 187-209 (2002).
- Miller, M. B., Bassler, B. L. Quorum sensing in bacteria. Annu Rev Microbiol. 55, 165-199 (2001).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr Opin Microbiol. 10, 638-643 (2007).
- Kolter, R., Greenberg, E. P. Microbial sciences: the superficial life of microbes. Nature. 441, 300-302 (2006).
- Kearns, D. B., Chu, F., Branda, S. S., Kolter, R., Losick, R. A master regulator for biofilm formation by Bacillus subtilis. Mol Microbiol. 55, 739-749 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol Microbiol. 59, 1229-1238 (2006).
- Romero, D., Aguilar, C., Losick, R., Kolter, R. Amyloid fibers provide structural integrity to Bacillus subtilis biofilms. Proc Natl Acad Sci USA. 107, 2230-2234 (2010).
- Kobayashi, K., Iwano, M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms. Mol Microbiol. 85, 51-66 (2012).
- Hobley, L., et al. BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm. Proc Natl Acad Sci USA. 110, 13600-13605 (2013).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol Microbiol. 80, 1155-1168 (2011).
- Kolodkin-Gal, I., et al. D-amino acids trigger biofilm disassembly. Science. 328, 627-629 (2010).
- Chan, Y. G., Kim, H. K., Schneewind, O., Missiakas, D. The capsular polysaccharide of Staphylococcus aureus is attached to peptidoglycan by the LytR-CpsA-Psr (LCP) family of enzymes. J Biol Chem. 289, 15680-15690 (2014).
- Mielich-Suss, B., Lopez, D. Molecular mechanisms involved in Bacillus subtilis biofilm formation. Environ Microbiol. 17, 555-565 (2014).
- Cairns, L. S., Hobley, L., Stanley-Wall, N. R. Biofilm formation by Bacillus subtilis: new insights into regulatory strategies and assembly mechanisms. Mol Microbiol. 93, 587-598 (2014).
- Chen, M., Yu, Q., Sun, H. Novel strategies for the prevention and treatment of biofilm related infections. Int J Mol Sci. 14, 18488-18501 (2013).
- Bucher, T., Oppenheimer-Shaanan, Y., Savidor, A., Bloom-Ackermann, Z., Kolodkin-Gal, I. Disturbance of the bacterial cell wall specifically interferes with biofilm formation. Environ Microbiol Rep. 7, 990-1004 (2015).
- Sarkar, S., Pires, M. M. D-Amino acids do not inhibit biofilm formation in Staphylococcus aureus. PLoS One. 10, e0117613 (2015).
- Wei, W., Bing, W., Ren, J., Qu, X. Near infrared-caged D-amino acids multifunctional assembly for simultaneously eradicating biofilms and bacteria. Chem Commun (Camb). 51, 12677-12679 (2015).
- Leiman, S. A., et al. D-amino acids indirectly inhibit biofilm formation in Bacillus subtilis by interfering with protein synthesis. J Bacteriol. 195, 5391-5395 (2013).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Davies, D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov. 2, 114-122 (2003).
- Olsen, I. Biofilm-specific antibiotic tolerance and resistance. Eur J Clin Microbiol Infect Dis. 34, 877-886 (2015).
- Tseng, B. S., et al. The extracellular matrix protects Pseudomonas aeruginosa biofilms by limiting the penetration of tobramycin. Environ Microbiol. 15, 2865-2878 (2013).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc Natl Acad Sci USA. 98, 11621-11626 (2001).
- Holscher, T., et al. Motility, Chemotaxis and Aerotaxis Contribute to Competitiveness during Bacterial Pellicle Biofilm Development. J Mol Biol. 427, 3695-3708 (2015).
- Bray, D. . Methods in Biotechnology. 13, 235-243 (2000).
- Ensikat, H. J., Ditsche-Kuru, P., Barthlott, W. . Scanning electron microscopy of plant surfaces: simple but sophisticated methods for preparation and examination. 1, 248-255 (2010).
- Hayat, M. A. . Principles and techniques of scanning electron microscopy: Biological applications. 2, (1976).
- Schatten, H. . Scanning Electron Microscopy for the Life Sciences. , (2013).
- Bridier, A., Meylheuc, T., Briandet, R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM, ESEM and FESEM). Micron. 48, 65-69 (2013).
- Boyde, A., MacOnnachie, E. Volume changes during preparation of mouse embryonic tissue for scanning electron microscopy. SCANNING. 2, 149-163 (1979).
- Yao, Z., Kahne, D., Kishony, R. Distinct single-cell morphological dynamics under beta-lactam antibiotics. Mol Cell. 48, 705-712 (2012).
- Epstein, A. K., Pokroy, B., Seminara, A., Aizenberg, J. Bacterial biofilm shows persistent resistance to liquid wetting and gas penetration. Proc Natl Acad Sci USA. 108, 995-1000 (2011).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11, 157-168 (2013).
- Shemesh, M., Chai, Y. A combination of glycerol and manganese promotes biofilm formation in Bacillus subtilis via histidine kinase KinD signaling. J Bacteriol. 195, 2747-2754 (2013).
- Kolodkin-Gal, I., et al. Respiration control of multicellularity in Bacillus subtilis by a complex of the cytochrome chain with a membrane-embedded histidine kinase. Genes Dev. 27, 887-899 (2013).
- Oppenheimer-Shaanan, Y., et al. Spatio-temporal assembly of functional mineral scaffolds within microbial biofilms. npj Biofilms and Microbiomes. 2, 15031 (2016).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. , e3796 (2012).
- Bogino, P. C., Oliva Mde, L., Sorroche, F. G., Giordano, W. The role of bacterial biofilms and surface components in plant-bacterial associations. Int J Mol Sci. 14, 15838-15859 (2013).
- Fratamico, P. M., Annous, B. A., Guenther, N. W. . Biofilms in the Food and Beverage Industires. 1, (2009).
- Gao, G., et al. Effect of biocontrol agent Pseudomonas fluorescens 2P24 on soil fungal community in cucumber rhizosphere using T-RFLP and DGGE. PLoS One. 7, e31806 (2012).
- Chen, Y., et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation. Environ Microbiol. 15, 848-864 (2013).
- Bryers, J. D. Medical biofilms. Biotechnol Bioeng. 100, 1-18 (2008).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7, 375-381 (2009).
- Nevin, K. P., Woodard, T. L., Franks, A. E., Summers, Z. M., Lovley, D. R. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. MBio. 1, (2010).
- Torres, C. I., et al. A kinetic perspective on extracellular electron transfer by anode-respiring bacteria. FEMS Microbiol Rev. 34, 3-17 (2010).
- Li, J., Wang, N. Foliar application of biofilm formation-inhibiting compounds enhances control of citrus canker caused by Xanthomonas citri subsp. citri. Phytopathology. 104, 134-142 (2014).
- Okegbe, C., Price-Whelan, A., Dietrich, L. E. Redox-driven regulation of microbial community morphogenesis. Curr Opin Microbiol. 18, 39-45 (2014).
- Mann, E. E., Wozniak, D. J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev. 36, 893-916 (2012).
- Bouffartigues, E., et al. Sucrose favors Pseudomonas aeruginosa pellicle production through the extracytoplasmic function sigma factor SigX. FEMS Microbiol Lett. 356, 193-200 (2014).
- Wu, C., Lim, J. Y., Fuller, G. G., Cegelski, L. Quantitative analysis of amyloid-integrated biofilms formed by uropathogenic Escherichia coli at the air-liquid interface. Biophys J. 103, 464-471 (2012).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an Architectural Element in Spatially Structured Escherichia coli Biofilms. J Bacteriol. 195, 5540-5554 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены