A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
خلايا الثدييات التغليف في أحجار الجينات باستخدام سفينة أثارت بسيطة
In This Article
Summary
هذا الفيديو ومخطوطة تصف طريقة مستحلب لتغليف خلايا الثدييات في 0.5٪ إلى 10٪ الخرز الجينات التي يمكن أن تنتج في دفعات كبيرة باستخدام وعاء أثارت بسيطة. يمكن زراعة الخلايا المغلفة في المختبر أو زرعها لتطبيقات العلاج الخلوي.
Abstract
وقد استخدمت تغليف الخلايا في الخرز الجينات لثقافة الخلايا يجمد في المختبر وكذلك ل إمونوسولاتيون في الجسم الحي . وقد تم دراسة تغليف جزيرة البنكرياس على نطاق واسع كوسيلة لزيادة بقاء جزيرة في زرع خيفي أو زينوجينيك. ويتحقق تغليف الألجينات عادة عن طريق قذف فوهة والهلام الخارجي. باستخدام هذه الطريقة، قطرات الجينات التي تحتوي على الخلية تشكلت في غيض من الفوهات تقع في محلول يحتوي على الكاتيونات ثنائي التكافؤ التي تسبب الجيلاتين المؤلمة الاجهاد كما أنها تنتشر في قطرات. شرط تشكيل الحبرية في طرف فوهة يحد من الإنتاجية الحجمي وتركيز الجينات التي يمكن تحقيقها. يصف هذا الفيديو طريقة استحلاب قابلة للتغليف خلايا الثدييات في 0.5٪ إلى 10٪ الجينات مع 70٪ إلى 90٪ البقاء على قيد الحياة الخلية. بواسطة هذه الطريقة البديلة، يتم استحصال قطرات الجينات التي تحتوي على خلايا وكربونات الكالسيوم في الزيوت المعدنية، فولمنخفضا بانخفاض في درجة الحموضة يؤدي إلى الإفراج الداخلي عن الكالسيوم و الجيلاتين المؤلمة. الأسلوب الحالي يسمح لإنتاج الخرز الجينات في غضون 20 دقيقة من الاستحلاب. المعدات المطلوبة لخطوة التغليف تتكون من سفن مقلوبة بسيطة متاحة لمعظم المختبرات.
Introduction
وقد تم دراسة تغليف الخلايا الثدييات على نطاق واسع كوسيلة لحماية الخلايا المزروعة من الرفض المناعي 1 أو لتوفير دعم ثلاثي الأبعاد لثقافة الخلايا يجمد 2 ، 3 ، 4 . وقد تم استخدام تغليف جزيرة البنكرياس في الخرز الجينات لعكس مرض السكري في خيفي 5 ، 6 أو زينوجينيك 7 ، 8 ، 9 ، 10 ، 11 ، 12 القوارض. التجارب قبل السريرية والسريرية من زرع جزيرة البنكرياس مغلفة لعلاج مرض السكري من النوع 1 مستمرة 13 ، 14 ، 15 . لتطبيقات زرع أو أكبر حجماه في المختبر يجمد إنتاج الخلايا، وتستخدم عموما مولدات حبة مقرها فوهة. عادة، يتم ضخ مزيج من الجينات والخلايا من خلال فوهة لتشكيل قطرات التي تقع في محلول محرض يحتوي على الكاتيونات ثنائي التكافؤ، مما أدى إلى هلام الخارجي للقطرات. تدفق الغاز المحوري 16 ، 17 ، فوهة الاهتزاز 18 ، كهرباء التنافر 19 أو الدورية الأسلاك 20 تسهيل تشكيل قطرة في طرف فوهة.
العوائق الرئيسية لمولدات حبة التقليدية هي إنتاجية محدودة ومجموعة محدودة من اللزوجة الحل الذي سيؤدي إلى تشكيل حبة كافية 21 . في معدلات تدفق عالية، والسوائل الخروج من فوهة يكسر في قطرات أصغر من قطر فوهة، وانخفاض حجم السيطرة. مولدات متعددة فوهة حبة يمكن استخدامها لزيادة الإنتاجية، ولكنوالتوزيع الموحد للتدفق بين الفتحات واستخدام الحلول> 0.2 باس هو مشكلة 22 . وأخيرا، من المتوقع أن نقل بعض الأضرار التي لحقت الجزر، لأن قطر الفوهات المستخدمة ما بين 100 ميكرون و 500 ميكرون، في حين أن ~ 15٪ من الجزر البشرية يمكن أن يكون أكبر من 200 ميكرون 23 .
في هذا الفيديو، ونحن تصف طريقة بديلة لتغليف خلايا الثدييات من خلال تشكيل قطرات في خطوة استحلاب واحد بدلا من قطرة عن طريق قطرة. منذ يتم تنفيذ إنتاج حبة في وعاء أثارت بسيطة، وطريقة مناسبة لصغيرة (~ 1 مل) على نطاق واسع (10 3 L مجموعة) حبة الإنتاج مع انخفاض تكاليف المعدات 24 . هذا الأسلوب يسمح لإنتاج الخرز مع كروية عالية باستخدام مجموعة واسعة من اللزوجة الجينات مع قصيرة (على سبيل المثال 20 دقيقة) حبة جيل مرات. وقد وضعت هذه الطريقة في الأصل من قبل بونسيليت وآخرونل. 25 ، 26 وتستخدم لتجميد الحمض النووي 27 والبروتينات 28 بما في ذلك الأنسولين 29 ، والبكتيريا 30 . لقد تكييفنا مؤخرا هذه الأساليب لتغليف خلايا الثدييات باستخدام خطوط خلايا بيتا البنكرياس 31 ، 32 وأنسجة البنكرياس الأساسي 32 .
مبدأ الأسلوب هو توليد المياه في النفط مستحلب تتكون من قطرات الجينات في الزيوت المعدنية، تليها هلام الداخلية من قطرات الجينات ( الشكل 1 ). أولا إنكابسولانت (على سبيل المثال، الخلايا) هو فرقت في محلول الجينات تحتوي على غرامة ملح الكالسيوم الحبوب مع ذوبان منخفضة في درجة الحموضة العملية الأولية. ثم تضاف خليط الجينات إلى مرحلة عضوية مهيجة لإنشاء مستحلب، وعادة في وجود التوتر السطحي. في حالة تغليف الخلايا الثدييات، يمكن أن تكون المكونات الموجودة في المصل بمثابة عوامل خافضة للتوتر السطحي. بعد ذلك، يتم تخفيض الرقم الهيدروجيني من أجل ذوبان ملح الكالسيوم بإضافة حمض قابل للذوبان في الزيت الذي يقسم إلى المرحلة المائية. يجب أن يذوب حامض الخليك مع معامل تقطيع الزيت / الماء <0.005 33 قبل أن يذوب في الزيت ثم يضاف إلى المستحلب حيث يتم خلطه في طور الزيت ويقسم بسرعة إلى المرحلة المائية 34 . ويوضح الشكل 2 التفاعلات الكيميائية ونشرها التي تحدث أثناء التحمض وخطوة الهلام الداخلية. وأخيرا، يتم استرداد الخلايا المغلفة من قبل انقلاب المرحلة، فصل المرحلة تسارع بواسطة الطرد المركزي، خطوات الغسيل المتكررة والترشيح. ويمكن بعد ذلك اتباع هذه الخطوات من قبل حبة وأخذ العينات خلية لتحليلات مراقبة الجودة، في الخلايا المخبرية ثقافة و / أو زرع الخلايا المغلفة.
s = "jove_content" فو: كيب-together.within-بادج = "1"> 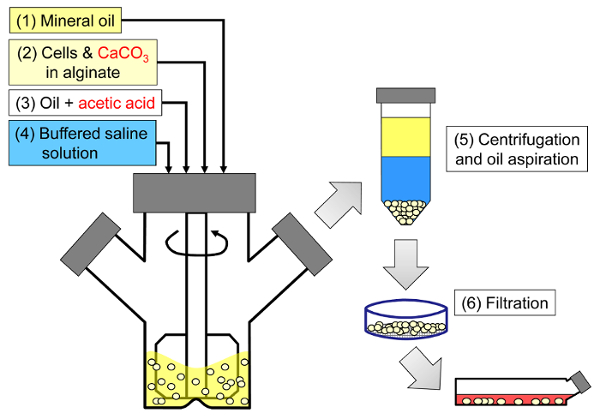
الشكل 1: تخطيطي لعملية مستحلب القائم لتغليف خلايا الثدييات. يتم إنتاج الخرز أولا عن طريق استحلاب الجينات والخلايا وكاكو 3 خليط في الزيوت المعدنية (الخطوات 1 و 2 في التخطيطي)، مما اثار الهلام الداخلي عن طريق إضافة حمض الخليك (الخطوة 3). ثم يتم فصل الخرز التبلور من النفط بإضافة العازلة المائية لتحريك مرحلة الانقلاب (الخطوة 4)، تليها الطرد المركزي وطموح النفط (الخطوة 5)، ثم الترشيح (الخطوة 6). وأخيرا، يتم نقل الخرز التي تم جمعها على مرشح في وسط زراعة الخلايا للفي المختبر الثقافة أو لزرع. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2: ردود الفعل ونشر الخطوات التي تحدث أثناء الهلام الداخلي. (1) يتم إضافة حمض الخليك إلى المرحلة العضوية ويتم نقله إلى قطرات الجينات بالحمل الحراري. (2) أقسام حمض الخليك في المرحلة المائية. (3) في وجود الماء، ينفصل الحمض وينتشر للوصول إلى حبوب الكاكاو 3 التي تصور باللون الأزرق الداكن. (4) يتم تبادل الأيونات H + مع أيونات كا 2 + في كاكو 3 ، والإفراج عن كا 2 + أيونات. (5) أيونات الكالسيوم منتشر حتى يواجهون الجينات غير المتفاعلة، مما يؤدي إلى الربط عبر اليونوتروبيك لسلاسل الجينات. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
على النقيض من التقليدية إنوابسولاتورس خلية مقرها فوهة، توزيع حجم حبة واسعة هو إكسبكتد من هذه العملية بسبب آلية تشكيل الحبرية في استحلب أثار. بالنسبة لمجموعة فرعية من التطبيقات، قد يكون هذا التوزيع حجم حبة مشكلة. على سبيل المثال، قد يتعرض جزء أكبر من الخلايا في سطح حبة في الخرز أصغر. إذا كانت القيود الغذائية ( مثل الأكسجين) هي مصدر قلق، قد تتفاقم هذه القيود في الخرز أكبر. ميزة من أسلوب استحلب أثار هو أن متوسط حجم حبة يمكن تعديلها بسهولة عن طريق تغيير معدل الإثارة خلال خطوة الاستحلاب. ويمكن أيضا توزيع حجم حبة واسعة يمكن استغلالها لدراسة تأثير حجم حبة على أداء الخلايا مغلفة.
تغليف الخلايا الثدييات عن طريق الاستحلاب والهلام الداخلي هو بديل مثير للاهتمام للمختبرات التي ليست مجهزة مع مولد حبة. وعلاوة على ذلك، وهذا الأسلوب يعطي المستخدمين خيار تقليل وقت المعالجة، أو توليد الخرز في منخفضة جدا أو عالية جدا الجينات كونسنتربالجمع.
بروتوكول موضح أدناه يصف كيفية تغليف الخلايا في 10.5 مل من محلول الجينات 5٪ أعدت في 10 ملم 4- (2-هيدروكسي إيثيل) -1-بيبيرازينيثان سلفونيك حمض (هيبيس) العازلة. يتكون الجينات من خليط 50:50 من لفم الزرع الصف (منخفض اللزوجة عالية محتوى حمض المنورونيك) و مفغ (اللزوجة المتوسطة محتوى حمض غولورونيك عالية) الجينات. كربونات الكالسيوم في تركيز النهائي من 24 ملم يستخدم كعامل الربط عبر المادية. يشكل الزيت المعدني الخفيف المرحلة العضوية، في حين يستخدم حامض الخليك لتحميض المستحلب وإطلاق الهلام الداخلي. ومع ذلك، نوع الجينات وتكوينها، فضلا عن المخزن المؤقت عملية اختيار تعتمد على التطبيق المطلوب 32 . وقد استخدمت مجموعة متنوعة من أنواع الجينات (انظر الجدول من المواد) لإنتاج الخرز مع هذا البروتوكول.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. تحضير محلول الألجينات، تعليق الكاكو 3 والنفط الحامض
- إعداد العازلة العملية والمتوسطة.
- إعداد العازلة عملية نموذجية تستخدم لتوليد عالية التركيز الخرز الجينات باستخدام 10 ملي هيبيس، 170 ملي كلوريد الصوديوم. ضبط درجة الحموضة إلى 7.4.
- إعداد وسط ثقافة نموذجية باستخدام دولبيكو تعديل النسر المتوسطة (دمم) تحتوي على 10٪ مصل بقري الجنين (فبس)، 6 ملي الجلوتامين، 100 / مل البنسلين، و 100 ملغ / مل الستربتومايسين.
- إعداد محلول المخزون الجينات في 1.17 أضعاف التركيز المطلوب النهائي في الخرز.
- أولا، تزن كمية مناسبة من مسحوق الجينات. على سبيل المثال، للحصول على تركيز النهائي من الجينات 5٪ مع 50:50 لفم و مفغ الجينات، تزن ما مجموعه 1.17 جرام الجينات الصوديوم من خلال الجمع بين 0.583 غرام لفم الجينات مسحوق و 0.583 غرام مفغ مسحوق الجينات.
- وضع 20 مل العازلة العملية في أوتوكجرة زجاجية لافابل على لوحة ضجة مغناطيسية وتهيج في ~ 200 دورة في الدقيقة. إضافة تدريجيا مسحوق الجينات الصوديوم إلى الحل.
- ترك الحل اثارة بين عشية وضحاها في سرعة منخفضة. إذا لزم الأمر، ربط قارورة إلى لوحة ضجة.
- إذا كان الحل غير حل تماما، ربط زجاجة على خلاط دوارة والاستمرار في الخلط عند 37 درجة مئوية لمدة 24 ساعة إضافية.
- تعقيم الحل الجينات عن طريق التعقيم الحل لمدة 30 دقيقة في وعاء أقل من نصف كامل. اترك درجة الحرارة أقل من 60 درجة مئوية قبل استرجاع الحل.
- إذا لزم الأمر، وإزالة الجسيمات عن طريق تصفية محلول الجينات بعد وقت قصير من التعقيم قبل أن تصل إلى درجة حرارة الغرفة، في حين أن اللزوجة لا تزال منخفضة بما فيه الكفاية.
- إعداد تعليق كربونات الكالسيوم في 21 أضعاف التركيز المطلوب النهائي لالهلام الداخلي.
- تزن مسحوق كاكو 3 . على سبيل المثال، الإعلاند 1 ز كاكو 3 إلى 20 مل العازلة العملية للحصول على 24 ملي كاو 3 كما النهائي تركيز عامل التبلور.
- الأوتوكلاف تعليق 3 كاكو لمدة 30 دقيقة.
ملاحظة: سوف تتغير تركيز كاكو 3 مع مرور الوقت بسبب بيكربونات - كو 2 التوازن. تجنب استخدام نفس المخزون كاكو 3 تعليق لأكثر من 10 إجراءات التغليف.
- الأوتوكلاف السفينة أثارت لعملية الاستحلاب. قبل الاستخدام، إزالة أي آثار من الماء المكثف المتبقية في قارورة الدوار.
- مباشرة قبل عملية الاستحلاب، إعداد النفط أسيديفيد. حل 44 ميكرولتر حامض الخليك في 11 مل من الزيوت المعدنية وضعت في أنبوب مخروطي 50 مل.
ملاحظة: خطأ شائع هو حل غير مكتملة للحمض الخليك. تجنب بيبتينغ كميات صغيرة من حمض الخليك والتأكد من أن حمض الأسيتيك يذوب تماما في النفط من قبل فورتيكسينغ المتكررة.
تنبيه: حمض الخليك هو سامة أ د حمض متطايرة. التعامل مع هذا الكاشف تحت غطاء الدخان والحفاظ على حمض الخليك / حل النفط في حاوية مغلقة حتى خطوة الاستحلاب. ارجع إلى معلومات مسس على هذا الكاشف للحصول على مزيد من المعلومات. - السماح لجميع الحلول للوصول إلى درجة حرارة الغرفة قبل الشروع في تغليف الخلايا.
2. الجينات حبة الجيل عن طريق الاستحلاب والهلام الداخلية
- وضع 10 مل من النفط المعدني الخفيف في قارورة الدوار والبدء في التحريض بسرعة دوران منخفضة (على سبيل المثال 250 دورة في الدقيقة لدورق الدوار تستخدم في هذا الفيديو).
- إذا كانت الخلايا المستخدمة لهذه العملية هي من الثقافات الملتصقة، وتطبيق التربسين لتعليق الخلايا. إنهاء رد فعل بإضافة فبس المحتوية على المتوسطة أو التربسين المانع وجمع عينة لتعداد الخلايا.
- تحديد تركيز الخلية وجدوى بعد تريبان تلطيخ الأزرق باستخدام عدادة الكريات أو عداد الخلية الآلي، كما هو موضح سابقاأس = "كريف"> 32.
- الطرد المركزي الخلايا لمدة 7 دقائق في 300 x ج وغسلها مرة واحدة في الوسط المطلوب لتجميد الخلايا. تأكد من أن هذه الوسيلة تحتوي على مستحلبات مثل فبس أو ألبومين المصل البقري (بسا). على سبيل المثال، استخدم دمم يحتوي على 10٪ فبس.
- إعادة تعليق بيليه الخلية في نفس المتوسطة للحصول على 10.5 أضعاف التركيز النهائي المطلوب في الخرز.
- إضافة 1.1 مل من 10.5 أضعاف مخزون الخلية المركزة إلى 9.9 مل من محلول الجينات. ثم، إضافة 550 ميكرولتر من تعليق 3 كاكو وتخلط عن طريق التحريك مع ملعقة معقمة لضمان توزيع حتى من كاكو 3 .
- نقل على الفور 10.5 مل من خليط الألجينات والخلايا وكاكو 3 في زيت تهييج باستخدام حقنة.
ملاحظة: بالنسبة للحلول عالية اللزوجة، نضح وإخراج الخليط ببطء شديد لتجنب فقاعات الهواء. في بعض الحالات، فمن الأفضل لوقف التحريض مع إضافة الخليط إلى قارورة لتجنبالجينات إنتراينمنت على المكره رمح. - مباشرة بعد إضافة الجينات والخلايا و كاكو 3 خليط إلى النفط، وزيادة معدل الإثارة.
ملاحظة: لفم 5٪: الجين مفغ المستخدمة هنا، تم تطبيق سرعة دوران 1025 دورة في الدقيقة لتوليد الخرز من حوالي 900 ميكرون قطرها مناسبة للفي المختبر الثقافة 35 . سوف تؤدي سرعات دوران أعلى و تركيزات أقل من الجينات إلى انخفاض متوسط أقطار حبة، كما هو موضح في المنشورات السابقة 25 ، 32 . التغيرات الطفيفة في المكره والهندسة السفينة، وكذلك خصائص الجينات يمكن أن تؤثر بشكل كبير على متوسط قطر حبة. لكل تغيير في تكوين السفينة أو الكثير من الجينات، يجب إنشاء منحنى قياسي يتعلق بحقل منطقة متوسط قطر حبة متوسط لسرعة دوران 32 . - بدء الموقت واستحلاب الجينات لمدة 12 دقيقة.
- إضافة 10 مل من رانه النفط وحمض الخليك حل لتحمض مستحلب، حل كاكو 3 ، وبالتالي جسديا عبر ربط الجينات في الخرز تبلور. السماح 8 دقيقة لهذه الخطوة التحمض.
3. حبة الانتعاش
- تقليل معدل التحريض إلى 400 دورة في الدقيقة. إضافة 40 مل من العازلة العملية مختلطة مع 10٪ المتوسطة لزيادة الرقم الهيدروجيني وتسبب انقلاب المرحلة.
- وقف التحريض 1 دقيقة في وقت لاحق ونقل الخليط إلى 50 مل أنابيب الطرد المركزي. شطف قارورة الدوار مع إضافية 20 مل المتوسطة وإضافة هذا إلى أنبوب. نضح قدر ما المرحلة المائية ممكن من قارورة الدوار قبل الشفط مرحلة النفط للحد من اتصال حبة مع مرحلة النفط.
ملاحظة: استخدام ماصة كبيرة تتحمل (على سبيل المثال 25 مل ماصة) في هذه الخطوة ومن هذه النقطة على لتجنب إتلاف الخرز. لأحجام أصغر، ويمكن أيضا التلاعب حبة تعليق مع نصائح ماصة قطع. للحصول على هذه النصائح، وقطع نهاية طرف ماصة مع مقص وإيل ارتداء حماية العين. - أجهزة الطرد المركزي أنابيب لمدة 3 دقائق في 630 x ج لتسريع حبة تسوية وفصل المرحلة.
- إزالة النفط والفائض محلول مائي عن طريق الشفط مع ماصة باستور.
- غسل الخرز مرة واحدة على الأقل مع المتوسطة. تصفية تعليق حبة على 40 ميكرون مصافي الخلايا النايلون، ونضح السائل الزائد المرتبطة مع الخرز من تحت مصفاة. نقل الخرز إلى حجم معروف من المتوسطة باستخدام ملعقة معقمة.
ملاحظة: أصغر أو أكبر حجم المسام مرشحات يمكن استخدامها في هذه الخطوة، اعتمادا على الهدف الحد الأدنى قطر حبة. ومع ذلك، ينصح الترشيح الجاذبية بدلا من الترشيح يحركها الضغط من خلال الفرعية ميكرون حجم المسام مرشحات لتجنب إتلاف الخرز. - قياس حجم حبة من حجم النزوح (حجم بعد إضافة الخرز، ناقص حجم قبل إضافة الخرز) وأعلى حتى المتوسطة للحصول على حبة المطلوب: إجمالي حجم نسبة، والتي هي عادة 1: 5، أو 1 مل الخرز في4 مل متوسطة. من هذه النقطة على، دائما استخدام ماصات تتحمل كبيرة لتجنب إتلاف الخرز.
- نقل الخلايا مغلفة في T- قوارير للفي المختبر ثقافة أو زرع التجارب.
4. مراقبة الجودة والتطبيقات
ملاحظة: من أجل ضمان الخلايا مغلفة وجودة حبة، وتوزيع حجم حبة والبقاء على قيد الحياة الخلية بعد العملية ينبغي أن يكون كميا. عكس هلام لاستعادة الخلايا من داخل الخرز لمزيد من التحليل يتم عادة.
- لتقييم توزيع حبة حجم، وصمة عار الخرز مع تولويدين الأزرق- O.
- وضع حبات 0.5 مل في المخزن المؤقت عملية 4 مل يحتوي على 10٪ المتوسطة كاملة.
- إضافة 500 ميكرولتر من 1 ز / لتر محلول الأزرق تولويدين أعدت في المخزن المؤقت العملية.
- احتضان لمدة 60 دقيقة في أنبوب مخروطي على شاكر دوارة في 50 دورة في الدقيقة.
- إضافة 5 مل العازلة العملية التي تحتوي على 10٪ كاملة المتوسطة و إمدنقل حبات على نحو حرفي والحل في طبق بتري والحصول على الصور على مجهر التكبير منخفضة أو باستخدام كاميرا رقمية باليد. إذا لزم الأمر، ضع طبق بتري على مربع الضوء قبل الحصول على الصور مع الكاميرا المحمولة لتعزيز التباين وتجنب الظلال.
- أداء تحليل الصورة لتحديد حجم حبة التوزيع كما هو موضح سابقا 32 ، على سبيل المثال باستخدام تحليل الصور مجانية 36 .
- لتقييم بقاء الخلية نوعيا، وصمة عار الخلايا باستخدام هوموديمر إثيديوم لتحديد الخلايا الميتة و كالسين آم لتحديد الخلايا الحية.
- إضافة 1 حجم من الخرز إلى 4 مجلدات من المخزن المؤقت العملية التي تحتوي على 10٪ المتوسطة كاملة.
- إضافة كمية مناسبة من كالسين آم و إديديوم حلول الأسهم هوموديمر للحصول على 4 ميكرومتر و 2 ميكرومتر تركيزات، على التوالي. توليد الضوابط وصمة عار واحدة عن طريق إضافة واحد فقط من الكواشف لبعض عينات حبة.
- احتضان الخرز على الجليد لمدة 20 دقيقة.
- وضع الحل بين شريحة ساترة باستخدام فاصل مثل حلقة o لتجنب ضغط الخرز.
- انتقل إلى المجهر مضان. استخدام الضوابط وصمة عار واحدة لتقييم مضان تنزف من خلال. حدد مرشحات مضان المناسبة على أساس موجات الإثارة / الانبعاثات المرتبطة كالسين آم (494/517 نانومتر) و إيثيديوم هوموديمر ملزمة دنا (528/617 نانومتر).
- لاستعادة الخلايا من الخرز لمزيد من التحليل، ديجيل الجينات باستخدام سيترات أو حل مخلب آخر.
- إعداد حل ديجلينغ تحتوي على 55 ملي سترات، هيبيس 10 ملي و 95 ملي كلوريد الصوديوم في درجة الحموضة 7.4.
- مزيج هذا الحل مع وسط 10٪، ومن ثم إضافة 1 مل الجينات الخرز إلى 9 مل من الخليط.
- ديجيل الخرز على الجليد مع 75 دورة في الدقيقة التحريض لمدة 20 دقيقة.
ملاحظة: يمكن الآن أن تستخدم الخلايا لتحليل أو إزالتها من سوليت الجينات ديجيلدأيون بواسطة الطرد المركزي. على سبيل المثال، بقاء الخلية بعد ديجلينغ يمكن قياسها من قبل تلطيخ تريبان الأزرق. بدلا من ذلك، يمكن طرد الخلايا وغسلها، تليها مرنا، الحمض النووي و / أو عينات العينات البروتين والتحليل.
Access restricted. Please log in or start a trial to view this content.
النتائج
في نهاية عملية الاستحلاب والهلام الداخلي، يجب استرداد حجم حبة مشابه لحجم الخليط الأولي وخليط الخلية. يجب أن تكون الخرز كروية للغاية مع عدد قليل من العيوب ( الشكل 3 ). يجب أن تكون الخرز قوية بما فيه الكفاية لتحمل بيبتينغ من خلال ماصا...
Access restricted. Please log in or start a trial to view this content.
Discussion
خطوات مختلفة (المبين في الشكل 2 ) خلال رد فعل الهلام الداخلي يمكن أن تحد من حركية الشاملة. بالنسبة للحبوب كربونات الكالسيوم أكبر من ~ 2.5 ميكرون، وقد تبين أن معدل حل كربونات أن الحد من معدل 26 ، 44 . خطوة التحمض التي تؤدي إلى الإفراج ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
نشكر جيل أوزبورن لعملها الأرض وضع على عملية الاستحلاب ولورين ويلكينسون للحصول على الدعم التقني. نشكر الدكتور إيغور لاسيك، الدكتور تيموثي J. كيفر والدكتور جيمس د. جونسون لإسهاماتهم وتعاونهم. نشكر ديابيت كيبيك، جدرف، ثيسيل، ومركز كوبيكويس سور ليس ماتيريوكس فونكتيونلز (سكمف)، ومجلس العلوم الطبيعية والهندسة البحوث (نزيرك)، ومركز زرع جزيرة الإنسان وتجديد خلايا بيتا، وشبكة الخلايا الجذعية الكندية، و ومؤسسة مايكل سميث للبحوث الصحية، ومؤسسة فوندز كيبيكواز دي لا ريشيرتش سور لا ناتشر إت ليس تيشنولوجيز، و كوست 865 للحصول على الدعم المالي.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
References
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes--a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O'Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli's cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15(2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E. 3rd, Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , University of British Columbia. (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100(2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels - a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M. Immobilized Cells. Wijffels, R. H. , Springer. Berlin Heidelberg. 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved