Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Encapsulation de cellules de mammifères dans des perles d'alginate à l'aide d'un récipient agité simple
Dans cet article
Résumé
Cette vidéo et ce manuscrit décrivent un procédé à base d'émulsion pour encapsuler des cellules de mammifères dans des billes d'alginate à 0,5% à 10% qui peuvent être produites en gros lots en utilisant un simple vaisseau agité. Les cellules encapsulées peuvent être cultivées in vitro ou transplantées pour des applications de thérapie cellulaire.
Résumé
L'encapsulation cellulaire dans des billes d'alginate a été utilisée pour la culture cellulaire immobilisée in vitro ainsi que pour l'immuno-isolement in vivo . L'encapsulation des îlots pancréatiques a été largement étudiée comme moyen d'augmenter la survie des îlots dans des greffes allogéniques ou xénogénétiques. L'encapsulation d'alginate est généralement obtenue par extrusion de buse et par gélification externe. En utilisant cette méthode, les gouttelettes d'alginate contenant des cellules formées à la pointe des buses tombent dans une solution contenant des cations divalents qui provoquent une gélification d'alginate ionotropique lorsqu'ils diffusent dans les gouttelettes. L'exigence de formation de gouttelettes à la pointe de la buse limite le débit volumétrique et la concentration d'alginate qui peuvent être atteints. Cette vidéo décrit une méthode d'émulsification évolutive pour encapsuler des cellules de mammifères dans un alginate de 0,5% à 10% avec une survie cellulaire de 70% à 90%. Selon ce procédé alternatif, des gouttelettes d'alginate contenant des cellules et du carbonate de calcium sont émulsionnées dans de l'huile minérale,Par une diminution du pH conduisant à une libération de calcium interne et à une gélification d'alginate ionotropique. La méthode actuelle permet la production de perles d'alginate dans les 20 minutes d'émulsification. L'équipement requis pour l'étape d'encapsulation consiste en des récipients agités simples disponibles pour la plupart des laboratoires.
Introduction
L'encapsulation des cellules de mammifères a été largement étudiée comme un moyen de protéger les cellules transplantées du rejet immunitaire 1 ou de fournir un support tridimensionnel pour la culture cellulaire immobilisée 2 , 3 , 4 . L'encapsulation d'îlots pancréatiques dans des billes d'alginate a été utilisée pour inverser le diabète chez les rorogènes allogéniques 5 , 6 ou xénogéniques 7 , 8 , 9 , 10 , 11 , 12 . Les essais précliniques et cliniques de la transplantation d'îlots pancréatiques encapsulés pour traiter le diabète de type 1 sont en cours 13 , 14 , 15 . Pour les applications de transplantation ou à plus grande échelleLa production cellulaire immobilisée in vitro , les générateurs de perles à buse sont généralement utilisés. Typiquement, un mélange d'alginate et de cellules est pompé à travers une buse pour former des gouttelettes qui tombent dans une solution agitée contenant des cations divalents, entraînant la gélification externe des gouttelettes. Le flux de gaz coaxial 16 , 17 , la vibration des buses 18 , la répulsion électrostatique 19 ou les fils rotatifs 20 facilitent la formation de gouttelettes au niveau de la pointe de la buse.
Les principaux inconvénients des générateurs de perles classiques sont leur débit limité et la gamme limitée de viscosités de la solution qui entraîneront une formation adéquate des talons 21 . À des débits élevés, le fluide sortant de la buse se décompose en gouttelettes plus petit que le diamètre de la buse, ce qui réduit le contrôle de la taille. Les générateurs de perles multi-buses peuvent être utilisés pour augmenter le débit, maisLa distribution uniforme du flux entre les buses et l'utilisation des solutions> 0,2 Pas est problématique 22 . Enfin, tous les dispositifs à base de buses devraient donner des dégâts aux îlots, puisque le diamètre des buses utilisées est compris entre 100 μm et 500 μm, alors que ~ 15% des îlots humains peuvent être supérieurs à 200 μm 23 .
Dans cette vidéo, nous décrivons une méthode alternative pour encapsuler les cellules de mammifères en formant des gouttelettes dans une seule étape d'émulsification au lieu de la goutte à goutte. Étant donné que la production de la perle est réalisée dans un récipient à agitation simple, la méthode est adaptée à une production de perles petite (~ 1 mL) à grande échelle (10 3 L) avec de faibles coûts d'équipement 24 . Cette méthode permet la production de perles à haute sphéricité en utilisant une large gamme de viscosités d'alginate avec des temps de génération courts courts ( par exemple, 20 minutes). Cette méthode a été développée à l'origine par Poncelet et aL. 25 , 26 et utilisé pour immobiliser l'ADN 27 , les protéines 28, y compris l'insuline 29 et les bactéries 30 . Nous avons récemment adapté ces méthodes à l'encapsulation de cellules de mammifères utilisant des lignées de cellules pancréatiques bêta 31 , 32 et des tissus pancréatiques primaires 32 .
Le principe de la méthode consiste à générer une émulsion eau-dans-huile constituée de gouttelettes d'alginate dans de l'huile minérale, suivie d'une gélification interne des gouttelettes d'alginate ( figure 1 ). D'abord, l'encapsulant ( par exemple, les cellules) est dispersé dans une solution d'alginate contenant un sel de calcium à grain fin avec une faible solubilité au pH initial du procédé. Le mélange d'alginate est ensuite ajouté à une phase organique agitée pour créer une émulsion, habituellement en présence d'unTensioactif. Dans le cas de l'encapsulation de cellules de mammifères, les composants présents dans le sérum peuvent agir comme tensioactifs. Ensuite, le pH est réduit afin de solubiliser le sel de calcium en ajoutant un acide soluble dans l'huile qui se divise en phase aqueuse. L'acide acétique, avec un coefficient de partage d'huile minérale <0,005 33 , doit être pré-dissous dans de l'huile, puis ajouté à l'émulsion où il est mélangé dans la phase huileuse et partitions rapides dans la phase aqueuse 34 . La figure 2 illustre les réactions chimiques et la diffusion qui ont lieu lors de l'étape d'acidification et de gélification interne. Enfin, les cellules encapsulées sont récupérées par inversion de phase, séparation de phase accélérée par centrifugation, étapes de lavage répétées et filtration. Ces étapes peuvent ensuite être suivies d'un échantillonnage de talons et de cellules pour des analyses de contrôle de qualité, une culture cellulaire in vitro et / ou une transplantation de cellules encapsulées.
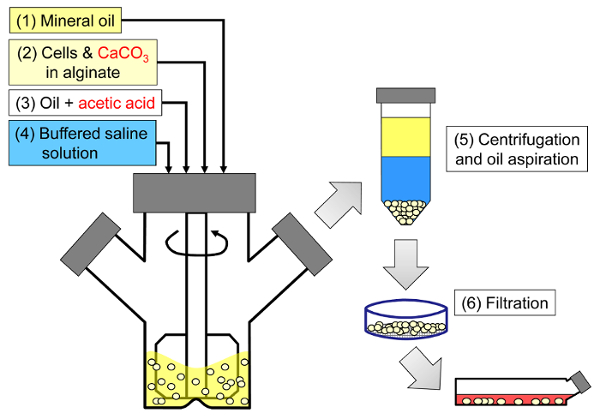
Figure 1: Schéma du procédé à base d'émulsification pour encapsuler des cellules de mammifères. Les perles sont d'abord produites par émulsification d'un mélange d'alginate, de cellule et de CaCO 3 dans de l'huile minérale (étapes 1 et 2 dans le schéma), déclenchant une gélification interne par addition d'acide acétique (étape 3). Les perles gélifiées sont ensuite séparées de l'huile en ajoutant un tampon aqueux pour déclencher l'inversion de phase (étape 4), puis par centrifugation et aspiration d'huile (étape 5), puis filtration (étape 6). Enfin, les perles collectées sur le filtre sont transférées dans un milieu de culture cellulaire pour une culture in vitro ou pour une transplantation. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2: Réactions et étapes de diffusion se produisant lors de la gélification interne. (1) L'acide acétique est ajouté à la phase organique et est transporté vers les gouttelettes d'alginate par convection. (2) L'acide acétique se divise en phase aqueuse. (3) En présence d'eau, l'acide se dissocie et se diffuse pour atteindre les grains de CaCO 3 représentés en bleu foncé. (4) Les ions H + sont échangés avec les ions Ca 2 + dans CaCO 3 , libérant des ions Ca 2+ . (5) Les ions calcium diffusent jusqu'à ce qu'ils rencontrent l'alginate n'ayant pas réagi, conduisant à la réticulation ionotropique des chaînes d'alginate. Cliquez ici pour voir une version plus grande de ce chiffre.
Contrairement aux encapsulateurs de cellules à base de buses classiques, une grande distribution de taille de perles est expeCité à partir de ce processus en raison du mécanisme de formation de gouttelettes dans une émulsification agitée. Pour un sous-ensemble d'applications, cette distribution de taille de talon peut être problématique. Par exemple, une plus grande fraction de cellules peut être exposée à la surface du talon dans des billes plus petites. Si les limitations d'éléments nutritifs ( par exemple, l' oxygène) sont préoccupantes, ces limitations peuvent être exacerbées dans des perles plus grandes. Un avantage du procédé d'émulsification agité est que la taille moyenne des bourrelets peut facilement être ajustée en modifiant le taux d'agitation pendant l'étape d'émulsification. La large distribution de la taille des perles peut également être exploitée pour étudier l'effet de la taille des talons sur les performances des cellules encapsulées.
L'encapsulation de cellules de mammifères par émulsification et gélification interne est une alternative intéressante pour les laboratoires qui ne sont pas équipés d'un générateur de talons. En outre, cette méthode donne aux utilisateurs la possibilité de réduire le temps de traitement, ou de générer des billes à très faible ou très haut concentré d'alginateTions.
Le protocole décrit ci-dessous décrit comment encapsuler des cellules dans 10,5 ml d'une solution d'alginate à 5% préparée dans un tampon 10 mM d'acide 4- (2-hydroxyéthyl) -1-pipérazineéthanesulfonique (HEPES). L'alginate se compose d'un mélange 50:50 de LVM de qualité transplantation (teneur en acide mannuronique à faible viscosité élevée) et d'alginate de MVG (teneur moyenne en acide à teneur élevée en acide guluronique). Le carbonate de calcium à une concentration finale de 24 mM est utilisé comme agent de réticulation physique. L'huile minérale légère constitue la phase organique, tandis que l'acide acétique est utilisé pour acidifier l'émulsion et déclencher une gélification interne. Cependant, le type et la composition d'alginate, ainsi que le tampon de processus sélectionné dépendent de l'application souhaitée 32 . Une variété de types d'alginate (voir le tableau des matériaux) a été utilisé pour produire des billes avec ce protocole.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Préparez la solution d'alginate, la suspension de CaCO 3 et l'huile acidifiée
- Préparez le tampon de traitement et le support.
- Préparer le tampon de traitement typique utilisé pour générer des billes d'alginate à haute concentration en utilisant de l'HEPES 10 mM, du NaCl 170 mM. Ajustez le pH à 7,4.
- Préparer le milieu de culture typique en utilisant le milieu d'Eagle modifié par Dulbecco (DMEM) contenant 10% de sérum bovin fœtal (FBS), 6 mM de glutamine, 100 U / mL de pénicilline et 100 mg / ml de streptomycine.
- Préparer la solution mère d'alginate à 1,17 fois la concentration souhaitée finale dans les billes.
- Tout d'abord, peser la quantité appropriée de poudre d'alginate. Par exemple, pour obtenir une concentration finale d'alginate à 5% avec 50,000 d'alginate de LVM et MVG, peser au total 1,17 g d'alginate de sodium en combinant 0,583 g de poudre d'alginate LVM et 0,583 g de poudre d'alginate de MVG.
- Placer un tampon de traitement de 20 mL dans un autocUn pot de verre lavable sur une plaque d'agitation magnétique et agiter à ~ 200 tr / min. Ajouter progressivement la poudre d'alginate de sodium à la solution.
- Laisser la solution remuer pendant une nuit à basse vitesse. Si nécessaire, fixez le flacon sur la plaque d'agitation.
- Si la solution est complètement dissoute, fixez la bouteille sur un mélangeur rotatif et continuez à mélanger à 37 ° C pendant 24 h supplémentaires.
- Stériliser la solution d'alginate en autoclaveant la solution pendant 30 min dans un vaisseau qui est moins de la moitié plein. Laisser la température diminuer au-dessous de 60 ° C avant de récupérer la solution.
- Si nécessaire, enlever les particules en filtrant la solution d'alginate peu de temps après l'autoclavage avant d'atteindre la température ambiante, alors que la viscosité reste suffisamment faible.
- Préparer la suspension de carbonate de calcium à 21 fois la concentration finale souhaitée pour la gélification interne.
- Pesez la poudre de CaCO 3 . Par exemple, l'annonceD 1 g CaCO 3 à 20 ml de tampon de traitement pour obtenir CaCO3 24 mM comme concentration finale en agent gélifiant.
- Autoclavez la suspension de CaCO 3 pendant 30 min.
REMARQUE: La concentration de CaCO 3 changera avec le temps en raison de l'équilibre du bicarbonate-CO 2 . Évitez d'utiliser le même stock de suspension de CaCO 3 pour plus de 10 procédures d'encapsulation.
- Autoclavez le récipient agité utilisé pour le processus d'émulsification. Avant d'utiliser, enlever toute trace d'eau condensée restant dans la fiole.
- Immédiatement avant le processus d'émulsification, préparer l'huile acidifiée. Dissoudre 44 μl d'acide acétique par 11 ml d'huile minérale placée dans un tube conique de 50 ml.
NOTE: Une erreur commune est la dissolution incomplète de l'acide acétique. Évitez de pipeter de petites quantités d'acide acétique et assurez-vous que l'acide acétique est complètement dissous dans de l'huile par vortex répété.
ATTENTION: l'acide acétique est toxique et D acide volatil. Manipuler ce réactif sous une hotte et garder la solution d'acide acétique / huile dans un récipient fermé jusqu'à l'étape d'émulsification. Reportez-vous aux informations sur la FS de ce réactif pour plus d'informations. - Permettre à toutes les solutions d'atteindre la température ambiante avant de procéder à l'encapsulation cellulaire.
2. Génération de perles d'alginate par émulsification et glaçage interne
- Placez 10 ml d'huile minérale légère dans le flacon et commencez à agiter à une vitesse de rotation faible ( p . Ex., 250 tr / min pour le flacon centrifuge utilisé dans cette vidéo).
- Si les cellules utilisées pour le procédé proviennent de cultures adhérentes, appliquer la trypsine pour suspendre les cellules. Mettre fin à la réaction en ajoutant un inhibiteur de la trypsine ou du milieu contenant du FBS et collecter un échantillon pour l'énumération des cellules.
- Déterminer la concentration et la viabilité des cellules après la coloration au bleu de Trypan à l'aide d'un hémocytomètre ou d'un compteur automatisé de cellules, tel que décrit précédemmentAss = "xref"> 32.
- Centrifugez les cellules pendant 7 min à 300 xg et lavez-les une fois dans le milieu désiré pour l'immobilisation cellulaire. Assurez-vous que ce milieu contient des émulsifiants tels que le FBS ou l'albumine de sérum bovin (BSA). Par exemple, utiliser le DMEM contenant 10% de FBS.
- Ré-suspendre le culot cellulaire dans le même milieu pour obtenir 10,5 fois la concentration finale souhaitée dans les perles.
- Ajouter 1,1 ml du stock cellulaire concentré 10,5 fois à 9,9 ml de la solution d'alginate. Ensuite, ajouter 550 μL de suspension de CaCO 3 et mélanger en agitant avec une spatule stérile pour assurer une répartition uniforme du CaCO 3 .
- Transférer immédiatement 10,5 ml du mélange d'alginate, de cellule et de CaCO 3 dans l'huile d'agitation à l'aide d'une seringue.
REMARQUE: Pour des solutions très visqueuses, aspirer et éjecter le mélange très lentement pour éviter les bulles d'air. Dans certains cas, il est préférable d'arrêter l'agitation tout en ajoutant le mélange au flacon pour éviterEntraînement d'alginate sur l'arbre de la turbine. - Immédiatement après l'addition du mélange d'alginate, de cellule et de CaCO 3 à l'huile, augmentez le taux d'agitation.
REMARQUE: Pour l'alginate MVG à 5% utilisé ici, une vitesse de rotation de 1025 tours par minute a été appliquée pour générer des perles d'environ 900 μm de diamètre adaptées à la culture in vitro 35 . Des vitesses de rotation plus élevées et des concentrations inférieures d'alginate conduiront à des diamètres de talons moyens inférieurs, comme décrit dans les publications précédentes 25 , 32 . Des légers changements dans la géométrie de la turbine et du vaisseau, ainsi que des propriétés d'alginate peuvent affecter grandement le diamètre moyen des bourrelets. Pour chaque modification de la configuration du navire ou du lot d'alginate, une courbe standard reliant le diamètre moyen du talon de la surface spécifique à la vitesse de rotation devrait être générée 32 . - Démarrez la minuterie et émulsionnez l'alginate pendant 12 min.
- Ajouter 10 mL de tL'huile et la solution d'acide acétique pour acidifier l'émulsion, dissoudre le CaCO 3 et donc réticuler physiquement l'alginate en perles gélifiées. Laisser 8 minutes pour cette étape d'acidification.
3. Recouvrement de perles
- Réduisez le taux d'agitation à 400 tr / min. Ajouter 40 ml de tampon de traitement mélangé avec 10% de milieu pour augmenter le pH et provoquer une inversion de phase.
- Arrêtez l'agitation 1 minute plus tard et transférez le mélange à des tubes de centrifugation de 50 ml. Rincer le flacon centrifuge avec un milieu additionnel de 20 ml et ajouter le à l'échantillon. Aspirer autant de phase aqueuse que possible de la fiole avant d'aspirer la phase huileuse pour minimiser le contact avec la phase huileuse.
REMARQUE: utilisez une pipette à gros alésage ( p . Ex. 25 ml de pipette) à cette étape et à partir de ce point afin d'éviter d'endommager les perles. Pour des volumes plus petits, la suspension des talons peut également être manipulée avec des pointes de pipettes coupées. Pour obtenir de tels conseils, couper l'extrémité de la pointe de pipette avec des ciseaux whIle portant une protection oculaire. - Centrifuger les tubes pendant 3 min à 630 xg pour accélérer le décapage des cordons et la séparation des phases.
- Enlever l'huile et l'excès de solution aqueuse en aspirant avec une pipette Pasteur.
- Laver les perles au moins une fois avec du milieu. Filtrer la suspension de talon sur des tamis de cellules de nylon de 40 μm et aspirer l'excès de liquide associé aux billes en dessous de la crépine. Transférer les perles dans un volume de milieu connu en utilisant une spatule stérile.
REMARQUE: des filtres de taille de pores plus petits ou plus grands peuvent être utilisés à cette étape, en fonction du diamètre de perles minimum cible. Cependant, la filtration par gravité est recommandée plutôt qu'une filtration sous pression par des filtres de taille de pores sous-micron pour éviter d'endommager les perles. - Mesurez le volume du talon par déplacement de volume (volume après avoir ajouté les perles, moins le volume avant d'ajouter les perles) et complétez le support pour obtenir le cordon souhaité: rapport de volume total, qui est généralement de 1: 5 ou 1 mL de perles dans4 mL de milieu. À partir de ce moment, utilisez toujours des pipettes à gros orifices pour éviter d'endommager les perles.
- Transférer les cellules encapsulées dans des flacons en T pour des expériences de culture ou de transplantation in vitro .
4. Contrôle qualité et applications
REMARQUE: Afin d'assurer la qualité des cordes et des cordons encapsulés, la répartition de la taille du talon et la survie cellulaire après le processus doivent être quantifiées. Inverser le gel pour récupérer les cellules à partir des perles pour une analyse plus approfondie est généralement effectuée.
- Pour évaluer la répartition de la taille du talon, tachez les billes avec du bleu de toluidine.
- Placez 0,5 ml de perles dans 4 ml de tampon de traitement contenant 10% de milieu complet.
- Ajouter 500 μL d'une solution de bleu de toluidine 1 g / L préparée dans un tampon de traitement.
- Incuber pendant 60 minutes dans un tube conique sur un agitateur rotatif à 50 tr / min.
- Ajouter 5 ml de tampon de traitement contenant 10% de milieu complet et immedTransférer immédiatement les perles et la solution dans une boîte de Petri et acquérir des images sur un microscope à faible grossissement ou en utilisant un appareil photo numérique portatif. Si nécessaire, placez la boîte de Petri sur une boîte lumineuse avant d'acquérir des images avec une caméra portable pour améliorer le contraste et éviter les ombres.
- Effectuer une analyse d'image pour quantifier la distribution de la taille des talons comme décrit précédemment 32 , par exemple en utilisant un logiciel gratuit d'analyse d'image 36 .
- Pour évaluer qualitativement la survie cellulaire, tachez les cellules en utilisant l'homodimère d'éthidium pour identifier les cellules mortes et la calcéine AM pour identifier les cellules vivantes.
- Ajouter 1 volume de perles à 4 volumes de mémoire tampon de traitement contenant 10% de support complet.
- Ajouter la quantité appropriée de solutions stock de calcéine AM et de homodimère d'éthidium pour obtenir des concentrations de 4 μM et 2 μM, respectivement. Générer des contrôles de taches individuelles en ajoutant un seul des réactifs à certains échantillons de talons.
- Incuber les perles sur de la glace pendant 20 min.
- Placez la solution entre une glissière et une lamelle coulissante à l'aide d'une entretoise telle qu'un joint torique pour éviter de comprimer les perles.
- Procéder au microscope à fluorescence. Utilisez les contrôles de tache unique pour évaluer la purge de la fluorescence. Sélectionnez des filtres de fluorescence appropriés en fonction des longueurs d'onde d'excitation / émission associées à la calceine AM (494/517 nm) et à l'homodimère d'éthidium lié à l'ADN (528/617 nm).
- Pour récupérer les cellules des perles pour une analyse plus approfondie, dégager l'alginate en utilisant un citrate ou une autre solution chélatante.
- Préparer une solution dégraissante contenant du citrate 55 mM, de l'HEPES 10 mM et du NaCl 95 mM à pH 7,4.
- Mélangez cette solution avec 10% de milieu, puis ajoutez 1 mL de perles d'alginate à 9 mL du mélange.
- Dégel les perles sur glace avec une agitation de 75 tr / min pendant 20 min.
REMARQUE: Les cellules peuvent maintenant être utilisées pour l'analyse ou retirées du solde d'alginate dégrailléPar centrifugation. Par exemple, la viabilité cellulaire après dégivrage peut être quantifiée par coloration au bleu de trypan. Alternativement, les cellules peuvent être centrifugées et lavées, suivies d'un échantillonnage et d'une analyse d'ARNm, d'ADN et / ou de protéines.
Access restricted. Please log in or start a trial to view this content.
Résultats
À la fin de l'émulsion et du processus de gélification interne, un volume de talon similaire au volume initial du mélange d'alginate et de cellule devrait être récupéré. Les perles devraient être très sphériques avec quelques défauts ( figure 3 ). Les perles doivent être suffisamment fortes pour résister à la pipetage à travers des pipettes à gros alvéoles. À des concentrations élevées d'alginate, des gouttelettes encap...
Access restricted. Please log in or start a trial to view this content.
Discussion
Diverses étapes (représentées sur la figure 2 ) pendant la réaction de gélification interne peuvent limiter la cinétique globale. Pour les grains de carbonate de calcium supérieurs à ~ 2,5 μm, le taux de dissolution du carbonate s'est révélé être un taux de limitation de la fréquence 26 , 44 . L'étape d'acidification qui conduit à la libération interne de calcium a également été démontrée comme étant la variabl...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Nous remercions Jill Osborne pour ses travaux de mise en terre sur le processus d'émulsification et Lauren Wilkinson pour un soutien technique. Nous remercions le Dr Igor Laçik, le Dr Timothy J. Kieffer et le Dr James D. Johnson pour leur contribution et leur collaboration. Nous remercions Diabète Québec, la JDRF, ThéCell, le Centre québécois sur les matériaux fonctionnels (CQMF), le Conseil de recherches en sciences naturelles et en génie (CRSNG), le Centre pour la transplantation d'islet humain et la régénération bêta-cellulaire, le Réseau canadien de cellules souches, le Fondation Michael Smith pour la recherche en santé, le Fonds québécois de recherche sur la nature et les technologies et COST 865 pour un soutien financier.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
Références
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes--a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O'Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli's cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15(2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E. 3rd, Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , University of British Columbia. (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100(2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels - a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M. Immobilized Cells. Wijffels, R. H. , Springer. Berlin Heidelberg. 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon