É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Encapsulamento de células de mamífero em grânulos de alginato usando um recipiente agitado simples
Neste Artigo
Resumo
Este vídeo e manuscrito descrevem um método baseado em emulsão para encapsular células de mamífero em pérolas de alginato de 0,5% a 10% que podem ser produzidas em grandes lotes usando um vaso de agitação simples. As células encapsuladas podem ser cultivadas in vitro ou transplantadas para aplicações de terapia celular.
Resumo
O encapsulamento celular em pérolas de alginato foi utilizado para cultura celular imobilizada in vitro , bem como para imuno-isolação in vivo . O encapsulamento de ilhotas pancreáticas tem sido amplamente estudado como meio de aumentar a sobrevivência de ilhotas em transplantes alogênicos ou xenogênicos. O encapsulamento de alginato é geralmente alcançado por extrusão de bicos e gelificação externa. Usando este método, as gotículas de alginato contendo células formadas na ponta dos bocais caem em uma solução contendo catiões divalentes que causam a gelificação ionotrópica de alginato à medida que se difundem nas gotículas. O requisito para a formação de gotículas na ponta do bico limita o rendimento volumétrico e a concentração de alginato que podem ser alcançados. Este vídeo descreve um método de emulsificação escalável para encapsular células de mamífero em alginato de 0,5% a 10% com sobrevivência celular de 70% a 90%. Por este método alternativo, as gotículas de alginato contendo células e carbonato de cálcio são emulsionadas em óleo mineral, folBaixada por uma diminuição do pH, levando à liberação interna de cálcio e à gelação de alginato ionotrópico. O método atual permite a produção de pérolas de alginato dentro de 20 min de emulsificação. O equipamento necessário para o passo de encapsulação consiste em recipientes de agitação simples disponíveis para a maioria dos laboratórios.
Introdução
O encapsulamento de células de mamíferos foi amplamente estudado como um meio para proteger as células transplantadas da rejeição imune 1 ou para fornecer um suporte tridimensional para cultura celular imobilizada 2 , 3 , 4 . O encapsulamento de ilhotas de pâncreas em esferas de alginato tem sido usado para reverter o diabetes em roedores 5 , 6 ou xenogênicos 7 , 8 , 9 , 10 , 11 , 12 , xenogênicos. Ensaios pré-clínicos e clínicos de transplante de ilhotas pancreáticas encapsuladas para tratar diabetes tipo 1 estão em andamento 13 , 14 , 15 . Para aplicações de transplantes ou maioresProdução celular imobilizada in vitro , geradores de talões baseados em bico são geralmente utilizados. Tipicamente, uma mistura de alginato e células é bombeada através de um bico para formar gotículas que caem numa solução agitada contendo catiões divalentes, resultando na gelificação externa das gotículas. O fluxo de gás coaxial 16 , 17 , a vibração de bocal 18 , a repulsão eletrostática 19 ou os fios rotativos 20 facilitam a formação de gotículas na ponta do bocal.
As principais desvantagens dos geradores de grânulos convencionais são a sua taxa de transferência limitada e a limitada gama de viscosidades da solução que resultarão na formação adequada de grânulos 21 . Em altas taxas de fluxo, o fluido que sai do bico quebra em gotículas menor do que o diâmetro do bocal, diminuindo o controle de tamanho. Os geradores de grânulos com vários bicos podem ser usados para aumentar a produção, masA distribuição uniforme do fluxo entre as bocas e o uso de soluções> 0,2 Pas é problemático 22 . Por fim, espera-se que todos os dispositivos baseados em bicos dêem algum dano aos islotes, uma vez que o diâmetro dos bicos usados está entre 100 μm e 500 μm, enquanto que ~ 15% das ilhotas humanas podem ser maiores do que 200 μm 23 .
Neste vídeo, descrevemos um método alternativo para encapsular células de mamíferos formando gotículas em um único passo de emulsão em vez de gota a gota. Uma vez que a produção de grânulos é realizada em um recipiente de agitação simples, o método é adequado para produção de grânulos pequenos (~ 1 mL) a grande escala (10 3 L) com baixos custos de equipamento 24 . Este método permite a produção de esferas com alta esfericidade usando uma ampla gama de viscosidades de alginato com tempos de geração de grânulos curtos ( por exemplo, 20 minutos). Este método foi desenvolvido originalmente por Poncelet et aeu. 25 , 26 e usado para imobilizar DNA 27 , proteínas 28 incluindo insulina 29 e bactérias 30 . Recorremos recentemente a estes métodos para o encapsulamento de células de mamíferos usando linhas de células pancreáticas beta 31 , 32 e tecido pancreático primário 32 .
O princípio do método é gerar uma emulsão de água em óleo consistindo de gotículas de alginato em óleo mineral, seguido de gelificação interna das gotículas de alginato ( Figura 1 ). Primeiro, o encapsulante ( por exemplo, células) é disperso em uma solução de alginato contendo um sal de cálcio de grão fino com baixa solubilidade no pH do processo inicial. A mistura de alginato é então adicionada a uma fase orgânica agitada para criar uma emulsão, geralmente na presença de umaSurfactante. No caso do encapsulamento de células de mamíferos, os componentes presentes no soro podem atuar como surfactantes. Em seguida, o pH é reduzido de modo a solubilizar o sal de cálcio pela adição de um ácido solúvel em óleo que particiona na fase aquosa. O ácido acético, com um coeficiente de partição de óleo mineral / óleo <0,005 33 , deve ser pré-dissolvido em óleo, depois adicionado à emulsão onde é misturado na fase oleosa e partições rápidas para a fase aquosa 34 . A Figura 2 ilustra as reações químicas e a difusão que ocorrem durante o passo de acidificação e gelificação interna. Finalmente, as células encapsuladas são recuperadas por inversão de fase, separação de fase acelerada por centrifugação, passos de lavagem repetidos e filtração. Essas etapas podem então ser seguidas por amostragem de contas e células para análises de controle de qualidade, cultura celular in vitro e / ou transplante de células encapsuladas.
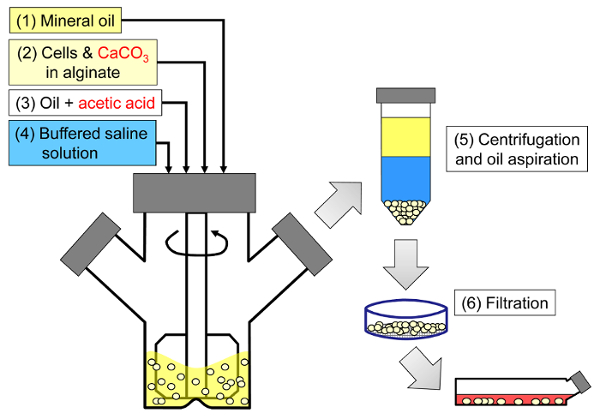
Figura 1: Esquema do processo à base de emulsão para encapsular células de mamíferos. As pérolas são primeiro produzidas por emulsão de uma mistura de alginato, célula e CaCO3 em óleo mineral (etapas 1 e 2 no esquema), desencadeando a gelificação interna por adição de ácido acético (passo 3). As pérolas gelificadas são então separadas do óleo adicionando um tampão aquoso para desencadear a inversão de fase (passo 4), seguida de centrifugação e aspiração de óleo (passo 5) e depois filtração (passo 6). Finalmente, as pérolas coletadas no filtro são transferidas para meio de cultura celular para cultura in vitro ou para transplante. Clique aqui para ver uma versão maior dessa figura.

Figura 2: Reações e etapas de difusão que ocorrem durante a gelificação interna. (1) O ácido acético é adicionado à fase orgânica e é transportado para as gotículas de alginato por convecção. (2) As partições de ácido acético na fase aquosa. (3) Na presença de água, o ácido dissocia e difunde para atingir os grãos de CaCO3 representados em azul escuro. (4) Os íons H + são trocados com os íons Ca 2 + em CaCO 3 , liberando íons Ca 2+ . (5) Os íons de cálcio difundem até encontrarem alginato não reagido, levando à reticulação ionotrópica das cadeias de alginato. Clique aqui para ver uma versão maior dessa figura.
Contrariamente aos encapsuladores de células convencionais baseados em bicos, uma ampla distribuição de tamanho de talão é expeCitado deste processo devido ao mecanismo de formação de gotículas em emulsificação agitada. Para um subconjunto de aplicativos, essa distribuição de tamanho de talão pode ser problemática. Por exemplo, uma maior fração de células pode ser exposta na superfície do talão em pérolas menores. Se as limitações de nutrientes ( por exemplo, oxigênio) são uma preocupação, essas limitações podem ser exacerbadas em grânulos maiores. Uma vantagem do método de emulsificação agitada é que o tamanho médio do talão pode ser facilmente ajustado alterando a taxa de agitação durante o passo de emulsão. A distribuição ampla do tamanho do talão também pode ser explorada para estudar o efeito do tamanho do talão no desempenho da célula encapsulada.
O encapsulamento de células de mamíferos por emulsificação e gelificação interna é uma alternativa interessante para laboratórios que não estão equipados com um gerador de notas. Além disso, este método oferece aos usuários a opção de reduzir o tempo de processamento ou gerar grânulos com concentrado de alginato muito baixo ou muito altoAções.
O protocolo descrito abaixo descreve como encapsular células em 10,5 mL de solução de alginato a 5% preparada em tampão de ácido 4- (2-hidroxietil) -1-piperazinoetanosulfónico 10 mM (HEPES) 10 mM. O alginato consiste em uma mistura 50:50 de LVM de grau de transplante (teor de ácido manurônico de baixa viscosidade e alto teor de ácido gulurônico com viscosidade média). O carbonato de cálcio na concentração final de 24 mM é utilizado como agente de reticulação física. O óleo mineral leve constitui a fase orgânica, enquanto o ácido acético é usado para acidificar a emulsão e desencadear a gelificação interna. No entanto, o tipo e composição de alginato, bem como o buffer de processo selecionado dependem da aplicação desejada 32 . Uma variedade de tipos de alginato (ver Tabela de materiais) foram utilizados para produzir esferas com este protocolo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Prepare a solução de alginato, a suspensão de CaCO 3 e o óleo acidificado
- Prepare o buffer de processo e o meio.
- Prepare o tampão de processo típico usado para gerar esferas de alginato de alta concentração usando HEPES 10 mM, NaCl 170 mM. Ajuste o pH para 7,4.
- Prepare o meio de cultura típico usando o Meio de Eagle Modificado de Dulbecco (DMEM) contendo 10% de soro bovino fetal (FBS), 6 mM de glutamina, 100 U / mL de penicilina e 100 mg / mL de estreptomicina.
- Prepare a solução de reserva de alginato a 1,17 vezes a concentração desejada final nas pérolas.
- Primeiro, pesa a quantidade apropriada de pó de alginato. Por exemplo, para obter uma concentração final de 5% de alginato com alginato LVM e MVG 50:50, pesar um total de 1,17 g de alginato de sódio combinando 0,583 g de pó de alginato LVM e 0,583 g de pó de alginato MVG.
- Coloque 20 mL de buffer de processo em um autocFrasco de vidro lavável em uma placa de agitação magnética e agite a ~ 200 rpm. Adicione progressivamente o pó de alginato de sódio à solução.
- Deixe a solução mexendo durante a noite a baixa velocidade. Se necessário, prenda o balão na placa de agitação.
- Se a solução estiver completamente dissolvida, prenda a garrafa sobre um misturador rotativo e continue a misturar a 37 ° C por 24 h adicionais.
- Esterilizar a solução de alginato esterilizando a solução por 30 min em uma embarcação que está menos da metade cheia. Deixe a temperatura diminuir abaixo de 60 ° C antes de recuperar a solução.
- Se necessário, remova as partículas filtrando a solução de alginato logo após a autoclavagem antes de atingir a temperatura ambiente, enquanto a viscosidade permanece suficientemente baixa.
- Prepare a suspensão de carbonato de cálcio a 21 vezes a concentração desejada final para a gelificação interna.
- Pesar o pó de CaCO 3 . Por exemplo, anúncioD 1 g de CaCO3 a 20 mL de tampão de processo para obter CaCO3 24 mM como a concentração final do agente gelificante.
- Autoclave a suspensão de CaCO 3 durante 30 min.
NOTA: A concentração de CaCO3 mudará ao longo do tempo devido ao equilíbrio de bicarbonato - CO 2 . Evite usar a mesma suspensão de CaCO 3 para mais de 10 procedimentos de encapsulamento.
- Autoclave o recipiente agitado usado para o processo de emulsão. Antes de usar, remova todos os vestígios de água condensada que permanecem no frasco giratório.
- Imediatamente antes do processo de emulsão, preparar o óleo acidificado. Dissolver 44 μL de ácido acético por 11 mL de óleo mineral colocado em um tubo cônico de 50 mL.
NOTA: Um erro comum é a dissolução incompleta do ácido acético. Evite pipetar pequenas quantidades de ácido acético e assegure-se de que o ácido acético é completamente dissolvido em óleo por meio de vortex repetido.
CUIDADO: o ácido acético é tóxico e D ácido volátil. Manuseie este reagente sob uma exaustão e mantenha a solução de ácido acético / óleo em um recipiente fechado até o passo de emulsão. Consulte as informações de MSDS sobre este reagente para obter mais informações. - Permita que todas as soluções atinjam a temperatura ambiente antes de proceder ao encapsulamento celular.
2. Geração de grânulos de alginato por emulsificação e gelação interna
- Coloque 10 mL de óleo mineral leve no frasco giratório e comece a agitar com uma baixa velocidade de rotação ( por exemplo, 250 rpm para o frasco giratório usado neste vídeo).
- Se as células utilizadas para o processo são de culturas aderentes, aplique tripsina para suspender as células. Termine a reação adicionando o meio contendo FBS ou o inibidor da tripsina e colete uma amostra para enumeração celular.
- Determine a concentração celular e a viabilidade após a coloração do azul de Trypan usando um hemocitómetro ou um contador de células automatizado, conforme descrito anteriormenteAss = "xref"> 32.
- Centrifugar as células por 7 min a 300 xg e lavá-las uma vez no meio desejado para imobilização celular. Certifique-se de que este meio contenha emulsionantes tais como FBS ou albumina de soro bovino (BSA). Por exemplo, use DMEM contendo 10% de FBS.
- Re-suspenda o sedimento celular no mesmo meio para obter 10,5 vezes a concentração final desejada nas pérolas.
- Adicione 1,1 mL do estoque celular concentrado de 10,5 vezes a 9,9 ml da solução de alginato. Em seguida, adicione 550 μL de suspensão de CaCO3 e misture com agitação com uma espátula estéril para assegurar uma distribuição uniforme do CaCO3.
- Transfira imediatamente 10,5 mL da mistura de alginato, célula e CaCO3 no óleo de agitação usando uma seringa.
NOTA: Para soluções altamente viscosa, aspirar e ejetar a mistura muito lentamente para evitar bolhas de ar. Em alguns casos, é preferível parar a agitação ao adicionar a mistura ao frasco para evitarArrastamento no eixo do impulsor. - Imediatamente após adicionar a mistura de alginato, célula e CaCO3 ao óleo, aumentar a taxa de agitação.
NOTA: Para o 5% LVM: alginato MVG usado aqui, uma velocidade de rotação de 1025 rpm foi aplicada para gerar esferas de aproximadamente 900 um de diâmetro adequadas para cultura in vitro 35 . Velocidades de rotação mais elevadas e menores concentrações de alginato levará a diâmetros de talão médios mais baixos, conforme descrito nas publicações anteriores 25 , 32 . Mudanças ligeiras na geometria do impulsor e do vaso, bem como propriedades de alginato podem afetar muito o diâmetro médio do talão. Para cada alteração na configuração da embarcação ou no lote de alginato, deve ser gerada uma curva padrão que relaciona o diâmetro da ponta média do momento da superfície com a velocidade de rotação 32 . - Inicie o temporizador e emulsionar o alginato durante 12 min.
- Adicione 10 mL de tEle óleo e solução de ácido acético para acidificar a emulsão, dissolver o CaCO 3 e, portanto, reticular fisicamente o alginato em pérolas geladas. Permitir 8 minutos para este passo de acidificação.
3. Recuperação de grânulos
- Reduza a taxa de agitação para 400 rpm. Adicione 40 mL de tampão de processo misturado com 10% de meio para aumentar o pH e causar inversão de fase.
- Pare a agitação 1 minuto depois e transfira a mistura para tubos de centrífuga de 50 mL. Enxaguar o frasco com um meio adicional de 20 mL e adicioná-lo ao tubo. Aspirar a maior quantidade possível de fase aquosa do frasco de centrifugação antes de aspirar a fase de óleo para minimizar o contato do talão com a fase de óleo.
NOTA: use uma pipeta de grande diâmetro ( por exemplo, uma pipeta de 25 mL) nesta etapa e a partir deste ponto para evitar danificar as contas. Para volumes menores, a suspensão do talão também pode ser manipulada com pontas de pipeta cortadas. Para obter essas dicas, corte o fim da ponta da pipeta com tesoura whIle usando proteção para os olhos - Centrifugue os tubos por 3 minutos a 630 xg para acelerar a sedimentação e a separação de feixes.
- Remova o óleo e o excesso de solução aquosa aspirando com uma pipeta Pasteur.
- Lave as contas pelo menos uma vez com meio. Filtre a suspensão de talão em filtros de células de nylon de 40 μm e aspirar o excesso de líquido associado com as contas abaixo do filtro. Transfira as contas para um volume conhecido de meio usando uma espátula estéril.
NOTA: filtros mais pequenos ou maiores de tamanho de poro podem ser usados nesta etapa, dependendo do diâmetro mínimo do talão do alvo. No entanto, recomenda-se filtração por gravidade em vez de filtração por pressão através de filtros de tamanho de poro sub-micron para evitar danificar as esferas. - Medir o volume do grânulo por deslocamento do volume (volume após a adição das pérolas, menos o volume antes da adição das esferas) e completar o meio para obter o grânulo desejado: razão do volume total, que é tipicamente 1: 5 ou 1 mL em contas4 mL de meio. A partir deste ponto, use sempre pipetas de grande diâmetro para evitar danificar as contas.
- Transfira as células encapsuladas para frascos T para experiências de cultura ou transplante in vitro .
4. Controle de Qualidade e Aplicações
NOTA: Para garantir a qualidade encapsulada de células e grânulos, a distribuição do tamanho do talão e a sobrevida celular após o processo devem ser quantificadas. Inverter o gel para recuperar as células dentro das contas para análise posterior é comumente executado.
- Para avaliar a distribuição do tamanho do talão, coloque as contas com azul de toluidina.
- Coloque bolinhas de 0,5 mL em 4 mL de tampão de processo contendo 10% de meio completo.
- Adicionar 500 μL de uma solução de 1 g / L de toluidina preparada em tampão de processo.
- Incube durante 60 minutos num tubo cónico em um agitador rotativo a 50 rpm.
- Adicione 5 mL de tampão de processo contendo 10% de meio completo e immedTransfira imediatamente os grânulos e a solução para uma placa de Petri e adquira imagens em um microscópio de baixa ampliação ou usando uma câmera digital portátil. Se necessário, coloque a placa de Petri em uma caixa de luz antes de adquirir imagens com uma câmera de mão para aumentar o contraste e evitar sombras.
- Execute a análise da imagem para quantificar a distribuição do tamanho do talão como descrito anteriormente 32 , por exemplo usando o freeware de análise de imagem 36 .
- Para avaliar qualitativamente a sobrevida celular, coloque as células usando homodímero de etídio para identificar células mortas e AM de calceína para identificar células vivas.
- Adicione 1 volume de pérolas a 4 volumes de buffer de processo contendo 10% de meio completo.
- Adicione a quantidade apropriada de soluções de reserva de calceína AM e de homidimidio de etidio para obter concentrações de 4 μM e 2 μM, respectivamente. Gerar controles de mancha simples, adicionando apenas um dos reagentes a algumas amostras de grânulos.
- Incubar as contas em gelo durante 20 min.
- Coloque a solução entre um slide e lamínula usando um espaçador, como um o-ring para evitar a compressão das pérolas.
- Proceda ao microscópio de fluorescência. Use os controles de mancha simples para avaliar o fluxo de fluorescência. Selecione filtros de fluorescência apropriados com base nos comprimentos de onda de excitação / emissão associados com calceína AM (494/517 nm) e homodímero de etidio ligado ao DNA (528/617 nm).
- Para recuperar as células das contas para análise posterior, desenrolar o alginato usando citrato ou outra solução quelante.
- Preparar uma solução desgastante contendo citrato 55 mM, HEPES 10 mM e NaCl 95 mM a pH 7,4.
- Misture esta solução com 10% de meio e, em seguida, adicione 1 mL de pérolas de alginato a 9 mL da mistura.
- Degel as contas em gelo com 75 rpm de agitação durante 20 min.
NOTA: As células podem agora ser usadas para análise ou removidas da solução de alginato desengorduradoPor centrifugação. Por exemplo, a viabilidade celular após desfoliamento pode ser quantificada por coloração com Trypan Blue. Alternativamente, as células podem ser centrifugadas e lavadas, seguidas por amostragem e análise de mRNA, DNA e / ou proteína.
Access restricted. Please log in or start a trial to view this content.
Resultados
No final do processo de emulsão e gelificação interna, um volume de talão semelhante ao volume inicial da mistura de alginato e célula deve ser recuperado. As contas devem ser altamente esféricas com alguns defeitos ( Figura 3 ). As pérolas devem ser suficientemente resistentes para resistir a pipetagem através de pipetas de grande diâmetro. A altas concentrações de alginato, gotas de óleo ou ar encapsuladas podem ser observadas nas pérola...
Access restricted. Please log in or start a trial to view this content.
Discussão
Várias etapas (representadas na Figura 2 ) durante a reação de gelificação interna podem limitar a cinética geral. Para grãos de carbonato de cálcio maiores do que ~ 2,5 μm, a taxa de dissolução do carbonato mostrou ser de 26 , 44 de limitação de taxa. O passo de acidificação que leva à liberação interna de cálcio também mostrou ser a variável do processo crítico que afeta a sobrevivência celular
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Agradecemos a Jill Osborne por seu trabalho de colocação no processo de emulsão e Lauren Wilkinson para suporte técnico. Agradecemos ao Dr. Igor Laçik, ao Dr. Timothy J. Kieffer e ao Dr. James D. Johnson por sua contribuição e colaboração. Agradecemos ao Diabète Québec, à JDRF, à ThéCell, ao Centro Quebécois sobre os Materiais Funais (CQMF), ao Conselho de Pesquisa em Ciências Naturais e Engenharia (CRSNG), ao Centro de Transplante de Ilhotas Humanas e à Regeneração de Células Beta, a Rede Canadense de Células-Tronco, a Fundação Michael Smith para Pesquisa em Saúde, os Fundos de pesquisa da pesquisa e a tecnologia e o COST 865 para apoio financeiro.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
Referências
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes--a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O'Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli's cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15(2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E. 3rd, Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , University of British Columbia. (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100(2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels - a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M. Immobilized Cells. Wijffels, R. H. , Springer. Berlin Heidelberg. 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados