Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Encapsulación de células de mamífero en perlas de alginato usando un recipiente agitador simple
En este artículo
Resumen
Este video y el manuscrito describen un método basado en emulsión para encapsular células de mamífero en perlas de alginato al 0,5% al 10% que se pueden producir en grandes lotes usando un simple recipiente agitado. Las células encapsuladas pueden cultivarse in vitro o trasplantarse para aplicaciones de terapia celular.
Resumen
La encapsulación celular en perlas de alginato se ha utilizado para cultivo celular inmovilizado in vitro así como para inmunoisolación in vivo . La encapsulación de islotes pancreáticos se ha estudiado extensamente como un medio para aumentar la supervivencia de los islotes en trasplantes alogénicos o xenogénicos. La encapsulación de alginato se alcanza comúnmente por extrusión de boquillas y gelificación externa. Usando este método, las gotitas de alginato que contienen células formadas en la punta de las boquillas caen en una solución que contiene cationes divalentes que causan gelación ionotrópica de alginato a medida que difunden en las gotitas. El requisito para la formación de gotitas en la punta de la boquilla limita el rendimiento volumétrico y la concentración de alginato que se pueden conseguir. Este video describe un método de emulsificación escalable para encapsular células de mamífero en alginato al 0,5% al 10% con una supervivencia celular del 70% al 90%. Mediante este método alternativo, las gotitas de alginato que contienen células y carbonato de calcio se emulsionan en aceite mineral, folPor una disminución del pH que conduce a la liberación interna de calcio ya la gelificación de alginato ionotrópico. El método actual permite la producción de perlas de alginato dentro de los 20 minutos de la emulsificación. El equipo requerido para la etapa de encapsulación consiste en recipientes agitados simples disponibles para la mayoría de los laboratorios.
Introducción
La encapsulación de células de mamífero se ha estudiado ampliamente como medio para proteger las células trasplantadas del rechazo inmune 1 o para proporcionar un soporte tridimensional para el cultivo celular inmovilizado 2 , 3 , 4 . El encapsulado de islotes pancreáticos en perlas de alginato se ha utilizado para revertir la diabetes en roedores alogénicos 5 , 6 o xenogénicos 7 , 8 , 9 , 10 , 11 , 12 . Los ensayos clínicos y preclínicos del trasplante de islotes pancreáticos encapsulados para tratar la diabetes tipo 1 están en curso 13 , 14 , 15 . Para aplicaciones de trasplante o de mayor escalaE la producción de células inmovilizadas in vitro , generalmente se utilizan generadores de perlas basados en boquillas. Típicamente, se bombea una mezcla de alginato y células a través de una boquilla para formar gotitas que caen en una solución agitada que contiene cationes divalentes, dando como resultado la gelificación externa de las gotitas. El flujo de gas coaxial 16 , 17 , la vibración de boquilla 18 , la repulsión electrostática 19 o los hilos giratorios 20 facilitan la formación de gotitas en la punta de la boquilla.
Los inconvenientes principales de los generadores de talón convencionales son su capacidad de producción limitada y el intervalo limitado de viscosidades en solución que darán lugar a una formación adecuada de talones 21 . A caudales elevados, el fluido que sale de la boquilla se rompe en gotitas más pequeñas que el diámetro de la boquilla, disminuyendo el control del tamaño. Se pueden utilizar generadores de bolas de boquillas múltiples para aumentar el rendimiento, peroLa distribución uniforme del flujo entre las toberas y el uso de soluciones> 0,2 Pas es problemático 22 . Por último, se espera que todos los dispositivos basados en boquillas impongan algún daño a los islotes, ya que el diámetro de las boquillas utilizadas está entre 100 μm y 500 μm, mientras que el ~ 15% de los islotes humanos puede ser mayor de 200 μm 23 .
En este video, describimos un método alternativo para encapsular células de mamífero formando gotitas en una única etapa de emulsificación en lugar de gota a gota. Dado que la producción de perlas se realiza en un recipiente de agitación simple, el método es adecuado para una producción pequeña (~ 1 ml) a gran escala (10 3 L) con costes de equipo reducidos 24 . Este método permite la producción de perlas con alta esfericidad usando una amplia gama de viscosidades de alginato con tiempos de generación cortos ( por ejemplo, 20 min). Este método fue desarrollado originalmente por Poncelet et aL 25 , 26 y se usan para inmovilizar el ADN 27 , las proteínas 28 incluyendo la insulina 29 y las bacterias 30 . Recientemente hemos adaptado estos métodos a la encapsulación de células de mamíferos utilizando líneas de células beta pancreáticas 31 , 32 y tejido pancreático primario 32 .
El principio del método es generar una emulsión agua-en-aceite que consiste en gotitas de alginato en aceite mineral, seguida de gelificación interna de las gotitas de alginato ( Figura 1 ). En primer lugar, el encapsulante ( por ejemplo, células) se dispersa en una solución de alginato que contiene una sal de calcio de grano fino con baja solubilidad al pH del proceso inicial. A continuación se añade la mezcla de alginato a una fase orgánica agitada para crear una emulsión, usualmente en presencia de unTensioactivo. En el caso de la encapsulación de células de mamífero, los componentes presentes en el suero pueden actuar como tensioactivos. A continuación, se reduce el pH con el fin de solubilizar la sal de calcio añadiendo un ácido soluble en aceite que divide en la fase acuosa. El ácido acético, con un coeficiente de reparto de aceite mineral / agua <0,005 33 , debe ser pre-disuelto en aceite, luego se agrega a la emulsión donde se mezcla en la fase oleosa y se divide rápidamente en la fase acuosa 34 . La Figura 2 ilustra las reacciones químicas y la difusión que tienen lugar durante la etapa de acidificación y gelificación interna. Finalmente, las células encapsuladas se recuperan mediante inversión de fase, separación de fases acelerada por centrifugación, etapas de lavado repetidas y filtración. Estos pasos pueden ser seguidos por muestreo de cuentas y células para análisis de control de calidad, cultivo celular in vitro y / o transplante de las células encapsuladas.
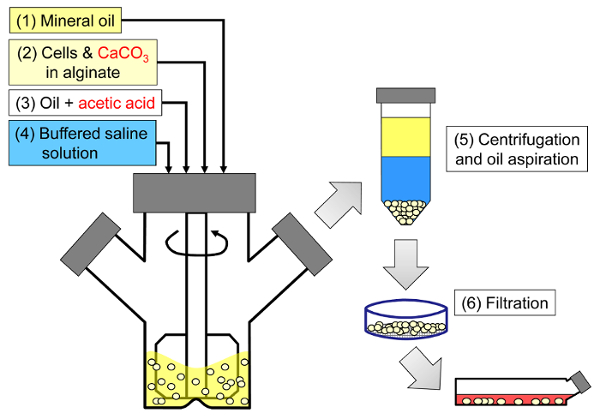
Figura 1: Esquema del proceso basado en emulsificación para encapsular células de mamífero. Las perlas se producen primero emulsionando un alginato, una célula y una mezcla de CaCO3 en aceite mineral (pasos 1 y 2 en el esquema), desencadenando la gelificación interna añadiendo ácido acético (paso 3). Las perlas gelificadas se separan después del aceite mediante la adición de un tampón acuoso para activar la inversión de fase (etapa 4), seguido de centrifugación y aspiración de aceite (etapa 5), y después filtración (etapa 6). Finalmente, las perlas recogidas en el filtro se transfieren al medio de cultivo celular para cultivo in vitro o para trasplante. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Reacciones y etapas de difusión que ocurren durante la gelificación interna. (1) Se añade ácido acético a la fase orgánica y se transporta a las gotitas de alginato por convección. (2) El ácido acético se divide en la fase acuosa. (3) En presencia de agua, el ácido se disocia y difunde hasta alcanzar los granos de CaCO3 representados en azul oscuro. (4) Los iones H + se intercambian con los iones Ca 2+ en CaCO 3 , liberando iones Ca 2+ . (5) Los iones de calcio se difunden hasta que encuentran alginato sin reaccionar, dando lugar a la reticulación ionotrópica de las cadenas de alginato. Haga clic aquí para ver una versión más grande de esta figura.
Contrariamente a los encapsuladores convencionales de celdas basadas en boquillas, una amplia distribución de tamaño de cordón es expeCitado a partir de este proceso debido al mecanismo de formación de gotitas en emulsificación agitada. Para un subconjunto de aplicaciones, esta distribución de tamaño de talón puede ser problemática. Por ejemplo, una fracción mayor de células puede estar expuesta en la superficie del cordón en perlas más pequeñas. Si las limitaciones de nutrientes ( por ejemplo, oxígeno) son una preocupación, estas limitaciones pueden exacerbarse en cuentas más grandes. Una ventaja del método de emulsión agitado es que el tamaño medio del cordón se puede ajustar fácilmente cambiando la velocidad de agitación durante la etapa de emulsión. La amplia distribución del tamaño del cordón también puede explotarse para estudiar el efecto del tamaño del cordón sobre el rendimiento de las células encapsuladas.
La encapsulación de las células de los mamíferos por emulsificación y gelificación interna es una alternativa interesante para los laboratorios que no están equipados con un generador de bolas. Además, este método ofrece a los usuarios la opción de reducir el tiempo de procesamiento, o generar perlas a muy bajo o muy alto concentrado de alginatoAciones.
El protocolo descrito a continuación describe cómo encapsular células en 10,5 ml de solución de alginato al 5% preparada en tampón de ácido 4- (2-hidroxietil) -1-piperazinoetanosulfónico (HEPES) 10 mM. El alginato consiste en una mezcla 50:50 de LVM de grado de trasplante (contenido de ácido manurónico alto en baja viscosidad) y alginato MVG (contenido de ácido gulurónico alto contenido en viscosidad media). Se utiliza carbonato de calcio a una concentración final de 24 mM como agente reticulante físico. El aceite mineral ligero constituye la fase orgánica, mientras que el ácido acético se utiliza para acidificar la emulsión y desencadenar la gelificación interna. Sin embargo, el tipo y composición de alginato, así como el tampón de proceso seleccionado dependen de la aplicación deseada 32 . Se ha utilizado una variedad de tipos de alginato (véase Tabla de materiales) para producir perlas con este protocolo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparar la Solución de Alginato, la Suspensión de CaCO3 y el Aceite Acidificado
- Prepare el buffer de proceso y el medio.
- Prepare el tampón de proceso típico usado para generar perlas de alginato de alta concentración utilizando HEPES 10 mM, NaCl 170 mM. Ajuste el pH a 7.4.
- Preparar el medio de cultivo típico usando Medio de Eagle Modificado de Dulbecco (DMEM) que contiene suero bovino fetal al 10% (FBS), glutamina 6 mM, penicilina 100 U / mL y estreptomicina 100 mg / ml.
- Preparar la solución madre de alginato a 1,17 veces la concentración final deseada en las perlas.
- Primero, pesa la cantidad apropiada de polvo de alginato. Por ejemplo, para obtener una concentración final de alginato al 5% con LVM 50:50 y alginato MVG, se pesan un total de 1,17 g de alginato sódico combinando 0,583 g de polvo de alginato LVM y 0,583 g de polvo de alginato MVG.
- Coloque 20 ml de buffer de proceso en un autocJarra de vidrio lavable en una placa de agitación magnética y agitar a ~ 200 rpm. Añadir progresivamente el polvo de alginato de sodio a la solución.
- Dejar la solución agitando durante una noche a baja velocidad. Si es necesario, sujete el matraz a la placa de agitación.
- Si la disolución se disuelve incompletamente, fije la botella en un mezclador rotatorio y continúe mezclando a 37 ° C durante 24 h adicionales.
- Esterilizar la solución de alginato en autoclave la solución durante 30 min en un recipiente que está a menos de la mitad llena. Deje que la temperatura disminuya por debajo de 60 ° C antes de recuperar la solución.
- Si es necesario, eliminar las partículas por filtración de la solución de alginato poco después de autoclave antes de que alcance la temperatura ambiente, mientras que la viscosidad se mantiene lo suficientemente bajo.
- Preparar la suspensión de carbonato de calcio a 21 veces la concentración final deseada para la gelificación interna.
- Pesar el polvo de CaCO3. Por ejemplo, anuncioD 1 g de CaCO $ ₃ $ a 20 ml de tampón de proceso para obtener CaCO $ ₃ $ 24 mM como la concentración final del agente gelificante.
- Autoclave la suspensión de CaCO 3 durante 30 min.
NOTA: La concentración de CaCO3 cambiará con el tiempo debido al equilibrio bicarbonato - CO 2 . Evite usar la misma suspensión de CaCO 3 para más de 10 procedimientos de encapsulación.
- Autoclave el recipiente de agitación utilizado para el proceso de emulsión. Antes de usar, retire cualquier traza de agua condensada que quede en el matraz de centrifugado.
- Inmediatamente antes del proceso de emulsión, preparar el aceite acidificado. Disolver 44 μl de ácido acético por 11 ml de aceite mineral colocado en un tubo cónico de 50 ml.
NOTA: Un error común es la disolución incompleta del ácido acético. Evite pipetear pequeñas cantidades de ácido acético y asegúrese de que el ácido acético esté completamente disuelto en el aceite por vórtex repetido.
PRECAUCIÓN: el ácido acético es tóxico D ácido volátil. Manejar este reactivo bajo una campana extractora y mantener la solución de ácido acético / aceite en un recipiente cerrado hasta la etapa de emulsificación. Consulte la información de MSDS de este reactivo para obtener más información. - Permita que todas las soluciones alcancen la temperatura ambiente antes de proceder a la encapsulación celular.
2. Generación de perlas de alginato por emulsificación y gelificación interna
- Coloque 10 ml de aceite mineral ligero en el matraz giratorio y comience a agitar a una velocidad de rotación baja ( por ejemplo, 250 rpm para el matraz giratorio usado en este video).
- Si las células usadas para el proceso son de cultivos adherentes, aplique tripsina para suspender las células. Termine la reacción añadiendo medio que contenga FBS o inhibidor de tripsina y recoja una muestra para la enumeración celular.
- Determine la concentración celular y la viabilidad después de la tinción con azul tripán utilizando un hemocitómetro o un contador de células automatizado, como se ha descrito anteriormenteAss = "xref"> 32.
- Centrifugar las células durante 7 min a 300 xg y lavarlas una vez en el medio deseado para la inmovilización celular. Asegúrese de que este medio contenga emulsionantes tales como FBS o albúmina de suero bovino (BSA). Por ejemplo, use DMEM que contenga FBS al 10%.
- Se vuelve a suspender el sedimento celular en el mismo medio para obtener 10,5 veces la concentración final deseada en las perlas.
- Añadir 1,1 ml de la población celular concentrada de 10,5 veces a 9,9 ml de la solución de alginato. Luego, agregue 550 μl de suspensión de CaCO3 y mezcle agitando con una espátula estéril para asegurar una distribución uniforme del CaCO3.
- Transfiera inmediatamente 10,5 ml de la mezcla de alginato, célula y CaCO3 en el aceite de agitación usando una jeringa.
NOTA: Para soluciones altamente viscosas, aspirar y expulsar la mezcla muy lentamente para evitar burbujas de aire. En algunos casos, es preferible detener la agitación mientras se añade la mezcla al matraz para evitarAlginato en el eje del impulsor. - Inmediatamente después de añadir el alginato, la célula y la mezcla de CaCO3 al aceite, aumentar la velocidad de agitación.
NOTA: Para el alginato LVM: MVG al 5% utilizado aquí, se aplicó una velocidad de rotación de 1025 rpm para generar perlas de aproximadamente 900 μm de diámetro adecuadas para cultivo in vitro 35 . Velocidades de rotación más altas y concentraciones más bajas de alginato conducirán a diámetros medios de perlas más bajos, como se describe en publicaciones anteriores 25 , 32 . Cambios leves en la geometría del impulsor y del recipiente, así como las propiedades del alginato pueden afectar grandemente el diámetro medio del grano. Para cada cambio en la configuración del recipiente o en el lote de alginato, debería generarse una curva estándar que relaciona el diámetro medio del talón del área superficial con la velocidad de rotación 32 . - Iniciar el temporizador y emulsionar el alginato durante 12 min.
- Añadir 10 ml de tEl aceite y la solución de ácido acético para acidificar la emulsión, disolver el CaCO3 y por lo tanto reticular físicamente el alginato en perlas gelificadas. Deje 8 min para esta etapa de acidificación.
3. Recuperación del grano
- Reducir la velocidad de agitación a 400 rpm. Añadir 40 mL de tampón de proceso mezclado con un 10% de medio para aumentar el pH y causar la inversión de fase.
- Parar la agitación 1 min después y transferir la mezcla a tubos de centrífuga de 50 ml. Enjuague el frasco giratorio con un medio adicional de 20 ml y agregue esto al tubo. Aspirar tanta fase acuosa como sea posible desde el matraz girador antes de aspirar la fase de aceite para minimizar el contacto del talón con la fase oleosa.
NOTA: Utilice una pipeta de gran calibre ( por ejemplo, una pipeta de 25 ml) en este paso y desde este punto para evitar dañar las perlas. Para volúmenes más pequeños, la suspensión del talón también se puede manipular con puntas de pipeta cortadas. Para obtener tales puntas, corte el extremo de la punta de la pipeta con las tijeras whProtección del ojo que usa. - Centrifugar los tubos durante 3 min a 630 xg para acelerar la sedimentación del grano y la separación de fases.
- Eliminar el aceite y el exceso de solución acuosa por aspiración con una pipeta Pasteur.
- Lave las perlas al menos una vez con el medio. Filtrar la suspensión de perlas en filtros de células de nylon de 40 μm, y aspirar el exceso de líquido asociado con las perlas desde debajo del filtro. Transferir las perlas en un volumen conocido de medio utilizando una espátula estéril.
NOTA: En este paso se pueden usar filtros de tamaño de poro más pequeño o más grande, dependiendo del diámetro mínimo del talón objetivo. Sin embargo, se recomienda la filtración por gravedad en lugar de filtración por presión a través de filtros de tamaño de poro submicrónicos para evitar dañar las perlas. - Medir el volumen de la perla por volumen (volumen después de añadir las perlas, menos el volumen antes de añadir las perlas) y recargar el medio para obtener la proporción deseada de perlas: volumen total, que es típicamente de 1: 5 o 1 ml de perlas en4 ml de medio. A partir de este punto, utilice siempre pipetas de gran diámetro para evitar dañar las perlas.
- Transferir las células encapsuladas en frascos T para el cultivo in vitro o experimentos de trasplante.
4. Control de Calidad y Aplicaciones
NOTA: Con el fin de garantizar la calidad de las células y los granos encapsulados, se debe cuantificar la distribución del tamaño del cordón y la supervivencia celular después del proceso. La inversión del gel para recuperar las células desde dentro de las perlas para un análisis posterior se realiza comúnmente.
- Para evaluar la distribución del tamaño del cordón, se tiñen las perlas con azul de toluidina-O.
- Se colocan 0,5 ml de perlas en 4 ml de tampón de proceso que contiene un 10% de medio completo.
- Añadir 500 μl de una solución de azul de toluidina 1 g / L preparada en tampón de proceso.
- Incubar durante 60 minutos en un tubo cónico en un agitador rotatorio a 50 rpm.
- Añadir 5 ml de tampón de proceso que contiene 10% de medio completo e immedInmediatamente transferir las perlas y la solución en una placa de Petri y adquirir imágenes en un microscopio de baja ampliación o utilizando una cámara digital de mano. Si es necesario, coloque la placa de Petri en una caja de luz antes de adquirir imágenes con una cámara de mano para mejorar el contraste y evitar las sombras.
- Realizar el análisis de imagen para cuantificar la distribución de tamaño de talón como se describió anteriormente 32 , por ejemplo utilizando el análisis de imágenes freeware [ 36] .
- Para evaluar cualitativamente la supervivencia celular, se tiñen las células usando homodímero de etidio para identificar células muertas y calceína AM para identificar células vivas.
- Añadir 1 volumen de perlas a 4 volúmenes de tampón de proceso que contiene 10% de medio completo.
- Se añade la cantidad apropiada de soluciones madre de calceína AM y de homodímero de etidio para obtener concentraciones de 4 μM y 2 μM, respectivamente. Genere controles de manchas individuales añadiendo sólo uno de los reactivos a algunas muestras de perlas.
- Incubar las perlas en hielo durante 20 min.
- Coloque la solución entre una diapositiva y un cubreobjetos usando un espaciador tal como una junta tórica para evitar comprimir las perlas.
- Proceder a la microscopía de fluorescencia. Utilice los controles de una sola mancha para evaluar el sangrado de fluorescencia. Seleccione filtros de fluorescencia apropiados basados en las longitudes de onda de excitación / emisión asociadas con calceína AM (494/517 nm) y homodímero de etidio unido a ADN (528/617 nm).
- Para recuperar las células de las perlas para un análisis posterior, se descomprime el alginato usando citrato u otra solución quelante.
- Preparar una solución de degelación que contenga citrato 55 mM, HEPES 10 mM y NaCl 95 mM a pH 7,4.
- Mezclar esta solución con medio al 10%, y luego agregar 1 ml de perlas de alginato a 9 ml de la mezcla.
- Degel las perlas en hielo con 75 rpm de agitación durante 20 min.
NOTA: Las células pueden ahora ser usadas para análisis o eliminadas de la solución de alginato desgomadoIon por centrifugación. Por ejemplo, la viabilidad celular después de la degelación puede cuantificarse mediante tinción con azul de tripán. Alternativamente, las células pueden centrifugarse y lavarse, seguido por mRNA, ADN y / o muestreo y análisis de proteínas.
Access restricted. Please log in or start a trial to view this content.
Resultados
Al final del proceso de emulsificación y gelificación interna, se debe recuperar un volumen de perlas similar al del alginato inicial y al volumen de la mezcla celular. Las cuentas deben ser muy esféricas con pocos defectos ( Figura 3 ). Las perlas deben ser suficientemente fuertes para soportar la pipeteado a través de pipetas de gran calibre. A altas concentraciones de alginato, se pueden observar gotas de aceite o aire encapsuladas en las perlas...
Access restricted. Please log in or start a trial to view this content.
Discusión
Varias etapas (representadas en la Figura 2 ) durante la reacción de gelificación interna pueden limitar la cinética global. Para los granos de carbonato cálcico mayores de ~ 2,5 μm, se ha demostrado que la velocidad de disolución del carbonato es limitante de la velocidad 26 , 44 . La etapa de acidificación que conduce a la liberación interna de calcio también ha demostrado ser la variable crítica del proceso q...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Damos las gracias a Jill Osborne por su trabajo de puesta a tierra en el proceso de emulsificación y Lauren Wilkinson para el apoyo técnico. Agradecemos al Dr. Igor Laçik, al Dr. Timothy J. Kieffer y al Dr. James D. Johnson por su contribución y colaboración. Agradecemos a Diabète Québec, a la JDRF, a ThéCell, al Centro de Investigación en Ciencias Naturales e Ingeniería (CRSNG), al Centro para el Trasplante de Islotes Humanos y la Regeneración de Células Beta, la Red Canadiense de Células Madre, Fundación Michael Smith para la Investigación en Salud, el Fondo québécois de la investigación sobre la naturaleza y las tecnologías y COST 865 para apoyo financiero.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
Referencias
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes--a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O'Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli's cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15(2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E. 3rd, Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , University of British Columbia. (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100(2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels - a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M. Immobilized Cells. Wijffels, R. H. , Springer. Berlin Heidelberg. 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados