JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
간단한 교반 용기를 사용하여 알긴산 염 비즈에서 포유류 세포 캡슐화
요약
이 동영상과 원고는 단순 교반 용기를 사용하여 큰 배치로 생산할 수있는 0.5 % ~ 10 % 알긴산 염 비즈로 포유류 세포를 캡슐화하는 유제 기반 방법을 설명합니다. 캡슐화 된 세포는 시험 관내에서 배양 되거나 세포 치료 응용을 위해 이식 될 수 있습니다.
초록
알기 네이트 비드에서의 세포 캡슐화는 시험 관내 뿐만 아니라 생체 내 면역 분리 를 위해 고정화 된 세포 배양 에 사용되어왔다. 췌도 소포 캡슐화는 동종 또는 이종 이식에서 랑게르한 생존을 증가시키는 수단으로서 광범위하게 연구되어왔다. 알지네이트 캡슐화는 일반적으로 노즐 압출 및 외부 겔화에 의해 달성됩니다. 이 방법을 사용하여, 노즐의 끝에 형성된 세포 함유 알지네이트 물방울은 물방울로 확산 될 때 이온 성 알지네이트 겔화를 유발하는 2가 양이온을 함유하는 용액에 빠지게된다. 노즐 팁에서의 액적 생성에 대한 요구는 용적 처리량 및 달성 될 수있는 알긴산 염 농도를 제한한다. 이 비디오는 포유류 세포를 70 % ~ 90 %의 세포 생존율을 갖는 0.5 %에서 10 %의 알지네이트로 캡슐화하는 확장 가능한 유화 방법을 설명합니다. 이 대체 방법에 의해, 세포 및 탄산 칼슘을 함유하는 알긴산 방울을 미네랄 오일,내부 칼슘 방출 및 이온 성 알기 네이트 겔화를 유도하는 pH의 감소로 낮아진다. 현재 방법은 유화 20 분 이내에 알지네이트 구슬의 생산을 허용합니다. 캡슐화 단계에 필요한 장비는 대부분의 실험실에서 사용할 수있는 단순 교반 용기로 구성됩니다.
서문
포유류 세포 캡슐화는 면역 거부 반응으로부터 이식 된 세포를 보호하거나 고정화 된 세포 배양을위한 3 차원 지지체를 제공하는 수단으로 광범위하게 연구되어왔다 2 , 3 , 4 . 알지네이트 구슬의 췌장 섬모 캡슐화는 동종 제 5 , 6 또는 이종 동물 7 , 8 , 9 , 10 , 11 , 12 개의 설치류에서 당뇨병을 역전시키는 데 사용되었습니다. 제 1 형 당뇨병을 치료하기위한 캡슐화 된 췌도 이식의 전임상 시험과 임상 시험이 진행 중이다 ( 13 , 14 , 15) . 이식 용도 또는보다 큰 규모의 경우체외 고정화 세포 생산, 노즐 기반 비드 발생기가 일반적으로 사용됩니다. 전형적으로, 알지네이트와 세포의 혼합물은 노즐을 통해 펌핑되어 2가 양이온을 함유하는 진탕 된 용액에 떨어지는 액 적이 형성되어 액적의 외부 겔화를 일으킨다. 동축 가스 흐름 ( 16 , 17) , 노즐 진동 ( 18) , 정전 반발력 ( 19) 또는 회전 와이어 ( 20) 는 노즐 팁에서 액적 형성을 용이하게한다.
기존의 비드 발생기의 주요 단점은 제한된 처리량과 적절한 비드 형성을 가져 오는 용액 점도 범위가 제한된다는 것입니다. 높은 유속에서, 노즐을 빠져 나가는 유체는 노즐 직경보다 작은 방울로 분열되어 크기 조절을 감소시킵니다. 다중 노즐 비드 발생기를 사용하여 처리량을 늘릴 수 있지만노즐 사이의 균일 한 유량 분포와 용액의 사용> 0.2 Pas는 문제가있다. 마지막으로 모든 노즐 기반 장치는 사용되는 노즐의 직경이 100 μm와 500 μm 사이 인 반면 섬의 ~ 15 %는 200 μm보다 클 수 있기 때문에 섬에 약간의 손상을 줄 것으로 예상됩니다 23 .
이 비디오에서는 드롭 다운 드롭 대신 단일 유화 단계에서 드롭 릿을 형성하여 포유류 세포를 캡슐화하는 대체 방법에 대해 설명합니다. 비드 생산이 간단한 교반 용기에서 수행되기 때문에,이 방법은 장비 비용이 저렴한 (~ 1 mL)에서 대규모 (10 3 L 범위) 비드 생산에 적합합니다. 이 방법은 비드 생성 시간이 짧은 ( 예 : 20 분) 넓은 알긴산 점도를 사용하여 구형도가 높은 비드를 생산할 수 있습니다. 이 방법은 원래 Poncelet et al에 의해 개발되었다 .엘. 25 , 26 및 DNA 27 , 인슐린 29 및 박테리아 30을 포함한 단백질 28 을 고정시키는 데 사용되었습니다. 우리는 최근에 췌장 베타 세포주 31 , 32 및 일차 췌장 조직 32를 사용하여 포유 동물 세포의 캡슐화에 이러한 방법을 적용했습니다.
이 방법의 원리는 미네랄 오일에 알지네이트 방울로 구성된 유 중수 에멀젼을 생성 한 다음 알긴산 방울을 내부 겔화시키는 것입니다 ( 그림 1 ). 먼저, 봉입 제 ( 예 : 세포)는 초기 공정 pH에서 낮은 용해도를 갖는 미세 입자 칼슘 염을 함유하는 알긴산 염 용액에 분산된다. 이어서 알긴산 염 혼합물을 교반 된 유기상에 첨가하여 보통 에멀젼의 존재하에 에멀젼을 생성시킨다.계면 활성제. 포유 동물 세포 캡슐화의 경우, 혈청에 존재하는 성분은 계면 활성제로 작용할 수 있습니다. 다음으로, 수성 상으로 분할되는 유용성 산을 첨가함으로써 칼슘 염을 가용화시키기 위해 pH를 감소시킨다. 미네랄 오일 / 물 분배 계수가 <0.005 33 인 초산은 오일에 미리 용해시킨 다음에 유상에 첨가하여 유상에 혼합하고 신속하게 수성 상에 분배한다. 그림 2 는 산성화 및 내부 겔화 단계에서 일어나는 화학 반응과 확산을 보여줍니다. 마지막으로, 캡슐화 된 세포는 상 전이, 원심 분리에 의한 상분리 촉진, 반복 된 세척 단계 및 여과에 의해 회수된다. 이러한 단계는 품질 관리 분석, 시험 관내 세포 배양 및 / 또는 캡슐화 된 세포의 이식을위한 비드 및 세포 샘플링에 의해 수행 될 수있다.
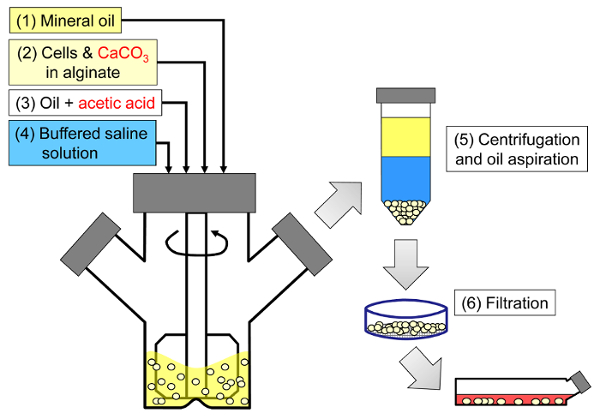
그림 1 : 포유 동물 세포를 캡슐화하는 유화 기반 공정의 개략도. 구슬은 처음에 알긴산 염, 세포 및 CaCO3 혼합물을 미네랄 오일 (도식의 1 단계와 2 단계)에 유화시켜 아세트산을 첨가하여 내부 겔화를 유발함으로써 생성됩니다 (3 단계). 이어서, 겔화 된 비드를 수성 완충액을 첨가하여 위상 반전 (단계 4), 원심 분리 및 오일 흡인 (단계 5), 및 여과 (단계 6)를 수행함으로써 오일로부터 분리 하였다. 마지막으로, 필터 상에 수집 된 비드 는 시험 관내 배양 또는 이식을 위해 세포 배양 배지로 옮겨진다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 내부 겔화 동안 일어나는 반응 및 확산 단계. (1) 아세트산은 유기상에 첨가되고 대류에 의해 알지네이트 방울로 수송된다. (2) 아세트산은 수상으로 분리된다. (3) 물의 존재 하에서, 산은 해리하고 확산되어 진한 파란색으로 묘사 된 CaCO3 입자에 이른다. (4) H + 이온은 CaCO3에서 Ca2 + 이온과 교환되어 Ca2 + 이온을 방출한다. (5) 칼슘 이온은 미 반응 알지네이트를 만나 알지네이트 사슬의 이온 결합 가교 결합을 일으킬 때까지 확산한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
종래의 노즐 기반의 세포 캡슐과는 달리, 넓은 비드 크기 분포가 얻어진다이는 교반 된 유화에서 액적 형성의 메카니즘으로 인해이 공정으로부터 유래된다. 일부 응용 프로그램의 경우이 구슬 크기 분포가 문제가 될 수 있습니다. 예를 들어, 더 큰 조각의 세포가 작은 비드의 비드 표면에 노출 될 수 있습니다. 영양소 ( 예 : 산소)의 제한이 우려된다면 큰 구슬에서는 이러한 한계가 악화 될 수 있습니다. 교반 된 유화 방법의 장점은 평균 비드 크기가 유화 단계 동안 교반 속도를 변화시킴으로써 쉽게 조절 될 수 있다는 것이다. 광범위한 비드 크기 분포는 또한 캡슐화 된 셀 성능에 대한 비드 크기의 효과를 연구하기 위해 이용 될 수 있습니다.
유화 및 내부 겔화에 의한 포유류 세포 캡슐화는 비드 발생기가 장착되지 않은 실험실에 대한 흥미로운 대안입니다. 또한,이 방법은 사용자에게 처리 시간을 줄이거 나 매우 낮은 또는 매우 높은 알긴산 염 농도에서 비드를 생성하는 옵션을 제공합니다ations.
아래에 약술 된 프로토콜은 10mM 4- (2- 하이드 록시 에틸) -1- 피페 라진 에탄 술폰산 (HEPES) 완충액에서 제조 된 5 % 알긴산 염 용액 10.5mL에 세포를 캡슐화하는 방법을 기술한다. 알지네이트는 이식 등급 LVM (낮은 점도의 높은 만 뉴론 산 함량)과 MVG (중간 점도의 높은 guluronic acid 함량) 알지네이트의 50:50 혼합물로 구성됩니다. 최종 농도 24 mM의 탄산 칼슘이 물리적 가교제로 사용됩니다. 경질 미네랄 오일은 유기상을 구성하고 아세트산은 유제를 산성화하고 내부 겔화를 유발하는 데 사용됩니다. 그러나, 알지네이트 유형 및 조성뿐만 아니라 선택된 공정 완충액은 원하는 적용 32 에 의존한다. 다양한 알지네이트 유형 (물질 표 참조)이이 프로토콜을 사용하여 비즈를 생산하는 데 사용되었습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 알긴산 염 용액, CaCO3 서스펜션 및 산성화 오일 준비
- 프로세스 버퍼와 매체를 준비하십시오.
- 10 mM HEPES, 170 mM NaCl을 사용하여 고농도 알긴산염 구슬을 생성하는 데 사용되는 일반적인 공정 완충액을 준비하십시오. pH를 7.4로 맞추십시오.
- 10 % 태아 소 혈청 (FBS), 6 MM 글루타민, 100 U / ML 페니실린, 100 MG / ML streptomycin을 포함하는 Dulbecco의 수정 독수리 매체 (DMEM)를 사용하여 전형적인 문화 매체를 준비합니다.
- 구슬의 최종 원하는 농도의 1.17 배에서 알지네이트 원액을 준비합니다.
- 먼저 알긴산 염 분말의 적절한 양을 칭량하십시오. 예를 들어, 50:50 LVM 및 MVG 알긴산 염을 함유 한 5 % 알긴산 염의 최종 농도를 얻으려면 0.583g LVM 알긴산 염 분말과 0.583g MVG 알긴산 염 분말을 합하여 총 1.17g 알긴산 나트륨을 계량하십시오.
- autoc에 20 mL 공정 완충액 넣기자석 교반 접시에 유리 용기를 넣고 ~ 200 rpm으로 교반하십시오. 이 용액에 sodium alginate powder를 점차적으로 첨가하십시오.
- 용액을 저속으로 밤새 저어 준다. 필요한 경우 플라스크를 저어 플레이트에 고정시킵니다.
- 용액이 불완전하게 용해 되었다면, 병을 회전식 혼합기에 고정시키고 37 ℃에서 추가로 24 시간 동안 혼합을 계속하십시오.
- 절반 만 채워진 용기에서 30 분 동안 용액을 고압 증기 멸균하여 알지네이트 용액을 멸균하십시오. 솔루션을 검색하기 전에 온도가 60 ° C 이하로 떨어지게하십시오.
- 필요한 경우, 점도가 충분히 낮게 유지되면서 오토 클레이브 직후에 알지네이트 용액을 실온에 도달하기 전에 여과하여 입자를 제거하십시오.
- 내부 겔화에 대한 최종 원하는 농도의 21 배로 탄산 칼슘 현탁액을 준비합니다.
- CaCO3 분말의 무게를 잰다. 예를 들어, 광고d g CaCO 3 를 20 mL 공정 완충액으로 옮겨서 최종 겔 화제 농도로서 24 mM CaCO3를 얻는다.
- 30 분 동안 CaCO3 서스펜션을 오토 클레이브하십시오.
참고 : CaCO 3 농도는 중탄산염 - CO 2 평형으로 인해 시간이 지남에 따라 변합니다. 10 캡슐화 절차 이상을 위해 동일한 스톡 CaCO3 서스펜션을 사용하지 마십시오.
- 유화 공정에 사용되는 교반 용기를 오토 클레이브합니다. 사용하기 전에 스피너 플라스크에 남아있는 응축수 흔적을 제거하십시오.
- 유화 공정 직전에 산성화 된 오일을 준비하십시오. 50 ML 원뿔 튜브에 배치 11 ML 미네랄 오일 당 44 μL 아세트산을 해산.
참고 : 일반적인 실수는 아세트산의 불완전한 용해입니다. 소량의 아세트산을 피펫 팅하지 않도록하고 아세트산이 반복적으로 볼 텍싱되어 오일에 완전히 용해되도록하십시오.
주의 : 아세트산은 독성이 있으며 휘발성 산. 이 시약을 흄 후드 아래에서 취급하고 유화 단계까지 아세트산 / 오일 용액을 밀폐 된 용기에 보관하십시오. 자세한 내용은이 시약의 MSDS 정보를 참조하십시오. - 모든 솔루션은 세포 캡슐에 진행하기 전에 실온에 도달 할 수 있습니다.
2. 유화 및 내부 겔화에 의한 알긴산염 비드 생성
- 스피너 플라스크에 10 mL의 미네랄 오일을 넣고 낮은 회전 속도 ( 예 : 이 비디오에 사용 된 스피너 플라스크의 경우 250 rpm)에서 교반을 시작하십시오.
- 과정에 사용되는 세포가 접착 성 문화의 경우 세포를 정지시키기 위해 트립신을 적용하십시오. FBS 함유 배지 또는 트립신 억제제를 첨가하여 반응을 종결시키고 세포 계수를위한 샘플을 수집한다.
- 이전에 설명한대로 hemocytometer 또는 자동 셀 카운터를 사용하여 Trypan 블루 얼룩 후 세포 농도와 생존 능력을 결정ass = "xref"> 32.
- 300 XG에서 7 분 동안 세포를 원심 분리하고 세포 고정을위한 원하는 매체에 한번 그들을 씻으십시오. 이 배지에 FBS 나 소 혈청 알부민 (BSA)과 같은 유화제가 포함되어 있는지 확인하십시오. 예를 들어 10 % FBS가 포함 된 DMEM을 사용하십시오.
- 구슬에서 원하는 최종 농도의 10.5 배를 얻기 위해 동일한 배지에서 세포 펠렛을 재현 탁하십시오.
- 9.9 mL의 알지네이트 용액에 10.5 배 농축 세포 저장 액 1.1 mL를 넣는다. 그런 다음 550 μL의 CaCO3 현탁액을 첨가하고 CaCO3가 고르게 분포되도록 살균 된 주걱으로 저어 준다.
- 즉시 알지네이트, 세포 및 CaCO 3 혼합물 10.5 mL를 주사기를 사용하여 진탕 오일에 옮긴다.
참고 : 고점도 용액의 경우 공기 방울을 피하기 위해 혼합물을 매우 천천히 흡인하고 배출하십시오. 어떤 경우에는, 플라스크에 혼합물을 첨가하는 동안 교반을 멈추는 것이 바람직하다알지네이트는 임펠러 샤프트에 동반된다. - 알지네이트, 세포 및 CaCO3 혼합물을 오일에 첨가 한 직후에 교반 속도를 증가시킨다.
참고 : 여기에 사용 된 5 % LVM : MVG 알지네이트의 경우 시험 구내 배양에 적합한 직경 약 900 μm의 구슬을 생성하기 위해 1025 rpm의 회전 속도를가했습니다. 높은 회전 속도와 낮은 알긴산 염 농도는 이전의 출판물 25 , 32 에서 설명한 것처럼 평균 구슬 직경을 줄입니다. 임펠러 및 혈관 기하학의 약간의 변화뿐만 아니라 알긴산 염의 특성은 평균 구슬 직경에 큰 영향을 줄 수 있습니다. 혈관 형상 또는 알기 네이트 로트의 각 변화에 대해, 표면적 모멘트 평균 비드 직경과 회전 속도를 관련시키는 표준 곡선이 생성되어야한다. - 타이머를 시작하고 알지네이트를 12 분 동안 유화시킵니다.
- 10 mL의 t그는 오일과 아세트산 용액을 사용하여 에멀젼을 산성화시키고, CaCO3를 용해시켜 알지네이트를 겔화 된 구슬로 물리적으로 가교 결합시킨다. 이 산성화 단계에 8 분을 허용하십시오.
3. 비드 복구
- 교반 속도를 400 rpm으로 줄입니다. 10 % 배지와 혼합 된 공정 완충액 40 mL를 첨가하여 pH를 증가시키고 상 전환을 일으킨다.
- 1 분 후 교반을 멈추고 혼합물을 50 mL 원심 분리 튜브로 옮긴다. 추가 20 ML 매체와 스피너 플라스크를 씻어 튜브에 추가합니다. 유상과의 비드 접촉을 최소화하기 위해 유상을 흡입하기 전에 스피너 플라스크에서 가능한 한 많은 수성 상을 흡인하십시오.
참고 :이 단계에서 큰 구경 피펫 ( 예 : 25 mL 피펫)을 사용하고이 시점부터 구슬이 손상되지 않도록하십시오. 소량의 경우, 비드 서스펜션은 절단 된 피펫 팁으로 조작 할 수 있습니다. 팁을 얻으려면 가위로 피펫 팁 끝 부분을 자릅니다.눈 보호 장치를 착용하십시오. - 비드 정착과 상 분리를 촉진하기 위해 630 xg에서 3 분 동안 튜브를 원심 분리하십시오.
- 파스퇴르 피펫으로 흡입하여 오일과 과도한 수용액을 제거하십시오.
- 매체로 적어도 한 번 비드를 씻으십시오. 40 μm 나일론 셀 스트레이너에서 비드 현탁액을 걸러 내고 스트레이너 아래에서 비드와 관련된 과도한 액체를 흡인하십시오. 멸균 주걱을 사용하여 매체의 알려진 볼륨에 구슬을 전송하십시오.
참고 : 목표 최소 구슬 직경에 따라이 단계에서 더 작거나 더 큰 기공 크기 필터를 사용할 수 있습니다. 그러나 구슬의 손상을 방지하기 위해 서브 마이크론 기공 크기 필터를 통한 압력 구동 여과보다는 중력 여과가 권장됩니다. - 볼륨 변위 (구슬을 추가 한 후 부피 - 구슬을 추가하기 전에 부피를 뺀 값)로 비드 부피를 측정하고 원하는 구슬 : 총 부피비 (일반적으로 1 : 5) 또는 구슬4 mL 배지. 이 시점부터 구슬이 손상되는 것을 피하기 위해 큰 보어 피펫을 사용하십시오.
- 체외 배양이나 이식 실험을 위해 캡슐화 된 세포를 T-flasks로 옮깁니다.
4. 품질 관리 및 응용
참고 : 캡슐화 된 세포 및 비드 품질을 보장하기 위해 프로세스 후의 비드 크기 분포 및 세포 생존을 정량화해야합니다. 추가 분석을 위해 비드 내에서 세포를 회수하기 위해 겔을 역전시키는 것이 일반적으로 수행된다.
- 구슬 크기 분포를 평가하기 위해 톨루이딘 블루 오로 염색합니다.
- 10 % 완전 배지가 들어있는 4 mL 공정 완충액에 0.5 mL 구슬을 넣습니다.
- 프로세스 버퍼에서 준비한 1 g / L 톨루이딘 블루 솔루션 500 μL를 추가합니다.
- 50 rpm의 회전 쉐이커 (rotary shaker)에있는 원추형 튜브에서 60 분 동안 인큐베이션한다.
- 10 % 완전 배지 및 담금질을 포함하는 5 mL 공정 완충액을 첨가한다비즈 니스 및 용액을 페트리 접시에 옮기고 저배율 현미경 또는 휴대용 디지털 카메라를 사용하여 이미지를 얻습니다. 필요한 경우 손잡이가 달린 카메라로 이미지를 획득하기 전에 페트리 접시를 밝은 상자에 올려 놓아 대비를 강화하고 그림자를 피하십시오.
- 예를 들어 이미지 분석 프리웨어 36을 사용하여 앞서 설명한 32 와 같이 비드 크기 분포를 정량화하기 위해 이미지 분석을 수행하십시오.
- 세포 생존을 정 성적으로 평가하기 위해 죽은 세포를 확인하기 위해 ethidium homodimer를 사용하고 살아있는 세포를 확인하기 위해 calcein AM을 사용하여 세포를 염색합니다.
- 10 % 완전 배지를 포함하는 4 부피의 공정 완충액에 1 부피의 비드를 첨가한다.
- calcein 오전과 에티 디움 homodimer 주식 솔루션의 적절한 금액을 각각 4 μm의와 2 μm의 농도를 얻기 위해 추가합니다. 일부 비드 샘플에 시약 중 하나만 추가하여 단일 얼룩 컨트롤을 생성하십시오.
- 20 분 동안 얼음에 구슬을 품어.
- 구슬을 압축하지 않도록 O 링과 같은 스페이서를 사용하여 슬라이드와 커버 슬립 사이에 용액을 놓습니다.
- 형광 현미경으로 진행합니다. 형광 얼룩을 평가하기 위해 단일 얼룩 조절 장치를 사용하십시오. calcein AM (494/517 nm) 및 DNA에 결합 된 ethidium homodimer (528/617 nm)와 관련된 여기 / 방출 파장을 기반으로 적절한 형광 필터를 선택하십시오.
- 추가 분석을 위해 구슬에서 세포를 복구하려면 구연산염이나 다른 chelating 솔루션을 사용하여 알지네이트를 degel.
- pH 7.4에서 55 mM 구연산염, 10 mM HEPES 및 95 mM NaCl을 포함하는 증발 용액을 준비한다.
- 이 용액을 10 % 배지와 섞은 다음, 혼합물 9 mL에 1 mL 알긴산 염 비즈를 첨가하십시오.
- 20 분 동안 75 rpm의 교반으로 얼음 위에서 구슬을 탈기시킨다.
참고 : 이제 세포를 분석에 사용하거나 degelled alginate solut에서 제거 할 수 있습니다이온. 예를 들어, degener 후 세포 생존 능력은 Trypan 블루 염색법으로 정량화 할 수 있습니다. 또는 세포를 원심 분리하고 세척 한 다음 mRNA, DNA 및 / 또는 단백질 샘플링 및 분석을 수행 할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
결과
유화 및 내부 겔화 공정이 끝나면 초기 알긴산염 및 세포 혼합물 부피와 유사한 비드 부피가 회복되어야합니다. 구슬은 결함이 거의없는 구형이어야합니다 ( 그림 3 ). 구슬은 대구경 피펫을 통해 피펫 팅을 견딜 수있을만큼 충분히 강해야합니다. 높은 알긴산 염 농도에서 캡슐화 된 오일 또는 공기 방울이 구슬에서 관찰 될 수 있습니다. 이는 유...
Access restricted. Please log in or start a trial to view this content.
토론
내부 겔화 반응 동안 다양한 단계 ( 그림 2 )가 전체 반응 속도를 제한 할 수 있습니다. ~ 2.5 μm보다 큰 탄산 칼슘 입자의 경우, 탄산염 용해 속도는 속도 제한 26 , 44 로 나타났습니다. 내부 칼슘 방출을 유도하는 산성화 단계는 또한 세포 생존에 영향을 미치는 중요한 공정 변수로도 나타났습니다 32 . 따라서 내부 겔화를 유?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
유화 공정에 대한 그녀의 토양 개발에 대한 질 오스본 (Jill Osborne)과 기술 지원에 대한 로렌 윌킨슨 (Lauren Wilkinson)에게 감사드립니다. Igor Laçik, Timothy J. Kieffer 박사 및 James D. Johnson 선생님의 의견과 협조에 감사드립니다. Diabète Québec, JDRF, ThéCell, 센터 연구 센터 (CQMF), 자연 과학 및 공학 연구위원회 (NSERC), 인간 섬 이식 및 베타 세포 재생 센터, 캐나다 줄기 세포 네트워크, 마이클 스미스 보건 연구 재단, 자금 지원에 대한 비용 및 비용 865
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
참고문헌
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes--a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O'Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli's cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15(2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E. 3rd, Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , University of British Columbia. (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100(2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels - a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M. Immobilized Cells. Wijffels, R. H. , Springer. Berlin Heidelberg. 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유