Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Alginat Boncuklarda Memeli Hücre Kapsüllenmesinin Basit Bir Karıştırılmış Geminin Kullanımı
Bu Makalede
Özet
Bu video ve el yazması memeli hücrelerini basit bir karıştırma teknesi kullanarak büyük partiler halinde üretilebilen% 0.5 ila% 10 aljinat boncuklar halinde kapsüllemek için emülsiyon temelli bir yöntemi tarif eder. Kapsüllenmiş hücreler, hücresel terapi uygulamaları için in vitro kültürlenebilir veya nakledilebilir.
Özet
Aljinat boncuklardaki hücre kapsüllemesi, in vitro immobilize edilmiş hücre kültürü için ve in vivo immüno izolasyon için kullanılmıştır. Pankreatik adacık kapsüllemesi allojenik veya ksenogeneik transplantlarda adacık sağkalımını artırmak için kapsamlı bir yöntem olarak incelenmiştir. Alginat kapsülleme sıklıkla meme ekstrüzyonu ve dış jelleştirme ile sağlanır. Bu yöntemi kullanarak, memelerin ucunda oluşturulan hücre içeren alginat damlacıkları, damlacıklara difüzyon yaparken iyonotropik alginat jelleşmesine neden olan iki değerlikli katyonları içeren bir çözeltiye düşer. Nozul ucunda damlacık oluşumu gereksinimi, elde edilebilen hacimsel üretim ve alginat konsantrasyonunu sınırlar. Bu video,% 0,5 ila% 10 alginat içindeki memeli hücrelerini% 70 ila% 90 hücre hayatta kalışını kapsüllemek için ölçeklenebilir bir emülsiyonlaşma yöntemi anlatmaktadır. Bu alternatif yöntemle, hücreleri içeren aljinat damlacıkları ve kalsiyum karbonat, mineral yağ, folPH'daki düşüş ile azaltılır ve iç kalsiyum salınımı ve iyonotropik aljinat jelleşmesine yol açar. Mevcut yöntem, alginat boncuklarının emülsifikasyon işleminden 20 dakika sonra üretilmesine olanak tanır. Kapsülleme aşaması için gerekli olan ekipman, çoğu laboratuarda bulunan basit karıştırmalı kaplardan oluşur.
Giriş
Memeli hücre kapsüllemesi, transplante edilen hücreleri immün rejeksiyon 1'den korumak veya immobilize edilmiş hücre kültürü 2 , 3 , 4 için üç boyutlu bir destek sağlamak için bir araç olarak geniş olarak incelenmiştir. Aljinat boncuklardaki pankreatik adacık kapsüllemesi allogeneik 5 , 6 veya ksenogeneik 7 , 8 , 9 , 10 , 11 , 12 kemirgenlerde diyabetin tersine çevrilmesi için kullanılmıştır. Tip 1 diyabet tedavisinde kapsüllenmiş pankreatik adacık transplantasyonunun klinik öncesi ve klinik çalışmaları devam ediyor 13 , 14 , 15 . Transplantasyon uygulamaları veya daha büyük ölçekliİn vitro immobilize hücre üretimi, meme esaslı boncuk jeneratörleri genellikle kullanılır. Tipik olarak, alginat ve hücrelerin bir karışımı, bir damlacıkları oluşturmak üzere bir memeden pompalanır ve damlacıkların dış jelasyonuyla sonuçlanan, iki değerlikli katyonlar içeren karıştırılmış bir solüsyona düşer. Eş eksenli gaz akışı 16 , 17 , nozul titreşimi 18 , elektrostatik itme 19 veya dönen teller 20 , meme ucunda damlacık oluşumunu kolaylaştırır.
Geleneksel boncuk jeneratörlerinin temel dezavantajları, sınırlı üretim ve yeterli boncuk oluşumuna neden olacak sınırlı çözelti viskozitesi aralığıdır 21 . Yüksek akış hızlarında, memeden çıkan sıvı, meme çapından daha küçük damlalar halinde parçalanır ve boyut kontrolü azalır. Verimi artırmak için çoklu nozullu boncuk jeneratörleri kullanılabilir, ancakMemelerin arasındaki akışın tekdüze dağılımı ve> 0.2 Pas çözeltilerin kullanımı problemlidir 22 . Son olarak, nozul esaslı cihazların hepsinin adacıklara bir miktar zarar vermesi beklenir, çünkü kullanılan memelerin çapı 100 um ila 500 um arasında iken insan adacıklarının ~% 15'i 200 um 23'den büyük olabilir.
Bu videoda, damla damla yerine tek bir emülsifikasyon adımında damlacıkları oluşturarak memeli hücrelerini kapsüllemek için alternatif bir yöntem tarif ediyoruz. Boncuk üretimi basit bir karıştırma teknesinde yapıldığından, yöntem, düşük ekipman maliyetleri ile küçük (~ 1 mL) ila büyük ölçekli (10 3 L aralıklı) boncuk üretimi için uygundur 24 . Bu yöntem, boncuk oluşum süreleri kısa ( örneğin 20 dakika) olan geniş bir aljinat viskoziteleri aralığında yüksek küreselliklü boncuk üretimine olanak tanır. Bu yöntem başlangıçta Poncelet ve ark. Tarafından geliştirildi.l. 25 , 26'ya bağlanır ve DNA 27'yi , insülin 29'u içeren proteinleri 28 ve bakterileri 30 hareketsiz hale getirir. Son zamanlarda bu yöntemleri pankreas beta hücre hatları 31 , 32 ve primer pankreatik doku 32 kullanarak memeli hücrelerinin kapsüllenmesine uyarladık.
Yöntemin prensibi, mineral yağı içerisindeki alginat damlalarından oluşan bir yağ içinde su emülsiyonu üretmek ve bunu takiben aljinat damlacıklarının iç jelleştirilmesini sağlamaktır ( Şekil 1 ). Önce, kapsülleyici ( örn., Hücreler), başlangıçtaki işlem pH'sında düşük çözünürlük ile ince taneli bir kalsiyum tuzu içeren bir aljinat solüsyonuna dağıtılır. Ardından alginat karışımı, bir emülsiyon oluşturmak üzere, genellikle biryüzey aktif madde. Memeli hücre kapsüllemesi durumunda, serumda bulunan bileşenler yüzey aktif maddeler olarak görev yapabilir. Daha sonra, pH, sulu faza bölünen yağda çözünür bir asit ilave ederek kalsiyum tuzunu çözündürmek için indirgenir. Mineral yağ / su bölme katsayısı <0.005 33 olan asetik asit yağda önceden çözülmüş, daha sonra yağ fazında karıştırıldığı emülsiyona ilave edilmeli ve sulu faza 34 hızla bölünmelidir. Şekil 2 , asitleştirme ve iç jelasyon adımında gerçekleşen kimyasal reaksiyonları ve difüzyonu göstermektedir. Son olarak, kapsüllenmiş hücreler, faz ters çevirme, faz ayrımı, santrifüjleme, tekrarlanan yıkama adımları ve filtrasyon ile hızlandırılarak toplanır. Bu aşamalardan sonra, kalite kontrol analizleri, in vitro hücre kültürü ve / veya kapsüllenmiş hücrelerin transplantasyonu için boncuk ve hücre örneklemesi yapılabilir.
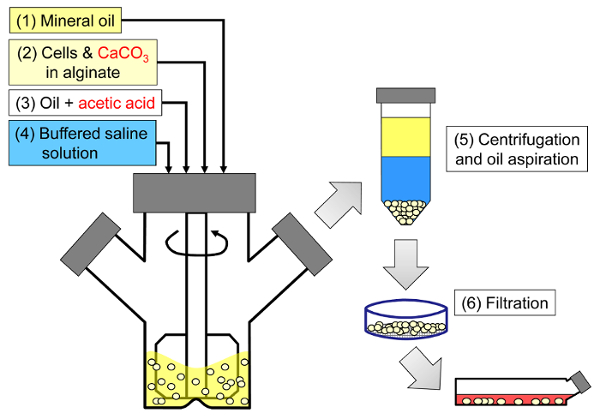
Şekil 1: Memeli hücreleri kapsüllemek için emülsifikasyona dayalı sürecin şematik. Boncuklar önce bir aljinat, hücre ve CaCO3 karışımının mineral yağı içerisinde emülsiyon haline getirilmesi (şemada adım 1 ve 2) ile üretilir ve asetik asit (adım 3) ilave edilerek iç jelleşmeye başlar. Daha sonra jel haline getirilmiş boncuklar, faz ters çevirme tetikleyicisine sulu bir tampon eklenerek (basamak 4), ardından santrifüj ve yağ aspirasyonu (basamak 5) ve daha sonra süzme (adım 6) vasıtasıyla yağdan ayrılır. Son olarak, filtre üzerinde toplanan boncuklar , in vitro kültür veya transplantasyon için hücre kültür ortamına aktarılır. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.

Şekil 2: İç jelleşme sırasında oluşan reaksiyonlar ve difüzyon basamakları. (1) Asetik asit organik faza eklenir ve konveksiyon ile aljinat damlacıklarına taşınır. (2) Asetik asit sulu faza bölünür. (3) Suyun bulunduğu yerde asit, dağılmakta ve koyu mavi renkte tasvir edilen CaCO 3 tanelerine ulaşmak için dağılmaktadır. (4) H + iyonları, Ca 2+ iyonlarını salan CaCO 3 içinde Ca 2+ iyonlarıyla değiştirilir. (5) Kalsiyum iyonları, reaksiyona girmemiş aljinatla karşılaşıncaya kadar dağılır ve alginat zincirlerinin iyonotropik çapraz bağlanmasına yol açar. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Geleneksel nozul tabanlı hücre kapsülleştiricilerinin aksine, geniş bir boncuk boyut dağılımıKarıştırılmış emülsifikasyonda damlacık oluşum mekanizması nedeniyle bu prosesten kaçınılmalıdır. Uygulamaların bir alt kümesi için bu boncuk boyut dağılımı sorunlu olabilir. Örneğin, küçük boncuklarda boncuk yüzeyinde daha büyük bir hücre fraksiyonu açığa çıkabilir. Besin maddesi ( örneğin oksijen) sınırlamaları endişe veriyorsa, bu kısıtlamalar daha büyük boncuklarda daha da artabilir. Karıştırılan emülsiyonlaşma yönteminin bir avantajı, ortalama boncuk boyutunun, emülsiyonlaşma aşamasında ajitasyon oranını değiştirerek kolayca ayarlanabilmesidir. Geniş boncuk boyutu dağılımı boncuk boyutunun kapsüllenmiş hücre performansı üzerindeki etkisini incelemek için de kullanılabilir.
Emülsifikasyon ve iç jelleştirme ile memeli hücresi kapsüllemesi, bir boncuk jeneratörü ile donatılmamış laboratuarlar için ilginç bir alternatiftir. Ayrıca, bu yöntem kullanıcılara işleme süresini azaltma veya çok düşük veya çok yüksek aljinat konsantrelerinde boncuk oluşturma seçeneği sunarations.
Aşağıda özetlenen protokol, hücrelerin, 10 mM 4- (2-hidroksietil) -1-piperazinetansülfonik asit (HEPES) tamponu içerisinde hazırlanan 10.5 mL% 5 alginat çözeltisi içerisinde nasıl kapsüle edileceğini açıklamaktadır. Aljinat, transplantasyon dereceli LVM (düşük viskoziteli yüksek mannuronik asit içeriği) ve MVG (orta viskozite yüksek guluronik asit içeriği) aljinatın bir 50:50 karışımından oluşur. 24 mM nihai konsantrasyonda kalsiyum karbonat, fiziksel çapraz bağlayıcı madde olarak kullanılır. Emülsiyonu asitleştirmek ve iç jelleştirmeyi tetiklemek için asetik asit kullanılırken hafif mineral yağ organik fazı oluşturur. Bununla birlikte, aljinat türü ve bileşimi ve seçilen işlem tamponu istenilen uygulamaya 32 bağlıdır. Bu protokolle boncuklar üretmek için çeşitli alginat türleri (bkz. Tablolar) kullanılmıştır.
Protokol
1. Aljinat Solüsyonunu, CaCO 3 Süspansiyonu ve Asitlenmiş Yağı'yı hazırlayın
- İşlem tamponu ve ortamını hazırlayın.
- 10 mM HEPES, 170 mM NaCl kullanarak yüksek konsantrasyonlu aljinat boncukları oluşturmak için kullanılan tipik işlem tamponunu hazırlayın. PH'ı 7.4'e ayarlayın.
- Tipik kültür ortamı,% 10 fetal sığır serumu (FBS), 6 mM glutamin, 100 U / mL penisilin ve 100 mg / mL streptomisin içeren Dulbecco Modifiye Kartal Ortamı (DMEM) ile hazırlayın.
- Aljinat stok solüsyonunu, boncuklardaki nihai arzu edilen konsantrasyonun 1,17 katı olacak şekilde hazırlayın.
- İlk olarak, uygun miktarda aljinat tozu tartın. Örneğin, 50:50 LVM ve MVG alginat ile% 5 aljinat nihai konsantrasyonunu elde etmek için, 0.583 g LVM aljinat tozu ve 0.583 g MVG aljinat tozunu birleştirerek toplam 1.17 g sodyum aljinat tartın.
- 20 mL işlem tamponunu otoklav içine yerleştirinManyetik bir karıştırma plakası üzerinde yıkanabilir cam kavanoz ve ~ 200 rpm'de çalkalandı. Sodyum alginat tozunu aşamalı olarak çözeltiye ilave edin.
- Çözeltiyi gece boyunca düşük bir hızda karıştırmaya bırakın. Gerekirse, şişeyi karıştırma plakasına sabitleyin.
- Çözelti tam olarak çözülürse şişeyi bir döner mikser üzerine tutturun ve 24 saat daha 37 ° C'de karıştırmaya devam edin.
- Aljinat solüsyonunu, yarım dolmadan daha az olan bir kapta 30 dakika süreyle otoklavlayarak sterilize edin. Çözümü almadan önce sıcaklığın 60 ° C'nin altına düşmesine izin verin.
- Gerekirse, viskozite yeterince düşük kaldığı sürece, aljinat solüsyonunu oda sıcaklığına ulaşmadan önce otoklavlamadan kısa bir süre filtreleyerek parçacıkları çıkarın.
- İç jelleşme için istenen son konsantrasyonun 21 katında kalsiyum karbonat süspansiyonu hazırlayın.
- CaCO 3 tozunu tartın. Örneğin, reklamD 1 g CaCO3 ila 20 mL işlem tamponu ile son jelleştirici madde konsantrasyonu olarak 24 mM CaCO3 elde edildi.
- CaCO 3 süspansiyonunu 30 dakika süreyle otoklavlayın.
NOT: CaCO 3 konsantrasyonu, bikarbonat-CO 2 dengesine bağlı olarak zamanla değişecektir. 10'dan fazla kapsülleme prosedürü için aynı stok CaCO 3 süspansiyonunu kullanmaktan kaçının.
- Emülsiyonlaşma işlemi için kullanılan karıştırılmış tekneyi otoklavlayın. Kullanmadan önce, döndürücü şişede kalan yoğunlaşmış su izlerini kaldırın.
- Emülsiyon haline getirme işleminden hemen önce asitlendirilmiş yağ hazırlayın. 50 mL konik tüp içine yerleştirilen 11 mL mineral yağı başına 44 μL asetik asit çözündürün.
NOT: Genel bir hata, asetik asidin tam olarak çözülmesidir. Az miktarda asetik asit pipetle atmaktan kaçının ve asetik asitin tekrarlanan vorteksleme ile yağda tamamen çözünmesini sağlayın.
DİKKAT: asetik asit toksiktir. D uçucu asit. Bu reaktifi duman kaputunun altında tutun ve asetik asit / yağ solüsyonunu emülsifikasyon aşamasına gelinceye kadar kapalı bir kapta tutun. Daha fazla bilgi için bu reaktife ilişkin MSDS bilgilerine bakın. - Tüm çözümlerin hücre kapsüllemeye geçmeden önce oda sıcaklığına ulaşmasına izin verin.
2. Aljinat Boncuk Üretimi, Emülsifikasyon ve İç Jelasyon ile
- 10 mL hafif madeni yağ spinner şişesine yerleştirin ve düşük devir hızında (bu videoda kullanılan spinner şişesi için 250 dev / dak) ajitasyona başlayın.
- Proses için kullanılan hücreler yapışık kültürlerden kaynaklanıyorsa, hücreleri askıya almak için tripsin uygulayın. FBS içeren ortam veya tripsin önleyicisi ekleyerek reaksiyonu durdurun ve hücre sayımı için bir numune toplayın.
- Daha önce tarif edildiği gibi bir hemositometre veya otomatik bir hücre sayacı kullanarak Tripan mavisi lekelenmesinden sonra hücre konsantrasyonunu ve yaşayabilirliğini belirleyinEşek = "xref"> 32.
- Hücreleri 300 xg'de 7 dakika boyunca santrifüjleyin ve hücre immobilizasyonu için arzu edilen ortamda bir kez yıkayın. Bu ortamın, FBS veya sığır serum albümini (BSA) gibi emülsiyon yapıcılar içerdiğinden emin olun. Örneğin,% 10 FBS içeren DMEM kullanın.
- Boncuklarda istenilen nihai konsantrasyonun 10.5 misli elde etmek için hücre ortamını aynı ortamda tekrar süspanse edin.
- 1.1 mL, 10.5 kat konsantre hücre stoğu, 9.9 mL aljinat solüsyonuna ilave edin. Ardından CaCO 3 süspansiyonundan 550 μL ekleyin ve CaCO 3'ün eşit dağılımını sağlamak için steril bir spatula ile karıştırarak karıştırın.
- Alginat, hücre ve CaCO 3 karışımının bir şırınga yardımıyla ajitasyon yağına 10.5 mL'lik derhal aktarılması.
NOT: Yüksek derecede yapışkan solüsyonlar için, havadaki kabarcıkları önlemek için karışımı aspire edin ve yavaşça çekin. Bazı durumlarda, ajiteyi önlemek için karışıma şişeyi eklerken ajitasyonun durdurulması tercih edilirAljinat sürüklenmesini çark miline yerleştirin. - Alginat, hücre ve CaCO 3 karışımını yağa ilave ettikten hemen sonra ajitasyon oranını arttırın.
NOT: Burada kullanılan% 5 LVM: MVG aljinat için , in vitro kültür 35 için uygun yaklaşık 900 μm çapında boncuklar üretmek üzere 1025 rpm'lik bir dönüş hızı uygulanmıştır. Daha önceki döngüler 25 , 32'de açıklandığı gibi, daha yüksek dönüş hızları ve daha düşük alginat konsantrasyonları, ortalama boncuk çaplarının daha düşük olmasına yol açacaktır. Çark ve damar geometrisindeki hafif değişiklikler ve alginat özellikleri ortalama boncuk çapını büyük ölçüde etkiler. Gemi konfigürasyonundaki veya aljinat partideki her değişiklik için, yüzey alanı momenti ortalaması boncuk çapı ile dönüş hızına ilişkin standart bir eğri oluşturulmalıdır 32 . - Zamanlayıcıyı çalıştırın ve alginatı 12 dakika boyunca emülize edin.
- 10 mL tEmülsiyonu asitleştirmek, CaCO 3'ü eritmek ve böylece aljinatı jel haline getirilmiş boncuklara fiziksel olarak çapraz bağlamak için yağ ve asetik asit çözeltisi. Bu asitlendirme basamağı için 8 dakika bekleyin.
3. Boncuk Kurtarma
- Çalkalama oranını 400 rpm'ye düşürün. PH'ı arttırmak ve faz ters çevirmesine neden olmak için% 10 ortam ile karıştırılmış 40 mL işlem tamponu ekleyin.
- 1 dakika sonra ajitasyonu durdurun ve karışımı 50 mL santrifüj tüplerine aktarın. Eğirici şişeyi ek bir 20 mL ortam ile durulayın ve tüpün içine ekleyin. Yağ fazı ile boncuk temasını en aza indirgemek için yağ fazını aspire etmeden önce döner cam şişeden mümkün olduğunca fazla sulu faz aspire.
NOT: Boncukların hasar görmesini önlemek için bu adımda ve bu noktadan büyük çaplı bir pipet kullanın ( örn. 25 mL pipet). Daha küçük hacimler için boncuk süspansiyonu kesilmiş pipet uçlarıyla da manipüle edilebilir. Bu tür ipuçları elde etmek için, pipet ucunun ucunu kesilen makaslaIle göz koruması giyen. - Boncuk yerleşimini ve faz ayrımını hızlandırmak için tüpleri 630 xg'de 3 dakika santrifüjleyin.
- Bir Pasteur pipetiyle aspire ederek yağ ve fazla sulu çözeltiyi çıkarın.
- Boncukları orta ile en az bir kez yıkayın. Boncuk süspansiyonunu 40 μm naylon hücre süzgeçleri üzerinde filtreleyin ve süzgeci altındaki boncuklarla ilişkili fazla sıvıyı aspire edin. Boncukları, steril bir spatula kullanarak bilinen bir hacim ortamına aktarın.
NOT: Bu adımda hedef minimum boncuk çapına bağlı olarak daha küçük veya daha büyük gözenek boyutu filtreleri kullanılabilir. Bununla birlikte, boncukların hasar görmesini önlemek için sub-micron gözenek boyutlu filtreler ile basınca dayalı filtrasyon yerine gravite filtrasyon önerilmektedir. - İstenen boncuk elde etmek için hacim yer değiştirmesi (boncuk ekledikten sonra hacim, boncuk eklemeden önce hacim eksi) ve boncuk hacmini ölçün: genel hacim oranı, genellikle 1: 5 veya 1 mL boncuk4 mL ortam. Bu noktadan itibaren, boncuklara zarar vermemek için her zaman büyük çaplı pipetleri kullanın.
- Kapsüllenmiş hücreleri , in vitro kültür veya transplantasyon deneyleri için T-flask içine aktarın.
4. Kalite Kontrol ve Uygulamaları
NOT: kapsüllenmiş hücre ve boncuk kalitesini sağlamak için, işlemden sonra boncuk boyutu dağılımı ve hücre sağkalımı nicelenmelidir. Daha ileri analiz için boncuklardan hücreleri kurtarmak için jelin tersine çevrilmesi sıklıkla gerçekleştirilir.
- Boncuk boyut dağılımını değerlendirmek için, boncukları toluidin mavi-O ile lekeleyin.
- % 10 komple ortam içeren 4 mL işlem tamponu içine 0.5 mL boncuk yerleştirin.
- İşlem tamponunda hazırlanan 1 g / L toluidin mavisi solüsyonundan 500 uL ekleyin.
- 50 rpm'de döner çalkalayıcıda konik bir tüp içinde 60 dakika inkübe edin.
- % 10 komple ortam ve immed içeren 5 mL işlem tamponu ekleyinIaths boncukları ve çözeltiyi bir Petri kabına aktarın ve düşük büyütmeli bir mikroskopta veya el tipi bir dijital kamerayla görüntü elde edin. Gerekirse, kontrastı artırmak ve gölgeleri önlemek için el tipi bir fotoğraf makinesiyle görüntü elde etmeden önce Petri kabını hafif bir kutuya yerleştirin.
- Daha önce tarif edilen 32 boncuk boyut dağılımını nicelemek için görüntü analizini gerçekleştirin, örneğin 36 görüntü analizini kullanarak.
- Niteliksel olarak hücre sağkalımını değerlendirmek için ölü hücreleri tanımlamak için etidyum homodimeri ve canlı hücreleri tanımlamak için kalsein AM'yi kullanarak hücreleri lekeleyin.
- % 10 komple ortam içeren 4 hacim işlem tamponuna 1 hacim boncuk ekleyin.
- Sırasıyla 4 uM ve 2 uM konsantrasyonlar elde etmek için uygun miktarda kalsein AM ve etidyum homodimer stok solüsyonları ekleyin. Bazı boncuk örneklerine reaktiflerden yalnızca birini ekleyerek tek leke kontrolü oluşturun.
- Boncuklar buz üzerinde 20 dakika inkübe edin.
- Çözeltiyi bir slayt ve lamel arasına, boncukların sıkışmasını önlemek için bir o-halka gibi bir boşluk kullanarak yerleştirin.
- Floresan mikroskobunda ilerleyin. Floresan kanamayı değerlendirmek için tek leke kontrollerini kullanın. Kalcein AM (494/517 nm) ve DNA'ya bağlı etidyum homodimeri (528/617 nm) ile ilgili uyarılma / emisyon dalga boylarına dayalı uygun floresan filtreleri seçin.
- Daha ileri analiz için hücreleri boncuklardan kurtarmak için alginatın sitrat veya başka bir kenetleme solüsyonu kullanılarak degelleştirilmesi.
- 55 mM sitrat, 10 mM HEPES ve pH 7.4'de 95 mM NaCl içeren bir çözücü çözelti hazırlayın.
- Bu solüsyonu% 10 orta hacimde karıştırın ve daha sonra 9 mL karışıma 1 mL aljinat boncuk ekleyin.
- Boncukları, buz üzerinde, 75 rpm'lik ajitasyonla 20 dakika boyunca püskürtün.
NOT: Hücreler şimdi analiz için kullanılabilir veya eritilmiş aljinat çözeltisinden uzaklaştırılabilirIyonu santrifüjleme ile Örneğin, degradasyondan sonra hücre yaşayabilirliği Trypan Blue lekelemesi ile nicelleştirilebilir. Alternatif olarak, hücreler santrifüje tabi tutulabilir ve yıkanabilir, ardından mRNA, DNA ve / veya protein örnekleme ve analizi yapılabilir.
Sonuçlar
Emülsifikasyon ve iç jelasyon işleminin sonunda, başlangıç aljinat ve hücre karışım hacmine benzer bir boncuk hacmi elde edilmelidir. Boncuklar çok kusurlu çok küresel olmalıdır ( Şekil 3 ). Boncuklar, büyük çaplı pipetler yardımıyla pipetlemeye dayanacak kadar güçlü olmalıdır. Yüksek alginat konsantrasyonlarında boncuklarda kapsüllenmiş yağ veya hava damlacıkları gözlemlenebilir. Bu, muhtemelen emülsifikasyon ...
Tartışmalar
İç jelleşme reaksiyonu sırasında çeşitli adımlar ( Şekil 2'de gösterilmektedir) genel kinetiği sınırlayabilir. ~ 2.5 μm'den büyük kalsiyum karbonat taneleri için karbonat çözünme hızı sınırlayıcı 26 , 44 olduğu gösterilmiştir. Dahili kalsiyum salınımına yol açan asitlendirme basamağının, hücre sağkalımını etkileyen kritik süreç değişkeni olduğu gösterilmiştir 32 . Do...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Jill Osborne'a emülsifikasyon prosesi üzerine zemin hazırlama çalışmaları ve teknik destek için Lauren Wilkinson'a teşekkür ediyoruz. Dr. Igor Laçik, Dr. Timothy J. Kieffer ve Dr. James D. Johnson'a girdileri ve işbirlikleri için teşekkür ediyoruz. Diabète Québec, JDRF, ThéCell, CQMF Merkezi, Doğal Bilimler ve Mühendislik Araştırma Konseyi (NSERC), İnsan Isleti Transplantasyonu Merkezi ve Beta Hücre Yenilenmesi Merkezi, Kanadalı Kök Hücre Ağı, Kanada Kök Hücre Şebekesi, Michael Smith Sağlık Araştırmaları Vakfı, mali yardım için COST 865 ve doğa koruma teknolojileri le Fonds québécois de la recherche sur la nature.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
Referanslar
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes--a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O'Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli's cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15 (2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E., Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. . Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels - a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M., Wijffels, R. H. . Immobilized Cells. , 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır