Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Säugetierzellverkapselung in Alginatperlen unter Verwendung eines einfachen gerafften Gefäßes
In diesem Artikel
Zusammenfassung
Dieses Video und Manuskript beschreiben ein Emulsions-basiertes Verfahren zur Einkapselung von Säugetierzellen in 0,5% bis 10% Alginatperlen, die in großen Chargen unter Verwendung eines einfachen Rührkessels hergestellt werden können. Die eingekapselten Zellen können in vitro kultiviert oder für zelluläre Therapieanwendungen transplantiert werden.
Zusammenfassung
Die Zellverkapselung in Alginatperlen wurde für die immobilisierte Zellkultur in vitro sowie für die Immunisolierung in vivo verwendet . Die Pankreasinselverkapselung wurde weitgehend als Mittel zur Erhöhung des Überfalles der Insel in allogenen oder xenogenen Transplantaten untersucht. Die Alginatverkapselung wird üblicherweise durch Düsenextrusion und externe Gelierung erreicht. Unter Verwendung dieses Verfahrens fallen zellhaltige Alginat-Tröpfchen, die an der Spitze der Düsen gebildet werden, in eine Lösung, die zweiwertige Kationen enthält, die eine ionotrope Alginat-Gelierung verursachen, wenn sie in die Tröpfchen diffundieren. Die Forderung nach Tröpfchenbildung an der Düsenspitze begrenzt den volumetrischen Durchsatz und die Alginatkonzentration, die erreicht werden kann. Dieses Video beschreibt ein skalierbares Emulgierungsverfahren zum Einkapseln von Säugetierzellen in 0,5% bis 10% Alginat mit 70% bis 90% Zellüberleben. Durch dieses alternative Verfahren werden Alginat-Tröpfchen, die Zellen und Calciumcarbonat enthalten, in Mineralöl emulgiertDurch eine Abnahme des pH-Werts, die zu einer internen Calciumfreisetzung und einer ionotropen Alginat-Gelierung führt, Die aktuelle Methode ermöglicht die Herstellung von Alginatperlen innerhalb von 20 min Emulgierung. Die für den Einkapselungsschritt benötigte Ausrüstung besteht in einfachen Rührgefäßen, die für die meisten Laboratorien zur Verfügung stehen.
Einleitung
Die Säugerzellverkapselung wurde weitgehend als Mittel zum Schutz transplantierter Zellen aus der Immunabstoßung 1 oder zur Bereitstellung eines dreidimensionalen Trägers für die immobilisierte Zellkultur 2 , 3 , 4 untersucht . Eine Pankreasinselverkapselung in Alginatperlen wurde verwendet, um Diabetes in allogenen 5 , 6 oder xenogenen 7 , 8 , 9 , 10 , 11 , 12 Nagetieren umzukehren. Präklinische und klinische Studien der eingekapselten Pankreasinsel-Transplantation zur Behandlung von Typ-1-Diabetes sind im Gange 13 , 14 , 15 . Für Transplantationsanwendungen oder größeres SkalierenE in vitro immobilisierte Zellproduktion, Düsen-basierte Wulstgeneratoren werden im allgemeinen verwendet. Typischerweise wird ein Gemisch aus Alginat und Zellen durch eine Düse gepumpt, um Tröpfchen zu bilden, die in eine gerührte Lösung fallen, die zweiwertige Kationen enthält, was zu einer externen Gelierung der Tröpfchen führt. Der koaxiale Gasfluss 16 , 17 , die Düsenvibration 18 , die elektrostatische Abstoßung 19 oder die rotierenden Drähte 20 erleichtern die Tröpfchenbildung an der Düsenspitze.
Die Hauptnachteile herkömmlicher Wulstgeneratoren sind ihr begrenzter Durchsatz und der begrenzte Bereich der Lösungsviskositäten, der zu einer adäquaten Wulstbildung führen wird. Bei hohen Strömungsraten zerfällt das aus der Düse austretende Fluid in Tröpfchen, die kleiner sind als der Düsendurchmesser, wodurch die Größensteuerung verringert wird. Multi-Düse Wulstgeneratoren können verwendet werden, um den Durchsatz zu erhöhen, aberDie gleichmäßige Verteilung der Strömung zwischen den Düsen und die Verwendung von Lösungen> 0,2 Pas ist problematisch 22 . Schließlich wird erwartet, dass alle Düsen-basierten Vorrichtungen den Inselchen einen gewissen Schaden zufügen, da der Durchmesser der verwendeten Düsen zwischen 100 μm und 500 μm beträgt, während ~ 15% der menschlichen Inseln größer als 200 μm 23 sein können .
In diesem Video beschreiben wir ein alternatives Verfahren zur Einkapselung von Säugetierzellen durch Bildung von Tröpfchen in einem einzigen Emulgierungsschritt anstelle von Tropfen-zu-Tropfen. Da die Wulstproduktion in einem einfachen Rührkessel durchgeführt wird, eignet sich das Verfahren für kleine (~ 1 mL) bis großformatige (10 3 L) Perlenproduktion mit geringen Ausrüstungskosten 24 . Diese Methode ermöglicht die Herstellung von Perlen mit hoher Sphärizität unter Verwendung eines breiten Bereichs von Alginat-Viskositäten mit kurzen ( z. B. 20 min) Wulst-Erzeugungszeiten. Diese Methode wurde ursprünglich von Poncelet et alL. 25 , 26 und verwendet, um DNA 27 , Proteine 28 einschließlich Insulin 29 und Bakterien 30 zu immobilisieren. Wir haben diese Methoden vor kurzem an die Verkapselung von Säugetierzellen angepasst, wobei die pankreatischen Beta-Zelllinien 31 , 32 und das primäre Pankreasgewebe 32 verwendet wurden .
Das Prinzip des Verfahrens besteht darin, eine Wasser-in-Öl-Emulsion zu erzeugen, die aus Alginat-Tröpfchen in Mineralöl besteht, gefolgt von einer internen Gelierung der Alginat-Tröpfchen ( Abbildung 1 ). Zuerst wird das Verkapselungsmittel ( z. B. Zellen) in einer Alginatlösung dispergiert, die ein feinkörniges Calciumsalz mit geringer Löslichkeit bei dem anfänglichen pH-Wert enthält. Die Alginatmischung wird dann zu einer gerührten organischen Phase zugegeben, um eine Emulsion zu erzeugen, üblicherweise in Gegenwart von aTensid Im Falle der Säugerzellverkapselung können im Serum vorhandene Komponenten als Tenside wirken. Als nächstes wird der pH-Wert reduziert, um das Calciumsalz durch Zugabe einer öllöslichen Säure, die sich in die wässrige Phase einteilt, zu lösen. Essigsäure mit einem Mineralöl / Wasser-Verteilungskoeffizienten <0,005 33 sollte in Öl vorgelöst und dann der Emulsion zugesetzt werden, wo sie in der Ölphase gemischt wird und sich schnell in die wässrige Phase 34 einteilt . Fig. 2 zeigt die chemischen Reaktionen und die Diffusion, die während der Versauerung und des inneren Gelierungsschrittes stattfinden. Schließlich werden die eingekapselten Zellen durch Phaseninversion, Phasentrennung, die durch Zentrifugation, wiederholte Waschschritte und Filtration beschleunigt wird, gewonnen. Auf diese Schritte können dann Perlen- und Zellproben für Qualitätskontrollanalysen, in vitro Zellkultur und / oder Transplantation der eingekapselten Zellen verfolgt werden.
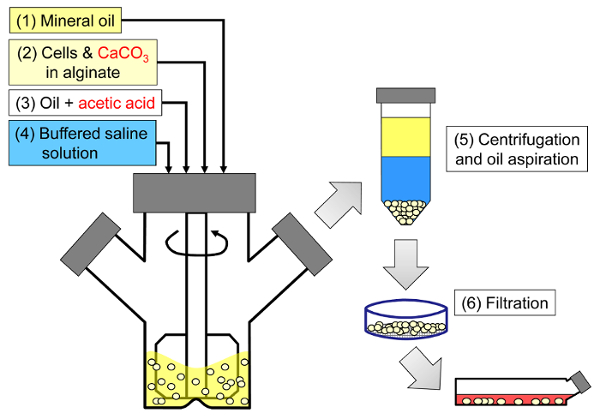
Abbildung 1: Schematische Darstellung des emulgierungsbasierten Prozesses zur Einkapselung von Säugetierzellen. Perlen werden zuerst durch Emulgieren einer Alginat-, Zell- und CaCO 3 -Mischung in Mineralöl (Schritte 1 und 2 im Schema) hergestellt, wobei die innere Gelierung durch Zugabe von Essigsäure ausgelöst wird (Schritt 3). Die gelierten Perlen werden dann durch Zugabe eines wässrigen Puffers zur Triggerphaseninversion (Schritt 4) von dem Öl abgetrennt, gefolgt von Zentrifugation und Ölabsaugung (Schritt 5) und dann Filtration (Schritt 6). Schließlich werden die auf dem Filter gesammelten Kügelchen in Zellkulturmedium für in vitro Kultur oder zur Transplantation überführt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2: Reaktionen und Diffusionsschritte bei interner Gelierung. (1) Essigsäure wird der organischen Phase zugesetzt und durch Konvektion zu den Alginattropfen transportiert. (2) Die Essigsäure trennt sich in die wässrige Phase. (3) In Gegenwart von Wasser dissoziiert und diffundiert die Säure, um die CaCO 3 -Körner zu erreichen, die in dunkelblau dargestellt sind. (4) Die H + -Ionen werden mit Ca 2+ -Ionen in CaCO 3 ausgetauscht, wobei Ca 2+ -Ionen freigesetzt werden. (5) Die Calciumionen diffundieren, bis sie auf nicht umgesetztes Alginat stoßen, was zur ionotropen Vernetzung der Alginatketten führt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Im Gegensatz zu herkömmlichen Düsen-basierten Zellverkapselungen ist eine breite Wulstgrößenverteilung zu erwartenAus diesem Verfahren aufgrund des Mechanismus der Tröpfchenbildung bei gerührter Emulgierung. Für eine Teilmenge von Anwendungen kann diese Perlengrößenverteilung problematisch sein. Beispielsweise kann ein größerer Anteil an Zellen an der Wulstoberfläche in kleineren Perlen belichtet werden. Wenn Nährstoff ( z. B. Sauerstoff) Einschränkungen ein Anliegen sind, können diese Einschränkungen in größeren Perlen verschärft werden. Ein Vorteil des gerührten Emulgierverfahrens besteht darin, daß die mittlere Wulstgröße leicht durch Ändern der Rührgeschwindigkeit während des Emulgierungsschritts eingestellt werden kann. Die breite Wulstgrößenverteilung kann auch genutzt werden, um die Wirkung der Perlengröße auf die eingekapselte Zellleistung zu untersuchen.
Säugetierzellverkapselung durch Emulgierung und interne Gelierung ist eine interessante Alternative für Laboratorien, die nicht mit einem Wulstgenerator ausgestattet sind. Darüber hinaus bietet diese Methode den Anwendern die Möglichkeit, die Verarbeitungszeit zu reduzieren oder Perlen in sehr niedrigem oder sehr hohem Alginatkonzentrat zu erzeugenAtions
Das nachstehend beschriebene Protokoll beschreibt die Einkapselung von Zellen in 10,5 ml einer 5% igen Alginatlösung, hergestellt in 10 mM 4- (2-Hydroxyethyl) -1-piperazinethansulfonsäure (HEPES) -Puffer. Das Alginat besteht aus einer 50: 50-Mischung aus Transplantationsgrad-LVM (niedrigviskoser hoher Mannuronsäuregehalt) und MVG (mittlerer Viskosität hoher Guluronsäuregehalt) Alginat. Calciumcarbonat mit einer Endkonzentration von 24 mM wird als physikalisches Vernetzungsmittel verwendet. Leichtes Mineralöl bildet die organische Phase, während Essigsäure verwendet wird, um die Emulsion zu säuern und interne Gelierung auszulösen. Jedoch hängen der Alginattyp und die Zusammensetzung sowie der ausgewählte Prozesspuffer von der gewünschten Anwendung 32 ab . Eine Vielzahl von Alginattypen (siehe Tabelle der Materialien) wurden verwendet, um Perlen mit diesem Protokoll herzustellen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Die Alginatlösung, die CaCO 3 Suspension und das Acidified Oil vorbereiten
- Vorbereiten des Prozesspuffers und des Mediums.
- Bereiten Sie den typischen Prozesspuffer vor, der zur Erzeugung von hochkonzentrierten Alginatperlen unter Verwendung von 10 mM HEPES, 170 mM NaCl verwendet wird. Den pH-Wert auf 7,4 einstellen.
- Bereiten Sie das typische Kulturmedium mit Dulbecco's Modified Eagle Medium (DMEM) mit 10% fötalem Rinderserum (FBS), 6 mM Glutamin, 100 U / mL Penicillin und 100 mg / mL Streptomycin vor.
- Bereiten Sie die Alginat-Stammlösung bei 1,17-fach der endgültigen gewünschten Konzentration in den Perlen vor.
- Zuerst wiegen die entsprechende Menge an Alginatpulver. Um beispielsweise eine Endkonzentration von 5% Alginat mit 50: 50 LVM und MVG-Alginat zu erhalten, wiegen wir insgesamt 1,17 g Natriumalginat durch Kombinieren von 0,583 g LVM-Alginatpulver und 0,583 g MVG-Alginatpulver.
- Platzieren Sie 20 ml Prozesspuffer in ein AutocLavable Glasgefäß auf einem magnetischen Rührblech und rührt bei ~ 200 U / min. Progressiv das Natriumalginatpulver zur Lösung hinzufügen.
- Lassen Sie die Lösung über Nacht bei niedriger Geschwindigkeit rühren. Falls nötig, den Kolben auf die Rührplatte aufkleben.
- Wenn die Lösung unvollständig aufgelöst ist, die Flasche auf einen Rotationsmischer aufkleben und weitere 24 h bei 37 ° C mischen.
- Sterilisieren der Alginatlösung durch Autoklavieren der Lösung für 30 min in einem Gefäß, das weniger als halb voll ist. Lassen Sie die Temperatur unter 60 ° C abnehmen, bevor Sie die Lösung abholen.
- Entfernen Sie ggf. Partikel durch Filtrieren der Alginatlösung kurz nach dem Autoklavieren, bevor sie Raumtemperatur erreichen, während die Viskosität ausreichend niedrig bleibt.
- Bereiten Sie die Calciumcarbonat-Suspension bei der 21fachen der endgültigen gewünschten Konzentration für die interne Gelierung vor.
- Wiegen Sie das CaCO 3 Pulver ab. Zum Beispiel adD 1 g CaCO 3 bis 20 ml Prozesspuffer, um 24 mM CaCO 3 als die endgültige Geliermittelkonzentration zu erhalten.
- Autoklavieren Sie die CaCO 3 Suspension für 30 min.
HINWEIS: Die CaCO 3 -Konzentration ändert sich im Laufe der Zeit aufgrund des Bicarbonat-CO 2 -Konzentrats. Vermeiden Sie die Verwendung der gleichen Lager CaCO 3 Suspension für mehr als 10 Verkapselung Verfahren.
- Autoklav das für den Emulgierungsprozess verwendete Rührkessel Vor dem Gebrauch entfernen Sie Spuren von kondensiertem Wasser, das in der Spinnkolben verbleibt.
- Unmittelbar vor dem Emulgierungsvorgang das angesäuerte Öl vorbereiten. Man löst 44 μl Essigsäure pro 11 ml Mineralöl in ein 50 ml konisches Röhrchen.
HINWEIS: Ein häufiger Fehler ist eine unvollständige Auflösung der Essigsäure. Vermeiden Sie es, kleine Mengen an Essigsäure zu pipettieren und sicherzustellen, dass die Essigsäure vollständig durch Öl durch wiederholtes Vortexen aufgelöst wird.
ACHTUNG: Essigsäure ist eine giftige und D flüchtige Säure. Behandeln Sie dieses Reagenz unter einer Abzugshaube und halten Sie die Essigsäure / Öl-Lösung in einem geschlossenen Behälter bis zum Emulgierungsschritt. Weitere Informationen finden Sie in den MSDS-Informationen zu diesem Reagenz. - Lassen Sie alle Lösungen auf Raumtemperatur zugreifen, bevor Sie mit der Zellverkapselung fortfahren.
2. Alginat-Perlenerzeugung durch Emulgierung und innere Gelierung
- Legen Sie 10 ml leichtes Mineralöl in den Spinnkolben und starten Sie das Rühren mit einer niedrigen Drehzahl ( z. B. 250 U / min für die Spinnkolben in diesem Video).
- Wenn die für den Prozess verwendeten Zellen aus adhärenten Kulturen bestehen, wenden Sie Trypsin an, um die Zellen zu suspendieren. Beenden Sie die Reaktion durch Zugabe von FBS-haltigem Medium oder Trypsin-Inhibitor und sammeln Sie eine Probe für die Zell-Enumeration.
- Bestimmen Sie die Zellkonzentration und die Lebensfähigkeit nach Trypan-Blau-Färbung mit einem Hämocytometer oder einem automatisierten Zellzähler, wie zuvor beschriebenAss = "xref"> 32.
- Zentrifugieren der Zellen für 7 min bei 300 xg und waschen sie einmal im gewünschten Medium zur Zellimmobilisierung. Stellen Sie sicher, dass dieses Medium Emulgatoren wie entweder FBS oder Rinderserumalbumin (BSA) enthält. Verwenden Sie zum Beispiel DMEM mit 10% FBS.
- Das Zellpellet in demselben Medium erneut suspendieren, um die gewünschte Endkonzentration in den Perlen 10,5-fach zu erhalten.
- Füge 1,1 ml des 10,5-fach konzentrierten Zellstoffs zu 9,9 ml der Alginatlösung hinzu. Dann fügen Sie 550 μl CaCO 3 -Suspension hinzu und mischen durch Rühren mit einem sterilen Spatel, um eine gleichmäßige Verteilung des CaCO 3 zu gewährleisten.
- Sofort 10,5 ml der Alginat-, Zell- und CaCO 3 -Mischung in das Rühröl unter Verwendung einer Spritze überführen.
HINWEIS: Für hochviskose Lösungen aspirieren und ausströmen die Mischung sehr langsam, um Luftblasen zu vermeiden. In einigen Fällen ist es bevorzugt, das Rühren zu stoppen, während das Gemisch dem Kolben zugesetzt wird, um zu vermeidenAlginat-Mitnahme auf die Laufradwelle. - Unmittelbar nach Zugabe der Alginat-, Zell- und CaCO 3 -Mischung zum Öl erhöhen Sie die Rührgeschwindigkeit.
HINWEIS: Für das hier verwendete 5% LVM: MVG-Alginat wurde eine Rotationsgeschwindigkeit von 1025 U / min angewendet, um Perlen von etwa 900 μm Durchmesser zu erzeugen, die für die in vitro Kultur geeignet sind 35 . Höhere Drehzahlen und niedrigere Alginatkonzentrationen führen zu niedrigeren mittleren Wulstdurchmessern, wie in den vorangegangenen Publikationen 25 , 32 beschrieben . Leichte Änderungen der Laufrad- und Gefäßgeometrie sowie Alginat-Eigenschaften können den mittleren Wulstdurchmesser stark beeinflussen. Für jede Änderung der Gefäßkonfiguration oder des Alginat-Loses sollte eine Standardkurve erzeugt werden, die den Flächenweitenmoment-Durchschnitt-Wulstdurchmesser auf die Drehzahl bezieht. - Starten Sie den Timer und emulgieren Sie das Alginat für 12 min.
- 10 ml t hinzufügenEr Öl- und Essigsäurelösung, um die Emulsion zu säuern, das CaCO 3 aufzulösen und somit das Alginat physikalisch zu gelierten Perlen zu vernetzen. 8 min für diesen Versauerungsschritt zulassen.
3. Bead Recovery
- Reduzieren Sie die Rührgeschwindigkeit auf 400 U / min. Füge 40 ml Prozesspuffer hinzu, der mit 10% Medium gemischt wurde, um den pH-Wert zu erhöhen und eine Phaseninversion zu bewirken.
- Stoppen Sie die Rührung 1 min später und übergeben Sie die Mischung auf 50 ml Zentrifugenröhrchen. Spülen Sie den Spinnkolben mit einem zusätzlichen 20 ml Medium und fügen Sie diese dem Schlauch hinzu. Aspirieren Sie so viel wässrige Phase wie möglich aus dem Spinnkolben, bevor die Ölphase angesaugt wird, um den Wulstkontakt mit der Ölphase zu minimieren.
HINWEIS: Bei diesem Schritt eine Großbohrpipette ( zB 25 mL Pipette) verwenden und von da an eine Beschädigung der Perlen vermeiden. Bei kleineren Volumina kann die Wulstaufhängung auch mit Schnittpipettenspitzen manipuliert werden. Um solche Spitzen zu erhalten, schneide das Ende der Pipettenspitze mit einer Schere abIle tragender Augenschutz. - Die Röhrchen für 3 min bei 630 xg zentrifugieren, um die Wulstablagerung und die Phasentrennung zu beschleunigen.
- Das Öl und die überschüssige wässrige Lösung durch Ansaugen mit einer Pasteurpipette entfernen.
- Waschen Sie die Perlen mindestens einmal mit Medium. Filzen Sie die Wulstaufhängung auf 40 μm Nylon-Zell-Siebe und saugt überschüssige Flüssigkeit, die mit den Perlen von unterhalb des Siebes verbunden ist. Übertragen Sie die Perlen in ein bekanntes Mediumvolumen mit einem sterilen Spatel.
HINWEIS: Je nach Ziel-Mindestwulstdurchmesser können kleinere oder größere Porengrößenfilter verwendet werden. Jedoch wird die Schwerkraftfiltration eher empfohlen als die druckgetriebene Filtration durch Sub-Mikron-Porengrßenfilter, um eine Beschädigung der Perlen zu vermeiden. - Messen Sie das Perlenvolumen nach Volumenverdrängung (Volumen nach dem Hinzufügen der Perlen, abzüglich des Volumens vor dem Hinzufügen der Perlen) und auffüllen das Medium, um die gewünschte Perle zu erhalten: Gesamtvolumenverhältnis, das typischerweise 1: 5 oder 1 ml Kügelchen ist4 mL mittel. Verwenden Sie ab diesem Zeitpunkt immer große Bohrpipetten, um eine Beschädigung der Perlen zu vermeiden.
- Übertragen der eingekapselten Zellen in T-Flaschen für in vitro Kultur- oder Transplantationsexperimente.
4. Qualitätskontrolle und Anwendungen
HINWEIS: Um die eingekapselte Zell- und Perlenqualität zu gewährleisten, sollten die Wulstgrößenverteilung und das Zellüberleben nach dem Prozess quantifiziert werden. Das Umkehren des Gels, um die Zellen aus den Perlen zur weiteren Analyse zurückzugewinnen, wird üblicherweise durchgeführt.
- Um die Perlengrößenverteilung zu beurteilen, färben Sie die Perlen mit Toluidinblau-O.
- Legen Sie 0,5 ml Perlen in 4 ml Prozesspuffer mit 10% Vollmedium.
- Fügen Sie 500 μl einer 1 g / l Toluidinblau-Lösung in Prozesspuffer vor.
- Inkubieren für 60 min in einem konischen Rohr auf einem Rotationsschüttler bei 50 U / min.
- Füge 5 ml Prozesspuffer hinzu, der 10% vollständiges Medium und sofort enthältIch benutze die Perlen und die Lösung in eine Petrischale und erhalte Bilder auf einem Mikroskop mit geringer Vergrößerung oder mit einer handgehaltenen Digitalkamera. Wenn nötig, legen Sie die Petrischale auf eine leichte Box, bevor Sie Bilder mit einer Handkamera erhalten, um den Kontrast zu verbessern und Schatten zu vermeiden.
- Führen Sie eine Bildanalyse durch, um die Wulstgrößenverteilung zu quantifizieren, wie zuvor beschrieben, z. B. mit der Bildanalyse Freeware 36 .
- Um das Zellüberleben qualitativ zu beurteilen, färben Sie die Zellen mit Ethidium-Homodimer, um tote Zellen zu identifizieren und Calcein AM, um lebende Zellen zu identifizieren.
- Füge 1 Volumen der Perlen zu 4 Volumen des Prozesspuffers hinzu, der 10% vollständiges Medium enthält.
- Fügen Sie die entsprechende Menge an Calcein-AM- und Ethidium-Homodimer-Stammlösungen hinzu, um 4 & mgr; M bzw. 2 & mgr; M-Konzentrationen zu erhalten. Generieren Sie einzelne Fleckkontrollen, indem Sie nur eines der Reagenzien zu einigen Perlenproben hinzufügen.
- Inkubieren Sie die Perlen auf Eis für 20 min.
- Legen Sie die Lösung zwischen einem Objektträger und einem Deckglas mit einem Abstandshalter wie einem O-Ring, um die Kompression der Perlen zu vermeiden.
- Weiter zur Fluoreszenzmikroskopie. Verwenden Sie die einzelnen Fleckkontrollen, um die Fluoreszenz-Durchblutung zu beurteilen. Wählen Sie geeignete Fluoreszenzfilter auf der Basis der Anregung / Emissionswellenlängen, die mit Calcein AM (494/517 nm) und Ethidiumhomodimer an DNA (528/617 nm) gebunden sind.
- Um die Zellen aus den Perlen zur weiteren Analyse zurückzugewinnen, degel das Alginat unter Verwendung von Citrat oder einer anderen Chelatlösung.
- Eine Degelling-Lösung mit 55 mM Citrat, 10 mM HEPES und 95 mM NaCl bei pH 7,4 vorbereiten.
- Mischen Sie diese Lösung mit 10% Medium und fügen Sie dann 1 ml Alginatperlen zu 9 ml der Mischung hinzu.
- Degel die Perlen auf Eis mit 75 U / min Agitation für 20 min.
HINWEIS: Die Zellen können nun zur Analyse verwendet oder aus dem degelierten Alginatlösungsmittel entfernt werdenIonen durch Zentrifugation. Zum Beispiel kann die Zelllebensfähigkeit nach Degelling durch Trypan-Blau-Färbung quantifiziert werden. Alternativ können die Zellen zentrifugiert und gewaschen werden, gefolgt von mRNA, DNA und / oder Proteinabtastung und -analyse.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Am Ende des Emulgierens und des internen Gelierungsverfahrens sollte ein Perlenvolumen ähnlich dem anfänglichen Alginat- und Zellgemischvolumen gewonnen werden. Die Perlen sollten mit wenigen Defekten sehr sphärisch sein ( Abbildung 3 ). Die Perlen sollten ausreichend stark sein, um Pipettieren durch großporige Pipetten zu widerstehen. Bei hohen Alginatkonzentrationen können eingekapselte Öl- oder Lufttröpfchen in den Kügelchen beobachtet werde...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Verschiedene Schritte (dargestellt in Abbildung 2 ) während der internen Gelierungsreaktion können die Gesamtkinetik begrenzen. Für Calciumcarbonatkörner, die grßer als ~ 2,5 um sind, hat sich gezeigt, daß die Rate der Carbonatauflösung eine ratenbegrenzende 26 , 44 aufweist . Der Säuerungsschritt, der zur internen Calciumfreisetzung führt, hat sich auch als die kritische Prozeßvariable erwiesen, die das Zellüberleben beeinflußt
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken Jill Osborne für ihre Bodenverarbeitung am Emulgierungsprozess und Lauren Wilkinson für technische Unterstützung. Wir danken Dr. Igor Laçik, Dr. Timothy J. Kieffer und Dr. James D. Johnson für ihre Aufnahme und Zusammenarbeit. Wir danken Diabète Québec, JDRF, ThéCell, dem Centre québécois sur les matériaux fonctionnels (CQMF), dem Naturwissenschaften und dem Ingenieurforschungsrat (NSERC), dem Zentrum für die menschliche Insertransplantation und der Beta-Zell-Regeneration, dem kanadischen Stammzellnetzwerk Michael Smith Stiftung für Gesundheitsforschung, le Fonds québécois de la recherche sur la nature et les technologies und COST 865 für finanzielle Unterstützung.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
Referenzen
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes--a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O'Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli's cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15(2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E. 3rd, Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , University of British Columbia. (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100(2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels - a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M. Immobilized Cells. Wijffels, R. H. , Springer. Berlin Heidelberg. 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten