A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحليل الطيفي لجزيئات البروتين وحيد باستخدام مجهر قوة ذرية قوة
In This Article
Summary
نحن وصف إجراءات مفصلة واستراتيجيات لقياس الخواص الميكانيكية والميكانيكية مسارات تتكشف من الجزيئات البروتينية مفرد باستخدام مجهر قوة ذرية. ونحن أيضا إظهار نتائج الممثل كمرجع للتحديد وتبرير لتسجيلات جزيء بروتين واحد جيد.
Abstract
تصميم عملية قابلة للطي للبروتينات من تسلسل الأحماض الأمينية بها إلى بنيتها ثلاثية الأبعاد الأصلية تعتبر مشكلة هامة في مجال البيولوجيا. مجهر القوة الذرية (AFM) ويمكن معالجة هذه المشكلة عن طريق تمكين التمدد والاسترخاء من جزيئات البروتين وحيد، الذي يعطي الأدلة المباشرة تتكشف وريفولدينج خصائص محددة. المستندة إلى فؤاد جزيء واحد القوة-التحليل الطيفي (فؤاد-SMFS) يوفر وسيلة لقياس ثبات والتشكلات الجسيمات ذات الطاقة العالية في البروتينات التي غير ممكنة في القياسات التقليدية الأكبر (البيوكيميائية). رغم أنه تم نشر العديد من الأوراق لإظهار مبادئ فؤاد SMFS، فإنه ليس من السهل إجراء تجارب SMFS نظراً لعدم وجود بروتوكول استفاضة كاملة. في هذه الدراسة، ونحن بإيجاز توضيح مبادئ فؤاد وتفاصيل البروتوكولات والإجراءات، وتحليل البيانات على نطاق واسع كمبدأ توجيهي لتحقيق نتائج جيدة من تجارب SMFS. نظهر الممثل SMFS نتائج القياسات التي تتكشف الميكانيكية البروتين وحيد ونحن نقدم استكشاف استراتيجيات لبعض شيوعاً واجه مشاكل.
Introduction
وقد مكنت السلف في جزيء واحد قوة التحليل الطيفي (SMFS) بفؤاد التلاعب الميكانيكية وتوصيف دقيق لجزيئات البروتين وحيد. وهذا الوصف قد أنتجت رؤى رواية عن البروتين ميكانيكا1،2، البروتين قابلة للطي3، البروتين-يجند التفاعلات4، تفاعلات البروتين البروتين5، والقائم على البروتين المهندسة المواد6،،من78. SMFS مفيد بشكل خاص لدراسة البروتين تتكشف، كما تمتد من فؤاد يسمح السندات الكيميائية والفيزيائية في جزيء البروتين تدريجيا تمديد وفقا صلابة، مما يثير بطول كفاف متزايدة باستمرار. هذا إرهاق لجزيء البروتين يمكن أن تنتج انتقال مفاجئ في منحنى القوة-ملحق أسفر عن حدث تمزق (أو القوة الذروة). ذروة القوة يعطي معلومات مباشرة على تغيير الهيكلية والقوة التي تتكشف من البروتين أثناء عملية تتكشف الميكانيكية. واحدة من أولى الدراسات استخدام فؤاد قياس تيتين1 والاطلاع على جوانب الرواية من البروتين التي تتكشف وريفولدينج تحت الظروف الفسيولوجية دون استخدام ديناتورانتس غير طبيعية مثل تركيز المواد الكيميائية أو درجات الحرارة القصوى.
SMFS تجارب تجري على مجموعة متنوعة من الصكوك، على الرغم من هنا ننظر فقط فؤاد. فؤاد يتكون من أربعة عناصر رئيسية: التحقيق والكاشف وصاحب العينة والماسح الضوئي كهرضغطية. التحقيق تلميح حاد في نهاية فريسوينجينج ناتئ. بعد المعايرة، يقاس منحنية ناتئ خلال تمتد من جزيء المرفقة استخدام شعاع ليزر الذي ينعكس قبالة الجزء الخلفي ناتئ لتحديد دقة باستخدام قانون هوك للقوات. المشاريع شعاع الليزر المنعكس في جهاز كشف الضوئي رباعي، التي تنتج من جهد ما يتناسب مع تشريد شعاع الليزر من مركز صمام ثنائي. الركيزة مع العينة البروتين في سائل محمل على خشبة المسرح كهرضغطية ثلاثية الأبعاد التي يمكن التحكم بدقة نانومتر الفرعية. كمبيوتر يقرأ الجهد من أجهزة الكشف الضوئي وضوابط مرحلة ثلاثية الأبعاد من خلال إمداد بجهد تسيطر على جهاز الكمبيوتر. هذه المراحل صمام بيزو عادة ما تكون مجهزة بالسعة أو السلالة-قياس أجهزة استشعار الموقف بدقة قياس بيزو التشرد وإلى التباطؤ الصحيحة من خلال نظام مراقبة التغذية المرتدة. يتم تحويل الناتج الاستشعار الإشارات من وحدة تحكم بيزو إلى المسافة باستخدام الجهد المستمر من بيزو هو معايرة مصنع. ويرد في الشكل 2منحنى قوة-ملحق مثال من تجربة سحب.
هناك نوعان من التجارب SMFS فؤاد: سرعة ثابتة ومستمرة قوة سحب القياسات. ويرد وصف القياسات SMFS قوة ثابتة في أوبيرهاوسير et al. 9، بينما نركز هنا على قياسات السرعة ثابتة. نموذجي فؤاد ثابت-سرعة سحب تجربة يتم عن طريق توفير الجهد إلى بيزو المضي بلطف ركيزة بالنسبة إلى طرف ناتئ. تجربة نموذجية بنصيحة في البداية الضغط على السطح. هو بدأ قياس سحب عن طريق تحريك الركيزة بعيداً عن التلميح ﻹخراج من جهة الاتصال. إذا كان بروتين يأتي في اتصال مع التلميح في البداية، فإنه سوف يتم سحب وسيقاس التتبع التي تتكشف للقوة ضد التشرد. الركيزة هو إعادته ثم اتصال مع التلميح ويتم قياس أثر استرخاء حيث يمكن تحديد طي البروتين من تشريد القوة.
Protocol
1-إعداد البروتين
- استنساخ الحمض النووي.
- تجميع تسلسل الحمض النووي للاهتمام، على سبيل المثال، تسلسل الحمض النووي ني10ج10، أو عزل عن طريق PCR من الكائن الحي المضيف باستخدام تقنيات البيولوجيا الجزيئية القياسية11. الجناح في الجينات للفائدة مع تقييد مواقع خلال التوليف أو عن طريق مواقع في 5 '-نهاية الإشعال PCR لتتوافق مع وحدة نمطية في pEMI91 بلازميد (أدجيني #74888)12.
- هضم كل على حدة pEMI91 بلازميد12 وتسلسل الحمض النووي للفائدة مع زوج من تقييد المواقع حيث أن تسلسل الفائدة سوف يكون محاط جنبا إلى جنب ويكرر I91 (انظر الشكل 1). يتبع البروتوكول القياسي لمواقع التقييد.
- تنقية المنتج هضمها باستخدام هلام التفريد وثم اضطر المنتجات باستخدام ليجاسى T4 الحمض النووي، بعد بروتوكول قياسي. بعد ربط، تتحول بلازميد كولاي الخلايا لتنقية بلازميد وتنقية بلازميد تستخدم بروتوكولات قياسية. تسلسل باستخدام كبسولة تفجير T7 أو كبسولة تفجير pEMI91 الداخلية للتحقق من أن التسلسل تحولت بنجاح.
- التحول.
- إزالة خلايا التعبير البروتين، مثل C41 الخلايا بليس (DE3)، من الثلاجة-80 درجة مئوية وذوبان الجليد تماما على الجليد.
- إضافة 1 ميليلتر من بلازميد الحمض النووي للخلايا ويقلب بإيجاز؛ لا ينصح بيبيتينج صعودا وهبوطاً كما سيتم إدخال فقاعات الهواء والحارة في الخلايا.
- احتضان ثقافة الأنبوبة التي تحتوي على الخلايا وبلازميد على الجليد لمدة 30 دقيقة.
- صدمة الحرارة الخلايا في حمام مائي في 42 درجة مئوية ل 45 ثانية.
- العودة على أنبوب للجليد لمدة 2 دقيقة.
- ضع ميليلتر 950 من مرق رطل في الخلايا ويهز 250 لفة في الدقيقة ح 1 في 37 درجة مئوية.
- ضع حوالي 200 ميليلتر لهذا التحول على لوحات رطل التي تحتوي على 100 ميكروغرام/مل الأمبيسلّين. في حالة استخدام بلازميد خلاف pEMI91، ثم استخدام المضادات الحيوية المناسبة لذلك بلازميد. ضع لوحة بين عشية وضحاها في حاضنة في 37 درجة مئوية. في اليوم التالي، إزالة لوحة من حاضنة، التفاف مع بارافيلم، وتخزين مبردة تصل إلى شهر واحد.
- تعبير البروتين.
- تطعيم 15 مل متوسطة مرق LB مع 100 ميكروغرام/مل الأمبيسلّين في أنبوب 50 مل عند 37 درجة مئوية للنمو بين عشية وضحاها بلمس تلميح ماصة معقمة إلى مستعمرة بكتيرية واحد على اللوحة وبيبيتينج صعودا وهبوطاً في رطل.
- نقل الثقافة 15 مل إلى 1 لتر متوسطة مرق LB مع 100 ميكروغرام/مل الأمبيسلّين ويهز ح 4-12 في 37 درجة مئوية (حتى OD600 > 0.8).
- جمع 10 مل الثقافة لإعداد بلازميد.
- إضافة 0.2-1 مم الأيزوبروبيل-β-د-ثيوجالاكتوبيرانوسيدي (إيبتج)، وانخفاض درجة الحرارة إلى درجة حرارة الغرفة للتعبير بين عشية وضحاها.
- حصاد الخلايا في اليوم التالي بتقسيم إلى أربعة أنابيب وسينتريفوجينج في 4,000 × ز لمدة 40 دقيقة، ومن ثم تجميد بيليه في-80 درجة مئوية لعدة ساعات.
- إرسال والبلازميدات المستخرجة من الخلايا للتسلسل مع الإشعال المقابلة للكاسيت المدرج من البروتين12 والتحقق من الدقة من الحمض النووي تم إدراجها.
- تنقية البروتين.
- ذوبان الجليد أنبوب واحد من الخلايا المجمدة لمدة 30 دقيقة في درجة حرارة الغرفة.
- تعليق الخلايا المذابة في المخزن المؤقت لتحلل (38 مل من الماء، 2 مل الجلسرين، 50 مم تريس-HCl درجة الحموضة 7.6، 150 مم كلوريد الصوديوم، 1 مم كاكل2، 10 ميكروغرام/مل الدناز، 1 مم بمسف، 1 مم تسيب، 500 ميكروغرام/مل lysozyme) ويهز على الجليد ح 1.
- تجميد الخلايا ليسيد في-80 درجة مئوية لعدة ساعات، وثم إعادة الذوبان في درجة حرارة الغرفة.
- تدور أسفل في × 13,100 ز لمدة 30 دقيقة في 4 درجات مئوية.
- قم بتشغيل المادة طافية عن طريق عمود تدفق جاذبية لعلامة محددة (مثل بكتيريا-العلامة أو صاحب العلامة).
- تنفيذ تبادل المخزن مؤقت استخدام عامل تصفية الطرد مركزي باستخدام المخزن المؤقت الملائم لبكتيريا-العلامة أو صاحب العلامة ومخزن في 4 درجات مئوية قبل الاستخدام.
2-التحضير لإعداد نموذج الشرائح
- إعداد الشرائح الزجاجية باستخدام حل البيرانا.
- جولة مكان 10-30 قطعة من الزجاج غطاء كشوف (دائرة قطرها 7.5 ملم) في كوب زجاج 40 مل.
ملاحظة: القيام بهذه الخطوة والخطوات التالية في غطاء محرك السيارة. اتباع إجراءات موحدة للتعامل مع المواد الكيميائية الخطرة أثناء هذه الخطوة. - إضافة 30 مل حمض الكبريتيك (18.4 م).
- أضف 10 مل بيروكسيد الهيدروجين 30%.
- تسخين المزيج لمدة 10-30 دقيقة إلى 95 درجة مئوية.
- صب حل البيرانا بعناية في حاوية نفايات منفصلة (إعادة استخدامها أو التخلص منها).
- شطف الشرائح مع المياه إزالة الحل البيرانا.
- تعليق الشرائح في 40 مل الأسيتون.
- صب الأسيتون في حاوية نفايات، وإعادة تعليق الشرائح في 40 مل إيثانول.
- استخدام الملقط نظيفة لاستخراج شريحة واحدة في كل مرة وجاف مع الأرجون أو الهواء النقي بعناية.
- مكان نظيف والمجففة الشرائح في إطار الفراغ حتى تبخر الذهب أو الأرجون للتخزين على المدى الطويل.
- جولة مكان 10-30 قطعة من الزجاج غطاء كشوف (دائرة قطرها 7.5 ملم) في كوب زجاج 40 مل.
- إعداد الشرائح المغلفة الذهب (اختياري).
ملاحظة: تتطلب هذه الخطوة استخدام مبخر الفراغ (e-شعاع)، التي تتوفر في العديد من مرافق غرفة نظيفة في الجامعات الرئيسية.- قطع خمس شرائح المجهر (25 مم × 75 مم مستطيلة الشكل) في نصف استخدام جلاسكوتير.
- تطبيق شريط لاصق الوجهين عبر منتصف كل 10 شرائح نصف المجهر.
- قطع الجانب لزجة من sticky note وتنطبق على الشريط على الوجهين حتى أن الجانب لزجة من المذكرة الوجه لأعلى. المذكرة لزجة لاصقة عموما أقل، لكن لا يزال راسخا وتعلق على الشرائح لمنع كسر مستقبلا. ثم يمكن الآن عمل تلك الشرائح مجهر نصف حامل الشرائح الزجاجية.
- اضغط أربع شرائح زجاجية نظيفة (من قسم 2.1.10) إلى كل ركن من الجانب مثبت حامل بعناية.
- نقل الشرائح الزجاجية إلى مبخر شعاع الإلكتروني. اتبع مواصفات مبخر لتطبيق 70 نيوتن متر من الكروم و 300 نانومتر ذهب إلى السطح.
- تخزين الشرائح المغلفة بالذهب تحت الأرجون.
3-نموذج إعداد
-
إعداد الشرائح.
- حدد قرص حديد نظيفة (15 مم) وإرفاق علامة تبويب لاصقة به.
- أوناتاتش قطعة غطاء من علامة التبويب لاصقة.
- حدد قطعة من الزجاج النظيفة (من قسم 2.1.10) أو الذهب (من قسم 2.2.7) وإيمانا راسخا وضعه على الجانب لزجة القرص الحديد، وستكون هذه الشريحة عينة.
- إيداع البروتين على شريحة.
- دياليزي بوليبروتين في المخزن المؤقت للتجربة (25 مم تريس-HCl، درجة الحموضة 7.6 مع 150 مم كلوريد الصوديوم) باستخدام عمود exchange المخزن مؤقت مثل عامل تصفية 0.5 مل الطرد مركزي. زيادة ونقصان البروتين في العمود لمدة 10 دقائق 13,000 لفة في الدقيقة وعكس العمود ثم الوتي البروتين في المخزن مؤقت جديد من الغزل 1,000 لفة في الدقيقة لمدة 2 دقيقة.
- تحديد تركيز البروتين تقريبية عن طريق قياس امتصاص في 280 نانومتر، باستخدام جهاز المطياف الضوئي.
- تمييع البروتين إلى 10-100 ميكروغرام/مل في وحدة تخزين نهائي من 100 ميليلتر.
- تطبيق 60 ميليلتر من محلول البروتين على وسط الشريحة. كن حذراً في هذه المرحلة عدم ترك أي سائل الدخول تحت في الفجوة بين الزجاج والشريحة الحديد، أن هذا يمكن أن يسبب تورم اللاصقة أثناء التجربة وحركات عينة غير المنضبط.
ملاحظة: شرائح الذهب مسعور، وسوف تشكل معالجة تجميعية كروية، بينما الشرائح الزجاجية ماء أكثر وقد نشر الحل البروتين. - واسمحوا العينة الجلوس في درجة حرارة الغرفة لمدة 10--60 دقيقة. خلال هذا الوقت، انتقل إلى الخطوة التالية للبدء في إعداد مجهر القوة الذرية.
4-الذرية قوة المجهر (فؤاد) الإعداد
ملاحظة: ما يلي وصف عام لإعداد فؤاد، وقد تختلف بعض التفاصيل المحددة وفقا للأجهزة المحددة المستخدمة. من الأجهزة المستخدمة جزئيا الصنع ووصف بالتفصيل في شول13.
- جبل ناتئ على خلية فؤاد.
- اختر ناتئ مع الخصائص المناسبة للتطبيق. استخدام كانتيليفيرس مع الثوابت الربيع 4-10 pN/nm للقوات التي تتكشف منخفضة (~ 10-50 السندات الإذنية)، في حين أن استخدام كانتيليفيرس مع الثوابت الربيع 15-100 pN/nm للقوات التي تتكشف عالية.
- تلتقط ناتئ من النهاية ووضعه في التحقيق معتقل بعناية.
- تأكد من أن الخلية عقد بحزم يحمل ناتئ في مكان قبل المتابعة.
- وضع الخلية عقد في الرأس فؤاد لمحاذاة الليزر.
- قم بمحاذاة الليزر في رأسه فؤاد.
- وضع رأسه على مجهر مقلوب وتوصيل بطارية رأسه فؤاد للمحرك بالليزر في الرأس.
- إرفاق كاميرا إلى كاشف المجهر بحيث يمكن تصور على ضوء الليزر على التلفزيون أو جهاز العرض.
- ضع الليزر بحيث يقع على طرف ناتئ
- جبل الرأس بعينه.
- طرد 10 ميليلتر من المخزن المؤقت إلى كل من المنافذ للتحقيق عقد الخليوي.
- تأخذ الشريحة العينة التي قد تم حضانة وصب 40 ميليلتر من السوائل من الحل المحتضنة. إضافة 40 ميليلتر من المخزن المؤقت على الشريحة. مكان الشريحة عينة على المغناطيس أعلاه بيزو.
- تأكد من أن مرحلة فؤاد في موقع مرتفع. ثم ضع رأس فؤاد على خشبة المسرح، حيث يكون ناتئ فؤاد أعلاه الحبرية عينة.
- مركز شعاع الليزر المنعكس على الضوئي.
- قص قطعة صغيرة من الورق ووضعه أمام الضوئي فؤاد.
- تغيير موضع الليزر فؤاد استخدام المقابض حتى تصبح بقعة الليزر على الورقة مركزة ومشرقة.
- ضبط مرآة الرأس فؤاد حيث أن الليزر يضرب الضوئي تكبير الإشارات الإجمالية في جميع الأرباع (ألف + باء + جيم + دال) ويسبب إشارة الفرق بين اثنين أعلى وأسفل الأرباع اثنين لتكون صفر (أ + ب-ج-د).
5. معايرة مجهر القوة الذرية
- قياس الطيف السلطة.
- في عامل التصفية متصلاً فؤاد، دورة إعداد عامل تصفية فؤاد إشارة الرأس لعرض النطاق الترددي الكامل.
- على فؤاد نفسه، تأكد من أن بيزو قبالة كما سيقوم هذا بإضافة الضوضاء إلى الإشارة.
- استخدام البرمجيات فؤاد14 لقياس متوسط حسابات 512 من الطيف السلطة من نقاط البيانات 1,024 لكل حساب.
- استخدام البرمجيات فؤاد15 لتكامل كثافة الطاقة الطيفية عبر الذروة الأولى، الذي يتوافق مع الوضع الرئيسي للاهتزاز ناتئ.
- حساب حساسية الضوئي.
- فؤاد نفسها، بتشغيل وحدة تحكم بيزو وقم بتغيير إعداد عامل التصفية إلى 500 هرتز (المنخفضة تمرير مرشح).
- رصد إشارة الفرق الذي ينبغي أن تقلب حول الصفر في البرنامج فؤاد. سرعة تحريك الرأس فؤاد أسفل ميكرومتر مئات قليلة باستخدام ميكروبوسيتيونيرس. تكرار نقل الرأس إلى أسفل ورصد إشارة الفرق يقفز متسقة. السطح هو جداً القريبة عندما يقفز الإشارة البدء في زيادة في الارتفاع.
- بمجرد أن يشبع إشارة انحراف عند الاتصال مع السطح، نقل الرأس بعيداً عن السطح قليلاً.
- في البرنامج فؤاد، استخدام عناصر تحكم الإدخال لتنظيم الجهد بيزو للعثور على السطح، بتحريك للأعلى أو الأسفل 100 5,000 نانومتر. إذا كان لا يزال غير السطح في متناول اليد، تواصل تضييق المسافة بين الرأس والعينة يدوياً.
- في البرنامج فؤاد، إجراء تجربة شد مع حجم المسح الضوئي لحوالي 500 نانومتر حيث أنه يأتي نصيحة في الاتصال لحوالي 100 نانومتر السفر بيزو.
- قياس منحدر منطقة خطية الإشارة الضوئي مقابل بيزو التشرد المنحنى حيث نصيحة فؤاد لا يزال على اتصال مع سطح الركيزة.
- حساب ثابت الربيع وحساسية استخدام المنحدر وطيف الطاقة المتكاملة (
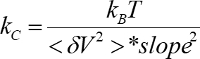 ).
).
6. الحصول على البيانات
- إعداد.
- حول عوامل التصفية متصلاً فؤاد، تعيين عامل تصفية وضع حيث يكون تواتر أخذ العينات مرتين على الأقل في عرض النطاق الترددي (معيار نايكست)، الذي سيعطي الحد الأعلى لقطع المنخفضة تمرير.
- القياسات.
- تعيين حجم المسح الضوئي إلى إجمالي حجم النظرية التي تتكشف بوليبروتين (عدد الأحماض الأمينية × 0.365) بالإضافة إلى حوالي 40% للسماح للضغط ضد الركازة. على سبيل المثال، سحب بنية x I91 9 سوف يكون طول تكشفت نظرية لحوالي 300 نانومتر، حيث ينبغي أن يكون حجم المسح حوالي 420 نانومتر.
- في البرنامج فؤاد، موقف ناتئ حيث يكون من 80% حجم المسح بعيداً عن السطح (في هذه الحالة، حول 340 نانومتر بعيداً عن السطح).
- في البرنامج فؤاد، تعيين سرعة المسح الضوئي إلى 300 نانومتر/s في البداية.
ملاحظة: يمكن تعديل هذه السرعة ليكون أبطأ أو أسرع, استناداً إلى التطبيق. - إجراء تجربة سحب وقياس موقف الناتجة في بيزو والإشارة الضوئي. استخدام البرمجيات فؤاد لبدء المسح الضوئي.
- في البرمجيات، وفؤاد يواصل إجراء القياسات حتى هناك حوالي 10,000 التسجيلات.
ملاحظة: عموما، معدل الالتقاط جزيء تسيطر عليها إيجابية حول 0.5%16، حتى 10,000 ضرورية ليتمكن من جمع ما يكفي من البيانات لتحليل.
7-بيانات التحليل
- تطبيع البيانات.
- تحسب لكل تسجيل، وتوسيع نطاق استخدام ملحق = التشرد--F/كيه سي (قريب من 5.2.7).
- تحديد مستوى القوة الأساس بأخذ متوسط بداية أو نهاية تتبع تمديد القوة، حيث لا توجد قمم القوة موجودة ولا تضغط ناتئ ضد السطح. ثم يمكن أن تحول المنحنى كامل القوة-ملحق بهذه القيمة الوسطية.
- ترجمة البيانات حيث أن التمديد هو المنحازة على طول المحور الصادي صفر. يرجع هذا الجزيء يجب تعيينها إلى صفر ملحق في بداية عملية تتبع.
- تحديد بروتين فائدة.
- تحديد التسجيلات مع مالا يقل عن أربعة أحداث I91 التي توفر بصمة جزيء واحد. التقاط هذه التسجيلات الحقيقية "القياسات جزيء واحد".
- حفظ الأحداث التي تتم الإشارة إليها أحداث جزيء واحد لمزيد من التحليل.
- تحديد زيادة طول كفاف.
- لكل تسجيل، يصلح نموذجا سلسلة مثل دودة لحدث تتكشف،
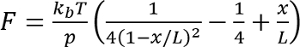 حيث
حيث 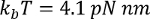 في درجة حرارة الغرفة، ف هو طول استمرار (عادة ما بين 0.4 إلى 1 نانومتر) و العاشر هو الملحق في نانومتر L هو طول كفاف في نانومتر.
في درجة حرارة الغرفة، ف هو طول استمرار (عادة ما بين 0.4 إلى 1 نانومتر) و العاشر هو الملحق في نانومتر L هو طول كفاف في نانومتر.
ملاحظة: نموذج السلسلة مثل دودة حل محرف بالضبط، وإيجاد حل أكثر دقة عددية في بوتشيات et al. 17-ويمكن الاطلاع على نماذج بديلة ملائمة في سو et al. 18. - حساب الفرق بين القيم ل مصممة لسنتين متتاليتين تطور الأحداث، وصاغ هذا الاختلاف "زيادة طول كفاف".
- لكل تسجيل، يصلح نموذجا سلسلة مثل دودة لحدث تتكشف،
- تحديد قوة تمزق.
- حساب القوة تمزق لحدث تتكشف معين بأخذ أعلى نقطة قبل انخفاض أكبر في منحنى تتكشف.
النتائج
وتظهر نتائج تمثيلية من هذا البروتوكول في الشكل 2. إظهار كلا الفريقين منحنيات تمديد القوة التمثيلية من البروتينات. يظهر الأعلى النتائج من بوليبروتين I91، بينما يظهر الأسفل البروتين I91 المرافقة بروتين من فائدة، جزيء10ج ني. هذه التسجيلات إظهار القوة الم?...
Discussion
خطوة حاسمة في البروتوكول هو استخدام بوليبروتين، الموضحة في الخطوة 1-1-2، الذي يعمل كعنصر تحكم إيجابية "البصمات" الأحداث جزيء واحد. عموما، هناك يجب أن تكون تتكشف أحداث البروتينات بوليبروتين (ل I91، وهذا يعني قوة تتكشف لزيادة طول السند الإذني وكفاف حوالي 200 من حوالي 28 nm) تختتم دون لبس أن بروتين ا?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
كان يدعمها هذا العمل على منح "المؤسسة الوطنية للعلوم" 1244297 المجلس والمجلس-1517245 ليم.
Materials
| Name | Company | Catalog Number | Comments |
| AFM Specimen Discs, 15mm diameter | Ted Pella, Inc. | 16218 | Serve as base for glass substrate |
| Round Glass Coverslips, 15mm diamiter No.1 Thick | Ted Pella, Inc. | 26024 | serve as glass substrate and base for gold coating |
| Adhesive Tabs | Ted Pella, Inc. | 16079 | Paste on AFM Specimen Discs to provide a sticky face for attaching glass coverslips |
| STD Multimode head assembly | Bruker Nano Inc. | 1B75C | AFM head |
| Glass probe holder | Bruker Nano Inc. | MTFML-V2 | Glass probe holder for scanning in fluid with the MultiMode AFM. |
| Microlever AFM probes | Bruker Nano Inc. | MLCT | Silicon Nitride cantilevers with Silicon Nitride tips, ideal for contact imaging modes |
| AFM probes with Au coated tips | Bruker Nano Inc. | OBL-10 | Cantilevers for pulling on proteins with low unfolding force |
| Multifunction Data Acquisition (DAQ) Card,16-Bit, 1 MS/s (Multichannel), 1.25 MS/s (1-Channel), 32 Analog Inputs | National Instruments | PCI-6259 | Data Acquisition for signals from AFM head and Piezo Actuators |
| LISA Linear Piezo Stage Actuators | Physik Instrumente LP | P-753.11C | Piezo Actuator to control the position of substrate and perform pulling measurements |
| XY Piezo Stage | Physik Instrumente LP | P-541.2CD | Piezo Actuator to control the position of substrate and scan on substrate surface |
References
- Rief, M., Gautel, M., Oesterhelt, F., Fernandez, J. M., Gaub, H. E. Reversible Unfolding of Individual Titin Immunoglobulin Domains by AFM. Science. 276 (5315), 1109-1112 (1997).
- Fisher, T. E., Oberhauser, A. F., Carrion-Vazquez, M., Marszalek, P. E., Fernandez, J. M. The study of protein mechanics with the atomic force microscope. Trends in Biochemical Sciences. 24 (10), 379-384 (1999).
- Ng, S., Rounsevell, R., Steward, A., Randles, L., Clarke, J. Single molecule studies of protein folding by atomic force microscopy(AFM). Abstracts of Papers of the American Chemical Society. 227, U545-U545 (2004).
- Rico, F., Chu, C., Moy, V. T., Braga, P. C., Ricci, D. . Methods in Molecular Biology. 736, 331-353 (2011).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nature Nanotechnology. 3 (5), 261-269 (2008).
- Lv, S., et al. Designed biomaterials to mimic the mechanical properties of muscles. Nature. 465 (7294), 69-73 (2010).
- Kim, M., et al. Nanomechanics of Streptavidin Hubs for Molecular Materials. Advanced Materials. 23 (47), 5684-5688 (2011).
- Gonzalez, M. A., et al. Self-Adhesive Hydrogels from Intrinsically Unstructured Proteins. Advanced Materials. , (2017).
- Oberhauser, A. F., Hansma, P. K., Carrion-Vazquez, M., Fernandez, J. M. Stepwise unfolding of titin under force-clamp atomic force microscopy. Proceedings of the National Academy of Sciences. 98 (2), 468-472 (2001).
- Li, Q., Scholl, Z. N., Marszalek, P. E. Capturing the Mechanical Unfolding Pathway of a Large Protein with Coiled-Coil Probes. Angewandte Chemie International Edition. 53 (49), 13429-13433 (2014).
- Davis, L. . Basic methods in molecular biology. , (2012).
- Scholl, Z. N., Josephs, E. A., Marszalek, P. E. A Modular, Non-Degenerate Polyprotein Scaffold for Atomic Force Spectroscopy. Biomacromolecules. , (2016).
- Scholl, Z. N. . The (Un) Folding of Multidomain Proteins Through the Lens of Single-molecule Force-spectroscopy and Computer Simulation. , (2016).
- Pawlak, K., Strzelecki, J. Nanopuller-open data acquisition platform for AFM force spectroscopy experiments. Ultramicroscopy. 164, 17-23 (2016).
- . Nanopuller Available from: https://sourceforge.net/projects/nanopuller/ (2018)
- Scholl, Z. N., Marszalek, P. E. Improving single molecule force spectroscopy through automated real-time data collection and quantification of experimental conditions. Ultramicroscopy. 136, 7-14 (2014).
- Bouchiat, C., et al. Estimating the persistence length of a worm-like chain molecule from force-extension measurements. Biophysical journal. 76 (1), 409-413 (1999).
- Su, T., Purohit, P. K. Mechanics of forced unfolding of proteins. Acta. 5 (6), 1855-1863 (2009).
- Steward, A., Toca-Herrera, J. L., Clarke, J. Versatile cloning system for construction of multimeric proteins for use in atomic force microscopy. Protein science. 11 (9), 2179-2183 (2002).
- Scholl, Z. N., Josephs, E. A., Marszalek, P. E. Modular, Nondegenerate Polyprotein Scaffolds for Atomic Force Spectroscopy. Biomacromolecules. 17 (7), 2502-2505 (2016).
- Hoffmann, T., et al. Rapid and Robust Polyprotein Production Facilitates Single-Molecule Mechanical Characterization of β-Barrel Assembly Machinery Polypeptide Transport Associated Domains. ACS. 9 (9), 8811-8821 (2015).
- Dudko, O. K., Hummer, G., Szabo, A. Theory, analysis, and interpretation of single-molecule force spectroscopy experiments. Proceedings of the National Academy of Sciences of the United States of America. 105 (41), 15755-15760 (2008).
- Popa, I., Berkovich, R., Alegre-Cebollada, J., Rivas-Pardo, J. A., Fernandez, J. M. Halotag Tethers to Study Titin Folding at the Single Molecule Level. Biophysical journal. 106 (2), 391a (2014).
- Yu, H., Siewny, M. G., Edwards, D. T., Sanders, A. W., Perkins, T. T. Hidden dynamics in the unfolding of individual bacteriorhodopsin proteins. Science. 355 (6328), 945-950 (2017).
- Rico, F., Gonzalez, L., Casuso, I., Puig-Vidal, M., Scheuring, S. High-speed force spectroscopy unfolds titin at the velocity of molecular dynamics simulations. Science. 342 (6159), 741-743 (2013).
- He, Y., Lu, M., Cao, J., Lu, H. P. Manipulating protein conformations by single-molecule AFM-FRET nanoscopy. ACS nano. 6 (2), 1221-1229 (2012).
- Fotiadis, D., Scheuring, S., Müller, S. A., Engel, A., Müller, D. J. Imaging and manipulation of biological structures with the AFM. Micron. 33 (4), 385-397 (2002).
- Edwards, D. T., Faulk, J. K., LeBlanc, M. A., Perkins, T. T. Force Spectroscopy with 9-μs Resolution and Sub-pN Stability by Tailoring AFM Cantilever Geometry. Biophysical journal. 113 (12), 2595-2600 (2017).
- Dudko, O. K., Mathe, J., Szabo, A., Meller, A., Hummer, G. Extracting kinetics from single-molecule force spectroscopy: Nanopore unzipping of DNA hairpins. Biophysical. 92 (12), 4188-4195 (2007).
- Scholl, Z. N., Li, Q., Yang, W., Marszalek, P. E. Single-molecule Force Spectroscopy Reveals the Calcium Dependence of the Alternative Conformations in the Native State of a βγ-Crystallin Protein. Journal of Biological Chemistry. 291 (35), 18263-18275 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved