Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kuvvet spektroskopisi bir Atomik kuvvet mikroskobu kullanılarak tek Protein moleküllerinin
Bu Makalede
Özet
Biz ayrıntılı yordamlar ve mekanik özellikleri ve mekanik unfolding yollar tek protein moleküllerinin bir Atomik kuvvet mikroskobu kullanarak ölçmek için stratejileri açıklar. Ayrıca seçim ve bloklama iyi tek protein molekülü kayıtları için bir başvuru olarak temsilcisi sonuçları göster.
Özet
Katlama işlemi yerel 3D yapıları için onların amino asit dizisi üzerinden proteinlerin tayini Biyolojide önemli bir sorundur. Atomik Kuvvet Mikroskobu (AFM) germe ve belirli unfolding ve özellikleri refolding doğrudan kanıt veren gevşeme tek protein moleküllerinin sağlayarak bu sorunu ele alabilir. AFM tabanlı tek molekül kuvvet-spektroskopisi (AFM-SMFS) sürekli olarak geleneksel toplu (biyokimyasal) ölçümlerde mümkün olmayan proteinler yüksek enerjili biçimler ölçmek için bir yol sağlar. AFM-SMFS prensipleri göstermek için pek çok makalesi yayımlandı rağmen etraflıca bir iletişim eksikliği nedeniyle SMFS deney kolay değildir. Bu çalışmada kısaca AFM prensipleri göstermek ve kapsamlı detay iletişim kuralları, yordamlar ve veri analizi SMFS deneyler iyi sonuçlar elde etmek için bir kılavuz olarak. Biz tek protein mekanik unfolding ölçümleri temsilcisi SMFS sonuçlarını göstermek ve stratejileri için bazı yaygın karşılaşılan sorun giderme sorunları sağlar.
Giriş
Tek molekül kuvvet spektroskopisi (SMFS) tarafından AFM gelişmeler tek protein molekülleri malzemelerin mekanik manipülasyon ve hassas etkinleştirdiniz. Bu karakterizasyonu protein mekaniği1,2,3, protein-ligand etkileşimleri4, protein-protein etkileşimleri5, katlama protein hakkında yeni anlayışlar üretti ve protein bazlı mühendislik malzemeler6,7,8. SMFS protein eğitimi için özellikle yararlı unfolding, yavaş yavaş kendi sertlik verir rise için sürekli artan bir kontur uzunluğu göre genişletmek için protein molekül içinde kimyasal ve fiziksel Tahvil sağlar AFM tarafından germe olarak. Bu bir protein molekülünün esneme ani geçişe rüptürü olayında ortaya çıkan kuvvet-uzantısı eğri üretmek (veya tepe zorla). Gücü en yüksek mekanik açılım sürecinde protein unfolding kuvvet ve yapısal değişikliği doğrudan bilgi verir. AFM kullanarak ilk çalışmalar titin1 ölçülen ve roman yönlerini unfolding ve yoğun kimyasal madde veya aşırı sıcaklıklara gibi doğal olmayan denatüranlar kullanmaya gerek kalmadan fizyolojik koşullar altında refolding protein bulundu.
Burada sadece AFM dikkate da SMFS deneyler aletleri, çeşitli üzerinde yapılmaktadır. AFM dört ana öğelerden oluşur: sonda, Dedektör, örnek sahibi ve piezoelektrik inceden inceye gözden geçirmek. Sonda bir konsol free-swinging ucunda keskin bir yolgösterendir. Kalibrasyon sonra konsol ekli bir molekülünün germe sırasında bükme tam Kuvvetleri Hooke'un Kanunu kullanarak belirlemek için konsol rahat yansıyan lazer ışını kullanılarak ölçülür. Bir lazer ışını diyot Merkezi'nden çıkarılması ile orantılı olarak Sinus bir çeyreği fotodiyot dedektörü yansıyan lazer ışını projelere. Substrat sıvı protein örneği ile alt nanometre hassasiyetle kontrol edilebilir bir 3D piezoelektrik sahne üzerine monte edilmiştir. Bir bilgisayar gerilim fotodiyot dedektörleri okur ve bilgisayar kontrollü voltaj kaynağı 3D adımında denetler. Bu piezo aktüatör aşamalar genellikle kapasitif ile donatılmıştır veya germe-pozisyon sensörleri tam ölçü piezo deplasman ve geri besleme kontrol sistemi aracılığıyla doğru histeresis detektörler. Sensör sinyal çıkış piezo denetleyicisinden fabrika kalibre piezo gerilim sabiti kullanılarak mesafe içine dönüştürülür. Çekerek bir deneme bir örnek kuvvet-uzantısı eğrisi Şekil 2' de gösterilmiştir.
AFM-SMFS deneyler iki türü vardır: sabit hız ve sürekli kuvvet ölçümleri çekerek. Sürekli kuvvet SMFS ölçümleri Oberhauser vd. açıklanan Burada sabit hız ölçümleri üzerinde ele iken 9. Tipik bir AFM sabit hızda çekme deneyi yavaşça bir substrat prensibine göre bahşiş göre taşımak için bir piezo gerilim sağlayarak yapılır. Tipik bir deney başlangıçta yüzeyine karşı basarak ucu vardır. Çekerek ölçü belgili tanımlık substrate temasımız getirmek için belgili tanımlık uç uzak hareket ettirerek başladı. Bir protein ile temas ipucu başlangıçta gelirse çekilmiş olacak ve deplasman karşı kuvvet unfolding izleme ölçülecektir. Belgili tanımlık substrate ipucu ile temas geri getirilir ve rahatlatıcı bir izleme nerede protein katlanması kuvvet uzaklığı belirlenebilir ölçülür.
Protokol
1. protein hazırlık
- DNA klonlama.
- Faiz, NI10C10, örneğin, DNA dizisi DNA dizisi sentez veya üzerinden PCR standart moleküler biyoloji teknikleri11kullanarak ana bilgisayar organizmadan yalıtmak. Kısıtlama sitelerle ilgi gen sentezi sırasında veya 5'-sonu plazmid pEMI91 modülünde (Addgene #74888)12karşılık gelecek şekilde PCR astar siteleri yerleştirerek kuşatın.
- Böylece faiz dizisi (bkz. şekil 1) I91 tekrarlar tandem tarafından çevrili ayrı olarak plazmid pEMI9112 ve ilgi kısıtlama sitelerin bir çift ile DNA dizisi sindirmek. Kısıtlama siteleri için standart iletişim kuralı izleyin.
- Jel Elektroforez kullanılarak sindirilir ürün arındırmak ve T4 DNA ligaz, standart bir protokol sonrası kullanarak ürün ligate. Tüp ligasyonu sonra E. coli hücreleri plazmid arıtma plazmid dönüştürün ve standart protokolleri kullanarak plazmid arındırmak. Sıra başarıyla dönüştü doğrulamak için T7 astar veya iç pEMI91 primerler kullanılarak sırası.
- Dönüştürme.
- C41 gibi protein ifade hücre kaldırma (DE3) pLysS hücrelerden-80 ° C dondurucu ve tezcan tamamen buz üzerinde.
- Plazmid DNA 1 µL hücrelere ekleyin ve kısa bir süre karıştırın; yukarı ve aşağı pipetting o hava kabarcıkları tanıtmak ve hücreleri sıcak tavsiye edilmez.
- Hücreleri ve 30 dk için buzda plazmid içeren kültür tüp kuluçkaya.
- Isı şok bir su banyosunda 45 için 42 ° C'de hücreler s.
- 2 min için buz için tüp dönün.
- 950 µL LB suyu hücrelere yerleştirmek ve 37 ° C'de 1 h için 250 rpm'de sallamak
- Yaklaşık 200 µL dönüştürme 100 µg/mL Ampisilin içeren LB plakalar üzerine yerleştirin. PEMI91 dışında bir plazmid kullanarak, uygun antibiyotik o plazmid için kullanın. Plaka gecede bir kuluçka 37 ° C'de yer. Ertesi gün, İnkübatör, tabaktan Kaldır parafilm ile sarın ve mağaza 1 ay kadar buzdolabında.
- Protein ifadesi.
- LB suyu orta gece büyüme için 37 ° C'de bir 50 mL tüp 100 µg/mL Ampisilin ile 15 mL steril pipet bahşiş plaka üzerinde bakteriyel bir koloni dokunmaktan ve yukarı ve aşağı içinde LB pipetting tarafından aşılamak.
- 15 mL kültür LB suyu orta 100 µg/mL Ampisilin ile 1 L içine transfer ve 4-12 h 37 ° C'de için sallamak (kadar OD600 > 0,8).
- Plazmid hazırlık için kültürünün 10 mL toplamak.
- 0,2-1 mM izopropil-β-D-thiogalactopyranoside (IPTG) ekleyin ve daha düşük sıcaklık oda sıcaklığına gecede ifade için.
- Dört tüpler içine bölme ve 4.000 × g 40 min için de centrifuging tarafından ertesi gün hücre hasat ve birkaç saat için Pelet-80 ° C'de dondurmak.
- Protein12 eklenen kaset için karşılık gelen astar ile sıralama için hücreleri elde plazmid göndermek ve eklenen DNA kalitesini doğrulayın.
- Protein saflaştırma.
- Oda sıcaklığında 30 dakika donmuş hücrelerinin bir tüp çözülme.
- Çözdürülen hücrelerinde lizis arabellek (38 mL su, 2 mL gliserol, 50 mM Tris-HCl pH 7,6, 150 mM NaCl, 1 mM CaCl2, 10 µg/mL Dnaz, 1 mM PMSF, 1 mM TCEP, 500 µg/mL lizozim) askıya alma ve 1 h için buz sallamak.
- Birkaç saat lysed hücre-80 ° C'de dondurmak ve oda sıcaklığında yeniden çözülme.
- Lysate aşağı 13,100 × g 4 ° C'de 30 dk için de spin
- Süpernatant üzerinden yerçekimi akışı sütun belirli etiketi (Örneğin, Strep-etiket veya etiket onun) için çalıştırın.
- Strep etiketi veya O'nun etiketi ve mağaza kullanmadan önce 4 ° C'de uygun arabellek kullanarak bir santrifüj filtresini kullanan bir arabellek alışverişi gerçekleştirin.
2. slayt hazırlama için numune hazırlama
- Piranha çözüm kullanarak cam slaytlar hazırlayın.
- Yer 10-30 adet cam kapak paket fişi (7,5 mm yarıçapında) 40 mL cam kabı yuvarlak.
Not: Bir mahallede bu adım ve aşağıdaki adımları gerçekleştirin. Bu adımı sırasında tehlikeli kimyasallar ile başa çıkmak için standart yordamları izleyin. - 30 mL (18,4 M) sülfürik asit ekleyin.
- 10 mL % 30 hidrojen peroksit ekleyin.
- Isı karışımı 10-30 dakika ile 95 ° c
- Dikkatle Piranha çözüm (yeniden atılır veya) için ayrı bir atık konteyner içine dikkatle boşaltmak.
- Slaytlar Piranha çözümü kaldırmak için deiyonize suyla durulayın.
- Slaytları 40 mL aseton askıya alma.
- Aseton atık konteyner içine dikkatle boşaltmak ve slaytlar 40 mL etanol yeniden askıya alma.
- Dikkatli bir slayt teker teker ayıklamak ve argon veya saflaştırılmış hava kuru temiz forseps kullanın.
- Yer temiz ve kuru slaytlar altın buharlaşma kadar vakum altında veya argon uzun süreli depolama için altında.
- Yer 10-30 adet cam kapak paket fişi (7,5 mm yarıçapında) 40 mL cam kabı yuvarlak.
- Altın kaplamalı slaytlar (isteğe bağlı) hazırlayın.
Not: Bu adım büyük üniversitelerde çok temiz Oda imkanları mevcuttur bir vakum (e-beam) Evaporatör kullanımını gerektirir.- Beş mikroskop slaytlar (25 x 75 mm dikdörtgen şeklinde) bir glasscutter kullanarak yarıya.
- Çift taraflı yapışkan bant her 10 Orta geçerli yarım mikroskop slaytlar.
- Yapışkan Not yapışkan tarafı kesme ve yapışkan notu yukarı doğru tarafı için çift taraflı bant uygulamak. Yapışkan notu genel olarak daha az yapışkan, ama hala sıkıca slaytlara gelecekteki kırma önlemek için ekler. O zaman bu yarım mikroskop slaytları artık cam slaytlar sahibi olarak çalışabilirsiniz.
- Dikkatle dört temiz cam slaytlara (2.1.10 bölümünden) sahibinin yapışkan tarafı her köşesinde tuşuna basın.
- Cam slaytlar bir e-beam Evaporatör hareket. 70 uygulamak için Evaporatör özellikleri izleyin krom ve 300 nm nm altın yüzeye.
- Altın kaplı slaytları argon altında depolama.
3. numune hazırlama
-
Slayt hazırlamak.
- Bir temiz demir disk (15 mm çap) seçin ve bir yapışkanlı etiket ekleyebilir.
- Yapışkanlı etiket kapak parça çıkarmak.
- (2.1.10 bölümünden) temiz cam veya altın (2.2.7 bölümünden) bir parça seçin ve sıkıca demir disk yapışkan tarafı yerleştirin, bu örnek slayt olacaktır.
- Protein bir slayda Kasası.
- Deney (25 mM Tris-HCl, pH 7,6 ile 150 mM NaCl) için arabellek içine polyprotein diyaliz 0.5 mL santrifüj filtresi gibi bir arabellek Satım sütun kullanarak. Sütun 10 dk 13000 RPM için protein spin ve sütun ters ve iplik için 2 dk 1000 devirde tarafından yeni bir arabelleğe protein elute.
- 280 Absorbans ölçerek yaklaşık protein konsantrasyonu belirlemek nm, bir Spektrofotometre kullanarak.
- 10-100 µg/ml 100 µL son bir hacim içinde protein sulandırmak.
- Protein çözüm merkezi slaydın üzerine 60 µL uygulanır. Bu aşamada bu yapışkan şişmesi deney ve kontrolsüz örnek hareketleri sırasında neden olabilir gibi altında cam ve demir slayt boşluğu girin herhangi bir sıvı bırakmamaya dikkat edin.
Not: Altın slaytlar hidrofobik ve iken cam slaytlar daha hidrofilik ve protein çözüm yayılabilir küresel bir damlacık oluşturacak. - Oda sıcaklığında 10-60 dakika için oturup örnek ver. Bu süre boyunca, Atomik kuvvet mikroskobu ayarlamadan sonraki adıma geçin.
4. Atomik Kuvvet Mikroskobu (AFM) Kurulum
Not: AFM ayarlamak için genel bir açıklama aşağıdadır ve bazı belirli ayrıntıları belirli araçları kullanılan bağlı olarak farklı olabilir. Kullanılan araçları kısmen ev yapımı ve Scholl13' te ayrıntılı olarak açıklanmıştır.
- Konsol bir AFM hücre üzerine monte.
- Konsol uygulama için uygun özelliklere sahip seçin. Kullanım cantilevers bahar sabitleriyle 4-10 pN/nm düşük unfolding kuvvetleri için (~ 10-50 pN), kullanım bahar sabitleriyle 15-100 pN/nm yüksek unfolding kuvvetleri için cantilevers süre.
- Dikkatle sonundan itibaren konsol almak ve hücre tutarak soruşturma yerleştirin.
- Hücre sıkıca devam etmeden önce yerde konsol tutar emin olun.
- AFM başından lazer hizalama için hücreye yerleştirin.
- AFM başından lazer hizalayın.
- Başından ters bir mikroskop üzerine yerleştirin ve bir pil AFM kafasına kafasına lazer güç bağlayın.
- Bir kamera lazer ışık bir TV veya monitör görselleştirildiği belgili tanımlık mikroskop bulmak için ekleyin.
- Konsol ucu bulunduğu lazer konumlandırın
- Kafa örnek ile bağlayın.
- 10 µL arabelleği her hücre tutarak soruşturma bağlantı noktaları içine sifonu çek.
- Kuluçka örnek slayt al ve sıvı inkübe çözümden 40 µL dikkatle boşaltmak. Arabellek 40 µL slaytta ekleyin. Örnek slayt piezo yukarıda mıknatıs üzerine yerleştirin.
- AFM sahne yükseltilmiş konumda olduğundan emin olun. Böylece AFM prensibine göre örnek damlacık sonra AFM kafası Sahne Alanı'na yer.
- Merkezi fotodiyot üzerine yansıyan lazer ışını.
- Küçük bir parça kağıda keser ve AFM fotodiyot önüne yerleştirir.
- AFM lazer lazer nokta kağıt üzerinde odaklanmış ve parlak olur, böylece düğmeleri kullanarak yeniden konumlandırın.
- Lazer her tarafta (A + B + C + D) toplam sinyalin en üst düzeye çıkarmak için fotodiyot vurur ve üstten iki arasındaki fark sinyal neden olur ve sıfır (A + B-C-D) olarak iki kadranın alt AFM baş ayna ayarlayın.
5. Atomik kuvvet mikroskobu kalibrasyon
- Güç spektrumu ölçmek.
- AFM için bağlı filtresinde tam bant genişliği için AFM baş sinyal için filtre ayarı açın.
- AFM kendisi üzerinde bu sinyal-gürültü ekler gibi piezo kapalı olduğundan emin olun.
- AFM yazılım14 ücret hesaplama 1.024 veri noktalarından güç spektrumun 512 hesaplamalar ortalamasını ölçmek için kullanın.
- AFM yazılım15 titreşim konsol için ana mod için karşılık gelen ilk zirve boyunca güç spektral yoğunluğu tümleştirmek için kullanın.
- Fotodiyot duyarlılık hesaplayın.
- AFM kendisi, piezo denetleyicisi açmak ve 500 Hz (alçak geçiren Filtre) için filtre ayarı değiştirmek.
- Sıfır AFM yazılım etrafında dalgalanıyor fark sinyal izlemek. Hızla AFM baş birkaç yüz mikrometre micropositioners kullanarak hareket ettirin. Baş aşağı hareket tekrarlayın ve tutarlı atlar için fark sinyal izlemek. Yüzey çok ne zaman sinyal atlar start yüksekliği artan.
- En kısa zamanda yüzeyi ile temas üzerine saptırma sinyal doyurur, yüzey uzak baş hafifçe hareket ettirin.
- AFM yazılım, 100-5000 nm aşağı ve yukarı hareket ettirerek yüzeyin, bulmak için piezo voltaj düzenleyen giriş denetimleri kullanın. Yüzey hala ulaşmak değilse, el ile baş ve örnek arasındaki uzaklığı azaltmak devam edin.
- AFM yazılım tarama boyutu yaklaşık 500 ile çekerek bir deneme yapmak nm ucu yaklaşık 100 için temas halinde gelir böylece nm piezo seyahat.
- Nerede AFM ipucu substrat yüzeyi ile temas halinde kalır doğrusal bölge fotodiyot sinyal karşı piezo deplasman eğrinin eğimini ölçmek.
- Bahar sabit ve duyarlılık eğimi ve entegre güç spektrumu kullanarak hesaplamak (
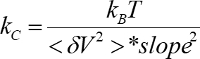 ).
).
6. veri toplama
- Hazırlık.
- AFM için bağlı, alçak-geçiren kesim için bir üst sınır sağlayacak en az iki kez bant genişliği (Nyquist kriteri), örnekleme frekans olduğunu sağlamak için filtre ayarı ayarlamak.
- Ölçümleri.
- Toplam teorik boyutu unfolding polyprotein (amino asitler × 0.365 sayısı) artı yaklaşık % 40 substrat karşı acil için izin vermek için tarama boyutu ayarlayın. Örneğin, bir 9 x I91 yapı çekerek yaklaşık 300 teorik gelişeceğini uzunluğu olacaktır yüzden tarama boyutu yaklaşık 420 nm, nm.
- Böylece yüzey uzak tarama boyutunu % 80'i AFM yazılım prensibine göre konumlandırın (Bu durumda, hakkında 340 nm yüzey uzak).
- AFM yazılım, başlangıçta 300 nm/s için tarama hızını ayarlar.
Not: Bu hızı daha yavaş ya da hızlı, uygulamaya bağlı olarak değiştirilebilir. - Bir çekme deneyi gerçekleştirmek ve piezo ve fotodiyot sinyal elde edilen konumunu ölçün. AFM yazılım tarama başlatmak için kullanın.
- AFM yazılım, yaklaşık 10.000 kayıtları olana ölçümleri gerçekleştirmek devam edin.
Not: Genellikle, pikap bir pozitif kontrol molekül %0,516, yani 10.000 analiz için yeterli veri toplamak gerekli oranıdır.
7. veri analizi
- Verileri normalleştirmek.
- Her kayıt için uzantısını uzantısı kullanarak hesaplamak = çıkarma - F/kc (kc olduğunu 5.2.7'den).
- Hiçbir kuvvet doruklarına mevcut nerede başlangıcını veya sonunu kuvvet-uzantısı izleme ortalamasını alarak temel kuvvet düzeyi belirlemek ve nerede konsol yüzeyine karşı baskı yapıyor değil. Tüm kuvvet-uzantısı eğrisi sonra bu ortalama değeri tarafından kaymış.
- Uzantının sıfır y ekseni hizalanır verileri çevirmek. Bunun nedeni molekül uzantısı bir izleme başında sıfır olarak ayarlanmalıdır.
- Protein ilgi belirlenmesi.
- Bir tek molekül parmak izi sağlamak en az dört I91 olaylar ile kayıtları belirleyin. Bu kayıtlar doğru "tek molekül ölçülerini" yakalama.
- Daha fazla çözümleme için izotopu tek molekül olaylar olayları kaydedin.
- Kontur uzunluğu artışı belirlemek.
- Her kayıt için unfolding olay, solucan benzeri zincir modeline uygun
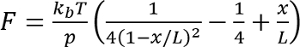 nerede
nerede 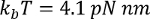 oda sıcaklığında p sebat uzunluğu (tipik olarak 0.4-1 nm) ise, x nanometre uzantısında ise L kontur uzunluğu nanometre.
oda sıcaklığında p sebat uzunluğu (tipik olarak 0.4-1 nm) ise, x nanometre uzantısında ise L kontur uzunluğu nanometre.
Not: Solucan benzeri zincir şeklinde bir enterpolasyonlu kesin çözümdür, Bouchiat vd. daha kesin bir sayısal çözüm bulundu 17. alternatif uygun modelleri-ebilmek bulunmak içinde Su vd. 18. - L tespit için iki ardışık unfolding olayları ve bu fark icat için değerleri arasındaki farkı hesaplama "kontur uzunluğu artışı".
- Her kayıt için unfolding olay, solucan benzeri zincir modeline uygun
- Rüptürü kuvveti belirlemek.
- Belirli bir unfolding olay için rüptürü kuvveti unfolding tonundaki en büyük damla önce en yüksek noktası alarak hesaplar.
Sonuçlar
Bu protokolden temsilcisi sonuçları Şekil 2' de gösterilmiştir. Her iki panelleri temsilcisi kuvvet-uzantısı eğrileri proteinler üzerinden göster. Alt protein--ilgi çekici bir, NI10C molekül kanat I91 protein gösterirken üst I91 polyprotein sonuçlarını gösterir. Bu kayıtlar I91 karakteristik gücünü göstermek (200 pN) ve kontur uzunluğu artışı (28 nm) hangi gösterir hizalama ve AFM kalibrasyonu başarılı oldu. Bu kuvvet...
Tartışmalar
Protokol kritik bir adımda "parmak izi tek molekül olaylar için" olumlu bir denetim olarak hizmet veren 1.1.2, adımda anlatılan bir polyprotein kullanımıdır. Genel olarak, orada polyprotein proteinler olayların unfolding gerekir (I91 için bu yaklaşık 28 yaklaşık 200 pN ve kontur uzunluğu artışı bir açılım güç anlamına gelir nm) belirsizliğe yer bırakmadan faiz protein gelişeceğini olmuştur sonuçlandırmak için. Örneğin, ne zaman faiz protein her iki taraftan üç I91 etki alanı tarafınd...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser Ulusal Bilim Vakfı Hibe MCB-1244297 ve MCB-1517245 PEM için tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AFM Specimen Discs, 15mm diameter | Ted Pella, Inc. | 16218 | Serve as base for glass substrate |
| Round Glass Coverslips, 15mm diamiter No.1 Thick | Ted Pella, Inc. | 26024 | serve as glass substrate and base for gold coating |
| Adhesive Tabs | Ted Pella, Inc. | 16079 | Paste on AFM Specimen Discs to provide a sticky face for attaching glass coverslips |
| STD Multimode head assembly | Bruker Nano Inc. | 1B75C | AFM head |
| Glass probe holder | Bruker Nano Inc. | MTFML-V2 | Glass probe holder for scanning in fluid with the MultiMode AFM. |
| Microlever AFM probes | Bruker Nano Inc. | MLCT | Silicon Nitride cantilevers with Silicon Nitride tips, ideal for contact imaging modes |
| AFM probes with Au coated tips | Bruker Nano Inc. | OBL-10 | Cantilevers for pulling on proteins with low unfolding force |
| Multifunction Data Acquisition (DAQ) Card,16-Bit, 1 MS/s (Multichannel), 1.25 MS/s (1-Channel), 32 Analog Inputs | National Instruments | PCI-6259 | Data Acquisition for signals from AFM head and Piezo Actuators |
| LISA Linear Piezo Stage Actuators | Physik Instrumente LP | P-753.11C | Piezo Actuator to control the position of substrate and perform pulling measurements |
| XY Piezo Stage | Physik Instrumente LP | P-541.2CD | Piezo Actuator to control the position of substrate and scan on substrate surface |
Referanslar
- Rief, M., Gautel, M., Oesterhelt, F., Fernandez, J. M., Gaub, H. E. Reversible Unfolding of Individual Titin Immunoglobulin Domains by AFM. Science. 276 (5315), 1109-1112 (1997).
- Fisher, T. E., Oberhauser, A. F., Carrion-Vazquez, M., Marszalek, P. E., Fernandez, J. M. The study of protein mechanics with the atomic force microscope. Trends in Biochemical Sciences. 24 (10), 379-384 (1999).
- Ng, S., Rounsevell, R., Steward, A., Randles, L., Clarke, J. Single molecule studies of protein folding by atomic force microscopy(AFM). Abstracts of Papers of the American Chemical Society. 227, U545-U545 (2004).
- Rico, F., Chu, C., Moy, V. T., Braga, P. C., Ricci, D. . Methods in Molecular Biology. 736, 331-353 (2011).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nature Nanotechnology. 3 (5), 261-269 (2008).
- Lv, S., et al. Designed biomaterials to mimic the mechanical properties of muscles. Nature. 465 (7294), 69-73 (2010).
- Kim, M., et al. Nanomechanics of Streptavidin Hubs for Molecular Materials. Advanced Materials. 23 (47), 5684-5688 (2011).
- Gonzalez, M. A., et al. Self-Adhesive Hydrogels from Intrinsically Unstructured Proteins. Advanced Materials. , (2017).
- Oberhauser, A. F., Hansma, P. K., Carrion-Vazquez, M., Fernandez, J. M. Stepwise unfolding of titin under force-clamp atomic force microscopy. Proceedings of the National Academy of Sciences. 98 (2), 468-472 (2001).
- Li, Q., Scholl, Z. N., Marszalek, P. E. Capturing the Mechanical Unfolding Pathway of a Large Protein with Coiled-Coil Probes. Angewandte Chemie International Edition. 53 (49), 13429-13433 (2014).
- Davis, L. . Basic methods in molecular biology. , (2012).
- Scholl, Z. N., Josephs, E. A., Marszalek, P. E. A Modular, Non-Degenerate Polyprotein Scaffold for Atomic Force Spectroscopy. Biomacromolecules. , (2016).
- Scholl, Z. N. . The (Un) Folding of Multidomain Proteins Through the Lens of Single-molecule Force-spectroscopy and Computer Simulation. , (2016).
- Pawlak, K., Strzelecki, J. Nanopuller-open data acquisition platform for AFM force spectroscopy experiments. Ultramicroscopy. 164, 17-23 (2016).
- . Nanopuller Available from: https://sourceforge.net/projects/nanopuller/ (2018)
- Scholl, Z. N., Marszalek, P. E. Improving single molecule force spectroscopy through automated real-time data collection and quantification of experimental conditions. Ultramicroscopy. 136, 7-14 (2014).
- Bouchiat, C., et al. Estimating the persistence length of a worm-like chain molecule from force-extension measurements. Biophysical journal. 76 (1), 409-413 (1999).
- Su, T., Purohit, P. K. Mechanics of forced unfolding of proteins. Acta. 5 (6), 1855-1863 (2009).
- Steward, A., Toca-Herrera, J. L., Clarke, J. Versatile cloning system for construction of multimeric proteins for use in atomic force microscopy. Protein science. 11 (9), 2179-2183 (2002).
- Scholl, Z. N., Josephs, E. A., Marszalek, P. E. Modular, Nondegenerate Polyprotein Scaffolds for Atomic Force Spectroscopy. Biomacromolecules. 17 (7), 2502-2505 (2016).
- Hoffmann, T., et al. Rapid and Robust Polyprotein Production Facilitates Single-Molecule Mechanical Characterization of β-Barrel Assembly Machinery Polypeptide Transport Associated Domains. ACS. 9 (9), 8811-8821 (2015).
- Dudko, O. K., Hummer, G., Szabo, A. Theory, analysis, and interpretation of single-molecule force spectroscopy experiments. Proceedings of the National Academy of Sciences of the United States of America. 105 (41), 15755-15760 (2008).
- Popa, I., Berkovich, R., Alegre-Cebollada, J., Rivas-Pardo, J. A., Fernandez, J. M. Halotag Tethers to Study Titin Folding at the Single Molecule Level. Biophysical journal. 106 (2), 391a (2014).
- Yu, H., Siewny, M. G., Edwards, D. T., Sanders, A. W., Perkins, T. T. Hidden dynamics in the unfolding of individual bacteriorhodopsin proteins. Science. 355 (6328), 945-950 (2017).
- Rico, F., Gonzalez, L., Casuso, I., Puig-Vidal, M., Scheuring, S. High-speed force spectroscopy unfolds titin at the velocity of molecular dynamics simulations. Science. 342 (6159), 741-743 (2013).
- He, Y., Lu, M., Cao, J., Lu, H. P. Manipulating protein conformations by single-molecule AFM-FRET nanoscopy. ACS nano. 6 (2), 1221-1229 (2012).
- Fotiadis, D., Scheuring, S., Müller, S. A., Engel, A., Müller, D. J. Imaging and manipulation of biological structures with the AFM. Micron. 33 (4), 385-397 (2002).
- Edwards, D. T., Faulk, J. K., LeBlanc, M. A., Perkins, T. T. Force Spectroscopy with 9-μs Resolution and Sub-pN Stability by Tailoring AFM Cantilever Geometry. Biophysical journal. 113 (12), 2595-2600 (2017).
- Dudko, O. K., Mathe, J., Szabo, A., Meller, A., Hummer, G. Extracting kinetics from single-molecule force spectroscopy: Nanopore unzipping of DNA hairpins. Biophysical. 92 (12), 4188-4195 (2007).
- Scholl, Z. N., Li, Q., Yang, W., Marszalek, P. E. Single-molecule Force Spectroscopy Reveals the Calcium Dependence of the Alternative Conformations in the Native State of a βγ-Crystallin Protein. Journal of Biological Chemistry. 291 (35), 18263-18275 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır