A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخراج هيموسيتيس من اليرقات melanogaster المورفولوجية للعدوى الميكروبية والتحليل
In This Article
Summary
هذا الأسلوب يوضح كيفية تصور غزو العوامل الممرضة في خلايا الحشرات مع نماذج ثلاثية الأبعاد (3D). هيموسيتيس من اليرقات المورفولوجية مصابات بمسببات الأمراض الفيروسية أو البكتيرية، أما فيفو السابقين أو في الجسم الحي. هيموسيتيس المصابة ثم الثابتة والملون للتصوير بالمجهر [كنفوكل] والتعمير الخلوية 3D اللاحقة.
Abstract
خلال العدوى المسببة للأمراض من melanogaster المورفولوجية، هيموسيتيس دوراً هاما في الاستجابة المناعية في جميع أنحاء العدوى. وهكذا، والهدف من هذا البروتوكول التوصل إلى أسلوب لتصور غزو العوامل الممرضة في حجرة محصنة محددة من الذباب، إلا وهي هيموسيتيس. استخدام الطريقة المعروضة هنا، تصل إلى 3 × 106 هيموسيتيس يعيش يمكن الحصول على 200 المورفولوجية 3rd الطور اليرقات في 30 دقيقة للعدوى السابقين فيفو . وبدلاً من ذلك، يمكن أن يكون هيموسيتيس المصابة في الجسم الحي من خلال حقن 3 يرقات الطورrd تليها استخراج هيموسيتي إلى 24 ساعة بعد الإصابة. هذه الخلايا المصابة الابتدائية كانت ثابتة والملون، وتصويرها باستخدام الفحص المجهري [كنفوكل]. بعد ذلك، تم إنشاؤها تمثيلات ثلاثية الأبعاد من الصور لإظهار غزو الممرض نهائياً. بالإضافة إلى ذلك، يمكن الحصول على الحمض النووي الريبي عالية الجودة قرت PCR للكشف عن العوامل الممرضة مرناً في أعقاب الإصابة، وبروتين كافية يمكن أن تستخلص من هذه الخلايا لتحليل لطخة غربية. أخذت معا، نقدم وسيلة للمصالحة محددة من غزو العوامل الممرضة وتأكيد الإصابة باستخدام أنواع مسببات الأمراض البكتيرية والفيروسية وطريقة فعالة لاستخراج هيموسيتي للحصول على ما يكفي هيموسيتيس الحية من المورفولوجية يرقات لتجارب العدوى السابقين فيفو و في فيفو .
Introduction
Melanogaster المورفولوجية كائن نموذج راسخة لدراسة الحصانة الفطرية1. خلال الاستجابة المناعية الفطرية، هيموسيتيس دوراً هاما في الاستجابة للتحدي الممرض. هيموسيتيس ذات أهمية حاسمة لتغليف الطفيليات، فضلا عن وجود وظيفة هامة في مكافحة مسببات المرض عن طريق عمل متجولة أثناء الإصابة الفطرية والفيروسية والبكتيرية2،3.
من أجل فهم أفضل للمضيف الاستجابة المناعية الفطرية للعدوى الميكروبية المسببة للأمراض، من المهم أن تصور كيف يغزو الممرض الخلايا المضيفة أثناء الإصابة. ويسهم هذا التصور فهم الآلية للغزو. جنبا إلى جنب مع تفاصيل عن التعريب الممرض داخل الخلايا والاستجابة الخلوية، يمكن أن توفر هذه البيانات أدلة حول استجابة المضيف للعدوى والعضيات الخلوية التي يتفاعل الميكروب. وهكذا، يمكن إعادة بناء نموذج ثلاثي الأبعاد بعد التصوير بواسطة الفحص المجهري مفيدة لتحديد الموقع الدقيق للعوامل الممرضة في الخلايا المضيفة. في هذه الدراسة، يمكننا تصور غزو الكوكسيلا البورنيتية (C. بورنيتيه)، المسبّب من حمى Q، أمراض الحيوانية المصدر التي يشكل تهديدا خطيرا لصحة الإنسان والحيوان على حد سواء، في الابتدائي المورفولوجية هيموسيتيس. في الآونة الأخيرة، اتضح أن المورفولوجية معرضة لمستوى السلامة الأحيائية 2 "ميل تسعة" المرحلة الثانية (نميي) استنساخ سلالة البورنيتية جيم- 4 وأن هذه السلالة غير قادرة على إجراء نسخ متماثل في المورفولوجية4، مشيراً إلى أن المورفولوجية يمكن استخدامها ككائن نموذج لدراسة إمراضية البورنيتية جيم .
الدراسات السابقة استخدمت هيموسيتيس لدراسة الاستجابة المناعية الفطرية للمضيف. وقد استخدمت هيموسيتيس للملاحظات المورفولوجية5،،من67، البلعمه التحليل2،3قرة-بكر2 ، شكلي التحليل2،8 , 9، تحليل إيممونوفلوريسسينت10،12إيمونوستاينينج13،، إيمونوبلوتينج3،10،10،إيمونوبريسيبيتيشن11 9، 11 وإيمونوهيستوتشيميستري14. على الرغم من أن الخلايا S2 المورفولوجية متاحة أيضا لمختلف التجارب في المختبر ، تخليد واحتمال العدوى الفيروسية الموجودة من قبل تغيير على15،السلوك16. استخدام الخلايا الأولية بدلاً من خط خلية مخلدة، مثل الخلايا S2، يسمح لدراسة وظيفة المناعة الفطرية في نظام أكثر تمثيلاً في الحي كله. بالإضافة إلى ذلك، يسمح العدوى من هيموسيتيس في فيفو، قبل الاستخراج، الخلايا للتفاعل مع بروتينات المضيف والأنسجة، وميزة على استخراج هيموسيتيس قبل السابقين فيفو العدوى الأخرى. وقد استخدمت عددا من الأساليب المختلفة للحصول على عدد كاف من هيموسيتيس في فترة قصيرة من الزمن أن تبقى على قيد الحياة8،هيموسيتيس17،،من1819.
في هذه الدراسة، نقدم طريقة لاستخراج هيموسيتيس من يرقات الطورrd المورفولوجية 3 للعدوى الميكروبية المسببة للأمراض مع جيم-البورنيتية، الليستريه المستوحدة (الليستريا) أو اللافقاريات قزحي الألوان فيروس 6 (IIV6). يصف لنا طرق العدوى هيموسيتي في فيفو و السابقين فيفو على حد سواء. في فيفو-و السابقين فيفو-هيموسيتيس المصابة كانت تصور مع الفحص المجهري [كنفوكل] وتستخدم لبناء نماذج ثلاثية الأبعاد لغزو البورنيتية جيم . بالإضافة إلى ذلك، باستخدام بروتوكول الاستخراج، السابقين فيفو-هيموسيتيس المصابة واستخدمت تعبير الجينات والبروتين فحوصات. على وجه التحديد، لدراسة مدى العدوى مع IIV6 والليستيريا، مجموع الحمض النووي الريبي أو البروتين كانت معزولة من خلايا بكر qRT أو تحليل لطخة غربية. أخذت معا، البروتوكول يوفر أساليب لسرعة جمع إعداد كبيرة من هيموسيتيس من 3rd الطور اليرقات والأدلة أن المصابين هيموسيتيس الأولية، أما في فيفو أو فيفو السابقين، وهي منبر مناسب للجراثيم الممرض الإصابة بالدراسات والتحليلات المتلقين للمعلومات السارية مثل الفحص المجهري، ترانسكريبتوميكس، والبروتينات.
Access restricted. Please log in or start a trial to view this content.
Protocol
1-الإصابة السابقين فيفو
- المتوسطة والمعدات
- تحت ظروف معقمة، إعداد جديدة المورفولوجية هيموسيتي عزل المتوسطة (دهيم) التي تحتوي على 75% شنايدر المورفولوجية متوسطة مع 25% مصل بقرى الجنين (FBS) وتصفية تعقيم أنه.
- الطبقة 2-3 قطعة من الفيلم البارافين 10 سم × 10 سم تحت ستيريوميكروسكوبي.
- إعداد الشعرية الزجاج. تعيين سخان ساحبة الشعرية إلى 55 في المائة من الحد الأقصى. سحب الأنبوبة الشعرية إلى نقطة حادة من حوالي 10 ميكرون.
- الردم شعري مع الزيت المعدني.
- تجميع الأنبوبة الشعرية شغلها على نانوينجيكتور (الشكل 1أ)، وفتح طرف الأنبوبة الشعرية تنصهر بقطع الحافة بالملقط (الشكل 1ب). يجب أن يكون القطر الخارجي من الطرف 100 ميكرومتر لامتصاص سهلة هيموسيتيس.
- إخراج النفط قدر ممكن من طرف الأنبوبة الشعرية، ثم ملء مع دهيم. لسهل التصور الحدود المتخذة حتى hemolymph والنفط، وتشمل فقاعة هواء بين النفط ودهيم (الشكل 1ب').
- استخراج هيموليمف
- اختيار 3rd instar اليرقات المورفولوجية من الداخل جدار أغذية زجاجة برفق باستخدام الملقط ووضعها في مصفاة 100 ميكرومتر (الشكل 1ج). وتوجد يرقات الطورrd 3 3-6 أيام بعد البيض خصبة زرع بأنثى راشدة.
ملاحظة: تستخدم هذه التجارب على النمط الوراثي، ث1118؛ ف {w+ mC= Hml GAL4.Δ} 2، ف {w+ mC= UAS-2xEGFP} AH2، حيث هيموسيتيس من هذه الحيوانات التعبير عن البروتين المعزز الفلورية الخضراء (اجفب) للمساعدة في تحديد الخلايا عن طريق الفحص المجهري. - صب 5 مل الماء المعقم على اليرقات ويهز المصفاة لمكان س. 5 المصفاة على مهمة مسح لإزالة الماء الزائد (الشكل 1ج').
- نقل اليرقات في أنبوب ميكروسينتريفوجي 1.5 مل. تخدير لهم مع شركة الغاز2 5 s (الشكل 1د).
- وضع اليرقات على الفيلم البارافين تحت ستيريوميكروسكوبي، مع الظهرية الجانب مواجهة (الشكل 2أ).
- مكان الزجاج الشعرية طفيفة على الجسم الخلفي اليرقات أنه عقد في مكان وتعطيل بشرة الخلفي فتح باستخدام الملقط أشار غرامة (الشكل 2ب).
- تسمح هيموليمف بالتدفق على الفيلم البارافين (الشكل 2-ج).
- تقديم مجموعة هيموليمف بما في ذلك هيموسيتيس من 20-50 يرقة في كل مرة على الفيلم البارافين.
- تناول hemolymph المجمعة باستخدام الزجاج الشعرية في نانوينجيكتور (الشكل 2د).
ملاحظة: ينبغي أن يكون هناك ما يقرب من 10-20 ميليلتر من hemolymph. - إخراج هيموليمف في أنبوب ميكروسينتريفوجي 1.5 مل تحتوي على 500 ميليلتر من دهيم (الشكل 2ه).
- كرر الخطوات من 1.2.4)-1.2.9) لكل دفعة من اليرقات.
- اختيار 3rd instar اليرقات المورفولوجية من الداخل جدار أغذية زجاجة برفق باستخدام الملقط ووضعها في مصفاة 100 ميكرومتر (الشكل 1ج). وتوجد يرقات الطورrd 3 3-6 أيام بعد البيض خصبة زرع بأنثى راشدة.
- حساب عدد هيموسيتيس.
- "الماصة؛" 5 ميليلتر من 0.4% تريبان الأزرق الحل في أنبوب ميكروسينتريفوجي مل 0.6 وصمة عار الخلايا الميتة. بلطف مزيج دهيم وهيموسيتيس في أنبوب 1.5 مل استخدام ماصة، ونقل 5 ميليلتر من دهيم بما في ذلك هيموسيتيس إلى أنبوب ميكروسينتريفوجي 0.6 مل وتخلط بلطف.
- "الماصة؛" 10 ميليلتر من الخلايا من 1:1 تريبان الأزرق: هيموسيتي الخليط إلى هيموسيتوميتير.
- حساب عدد هيموسيتيس الحية التي هي ليست ملطخة تريبان الأزرق في كل مجال من مجالات الركن 4 هيموسيتومتير وحساب تركيز هيموسيتيس في المليلتر باستخدام الصيغة:
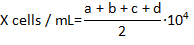
حيث X هو تركيز هيموسيتيس يعيش في المليلتر؛ أ، ب، ج، ود يتم عد الخلايا الحية (كما يحددها الاستبعاد تريبان الأزرق) في كل 4 من الحقول في هيموسيتوميتير. شعبة 2 من العدد الكلي للخلايا التي تم عدها بسبب تمييع الخلايا مع تريبان الأزرق 1:1. وتعتبر الخلايا ملطخة تريبان الأزرق الميت.
-
السابقين فيفو التهابات
- تحديد يتطابق العدد الآبار أن المصنف مع الخلايا استناداً إلى تيميبوينتس والبيولوجية اللازمة لكل تجربة. 5.0 × 10 هيموسيتيس4 تكون مرغوبة لتنقية البروتين والحمض النووي الريبي بعد الإصابة.
- حساب حجم المخزون الممرض أن تضعف مع دهيم للإصابة باستخدام الصيغة التالية:
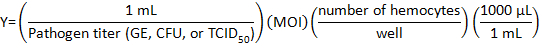
حيث تعدد العدوى (وزارة الداخلية) هو عدد الفيروسية أو البكتيريا المطلوب كل خلية.
ملاحظة: وزارة الداخلية المستخدمة يعتمد على التجربة الفردية وإجراء فحوصات. هنا، 10 الجينوم مكافئات (شركة جنرال الكتريك)/استخدمت خلية البورنيتية جيم-10 زيمبابوي/خلية من الليستيرياأو تسيد 150/الخليوي من IIV6. - إعداد 500 ميليلتر من الممرض المتوسطة لكل بئر من صفيحة 24-جيدا بإضافة وحدة التخزين السليم من دهيم إلى وحدة التخزين الفيروسية أو البكتيرية في أنبوب.
- مكان مم 12 جولة تغطية الزجاج (سمك رقم 1) في بئر صفيحة 24-جيدا.
- تقسيم دهيم بما في ذلك في هيموسيتيس في آبار صفيحة 24-جيدا.
- إضافة 500 ميليلتر من الممرض المتوسطة إلى هيموسيتيس في بئر.
- الطرد المركزي اللوحة في 1,000 س ز لمدة 5 دقائق.
- احتضان لوحة ح 1 في 28 درجة مئوية. كل 15 دقيقة، بلطف إمالة اللوحة من العودة إلى الجبهة، ثم من اليسار إلى اليمين ل 5 s باليد.
- بعد ح 1 من الخطوة الغزو/مرفق 1.4.8)، بلطف "الماصة؛" قبالة متوسطة الممرض وتغسل هيموسيتيس مع دهيم جديدة، وإعادة ملء ذلك مع 500 ميليلتر من دهيم الطازجة.
- احتضان هيموسيتيس المصابة للوقت المطلوب. في هذه التجارب، البورنيتية جيم--أو هي المحتضنة المصابين IIV6 هيموسيتيس ح 24، و الليستيريا-هيموسيتيس المصابة هي المحتضنة ل 1 أو 2 أو 4 ح.
2-الإصابة في فيفو
- العدوى
- الدافئة التي تصنع لوحة أجار المورفولوجية عصير الفاكهة في درجة حرارة الغرفة للوحات 15 دقيقة كما سبق وصف20.
- أضف 30 غ أجار إلى 700 مل من الماء والاوتوكلاف عليه لمدة 40 دقيقة.
- حل ز 0.5 من ميثيل بارابين في 10 مل إيثانول المطلقة.
- إضافة حل بارابين الميثيل إلى 300 مل مركزات عصير الفواكه.
- بسرعة مزيج عصير التركيز في المحلول يعقم أجار والاستغناء عن مل 5 إلى 10 × 35 ملم أطباق بيتري.
- بعد اللوحات قد يبرد لمدة 15 دقيقة، تخزينها في 4 درجات مئوية.
- إعداد 3 يرقات الطورrd اتباع الخطوات 1.2.1)-1-2-3).
- ضع لصق الخميرة على صفيحة أجار. جعل خفض غرامة في لوحة أجار حيث يمكن أن تهاجر اليرقات تجنب التجفيف (الشكل 3أ). تجميع إبرة تنغستن أشار 0.001 مم مع عقد الملقط استخدام البارافين الفيلم (الشكل 3ب، ج).
- "الماصة؛" 50 ميليلتر من عيار عالي مشري أعرب-جيم-البورنيتية (5.95 × 109 GE/mL) على البارافين الفيلم تحت المجهر الاستريو ووضع اليرقات في التجمع للبكتيريا.
- وضع اليرقات في التجمع للبكتيريا. وخز اليرقات بإبرة تنغستن (الشكل 3د). نقل اليرقات على صفيحة أجار (الشكل 3ه).
- نقل متوسطة الممرض المتبقية على لوح أجار وختم اللوحة مع الفيلم البارافين.
- تبقى اليرقات في اللوحة في الهواء الرطب حتى العدوى بعد انتهاء الوقت المطلوب (الشكل 3و). في هذه التجربة، البورنيتية جيم--يرقات مصابة على لوحة ح 24.
- الدافئة التي تصنع لوحة أجار المورفولوجية عصير الفاكهة في درجة حرارة الغرفة للوحات 15 دقيقة كما سبق وصف20.
- استخراج hemolymph والطلاء هيموسيتيس
- تعد المتوسطة والمعدات بعد الخطوة 1، 1).
- مكان مم 12 جولة تغطية الزجاج (سمك رقم 1) في بئر صفيحة 24-جيدا. "الماصة؛" 500 ميليلتر من دهيم في البئر.
- استخراج هيموليمف من اليرقات المصابة اتباع الخطوات 1.2.4)-1.2.8).
- إخراج هيموليمف إلى التالية أيضا خطوة 2.2.2).
- كرر 2.2.3) و 2.2.4) لمجموعات متعددة من اليرقات.
- الطرد المركزي اللوحة في 1,000 س ز لمدة 5 دقائق.
3-التصور
- تحديد، وتلطيخ
- بعد السماح هيموسيتيس ليستقر على الزجاج غطاء جولة في البئر، إزالة بلطف في المتوسط من كل بئر.
- بلطف إضافة 200 ميليلتر من 4% بارافورمالدهيد (PFA) إلى كل من هيموسيتيس تمت تسويتها جيدا. احتضان هيموسيتيس لمدة 20 دقيقة في درجة حرارة الغرفة.
- إزالة 4% منهاج عمل بيجين وإضافة 200 ميليلتر من برنامج تلفزيوني يحتوي على 0.1% بلطف تريتون X-100 و 1% ألبومين المصل البقري (BSA) لكل بئر. احتضان هيموسيتيس لمدة 10 دقائق في درجة حرارة الغرفة.
- إزالة برنامج تلفزيوني ولطف إضافة 200 ميليلتر من 1 × 4 ', 6-دياميدينو-2-فينيليندولي (DAPI) لكل بئر. احتضان هيموسيتيس لمدة 10 دقائق في الظلام في درجة حرارة الغرفة.
- إزالة الحل DAPI وإضافة برنامج تلفزيوني برفق لكل بئر. احتضان هيموسيتيس لمدة 5 دقائق في درجة حرارة الغرفة.
- إسقاط 10 ميليلتر من المتوسطة التركيب أنتيفادي على شريحة الميكروسكوب زجاجية.
- بعد إزالة برنامج تلفزيوني من كل بئر، إزالة الزجاج غطاء من لوحة 24-جيدا باستخدام الملقط أشار غرامة. بلطف مكان الزجاج غطاء على المتوسط تصاعد أنتيفادي على الشريحة الزجاجية، مع هيموسيتيس إلى الأسفل.
- تسمح الشريحة لتجف بوضعه في ليل الظلام.
- تصوير [كنفوكل]
- تكوين المجهر [كنفوكل] للتصوير بالألوان الثلاثة DAPI، اجفب، ومشري. استخدم الإعداد التالي: الإثارة DAPI (السابقين) 405 نانومتر، والانبعاثات (م) 415-480 نانومتر؛ اجفب ت 488 نانومتر، م 493-564 نانومتر؛ مشري ت 587 نانومتر، م 597-700 نانومتر.
- ضع العينة على المجهر والتركيز على العينة من 63 X باستخدام/1.4 الفتحة العددية (غ) الهدف. حدد موقع هيموسيتيس المرجوة في مجال الرؤية للتصوير.
- ضبط المكاسب السلطة وكاشف الليزر لتحقيق التعرض المناسب للعينة. تحقق من z-طائرات متعددة للتأكد من مستوى التعرض المناسب لسمك العينة كاملة.
- العثور على الموضع العلوي والسفلي على محور ع هيموسيتي كله. تعيين هذه المواقع كمواقع بداية ونهاية لتقطيع z.
- استخدم التكبير المسح الضوئي للصورة المساحة التي تحتوي هيموسيتي فقط. غالباً ما تستخدم عوامل التكبير 3 X.
- جمع سلسلة الصورة بدقة مناسبة مثل 1024 × 1024 بكسل في طائرة س-ص، و 0.3 ميكرومتر التباعد في البعد z.
- إعادة بناء نموذج ثلاثي الأبعاد
ملاحظة: البرمجيات المفتوحة المصدر موجود يقوم بالعديد من المهام المبينة أدناه لإعادة بناء نموذج ثلاثي الأبعاد.- استيراد ملف سلسلة مقطوع زي الصورة في البرامج المرتبطة بالمجهر [كنفوكل] لتعمير النموذج الثلاثي الأبعاد.
- حدد خلية يظهر التعريب المشارك نويات ملطخة DAPI ومشري معربا عن البورنيتية جيم في اجفب التعبير عن هيموسيتي. اقتصاص صورة سلسلة لاحتواء الخلية واحد فقط.
- حدد خيار عارض ثلاثي الأبعاد الذي يعيد بناء نموذج ثلاثي الأبعاد باستخدام خوارزمية البرمجيات الجاهزة. اختر نوع 3D التمثيل بين خيارات مختلطة والسطح ومزيج المرجوة. في هذا الأسلوب، يتم إظهار هيموسيتيس ونوى البورنيتية جيم- استخدام نماذج السطح.
- مراقبة الخلية أعيد بناؤها 3D من عرض المواقف المختلفة بالضغط على زر الماوس وسحب المؤشر حول الشاشة. ضبط اتجاه الخلية وموضع مصدر الضوء على غرار لتحسين الصورة. وتوجد خيارات أخرى للتعتيم والحد الأدنى والحد الأقصى، براق، المحيطة، شينينيس، وغاما لتحسين الصورة.
- تأخذ المقاطع العرضية من خلال نموذج باستخدام أوامر لقطة وتقطيع لتصور المحتويات الداخلية هيموسيتي.
4-تطبيق لتحليل الجينات و/أو البروتين
- عقب العدوى مع IIV6 الليستيريا، خلايا بكر قرت اللاحقة أو تحليل لطخة غربية كما تم وصفه سابقا21 وإرشادات الشركة المصنعة التالية.
ملاحظة: تشير الجدول للمواد للإشعال لبكر قرة والأجسام المضادة للطخة غربية. - تحليل منتجات PCR قبل [اغروس] هلام التفريد، كما هو موضح سابقا22، لضمان طول السليم للمنتج تضخيم.
Access restricted. Please log in or start a trial to view this content.
النتائج
جمع العيش هيموسيتيس للعدوى السابقين فيفو ، إلى 3 × 106 هيموسيتيس استخرجت من 200 المورفولوجية 3rd الطور اليرقات. تطوير أسلوبنا، جرت محاولة عدد من التقنيات المختلفة. تشريح اليرقات الفردية أن تصل إلى 1.5 ح، ومتوسط الخلايا ~ 8000 تم الحصول عليها باستخدام هذا الأ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
لفهم كيف تصاب الخلايا المضيفة، من المهم توضيح إضفاء الطابع المحلي على الممرض في الخلايا، ولا سيما عند تجارب على الممرض لم تختبر سابقا و تركيبات نوع الخلية4. بينما تدرس تتالي الاستجابة الخلوية بعد الإصابة يمكن أن تشير إلى غزو الممرض الإنتاجية، مزيج بيانات الاستجابة الخلوية وا...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب يعلن أن لديهم لا تضارب المصالح المالية.
Acknowledgements
ونحن ممتنون للدكتور روبرت هينزين لتوفير مخزون من التعبير عن متشيري الكوكسيلا البورنيتية. ونحن نشكر الدكتور لويس تيكسيرا لتوفير مركز الأسهم بلومينغتون واللافقاريات فيروس قزحي الألوان 6 لتوفير الأرصدة يطير. وكان تمويل هذا المشروع في جزء من المعاهد الوطنية للصحة منحة R00 AI106963 (A.G.G.)، وجامعة ولاية واشنطن.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Schneider's Drosophila Medium | Thermo Fisher Scientific (Gibco) | 21720024 | 1.1.1), 2.1.2) |
| Fetal Bovine Serum | GE Healthcare Life Sciences (HyClone) | SH30070.03HI | 1.1.1), 2.1.2) |
| Filter (0.22 µL) | RESTEK | 26158 | 1.1.1) |
| Strainer (100 µm) | Greiner bio-one | 542000 | 1.2.1), 2) |
| Stereo microscope | Amscope | SM-1BSZ-L6W | 1.2), 2) |
| Glass capillary | Fisher Scientific | 21-171-4 | 1.1), 1.2), 2) |
| Capillary puller | Narishige International USA, Inc. | PC-10 | 1.1.3) |
| Mineral oil | Snow River Products | 1.1.4) | |
| Nanoinjector | Drummond Scientific Company | 3-000-204 | 1.1), 1.2), 2.2) |
| Forceps | VWR | 82027-402 | 1.1.5), 1.2), 2), 3.1.7) |
| CO2 delivery apparatus | Genesee Scientific | 59-122BC | 1.2), 2) |
| Trypan Blue | Thermo Fisher Scientific (Gibco) | 15250061 | 1.3) |
| Hemocytometer | Hausser Scientific | 3100 | 1.3) |
| 24 well plate | Greiner bio-one | 662160 | 1.4), 2.2) |
| Coxiella burnetii - mCherry | Dr. Heinzen, R. | 1.4), 2.2) | |
| Drosophila fruit juice plates | Cold Spring Harbor Protocols | 2.1) http://cshprotocols.cshlp.org/content/2007/9/pdb.rec11113.full | |
| Agar | Fisher Bioreagents | BP1423-500 | 2.1.1.1) |
| Methyl paraben | Amresco | 0572-500G | 2.1.1.2) |
| Absolute ethanol | Fisher Bioreagents | BP2818-500 | 2.1.1.2) |
| Welch's 100% Grape juice frozen concentrate, 340 mL | Amazon | B0025UJVGM | 2.1.1.3) |
| Petri dishes, 10 x 35 mm | Fisher Scientific | 08-757-100A | 2.1.1.4) |
| Microscope cover glass | Fisher Scientific | 12-545-80 | 1.4.4), 2.2.2) |
| Yeast, Bakers Dried Active | MP Biomedicals | 0210140001 | 2.1) Add 2 parts of water to 1 part of yeast (v/v) |
| Tungsten needle | Fine Science Tools | 10130-20 | 2.1) |
| Holding forceps | VWR | HS8313 | 2.1) |
| Paraformaldehyde | Fisher Scientific | FLO4042-500 | 3.1.3) |
| Triton X-100 | Fisher Scientific | BP151-500 | 3.1.3) |
| Bovine Serum Albumin | Fisher Scientific | BP9706-100 | 3.1.3) |
| 4',6-diamidino-2-phenylindole | Thermo Fisher Scientific | 62247 | 3.1.4) |
| Antifade mounting medium | Thermo Fisher Scientific | P36930 | 3.1.6) |
| Confocal microsope | Leica | TCS SP8-X White Light Confocal Laser Scanning Microscope | 3.2) |
| 3D imaging reconstruction software | Leica | LASX with 3D visualization module | 3.3) |
| Microscope slides | Fisher Scientific | 12-552-3 | 3.1.6) |
| Invertebrate iridescent virus 6 (IIV6) | Dr. Teixeria, L. | 4) PLoS Biol, 6 (12), 2753-2763, doi: 10.1371/journal.pbio.1000002, (2008) | |
| Listeria monocytogenes | ATCC | strain: 10403S | 4) Listeria monocytogenes strain 10403S (Bishop and Hinrichs, 1987) was grown in Difco Brain-heart infusion (BHI) broth (BD Biosciences) containing 50 µg/ml streptomycin at 30 °C. |
| DNase I | Thermo Fisher Scientific(Invitrogen) | 18068015 | gDNA degradation |
| cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| IIV6_193R_F | IDT | qRT-PCR, 5'- TCT TGT TTT CAG AAC CCC ATT -3' | |
| IIV6_193R_R | IDT | qRT-PCR, 5'- CAC GAA GAA TGA CCA CAA GG -3' | |
| RpII_qRTPCR_fwd | SIGMA-ALDRICH | qRT-PCR, 5'- GAA GCG TTT CTC CAA ACG -AG | |
| RpII_qRTPCR_rev | SIGMA-ALDRICH | qRT-PCR, 5'- TTG AGC GTA AGC ATC ACC -TG | |
| SYBR Green qRT-PCR reagent | Thermo Fisher Scientific | K0251, K0252, K0253 | qRT-PCR |
| Real-Time PCR System | Thermo Fisher Scientific | 4351107, 7500 Software v2.0 | qRT-PCR |
| Anti-Listeria monocytogenes antibody | abcam | ab35132 | Western blot |
| Anti-Actin antibody produced in rabbit | SIGMA-ALDRICH | A2066 | Western blot |
| Anti-Rabbit IgG (H+L), HRP Conjugate | Promega | W4011 | Western blot |
References
- Hoffmann, J. A. The immune response of Drosophila. Nature. 426 (6962), 33-38 (2003).
- Regan, J. C., et al. Steroid hormone signaling is essential to regulate innate immune cells and fight bacterial infection in Drosophila. PLoS Pathog. 9 (10), 1003720(2013).
- Yano, T., et al. Autophagic control of listeria through intracellular innate immune recognition in Drosophila. Nat Immunol. 9 (8), 908-916 (2008).
- Bastos, R. G., Howard, Z. P., Hiroyasu, A., Goodman, A. G. Host and Bacterial Factors Control Susceptibility of Drosophila melanogaster to Coxiella burnetii Infection. Infect Immun. 85 (7), (2017).
- Kacsoh, B. Z., Schlenke, T. A. High hemocyte load is associated with increased resistance against parasitoids in Drosophila suzukii, a relative of D. melanogaster. PLoS One. 7 (4), 34721(2012).
- Tsuzuki, S., et al. Switching between humoral and cellular immune responses in Drosophila. is guided by the cytokine GBP. Nat Commun. 5, 4628(2014).
- Kurucz, E., et al. Definition of Drosophila. hemocyte subsets by cell-type specific antigens. Acta Biol Hung. 58, Suppl 95-111 (2007).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods. 68 (1), 116-128 (2014).
- Arefin, B., et al. Apoptosis in Hemocytes Induces a Shift in Effector Mechanisms in the Drosophila. Immune System and Leads to a Pro-Inflammatory State. PLoS One. 10 (8), 0136593(2015).
- Rus, F., et al. Expression pattern of Filamin-240 in Drosophila blood cells. Gene Expr Patterns. 6 (8), 928-934 (2006).
- Kurucz, E., et al. Hemese, a hemocyte-specific transmembrane protein, affects the cellular immune response in Drosophila. P Natl Acad Sci USA. 100 (5), 2622-2627 (2003).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. P Natl Acad Sci USA. 106 (12), 4805-4809 (2009).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biol Open. 4 (3), 355-363 (2015).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. P Natl Acad Sci USA. 101 (39), 14192-14197 (2004).
- Flynt, A., Liu, N., Martin, R., Lai, E. C. Dicing of viral replication intermediates during silencing of latent Drosophila viruses. P Natl Acad Sci USA. 106 (13), 5270-5275 (2009).
- Jovel, J., Schneemann, A. Molecular characterization of Drosophila cells persistently infected with Flock House virus. Virology. 419 (1), 43-53 (2011).
- Stoepler, T. M., Castillo, J. C., Lill, J. T., Eleftherianos, I. A simple protocol for extracting hemocytes from wild caterpillars. J Vis Exp. (69), e4173(2012).
- Sampson, C. J., Williams, M. J. Protocol for ex vivo incubation of Drosophila primary post-embryonic haemocytes for real-time analyses. Methods Mol Biol. 827, 359-367 (2012).
- Nehme, N. T., et al. A model of bacterial intestinal infections in Drosophila melanogaster. PLoS Pathog. 3 (11), 173(2007).
- Drosophila fruit juice egg plates. Cold Spring Harbor Protocols. (9), pdb.rec11113 (2007).
- Ahlers, L. R., Bastos, R. G., Hiroyasu, A., Goodman, A. G. Invertebrate Iridescent Virus 6, a DNA Virus, Stimulates a Mammalian Innate Immune Response through RIG-I-Like Receptors. PLoS One. 11 (11), 0166088(2016).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), (2012).
- Petraki, S., Alexander, B., Bruckner, K. Assaying Blood Cell Populations of the Drosophila melanogaster Larva. J Vis Exp. (105), (2015).
- Figliozzi, R. W., Chen, F., Chi, A., Hsia, S. C. Using the inverse Poisson distribution to calculate multiplicity of infection and viral replication by a high-throughput fluorescent imaging system. Virol Sin. 31 (2), 180-183 (2016).
- Rizki, T. M., Rizki, R. M. Lamellocyte differentiation in Drosophila. larvae parasitized by Leptopilina. Dev Comp Immunol. 16 (2-3), 103-110 (1992).
- Markus, R., Kurucz, E., Rus, F., Ando, I. Sterile wounding is a minimal and sufficient trigger for a cellular immune response in Drosophila melanogaster. Immunol Lett. 101 (1), 108-111 (2005).
- McCormack, R., et al. Perforin-2 Protects Host Cells and Mice by Restricting the Vacuole to Cytosol Transitioning of a Bacterial Pathogen. Infect Immun. 84 (4), 1083-1091 (2016).
- Ozgen, A., et al. Construction and characterization of a recombinant invertebrate iridovirus. Virus Res. 189, 286-292 (2014).
- Jakob, N. J., Muller, K., Bahr, U., Darai, G. Analysis of the first complete DNA sequence of an invertebrate iridovirus: coding strategy of the genome of Chilo iridescent virus. Virology. 286 (1), 182-196 (2001).
- Ghigo, E., Colombo, M. I., Heinzen, R. A. The Coxiella burnetii parasitophorous vacuole. Adv Exp Med Biol. 984, 141-169 (2012).
- Liu, F., et al. Drosophila melanogaster prophenoloxidases respond inconsistently to Cu2+ and have different activity in vitro. Dev Comp Immunol. 36 (3), 619-628 (2012).
- De Gregorio, E., et al. An immune-responsive Serpin regulates the melanization cascade in Drosophila. Dev Cell. 3 (4), 581-592 (2002).
- Kari, B., et al. The raspberry Gene Is Involved in the Regulation of the Cellular Immune Response in Drosophila melanogaster. PLoS One. 11 (3), 0150910(2016).
- Wu, A. R., et al. Quantitative assessment of single-cell RNA-sequencing methods. Nat Methods. 11 (1), 41-46 (2014).
- Buettner, F., et al. Computational analysis of cell-to-cell heterogeneity in single-cell RNA-sequencing data reveals hidden subpopulations of cells. Nat Biotechnol. 33 (2), 155-160 (2015).
- Nevil, M., Bondra, E. R., Schulz, K. N., Kaplan, T., Harrison, M. M. Stable Binding of the Conserved Transcription Factor Grainy Head to its Target Genes Throughout Drosophila melanogaster Development. Genetics. 205 (2), 605-620 (2017).
- Yang, C. P., et al. Transcriptomes of lineage-specific Drosophila neuroblasts profiled by genetic targeting and robotic sorting. Development. 143 (3), 411-421 (2016).
- Jaitin, D. A., et al. Dissecting Immune Circuits by Linking CRISPR-Pooled Screens with Single-Cell RNA-Seq. Cell. 167 (7), 1883-1896 (2016).
- Karaiskos, N., et al. The Drosophila embryo at single-cell transcriptome resolution. Science. 358 (6360), 194-199 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved