A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
החילוץ של Hemocytes של הזחלים דרוזופילה melanogaster זיהום מיקרוביאלי וניתוח
In This Article
Summary
שיטה זו מדגימה כיצד להמחיש הפתוגן הפלישה לתוך תאים חרקים עם דגמים תלת ממדיים (3D). Hemocytes של הזחלים דרוזופילה נדבקו בנגיף פתוגנים נגיפי או חיידקי, או vivo לשעבר או ויוו. Hemocytes נגוע היו לאחר מכן קבועה, צבעונית עבור הדמיה עם מיקרוסקופ קונפוקלי, עוקבות שיחזור תאי תלת-ממד.
Abstract
במהלך זיהום פתוגניים של דרוזופילה melanogaster, hemocytes יש תפקיד חשוב בתגובה החיסונית לאורך כל הזיהום. לכן, המטרה של פרוטוקול זה היא לפתח שיטה כדי להמחיש את פלישת פתוגן בתא החיסון הספציפי של זבובים, כלומר hemocytes. באמצעות השיטה המוצגת כאן, עד 3 × 106 hemocytes בשידור חי ניתן להשיג 200 דרוזופילה 3rd לחלל הזחלים 30 דקות לשעבר vivo זיהום. לחלופין, hemocytes יכולים להיות נגועים ויוו באמצעות הזרקה של 3rd לחלל הזחלים ואחריו hemocyte החילוץ עד 24 שעות לאחר הפגיעה. אלו תאים נגועים הראשי היה קבוע, צבעונית, עם תמונה באמצעות מיקרוסקופיה קונפוקלית. לאחר מכן, ייצוגים תלת-ממד נוצרו מן התמונות להראות באופן מוחלט לפלישה הפתוגן. בנוסף, ה-RNA באיכות גבוהה עבור לרביעיית-PCR ניתן להשיג איתור של פתוגן mRNA הבאים לזיהום, ולא מספיק חלבון יכול להיות מופק תאים אלה לניתוח תספיג חלבון. יחדיו אנו מציגים שיטה התאמת מובהק של פלישת פתוגן ואישור של זיהום באמצעות סוגי הפתוגן בקטריאליים וויראליים שיטה יעילה לחילוץ hemocyte כדי להשיג מספיק hemocytes בשידור חי של דרוזופילה הזחלים לניסויים זיהום ex-vivo ו ויוו .
Introduction
דרוזופילה melanogaster הוא אורגניזם מודל ומבוססת המחקר של מולדת חסינות1. במהלך התגובה החיסונית מולדת, hemocytes יש תפקיד חשוב בתגובה לאתגר הפתוגן. Hemocytes הם קריטיים עבור לבצע טפילים, כמו גם יש תפקיד חשוב במאבק נגד המחלה דרך פעולה phagocytic במהלך זיהום פטרייתי, ויראלי, חיידקי2,3.
על מנת להבין בצורה הטובה ביותר של המחשב המארח תגובה חיסונית מולדת לזיהום חיידקים פתוגניים, חשוב להמחיש איך הפתוגן חודר התאים המארחים במהלך זיהום. הדמיה זו תורמת להבנת המנגנון של פלישה. יחד עם הפרטים של פתוגן לוקליזציה תאיים ואת התגובה התאית, נתונים אלה יכולים לספק רמזים על התגובה מארח זיהום, את organelles הסלולר שבה אינטראקציה תא החיידק. לפיכך, דגם התלת-ממד שחזור לאחר הדמיה על ידי מיקרוסקופ יכול להיות מועיל לקבוע את המיקום המדויק של פתוגנים בתוך התאים המארחים. במחקר זה, אנו דמיינו את הפלישה Coxiella burnetii (burnetii ג), סוכן סיבתי של קדחת Q, מחלה נגיפית אשר מהווה איום רציני לבריאות האדם ושל בעלי החיים, לתוך ראשי דרוזופילה hemocytes. לאחרונה, הוכח כי דרוזופילה רגישים רמת אבטחה 2 פאזות 9 מייל II (NMII) לשבט 4 מזן burnetii ג ו הזן זה אפשרות לשכפל דרוזופילה4, המציין את דרוזופילה יכול לשמש כאורגניזם מודל ללמוד burnetii ג פתוגנזה.
מחקרים קודמים השתמשו hemocytes כדי לבדוק תגובה חיסונית מולדת של המחשב המארח. Hemocytes שימשו הבחנות מורפולוגיות5,6,7, morphometric ניתוח2,8, phagocytosis ניתוח2,3, לרביעיית-PCR2 , 9, immunoprecipitation10,11, ניתוח immunofluorescent10,12immunostaining13,3,immunoblotting10, 9, 11 ו אימונוהיסטוכימיה14. למרות דרוזופילה S2 תאים זמינים גם עבור ניסויים במבחנה שונים, immortalization, פוטנציאל זיהום ויראלי הקיימת מראש לשנות התנהגות שלהם,15,16. השימוש העיקרי תאים לעומת קו תא מונצחים, כגון תאים S2, מאפשר המחקר של תפקוד מערכת החיסון מולדים במערכת יותר ייצוגית של האורגניזם כולו. בנוסף, הזיהום של hemocytes ויוו, לפני החילוץ, מאפשר את התאים אינטראקציה עם המארח חלבונים אחרים רקמות, יתרון על החילוץ של hemocytes לפני שמחוץ זיהום. כבר מנוצל מספר שיטות שונות להשגת מספר מספיק של hemocytes בתקופה קצרה של זמן לשמור את hemocytes בחיים8,17,18,19.
במחקר זה, אנו מציגים שיטה כדי לחלץ hemocytes דרוזופילה 3rd לחלל הזחלים זיהום חיידקים פתוגניים burnetii ג, ליסטריה (ליסטריה) או חסרי חוליות ססגוני וירוס 6 (IIV6). אנו מתארים את פעולות השירות עבור זיהומים hemocyte הן vivo והן ex-vivo . In vivo- ו - ex-vivo-hemocytes הנגועים היו דמיינו מיקרוסקופיה קונפוקלית, ששימשו לבניית מודלים 3D הפלישה burnetii ג . בנוסף, באמצעות פרוטוקול החילוץ, ex-vivo-hemocytes נגועות שימשו עבור ביטוי גנים וחלבונים מבחני. באופן ספציפי, לבחון את היקף זיהום עם IIV6, ליסטריה, הכולל RNA או חלבון היה מבודד את התאים לרביעיית-PCR או ניתוח תספיג. יחדיו, הפרוטוקול מספקת שיטות לאסוף במהירות מספר גבוה של hemocytes מן 3rd לחלל הזחלים וראיות hemocytes הראשית, נגוע או ויוו או vivo לשעבר, הם פלטפורמה מתאימה עבור חיידקים הפתוגן זיהום מחקרים וניתוחים במורד הזרם הרלוונטיים כגון מיקרוסקופ, transcriptomics פרוטאומיקס.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. זיהום ex-vivo
- בינוני וציוד
- תחת תנאים סטריליים, להכין טרי דרוזופילה Hemocyte בידוד בינוני (DHIM) הכוללת של 75% שניידר דרוזופילה בינוני עם 25% סרום שור עוברית (FBS) ומסנן לחטא זה.
- שכבה 2-3 חתיכות של 10 ס"מ על 10 ס"מ הסרט פרפין תחת stereomicroscope.
- הכינו את נימי זכוכית. הגדר את החימום פולר נימי 55% לכל היותר. משוך את צינור קפילרי כדי ליצור קצה חד של-10 מיקרומטר.
- מילוי נימי עם שמן מינרלי.
- להרכיב צינור קפילרי מלא על גבי nanoinjector (איור 1א') ופתח צינור קפילרי מאוחה עצה על ידי שבירת את קצהו עם מלקחיים (איור 1B). הקוטר החיצוני של הטיפ צריך להיות 100 מיקרומטר עבור ספיגת קל של hemocytes.
- להוציא כמה שיותר שמן ככל האפשר מקצה צינור קפילרי ולאחר מכן למלא את DHIM. להמחשת קל של הגבול של hemolymph למעלה, אני מסודר, והשמן, כוללים בועת אוויר בין שמן DHIM (איור 1ב'').
- Hemolymph החילוץ
- לבחור 3rd instar דרוזופילה הזחלים מבפנים קיר של מזון שבקבוקי בעדינות באמצעות מלקחיים, למקם אותם לתוך מסננת 100 מיקרומטר (איור 1C). 3rd לחלל הזחלים מצויים 3-6 ימים בעקבות הביצה פוריה הנחת על ידי אישה מבוגרת.
הערה: ניסויים אלה להשתמש את גנוטיפ, w1118; P {w+ mC= Hml-GAL4.Δ} 2, P {w+ mC= UAS-2xEGFP} AH2, מאחר hemocytes של החיות האלה מבטאים חלבון פלואורסצנטי ירוק (EGFP) כדי לסייע בזיהוי של התאים על-ידי מיקרוסקופיה משופרות. - שופכים 5 מ ל מים סטריליים הזחלים ולנער את מסננת על המקום ס' 5 מסננת על פעילות מחיקה להסיר את עודפי המים (איור 1ג').
- להעביר את הזחלים לתוך צינור microcentrifuge 1.5 mL. עזים ומתנגד אותם עם גז CO2 5 s (איור 1D).
- מניחים את הזחלים על גבי הסרט פרפין תחת stereomicroscope, בצד הגבי פונה כלפי מעלה (איור 2א).
- מקום הזכוכית נימי בקלילות אל הגוף האחורי זחל שיצמיד אותו למקום בו לשבש את הקוטיקולה אחורי פתח באמצעות מלקחיים המחודד בסדר (איור 2B).
- אפשר את hemolymph לזרום אל הסרט פרפין (איור 2C).
- להכין מאגר של hemolymph כולל hemocytes מ- 20-50 הזחלים בכל פעם על הסרט פרפין.
- תופסים hemolymph במאגר באמצעות הזכוכית נימי-nanoinjector (איור 2D).
הערה: צריך להיות בערך 10-20 µL של hemolymph. - הוצא את hemolymph לתוך צינור microcentrifuge 1.5 mL המכיל 500 µL של DHIM (איור 2E).
- חזור על שלבים 1.2.4) - 1.2.9) על כל הזחלים.
- לבחור 3rd instar דרוזופילה הזחלים מבפנים קיר של מזון שבקבוקי בעדינות באמצעות מלקחיים, למקם אותם לתוך מסננת 100 מיקרומטר (איור 1C). 3rd לחלל הזחלים מצויים 3-6 ימים בעקבות הביצה פוריה הנחת על ידי אישה מבוגרת.
- לספור את מספר hemocytes.
- פיפטה 5 µL של 0.4% פתרון Trypan blue בצינור microcentrifuge 0.6 מ"ל כדי להכתים את התאים המתים. בעדינות לערבב את DHIM ואת hemocytes בצינור 1.5 mL באמצעות פיפטה, ולא להעביר 5 µL של DHIM כולל hemocytes אל הצינור microcentrifuge 0.6 מ"ל ומערבבים בעדינות.
- פיפטה 10 µL של תאים מ- 1:1 Trypan blue: hemocyte התערובת לתוך hemocytometer.
- לספור את מספר hemocytes בשידור חי זה לא מוכתמים Trypan כחול כל אחד מהשדות בפינה של hemocytomter ולחשב את ריכוז hemocytes למיליליטר באמצעות הנוסחה:
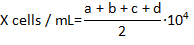
כאשר X הוא הריכוז של hemocytes חיה למיליליטר; a, b, c ו- d הם מספר תאים חיים (כפי שנקבע על ידי הדרה Trypan blue) כל 4 של השדות במניין את hemocytometer. חילוק ב 2 המספר הכולל של תאים נספרים הוא דילול 1:1 של התאים עם Trypan blue. תאים מוכתם Trypan blue נחשב מת.
-
Ex-vivo זיהומים
- לקבוע מספר בארות כדי להיות נזרע עם תאים בהתבסס על timepoints, ביולוגיים משכפל לצורך ניסוי. 5.0 × 104 hemocytes הם רצויים לטיהור RNA וחלבון בעקבות זיהום.
- לחשב את עוצמת הקול של פתוגן מניות כדי לדלל אותו עם DHIM זיהום באמצעות הנוסחה הבאה:
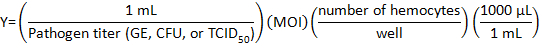
איפה ריבוי של זיהום (MOI) הוא המספר של נגיפי או חיידקים הרצוי בכל תא.
הערה: MOI בשימוש תלוי בניסוי בודדים ואת מבחני שבוצעה. . הנה, הגנום 10 מקבילות (GE) / תא burnetii ג, 10 CFU/תא ליסטריהאו 150TCID /cell של IIV6 היה בשימוש. - להכין µL 500 של פתוגן בינוני כל טוב של צלחת 24-טוב על-ידי הוספת נפח מתאים של DHIM לאמצעי האחסון נגיפי או חיידקי בשפופרת.
- המקום 12 מ מ עגול כיסוי זכוכית (מס ' 1 עובי) בטוב של צלחת 24-. טוב.
- לפצל את DHIM כולל את hemocytes לתוך בארות של צלחת 24-. טוב.
- להוסיף 500 µL של פתוגן בינוני hemocytes בטוב.
- Centrifuge את הצלחת ב 1,000 x g למשך 5 דקות.
- דגירה את הצלחת. בשביל 1 h ב- 28 מעלות צלזיוס. כל 15 דקות, להטות בעדינות את הצלחת בחזרה קבלה, ואז משמאל לימין עבור 5 s ביד.
- לאחר האחד עשר של הפלישה/מצורף צעד 1.4.8), בעדינות פיפטה את המדיום הפתוגן לשטוף את hemocytes עם DHIM טריים ו למלא אותו עם 500 µL של DHIM טריים.
- תקופת דגירה של hemocytes נגוע של הזמן המבוקש. בניסויים אלה, burnetii ג- או נגועה IIV6 hemocytes מודגרת למשך 24 שעות, ליסטריה-hemocytes נגוע מודגרת למשך 1, 2 או 4 שעות.
2. זיהום in vivo
- זיהום
- חמים צלחת אגר דרוזופילה מיץ פירות בטמפרטורת החדר במשך 15 דקות לוחות עשויים כאמור תיאר20.
- להוסיף 30 גרם של אגר 700 מ"ל של מים ושל אוטוקלב זה למשך 40 דקות.
- להמיס 0.5 גר' מתיל paraben ב- 10 מ"ל אתנול מוחלטת.
- הוסף את הפתרון paraben מתיל 300 מ ל תרכיז מיץ פירות.
- במהירות לערבב להתרכז מיץ בתוך תמיסת אגר בלוק, לוותר על 5 מ ל 10 × 35 מ מ פטרי.
- לאחר הצלחות קיררה למשך 15 דקות, לאחסן אותם ב 4 º C.
- להכין 3rd לחלל הזחלים ביצוע השלבים 1.2.1) - 1.2.3).
- מניחים את העיסה שמרים על צלחת אגר. לעשות חתך בסדר בצלחת אגר איפה הזחלים ניתן להעביר כדי למנוע ייבוש (איור 3א). להרכיב מחט טונגסטן המחודד מ מ 0.001 עם מחזיק מלקחיים באמצעות סרט פרפין (איור 3B, C).
- פיפטה 50 µL של mCherry גבוהה-כייל לביטוי -burnetii ג (5.95 × 109 ג ' נרל אלקטריק/mL) על גבי הפרפין סרט תחת המיקרוסקופ סטריאו ולמקם את הזחלים לתוך הבריכה של חיידקים.
- מקם את הזחלים לתוך הבריכה של חיידקים. . שמוק הזחלים עם מחט טונגסטן (איור 3ד') להעביר את הזחלים על גבי צלחת אגר (איור 3E).
- להעביר את המדיום הפתוגן הנותרים על צלחת אגר, לאטום את הצלחת עם סרט פרפין.
- להשאיר את הזחלים בצלחת באוויר לח עד הזיהום שלאחר הזמן הרצויים (איור 3F). בניסוי זה, burnetii ג-נגועים הזחלים הם על הצלחת במשך 24 שעות ביממה.
- חמים צלחת אגר דרוזופילה מיץ פירות בטמפרטורת החדר במשך 15 דקות לוחות עשויים כאמור תיאר20.
- Hemolymph החילוץ, ציפוי של hemocytes
- להכין את בינוני ציוד בעקבות צעד 1.1).
- המקום 12 מ מ עגול כיסוי זכוכית (מס ' 1 עובי) בטוב של צלחת 24-. טוב. פיפטה 500 µL של DHIM לתוך הבאר.
- לחלץ את hemolymph של הזחלים נגוע ביצוע השלבים 1.2.4) - 1.2.8).
- הוצא את hemolymph לתוך גם בעקבות צעד 2.2.2).
- חזור על 2.2.3) ו 2.2.4) עבור קבוצות מרובות של הזחלים.
- Centrifuge את הצלחת ב 1,000 x g למשך 5 דקות.
3. הדמיה
- תיקון ולא מכתים
- לאחר ומאפשר את hemocytes להתיישב על הזכוכית המכסה העגול בתוך הבאר, להסיר בעדינות את המדיום מכל קידוח.
- בעדינות להוסיף 200 µL של 4% paraformaldehyde (PFA) כל טוב של hemocytes התיישבו. דגירה של hemocytes עבור 20 דקות בטמפרטורת החדר.
- להסיר את % 4 מחברים ולהוסיף בעדינות µL 200 ל- PBS המכיל 0.1% טריטון X-100 ו- 1% אלבומין שור (BSA) כל טוב. דגירה של hemocytes 10 דקות בטמפרטורת החדר.
- להסיר את PBS ולהוסיף בעדינות µL 200 של 1 × 4', 6-diamidino-2-phenylindole (דאפי) כדי מכל קידוח. דגירה של hemocytes 10 דקות בחושך בטמפרטורת החדר.
- הסר את הפתרון דאפי ולהוסיף בעדינות PBS מכל קידוח. דגירה של hemocytes עבור 5 דקות בטמפרטורת החדר.
- ירידה 10 µL של המדיום antifade גובר על משטח זכוכית מיקרוסקופ.
- לאחר הסרת מגניב מכל קידוח, הסר הזכוכית המכסה הצלחת 24-ובכן באמצעות מלקחיים הארכית פיין. הנח בעדינות את הזכוכית המכסה על המדיום הרכבה antifade בשקופית זכוכית, עם hemocytes פונה כלפי מטה.
- לאפשר את השקופית להתייבש על-ידי הצבתו של הלילה האפל.
- הדמיה קונפוקלי
- קביעת התצורה של מיקרוסקופ קונפוקלי להדמיית צבע שלוש של דאפי, EGFP ו- mCherry. השתמש בהגדרה הבאה: עירור דאפי (לשעבר) 405 ננומטר, פליטה (em) 415-480 ננומטר; EGFP לשעבר 488 ננומטר, em 493-564 ננומטר; mCherry לשעבר 587 ננומטר, em 597-700 nm.
- למקם את הדגימה על המיקרוסקופ, דגש על המדגם באמצעות 63 X / 1.4 מטרת מפתח נומרי (NA). אתר hemocytes הרצוי בתחום התצוגה עבור הדמיה.
- להתאים את רווחי כוח, גלאי לייזר על מנת להשיג חשיפה המתאימה של המדגם. בדוק z-מישורים מרובים כדי להבטיח שרמת החשיפה מתאים העובי המדגם כולו.
- לאתר את המיקום העליון והתחתון על ציר z של hemocyte כולו. הגדר תפקידים אלה מיקומי ההתחלה והסיום עבור z-חלוקתה.
- השתמש רק זום סריקה תמונת אזור הכולל את hemocyte. זום גורמים של 3 X משמשים לעתים קרובות.
- לאסוף את סדרת תמונות ברזולוציה המתאימה כגון 1024 x 1024 פיקסלים במישור x-y, ומרווח 0.3 מיקרומטר בממד z.
- שחזור דגם תלת-ממד
הערה: תוכנת קוד פתוח קיימת המבצעת מהפונקציות המתוארים להלן עבור שחזור דגם התלת-ממד.- לייבא קובץ סדרת z-למחלקה התמונה לתוך התוכנה המשויכים מיקרוסקופ קונפוקלי עבור שחזור דגם התלת-ממד.
- בחר בתא מציג שיתוף לוקליזציה של גרעינים צבעונית עם דאפי, mCherry הבעת burnetii ג ב EGFP לבטא hemocyte. לחתוך את הסידרה התמונה כדי להכיל רק התא הבודד.
- בחר באפשרות הצופה 3D, אשר משחזר את דגם התלת-ממד באמצעות אלגוריתם ארוזים מראש של התוכנה. בחר בסוג הרצוי של ייצוג תלת-ממד בין תערובת, משטח ואפשרויות מעורבת. בשיטה זו, hemocytes, גרעינים, ג burnetii מוצגים באמצעות מודלים השטח.
- להתבונן התא המשוחזרת 3D מזוויות צפייה שונות על-ידי החזקת לחצן העכבר וגרירת הסמן סביב המסך. התאם את הכיוון התא ואת המיקום של מקור האור מעוצבת כדי למטב את התמונה. קיימות גם אפשרויות אחרות עבור אטימות, מינימום הסף המרבי, Specular, אמביינט, Shineness ואת גמא כדי למטב את התמונה.
- קח חתכים דרך המודל באמצעות מסיכה ואופטים כדי להמחיש את תכולת hemocyte הפנים.
4. יישום לניתוח ג'ין ו/או חלבון
- בעקבות הזיהום עם IIV6, ליסטריה, lyse תאים עבור לרביעיית עוקבות-PCR או ניתוח תספיג תיאר כאמור21 והוראות היצרן הבא.
הערה: עיין טבלה של חומרים עבור צבעי יסוד לרביעיית-PCR והנוגדנים עבור תספיג חלבון. - לנתח PCR מוצרים על ידי אלקטרופורזה בג'ל agarose, כפי שתואר לעיל22, כדי להבטיח אורך תקין של המוצר מוגבר.
Access restricted. Please log in or start a trial to view this content.
תוצאות
לחיות לאסוף hemocytes vivo לשעבר זיהום, 3 × 106 hemocytes היו מופק 200 דרוזופילה 3rd לחלל הזחלים. כדי לפתח את השיטה שלנו, נעשה ניסיון מספר טכניקות שונות. דיסקציה זחל בודדים ינצל עד 1.5 שעות, ממוצע של ~ 8000 תאים התקבלו באמצעות זו שיטה18, אשר רובם לא היו בחיים עד ...
Access restricted. Please log in or start a trial to view this content.
Discussion
כדי להבין טוב יותר איך נדבקים התאים המארחים, חשוב להבהיר הלוקליזציה של פתוגן בתאים, במיוחד כאשר ערך ניסויים על הפתוגן נבדק בעבר ותא סוג שילובים4. בעוד לומד את המפל תגובת תאי בעקבות זיהום יכול להצביע על פלישת פתוגן פרודוקטיבי, השילוב של נתוני ההיענות הדמיה וסלולריות חיוני כדי ל...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי יש להם אינטרסים כלכליים אין מתחרים.
Acknowledgements
אנחנו אסירי תודה ד ר רוברט Heinzen על מתן מניות של ביטוי mCherry Coxiella burnetii. אנו מודים ד ר לואיס טיישיירה על מתן וירוס ססגוני הגעה 6 מרכז מניות בלומינגטון מתן מניות לעוף. פרויקט זה מומן בחלקו על ידי NIH מענק R00 AI106963 (A.G.G.) ואת אוניברסיטת מדינת וושינגטון.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Schneider's Drosophila Medium | Thermo Fisher Scientific (Gibco) | 21720024 | 1.1.1), 2.1.2) |
| Fetal Bovine Serum | GE Healthcare Life Sciences (HyClone) | SH30070.03HI | 1.1.1), 2.1.2) |
| Filter (0.22 µL) | RESTEK | 26158 | 1.1.1) |
| Strainer (100 µm) | Greiner bio-one | 542000 | 1.2.1), 2) |
| Stereo microscope | Amscope | SM-1BSZ-L6W | 1.2), 2) |
| Glass capillary | Fisher Scientific | 21-171-4 | 1.1), 1.2), 2) |
| Capillary puller | Narishige International USA, Inc. | PC-10 | 1.1.3) |
| Mineral oil | Snow River Products | 1.1.4) | |
| Nanoinjector | Drummond Scientific Company | 3-000-204 | 1.1), 1.2), 2.2) |
| Forceps | VWR | 82027-402 | 1.1.5), 1.2), 2), 3.1.7) |
| CO2 delivery apparatus | Genesee Scientific | 59-122BC | 1.2), 2) |
| Trypan Blue | Thermo Fisher Scientific (Gibco) | 15250061 | 1.3) |
| Hemocytometer | Hausser Scientific | 3100 | 1.3) |
| 24 well plate | Greiner bio-one | 662160 | 1.4), 2.2) |
| Coxiella burnetii - mCherry | Dr. Heinzen, R. | 1.4), 2.2) | |
| Drosophila fruit juice plates | Cold Spring Harbor Protocols | 2.1) http://cshprotocols.cshlp.org/content/2007/9/pdb.rec11113.full | |
| Agar | Fisher Bioreagents | BP1423-500 | 2.1.1.1) |
| Methyl paraben | Amresco | 0572-500G | 2.1.1.2) |
| Absolute ethanol | Fisher Bioreagents | BP2818-500 | 2.1.1.2) |
| Welch's 100% Grape juice frozen concentrate, 340 mL | Amazon | B0025UJVGM | 2.1.1.3) |
| Petri dishes, 10 x 35 mm | Fisher Scientific | 08-757-100A | 2.1.1.4) |
| Microscope cover glass | Fisher Scientific | 12-545-80 | 1.4.4), 2.2.2) |
| Yeast, Bakers Dried Active | MP Biomedicals | 0210140001 | 2.1) Add 2 parts of water to 1 part of yeast (v/v) |
| Tungsten needle | Fine Science Tools | 10130-20 | 2.1) |
| Holding forceps | VWR | HS8313 | 2.1) |
| Paraformaldehyde | Fisher Scientific | FLO4042-500 | 3.1.3) |
| Triton X-100 | Fisher Scientific | BP151-500 | 3.1.3) |
| Bovine Serum Albumin | Fisher Scientific | BP9706-100 | 3.1.3) |
| 4',6-diamidino-2-phenylindole | Thermo Fisher Scientific | 62247 | 3.1.4) |
| Antifade mounting medium | Thermo Fisher Scientific | P36930 | 3.1.6) |
| Confocal microsope | Leica | TCS SP8-X White Light Confocal Laser Scanning Microscope | 3.2) |
| 3D imaging reconstruction software | Leica | LASX with 3D visualization module | 3.3) |
| Microscope slides | Fisher Scientific | 12-552-3 | 3.1.6) |
| Invertebrate iridescent virus 6 (IIV6) | Dr. Teixeria, L. | 4) PLoS Biol, 6 (12), 2753-2763, doi: 10.1371/journal.pbio.1000002, (2008) | |
| Listeria monocytogenes | ATCC | strain: 10403S | 4) Listeria monocytogenes strain 10403S (Bishop and Hinrichs, 1987) was grown in Difco Brain-heart infusion (BHI) broth (BD Biosciences) containing 50 µg/ml streptomycin at 30 °C. |
| DNase I | Thermo Fisher Scientific(Invitrogen) | 18068015 | gDNA degradation |
| cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| IIV6_193R_F | IDT | qRT-PCR, 5'- TCT TGT TTT CAG AAC CCC ATT -3' | |
| IIV6_193R_R | IDT | qRT-PCR, 5'- CAC GAA GAA TGA CCA CAA GG -3' | |
| RpII_qRTPCR_fwd | SIGMA-ALDRICH | qRT-PCR, 5'- GAA GCG TTT CTC CAA ACG -AG | |
| RpII_qRTPCR_rev | SIGMA-ALDRICH | qRT-PCR, 5'- TTG AGC GTA AGC ATC ACC -TG | |
| SYBR Green qRT-PCR reagent | Thermo Fisher Scientific | K0251, K0252, K0253 | qRT-PCR |
| Real-Time PCR System | Thermo Fisher Scientific | 4351107, 7500 Software v2.0 | qRT-PCR |
| Anti-Listeria monocytogenes antibody | abcam | ab35132 | Western blot |
| Anti-Actin antibody produced in rabbit | SIGMA-ALDRICH | A2066 | Western blot |
| Anti-Rabbit IgG (H+L), HRP Conjugate | Promega | W4011 | Western blot |
References
- Hoffmann, J. A. The immune response of Drosophila. Nature. 426 (6962), 33-38 (2003).
- Regan, J. C., et al. Steroid hormone signaling is essential to regulate innate immune cells and fight bacterial infection in Drosophila. PLoS Pathog. 9 (10), 1003720(2013).
- Yano, T., et al. Autophagic control of listeria through intracellular innate immune recognition in Drosophila. Nat Immunol. 9 (8), 908-916 (2008).
- Bastos, R. G., Howard, Z. P., Hiroyasu, A., Goodman, A. G. Host and Bacterial Factors Control Susceptibility of Drosophila melanogaster to Coxiella burnetii Infection. Infect Immun. 85 (7), (2017).
- Kacsoh, B. Z., Schlenke, T. A. High hemocyte load is associated with increased resistance against parasitoids in Drosophila suzukii, a relative of D. melanogaster. PLoS One. 7 (4), 34721(2012).
- Tsuzuki, S., et al. Switching between humoral and cellular immune responses in Drosophila. is guided by the cytokine GBP. Nat Commun. 5, 4628(2014).
- Kurucz, E., et al. Definition of Drosophila. hemocyte subsets by cell-type specific antigens. Acta Biol Hung. 58, Suppl 95-111 (2007).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods. 68 (1), 116-128 (2014).
- Arefin, B., et al. Apoptosis in Hemocytes Induces a Shift in Effector Mechanisms in the Drosophila. Immune System and Leads to a Pro-Inflammatory State. PLoS One. 10 (8), 0136593(2015).
- Rus, F., et al. Expression pattern of Filamin-240 in Drosophila blood cells. Gene Expr Patterns. 6 (8), 928-934 (2006).
- Kurucz, E., et al. Hemese, a hemocyte-specific transmembrane protein, affects the cellular immune response in Drosophila. P Natl Acad Sci USA. 100 (5), 2622-2627 (2003).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. P Natl Acad Sci USA. 106 (12), 4805-4809 (2009).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biol Open. 4 (3), 355-363 (2015).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. P Natl Acad Sci USA. 101 (39), 14192-14197 (2004).
- Flynt, A., Liu, N., Martin, R., Lai, E. C. Dicing of viral replication intermediates during silencing of latent Drosophila viruses. P Natl Acad Sci USA. 106 (13), 5270-5275 (2009).
- Jovel, J., Schneemann, A. Molecular characterization of Drosophila cells persistently infected with Flock House virus. Virology. 419 (1), 43-53 (2011).
- Stoepler, T. M., Castillo, J. C., Lill, J. T., Eleftherianos, I. A simple protocol for extracting hemocytes from wild caterpillars. J Vis Exp. (69), e4173(2012).
- Sampson, C. J., Williams, M. J. Protocol for ex vivo incubation of Drosophila primary post-embryonic haemocytes for real-time analyses. Methods Mol Biol. 827, 359-367 (2012).
- Nehme, N. T., et al. A model of bacterial intestinal infections in Drosophila melanogaster. PLoS Pathog. 3 (11), 173(2007).
- Drosophila fruit juice egg plates. Cold Spring Harbor Protocols. (9), pdb.rec11113 (2007).
- Ahlers, L. R., Bastos, R. G., Hiroyasu, A., Goodman, A. G. Invertebrate Iridescent Virus 6, a DNA Virus, Stimulates a Mammalian Innate Immune Response through RIG-I-Like Receptors. PLoS One. 11 (11), 0166088(2016).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), (2012).
- Petraki, S., Alexander, B., Bruckner, K. Assaying Blood Cell Populations of the Drosophila melanogaster Larva. J Vis Exp. (105), (2015).
- Figliozzi, R. W., Chen, F., Chi, A., Hsia, S. C. Using the inverse Poisson distribution to calculate multiplicity of infection and viral replication by a high-throughput fluorescent imaging system. Virol Sin. 31 (2), 180-183 (2016).
- Rizki, T. M., Rizki, R. M. Lamellocyte differentiation in Drosophila. larvae parasitized by Leptopilina. Dev Comp Immunol. 16 (2-3), 103-110 (1992).
- Markus, R., Kurucz, E., Rus, F., Ando, I. Sterile wounding is a minimal and sufficient trigger for a cellular immune response in Drosophila melanogaster. Immunol Lett. 101 (1), 108-111 (2005).
- McCormack, R., et al. Perforin-2 Protects Host Cells and Mice by Restricting the Vacuole to Cytosol Transitioning of a Bacterial Pathogen. Infect Immun. 84 (4), 1083-1091 (2016).
- Ozgen, A., et al. Construction and characterization of a recombinant invertebrate iridovirus. Virus Res. 189, 286-292 (2014).
- Jakob, N. J., Muller, K., Bahr, U., Darai, G. Analysis of the first complete DNA sequence of an invertebrate iridovirus: coding strategy of the genome of Chilo iridescent virus. Virology. 286 (1), 182-196 (2001).
- Ghigo, E., Colombo, M. I., Heinzen, R. A. The Coxiella burnetii parasitophorous vacuole. Adv Exp Med Biol. 984, 141-169 (2012).
- Liu, F., et al. Drosophila melanogaster prophenoloxidases respond inconsistently to Cu2+ and have different activity in vitro. Dev Comp Immunol. 36 (3), 619-628 (2012).
- De Gregorio, E., et al. An immune-responsive Serpin regulates the melanization cascade in Drosophila. Dev Cell. 3 (4), 581-592 (2002).
- Kari, B., et al. The raspberry Gene Is Involved in the Regulation of the Cellular Immune Response in Drosophila melanogaster. PLoS One. 11 (3), 0150910(2016).
- Wu, A. R., et al. Quantitative assessment of single-cell RNA-sequencing methods. Nat Methods. 11 (1), 41-46 (2014).
- Buettner, F., et al. Computational analysis of cell-to-cell heterogeneity in single-cell RNA-sequencing data reveals hidden subpopulations of cells. Nat Biotechnol. 33 (2), 155-160 (2015).
- Nevil, M., Bondra, E. R., Schulz, K. N., Kaplan, T., Harrison, M. M. Stable Binding of the Conserved Transcription Factor Grainy Head to its Target Genes Throughout Drosophila melanogaster Development. Genetics. 205 (2), 605-620 (2017).
- Yang, C. P., et al. Transcriptomes of lineage-specific Drosophila neuroblasts profiled by genetic targeting and robotic sorting. Development. 143 (3), 411-421 (2016).
- Jaitin, D. A., et al. Dissecting Immune Circuits by Linking CRISPR-Pooled Screens with Single-Cell RNA-Seq. Cell. 167 (7), 1883-1896 (2016).
- Karaiskos, N., et al. The Drosophila embryo at single-cell transcriptome resolution. Science. 358 (6360), 194-199 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved