Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hemocytes mikrobiyal enfeksiyon ve çözümleme çekme--dan Drosophila melanogaster larva
Bu Makalede
Özet
Bu yöntem, patojen işgali üç boyutlu (3D) modelleri ile böcek hücreye görselleştirmek gösterilmiştir. Hemocytes Drosophila larvaları üzerinden viral veya bakteriyel patojenler, ex vivo veya vivo içindeile bulaşmış. Virüslü hemocytes daha sonra sabit ve görüntüleme için bir confocal mikroskop ve sonraki 3D hücresel yeniden yapılanma ile lekeli.
Özet
Drosophila melanogaster, patojenik enfeksiyon sırasında hemocytes enfeksiyon boyunca bağışıklık yanıtındaki önemli bir rol oynamaktadır. Böylece, bu iletişim kuralının amacı belirli bir bağışıklık yerde uçar, yani hemocytes patojen işgali görselleştirmek için bir yöntem geliştirmektir. Burada 3 × 10 anlatılan yöntemle6 canlı hemocytes 200 Drosophila 3rd INSTAR larva ex vivo enfeksiyon için 30 dk içinde elde edilebilir. Alternatif olarak, hemocytes enfekte vivo içinde 3rd INSTAR larva için 24 saat sonrası enfeksiyon hemocyte çıkarma tarafından takip enjeksiyon yoluyla olabilir. Bu virüslü primer hücre tespit edildi, lekeli ve confocal mikroskobu kullanarak yansıma. Sonra 3D temsilcilikleri patojen işgal kesin olarak göstermek için görüntülerden üretildi. Ayrıca, yüksek kaliteli RNA qRT-PCR patojen mRNA şu tespiti için elde edilebilir enfeksiyon ve yeterli protein hulâsa Western blot analizi için bu hücrelerden. Birlikte ele alındığında, biz patojen işgalinin kesin uzlaşma ve enfeksiyon bakteriyel ve viral patojen türleri ve verimli bir yöntem hemocyte çıkarılması için yeterli canlı hemocytes Drosophila elde etmek için kullanarak onay için bir yöntem mevcut larva ex vivo ve in vivo enfeksiyon deneyler için.
Giriş
Drosophila melanogaster doğuştan gelen bağışıklık1incelenmesi için bir iyi kurulmuş model organizmadır. Doğuştan gelen bağışıklık yanıtı sırasında hemocytes yanıt patojeni meydan okuma olarak önemli bir rol oynamaktadır. Hemocytes mantar, viral ve bakteriyel enfeksiyon2,3sırasında fagositik eylem yoluyla patojen mücadelede önemli bir işleve sahip yanı sıra parazit Kapsüllenen için kritik öneme sahiptir.
En iyi ana bilgisayarın doğuştan gelen bağışıklık yanıtı patojenik mikrobiyal enfeksiyon anlamak için nasıl patojen konak hücreleri enfeksiyon sırasında işgal görselleştirmek önemlidir. Bu görselleştirme işgali mekanizmasının bir anlaşmaya katkıda bulunur. Patojen hücre içi yerelleştirme ayrıntılarını ve hücresel yanıt ile birlikte, bu veriler enfeksiyon ve hangi ile mikrop etkileşim hücre organelleri ana bilgisayar yanıt hakkında ipuçları sağlar. Böylece, 3D modeli yeniden görüntüleme mikroskobu tarafından sonra konak hücreleri patojenler tam yerini belirlemek yararlı olabilir. Bu çalışmada, Avusturya'nın Coxiella burnetii (C. burnetii), Q ateşi, insan ve hayvan sağlığı için ciddi bir tehdit teşkil etmektedir birincil Drosophila hemocytes Hayvansal bir hastalık hastalığının görüntülenir. Son zamanlarda, Drosophila 2 dokuz mil faz II (NMII) klon C. burnetii 4 suşu ve bu zorlanma Drosophila4' te, çoğaltmak yapabiliyor bu gösteren Biyogüvenlik düzeyi duyarlı gösterilmiştir Drosophila C. burnetii patogenezi okumaya bir model organizma kullanılır.
Önceki çalışmalarda hemocytes ana bilgisayarın doğuştan gelen bağışıklık yanıtı incelemek için kullandık. Hemocytes kullanılan morfolojik gözlemleri5,6,7, xarakteristikaları analiz2,8, fagositoz analiz2,3, qRT-PCR2 için , 9, immunoprecipitation10,11, immünfloresan analiz10,12, immunostaining13, immunoblotting3,10, 11 ve immünhistokimya9,14. Drosophila S2 hücreleri de çeşitli vitro deneyler için kullanılabilir olmakla birlikte, onların davranış15,16-əbadoləşdirmək ve önceden var olan potansiyel viral enfeksiyon değiştirmek. Primer Hücre S2 hücreleri gibi bir ölümsüzleştirdi hücre kültürünü aksine kullanımı doğuştan gelen bağışıklık fonksiyonu çalışma için bir sistem tüm organizmanın daha temsilcisi sağlar. Ayrıca, hemocytes vivo, ayıklama önce enfeksiyonu hücrelere diğer ana bilgisayar proteinler ve doku, hemocytes ex vivo enfeksiyonu önce çıkarılması üzerinde bir avantaj etkileşim sağlar. Birkaç farklı yöntem hemocytes yeterli sayıda hemocytes canlı8,17,18,19tutmak için zaman kısa bir süre içinde elde etmek için kullanılmıştır.
Bu çalışmada, biz Drosophila 3rd INSTAR larva C. burnetii, Listeria Monositogenez (Listeria) veya omurgasız yanardöner patojenik mikrobiyal enfeksiyon için hemocytes ayıklamak için bir yöntem mevcut virüs 6 (IIV6). Vivo ve ex vivo hemocyte enfeksiyon yöntemleri açıklanmaktadır. Vivo- ve ex vivo-virüslü hemocytes confocal mikroskobu ile görüntülenir ve C. burnetii işgalinin 3D modeller oluşturmak için kullanılır. Buna ek olarak, ex vivoayıklama iletişim kuralını kullanarak-virüslü hemocytes için gen ve protein ifadesi kullanılmıştır deneyleri. Özellikle, IIV6 ve Listeriaenfeksiyonu ölçüde incelemek için toplam RNA veya protein qRT-PCR veya Western blot analizi için hücrelerden izole edildi. Birlikte ele alındığında, protokol hızla hemocytes sayısının fazlalığı 3rd INSTAR larva ve birincil hemocytes, in vivo veya ex vivoenfekte kanıt toplamak için yöntemler sağlar, için uygun bir platform olan mikrobiyal patojen enfeksiyon çalışmaları ve ilgili aşağı akım analizleri mikroskobu, transcriptomics ve proteomik gibi.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. ex vivo enfeksiyon
- Orta ve donanımları
- Steril koşullarda, taze Drosophila Hemocyte izole Orta (% 75 Schneider'ın Drosophila içeren DHIM) hazırlamak orta % 25 ile Fetal sığır Serum (FBS) ve filtre bu sterilize.
- 2-3 adet 10 cm x 10 cm parafin film bir stereomicroscope altında katman.
- Cam kılcal hazırlayın. Kapiller çektirme ısıtıcı maksimum % 55'i için ayarlayın. Kılcal tüp yaklaşık 10 µm keskin bir noktaya kadar çekin.
- Mineral yağ ile kılcal tamamlanmıyor.
- Dolu kılcal tüp nanoinjector (Şekil 1A) üzerine monte ve erimiş kılcal tüp İpucu İpucu off forseps ile (Şekil 1B) kırarak açık. Ucu dış çapı hemocytes kolay alımını için 100 µm olmalıdır.
- Kılcal tüp ucundan mümkün olduğunca çok yağ çıkarma sonra DHIM ile doldurun. Kenarlığı yukarı çekilen hemolymph ve yağ ile kolay görselleştirme için petrol ve DHIM arasında bir hava kabarcığı şunlardır (Şekil 1B').
- Hemolymph ayıklama
- Al 3rd biçim Drosophila larva iç duvar gıda yavaşça forseps kullanarak tüp ve bir 100 µm süzgeç (Şekil 1C) koyun. 3rd INSTAR larvalar 3-6 gün yetişkin bir kadın tarafından döşeme verimli yumurta bulunur.
Not: Bu deneyler genotip, w1118kullanılan; P {w+ mCHml-GAL4.Δ =} 2, P {w+ mCUAS-2xEGFP =} AH2 beri hemocytes bu hayvanlardan gelişmiş yeşil flüoresan protein (EGFP) mikroskopi tarafından hücreleri tanımlaması içinde yardım etmek için hızlı. - Larvaları 5 mL steril su dökün ve aşırı su kaldırmak 5 s. yer için görev silme üzerine süzgeç Süzgeç sallamak (Şekil 1C').
- Larvalar 1.5 mL microcentrifuge tüp içine aktarın. Onları CO2 gaz için 5 ile anestezi s (Şekil 1D).
- Parafin filmi stereomicroscope altında üzerine larva dorsal yüzü (Şekil 2A) bakacak şekilde yerleştirin.
- Yere tutun ve posterior kütikül bozmak için yer cam larva arka gövde üzerine hafifçe kapiller ince sivri uçlu forseps (Şekil 2B) kullanarak açın.
- Parafin filmin (Şekil 2C) akmaya hemolymph izin verir.
- Parafin film üzerinde bir anda hemocytes 20-50 larvaları üzerinden de dahil olmak üzere hemolymph bir havuz yapmak.
- Cam kullanarak havuza alınan hemolymph kadar nanoinjector (resim 2D) kapiller al.
Not: Hemolymph, yaklaşık 10-20 µL olmalıdır. - Hemolymph DHIM (Şekil 2E) 500 µL içeren bir 1.5 mL microcentrifuge tüp çıkar.
- Adımları yineleyin 1.2.4) - 1.2.9 yükleme) larva her dizi için.
- Al 3rd biçim Drosophila larva iç duvar gıda yavaşça forseps kullanarak tüp ve bir 100 µm süzgeç (Şekil 1C) koyun. 3rd INSTAR larvalar 3-6 gün yetişkin bir kadın tarafından döşeme verimli yumurta bulunur.
- Hemocytes saymak.
- 5 µL % 0,4 Trypan mavi çözüm ölü hücreleri leke 0.6 mL microcentrifuge tüp içinde pipet. Hafifçe DHIM ve hemocytes bir pipet kullanarak 1,5 mL tüp içinde karıştırın ve DHIM 0.6 mL microcentrifuge Tube hemocytes de dahil olmak üzere 5 µL aktarmak ve karışımı yavaşça.
- 11: Trypan mavi: hemocyte karışımı hücre 10 µL hemasitometre pipet.
- Trypan ile değil lekeli hemocytomter 4 köşe alanların her birinde mavi ve hemocytes formülünü kullanarak mililitre başına konsantrasyonu hesaplayan canlı hemocytes saymak:
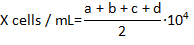
Burada X mililitre başına canlı hemocytes konsantrasyonu ise; a, b, c ve d mı hemasitometre içinde sayılan alanların her 4 canlı hücrelerde (Trypan mavi dışlama tarafından belirlenen) sayısı. 1:1 seyreltme Trypan mavi içeren hücrelerin hücre sayılan toplam sayısı 2 ile bölme kaynaklanmaktadır. Trypan ile mavi lekeli hücreleri ölü kabul edilir.
-
Ex vivo Enfeksiyonlar
- Kuyu timepoints ve biyolojik dayalı hücreleri ile seribaşı sayısını çoğaltır her deneme için gerekli belirlemek. 5.0 × 104 hemocytes enfeksiyonu takip RNA ve protein arıtma için arzu.
- DHIM ile enfeksiyon için aşağıdaki formülü kullanarak seyreltilmiş için patojen stok hacmi hesaplamak:
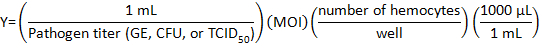
nerede enfeksiyon (MOI) çokluğu veya bakteri hücre başına istenen viral sayısıdır.
Not: kullanılan MOI bireysel deney ve deneyleri gerçekleştirilen bağlıdır. Burada, 10 genom eşdeğerleri (GE) / C. burnetii, 10 CFU/hücrenin Listeriaveya 1 TCID50/cell IIV6, hücresi kullanıldı. - 500 µL patojen orta bir tüp viral veya bakteriyel cilt DHIM uygun hacmi ekleyerek bir 24-şey plaka her şey için hazır olun.
- Yer 12 mm yuvarlak cam (No 1 kalınlık) 24-şey kalıbının kuyuya.
- Hemocytes 24-şey plaka kuyu dahil DHIM bölme.
- 500 µL patojen orta hemocytes bir kuyu içinde ekleyin.
- 1000 x g 5 min için plaka santrifüj kapasitesi.
- 28 ° C'de 1 h plaka kuluçkaya Her 15 dk, hafifçe açık, daha sonra soldan sağa 5 arka plakasına eğimli el tarafından s.
- 1 h işgali/ek adım 1.4.8) sonra yavaşça patojen orta pipet hemocytes taze DHIM ile yıkayın ve taze DHIM 500 µL ile doldurma.
- Virüslü hemocytes için istenen saat kuluçkaya. Bu deneylerde, C. burnetii- veya hemocytes IIV6 enfekte inkübe 24 h ve Listeriaiçin-virüslü hemocytes inkübe 1, 2 veya 4 h için.
2. vivo enfeksiyon
- Enfeksiyon
- Drosophila meyve suyu agar tabağı 15 dk. plakaları için oda sıcaklığında daha önce yapılan sıcak20nitelendirdi.
- 30 g agar 700 mL su ve basınçlı kap ekleyin 40 dk için.
- Metil paraben mutlak etanol 10 ml 0.5 g geçiyoruz.
- Metil paraben çözüm için 300 mL meyve suyu konsantresi ekleyin.
- Hızlı bir şekilde suyu konsantresi autoclaved agar çözüm mix ve 5 mL 10 × 35 mm Petri yemekleri dağıtmak.
- Tabakları 15dk için soğutmalı sonra onları 4 ° C'de depolayın
- Hazırlamak 3rd INSTAR larva aşağıdaki adımları 1.2.1) - 1.2.3).
- Maya Yapıştır bir agar tabağa yerleştirin. Nerede larva (Şekil 3A) kurutma önlemek için geçirebilirsiniz agar plaka iyi bir kesim yapmak. Parafin film (Şekil 3B, C) kullanarak forseps holding ile 0,001 mm sivri tungsten iğne bir araya getirin.
- Yüksek-titresi mCherry 50 µL pipet ifade -C. burnetii (5,95 × 109 GE/mL) parafin üzerine film stereo mikroskop altında ve larvalar bakteri havuzun yerleştirin.
- Larvalar bakteri havuzun yerleştirin. Larva (Şekil 3D) tungsten iğne ile dikmek. Larvalar agar plaka (Şekil 3E) üzerine aktarın.
- Agar plaka kalan patojen ortamına aktarmak ve parafin film ile plaka mühür.
- Larvalar plaka üzerinde istenen saat sonrası enfeksiyon (Şekil 3F) kadar nemli havada tut. Bu deneyde, C. burnetii-virüslü larvaları vardır 24 h için plaka üzerinde.
- Drosophila meyve suyu agar tabağı 15 dk. plakaları için oda sıcaklığında daha önce yapılan sıcak20nitelendirdi.
- Hemolymph çıkarma ve hemocytes kaplama
- Orta ve 1.1. adımda takip donanımları hazırlamak).
- Yer 12 mm yuvarlak cam (No 1 kalınlık) 24-şey kalıbının kuyuya. DHIM 500 µL kuyunun içine pipet.
- Hemolymph aşağıdaki adımları 1.2.4 virüslü larvaları özü) - 1.2.8).
- Hemolymph de aşağıdaki içine çıkarma adım 2.2.2).
- 2.2.3 tekrar) ve 2.2.4) larva, birden çok toplu işlem için.
- 1000 x g 5 min için plaka santrifüj kapasitesi.
3. görsel öğe
- Sabitleme ve boyama
- Hemocytes iyi yuvarlak kapak camına yerleşmek izin sonra yavaşça orta her kuyudan çıkarın.
- Yavaşça 200 µL % 4 paraformaldehyde (PFA), kapatılan hemocytes her şey için ekleyin. Hemocytes oda sıcaklığında 20 dk için kuluçkaya.
- %4 kaldırmak PFA ve yavaşça 200 µL % 0,1 içeren PBS ekleyin Triton X-100 ve %1 sığır Serum Albumin (BSA) her şey için. Hemocytes oda sıcaklığında 10 dakika için kuluçkaya.
- PBS kaldır ve yavaşça, 1 × 4', 6-diamidino-2-phenylindole (DAPI) her şey için 200 µL ekleyin. Hemocytes içinde belgili tanımlık karanlık oda sıcaklığında 10 dakika için kuluçkaya.
- DAPI çözümü kaldırmak ve yavaşça her şey için PBS ekleyin. Hemocytes oda sıcaklığında 5 min için kuluçkaya.
- Antifade montaj orta 10 µL cam mikroskop slayt üzerinde bırakın.
- PBS her kuyudan kaldırdıktan sonra kapak cam 24-şey plaka ince sivri uçlu forseps kullanarak kaldırın. Yavaşça kapak cam antifade montaj ortama cam slayt üzerinde hemocytes aşağı bakacak şekilde yerleştirin.
- Karanlık gecede yerleştirerek kurumaya slayt izin.
- Confocal görüntüleme
- Üç renk görüntüleme DAPI, EGFP ve mCherry için confocal mikroskop yapılandırın. Aşağıdaki ayarı kullanın: DAPI uyarma (ex) 405 nm, emisyon (em) 415-480 nm; EGFP 488 ex nm, em 493-564 nm; mCherry 587 ex nm, em 597-700 nm.
- Mikroskop ve odak bir 63 X kullanarak örnek örnek yerleştirin / 1.4 sayısal diyafram (NA) amaç. İstenen hemocytes görüntüleme için görüş alanı bulun.
- Lazer güç ve dedektör kazançlar örnek uygun pozlama elde etmek için ayarlayın. Birden çok z-düzlem pozlama seviyesi tüm örnek kalınlığı için uygun olduğundan emin olmak için denetleyin.
- Bütün hemocyte z ekseni üzerinde üst ve alt konumu bulun. Bu pozisyonlar z kesit için başlangıç ve bitiş konumlarını ayarlayın.
- Sadece görüntü hemocyte bulunduğu alanı için tarama zoom özelliğini kullanın. 3 X Zoom faktörleri genellikle kullanılır.
- 1024 x 1024 piksel x-y düzlemde gibi uygun çözünürlükte görüntü serisi ve 0.3 µm Aralık z boyut toplamak.
- 3D modeli yeniden yapılanma
Not: Açık kaynak yazılım 3D modeli yeniden yapılanma için aşağıda açıklanan işlevlerin çoğunu gerçekleştiren oluşur.- Z kesitli resim serisi dosyası 3D modeli yeniden inşası için confocal mikroskop ile İlişkili Yazılım alın.
- DAPI ve C. burnetii hemocyte ifade bir EGFP ifade mCherry ile lekeli çekirdeklerin ortak yerelleştirme gösterilen bir hücre seçin. Kırpma görüntü serisi yalnızca tek hücre içerir.
- Yazılımın önceden paketlenmiş algoritması kullanarak 3D modeli yeniden yapılandırır 3B görüntüleyici seçeneğini seçin. 3D temsil karışım, yüzey ve karışık seçenekleri arasında istediğiniz türü seçin. Bu yöntemde, hemocytes, çekirdek ve C. burnetii yüzey modeller kullanılarak gösterilir.
- Tutmak belgili tanımlık fare düğme ve belgili tanımlık perde imleci sürükleyerek 3D yeniden oluşturulan hücre çeşitli görüntüleme konumlardan gözlemlemek. Hücre yönlendirme ve görüntü optimize etmek için modellenmiş ışık kaynağının konumunu ayarlayın. Diğer seçenek saydamlık, en az ve en fazla eşik, Specular, Ambient, Shineness ve gama için görüntü optimize etmek için vardır.
- Kesit hemocyte iç içeriğini görselleştirmek için kırpma ve parça komutlarını kullanarak modeli üzerinden alın.
4. uygulama gen ve/veya protein analizi için
- IIV6 ve Listeria, enfeksiyonla takip koşullar sonraki qRT PCR hücreleri veya Western blot analizi daha önce açıklanan21 ve aşağıdaki prosedürü yerine getirin.
Not: Tablo reçetesi qRT-PCR astar ve Western blot için antikorlar için bakın. - PCR ürünlerinin özel jel elektroforez tarafından güçlendirilmiş ürün uygun uzunlukta sağlamak için yukarıda açıklanan22, analiz.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Hemocytes ex vivo enfeksiyonu, 3 × 10 toplamak yaşamak için6 hemocytes 200 Drosophila 3rd INSTAR larvaları elde. Bizim yöntem geliştirmek için bir takım farklı teknikler denendi. Bireysel larva diseksiyon en fazla 1,5 saat sürer ve ortalama ~ 8000 hücre elde edilen en çok hangi koleksiyonun sonuna tarafından canlı değildi bu yöntemi18, kullanarak. Daha sonra hemocytes bulunan hemolymph çıkarmak için çalı?...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Nasıl konak hücreleri enfekte olma daha iyi anlamak için özellikle daha önce denenmemiş patojen ve hücre tipi kombinasyonları4' te deneme zaman patojen hücrelerdeki lokalizasyonu netleştirmek önemlidir. Enfeksiyonu takip hücresel yanıt basamaklı eğitim üretken patojen işgali gösterebilir iken, görüntüleme ve hücresel yanıt verilerini kombinasyonu patojen işgali ve enfeksiyon göstermek için önemlidir. Patojen işgalinin 2D görüntüleri ana hücreleri gösteren raporlar ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar onlar rakip hiçbir mali çıkarları var bildirin.
Teşekkürler
MCherry ifade Coxiella burnetiistokları sağlamak için Dr Robert Heinzen için minnettarız. Biz Dr Luis Teixeira omurgasız yanardöner virüs 6 ve Bloomington stok merkezi sinek stokları sağlamak için verdiğiniz için teşekkür ederiz. Bu projenin kısmen NIH hibe R00 AI106963 (A.G.G.) ve Washington State Üniversitesi tarafından finanse edildi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Schneider's Drosophila Medium | Thermo Fisher Scientific (Gibco) | 21720024 | 1.1.1), 2.1.2) |
| Fetal Bovine Serum | GE Healthcare Life Sciences (HyClone) | SH30070.03HI | 1.1.1), 2.1.2) |
| Filter (0.22 µL) | RESTEK | 26158 | 1.1.1) |
| Strainer (100 µm) | Greiner bio-one | 542000 | 1.2.1), 2) |
| Stereo microscope | Amscope | SM-1BSZ-L6W | 1.2), 2) |
| Glass capillary | Fisher Scientific | 21-171-4 | 1.1), 1.2), 2) |
| Capillary puller | Narishige International USA, Inc. | PC-10 | 1.1.3) |
| Mineral oil | Snow River Products | 1.1.4) | |
| Nanoinjector | Drummond Scientific Company | 3-000-204 | 1.1), 1.2), 2.2) |
| Forceps | VWR | 82027-402 | 1.1.5), 1.2), 2), 3.1.7) |
| CO2 delivery apparatus | Genesee Scientific | 59-122BC | 1.2), 2) |
| Trypan Blue | Thermo Fisher Scientific (Gibco) | 15250061 | 1.3) |
| Hemocytometer | Hausser Scientific | 3100 | 1.3) |
| 24 well plate | Greiner bio-one | 662160 | 1.4), 2.2) |
| Coxiella burnetii - mCherry | Dr. Heinzen, R. | 1.4), 2.2) | |
| Drosophila fruit juice plates | Cold Spring Harbor Protocols | 2.1) http://cshprotocols.cshlp.org/content/2007/9/pdb.rec11113.full | |
| Agar | Fisher Bioreagents | BP1423-500 | 2.1.1.1) |
| Methyl paraben | Amresco | 0572-500G | 2.1.1.2) |
| Absolute ethanol | Fisher Bioreagents | BP2818-500 | 2.1.1.2) |
| Welch's 100% Grape juice frozen concentrate, 340 mL | Amazon | B0025UJVGM | 2.1.1.3) |
| Petri dishes, 10 x 35 mm | Fisher Scientific | 08-757-100A | 2.1.1.4) |
| Microscope cover glass | Fisher Scientific | 12-545-80 | 1.4.4), 2.2.2) |
| Yeast, Bakers Dried Active | MP Biomedicals | 0210140001 | 2.1) Add 2 parts of water to 1 part of yeast (v/v) |
| Tungsten needle | Fine Science Tools | 10130-20 | 2.1) |
| Holding forceps | VWR | HS8313 | 2.1) |
| Paraformaldehyde | Fisher Scientific | FLO4042-500 | 3.1.3) |
| Triton X-100 | Fisher Scientific | BP151-500 | 3.1.3) |
| Bovine Serum Albumin | Fisher Scientific | BP9706-100 | 3.1.3) |
| 4',6-diamidino-2-phenylindole | Thermo Fisher Scientific | 62247 | 3.1.4) |
| Antifade mounting medium | Thermo Fisher Scientific | P36930 | 3.1.6) |
| Confocal microsope | Leica | TCS SP8-X White Light Confocal Laser Scanning Microscope | 3.2) |
| 3D imaging reconstruction software | Leica | LASX with 3D visualization module | 3.3) |
| Microscope slides | Fisher Scientific | 12-552-3 | 3.1.6) |
| Invertebrate iridescent virus 6 (IIV6) | Dr. Teixeria, L. | 4) PLoS Biol, 6 (12), 2753-2763, doi: 10.1371/journal.pbio.1000002, (2008) | |
| Listeria monocytogenes | ATCC | strain: 10403S | 4) Listeria monocytogenes strain 10403S (Bishop and Hinrichs, 1987) was grown in Difco Brain-heart infusion (BHI) broth (BD Biosciences) containing 50 µg/ml streptomycin at 30 °C. |
| DNase I | Thermo Fisher Scientific(Invitrogen) | 18068015 | gDNA degradation |
| cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| IIV6_193R_F | IDT | qRT-PCR, 5'- TCT TGT TTT CAG AAC CCC ATT -3' | |
| IIV6_193R_R | IDT | qRT-PCR, 5'- CAC GAA GAA TGA CCA CAA GG -3' | |
| RpII_qRTPCR_fwd | SIGMA-ALDRICH | qRT-PCR, 5'- GAA GCG TTT CTC CAA ACG -AG | |
| RpII_qRTPCR_rev | SIGMA-ALDRICH | qRT-PCR, 5'- TTG AGC GTA AGC ATC ACC -TG | |
| SYBR Green qRT-PCR reagent | Thermo Fisher Scientific | K0251, K0252, K0253 | qRT-PCR |
| Real-Time PCR System | Thermo Fisher Scientific | 4351107, 7500 Software v2.0 | qRT-PCR |
| Anti-Listeria monocytogenes antibody | abcam | ab35132 | Western blot |
| Anti-Actin antibody produced in rabbit | SIGMA-ALDRICH | A2066 | Western blot |
| Anti-Rabbit IgG (H+L), HRP Conjugate | Promega | W4011 | Western blot |
Referanslar
- Hoffmann, J. A. The immune response of Drosophila. Nature. 426 (6962), 33-38 (2003).
- Regan, J. C., et al. Steroid hormone signaling is essential to regulate innate immune cells and fight bacterial infection in Drosophila. PLoS Pathog. 9 (10), 1003720(2013).
- Yano, T., et al. Autophagic control of listeria through intracellular innate immune recognition in Drosophila. Nat Immunol. 9 (8), 908-916 (2008).
- Bastos, R. G., Howard, Z. P., Hiroyasu, A., Goodman, A. G. Host and Bacterial Factors Control Susceptibility of Drosophila melanogaster to Coxiella burnetii Infection. Infect Immun. 85 (7), (2017).
- Kacsoh, B. Z., Schlenke, T. A. High hemocyte load is associated with increased resistance against parasitoids in Drosophila suzukii, a relative of D. melanogaster. PLoS One. 7 (4), 34721(2012).
- Tsuzuki, S., et al. Switching between humoral and cellular immune responses in Drosophila. is guided by the cytokine GBP. Nat Commun. 5, 4628(2014).
- Kurucz, E., et al. Definition of Drosophila. hemocyte subsets by cell-type specific antigens. Acta Biol Hung. 58, Suppl 95-111 (2007).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods. 68 (1), 116-128 (2014).
- Arefin, B., et al. Apoptosis in Hemocytes Induces a Shift in Effector Mechanisms in the Drosophila. Immune System and Leads to a Pro-Inflammatory State. PLoS One. 10 (8), 0136593(2015).
- Rus, F., et al. Expression pattern of Filamin-240 in Drosophila blood cells. Gene Expr Patterns. 6 (8), 928-934 (2006).
- Kurucz, E., et al. Hemese, a hemocyte-specific transmembrane protein, affects the cellular immune response in Drosophila. P Natl Acad Sci USA. 100 (5), 2622-2627 (2003).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. P Natl Acad Sci USA. 106 (12), 4805-4809 (2009).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biol Open. 4 (3), 355-363 (2015).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. P Natl Acad Sci USA. 101 (39), 14192-14197 (2004).
- Flynt, A., Liu, N., Martin, R., Lai, E. C. Dicing of viral replication intermediates during silencing of latent Drosophila viruses. P Natl Acad Sci USA. 106 (13), 5270-5275 (2009).
- Jovel, J., Schneemann, A. Molecular characterization of Drosophila cells persistently infected with Flock House virus. Virology. 419 (1), 43-53 (2011).
- Stoepler, T. M., Castillo, J. C., Lill, J. T., Eleftherianos, I. A simple protocol for extracting hemocytes from wild caterpillars. J Vis Exp. (69), e4173(2012).
- Sampson, C. J., Williams, M. J. Protocol for ex vivo incubation of Drosophila primary post-embryonic haemocytes for real-time analyses. Methods Mol Biol. 827, 359-367 (2012).
- Nehme, N. T., et al. A model of bacterial intestinal infections in Drosophila melanogaster. PLoS Pathog. 3 (11), 173(2007).
- Drosophila fruit juice egg plates. Cold Spring Harbor Protocols. (9), pdb.rec11113 (2007).
- Ahlers, L. R., Bastos, R. G., Hiroyasu, A., Goodman, A. G. Invertebrate Iridescent Virus 6, a DNA Virus, Stimulates a Mammalian Innate Immune Response through RIG-I-Like Receptors. PLoS One. 11 (11), 0166088(2016).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), (2012).
- Petraki, S., Alexander, B., Bruckner, K. Assaying Blood Cell Populations of the Drosophila melanogaster Larva. J Vis Exp. (105), (2015).
- Figliozzi, R. W., Chen, F., Chi, A., Hsia, S. C. Using the inverse Poisson distribution to calculate multiplicity of infection and viral replication by a high-throughput fluorescent imaging system. Virol Sin. 31 (2), 180-183 (2016).
- Rizki, T. M., Rizki, R. M. Lamellocyte differentiation in Drosophila. larvae parasitized by Leptopilina. Dev Comp Immunol. 16 (2-3), 103-110 (1992).
- Markus, R., Kurucz, E., Rus, F., Ando, I. Sterile wounding is a minimal and sufficient trigger for a cellular immune response in Drosophila melanogaster. Immunol Lett. 101 (1), 108-111 (2005).
- McCormack, R., et al. Perforin-2 Protects Host Cells and Mice by Restricting the Vacuole to Cytosol Transitioning of a Bacterial Pathogen. Infect Immun. 84 (4), 1083-1091 (2016).
- Ozgen, A., et al. Construction and characterization of a recombinant invertebrate iridovirus. Virus Res. 189, 286-292 (2014).
- Jakob, N. J., Muller, K., Bahr, U., Darai, G. Analysis of the first complete DNA sequence of an invertebrate iridovirus: coding strategy of the genome of Chilo iridescent virus. Virology. 286 (1), 182-196 (2001).
- Ghigo, E., Colombo, M. I., Heinzen, R. A. The Coxiella burnetii parasitophorous vacuole. Adv Exp Med Biol. 984, 141-169 (2012).
- Liu, F., et al. Drosophila melanogaster prophenoloxidases respond inconsistently to Cu2+ and have different activity in vitro. Dev Comp Immunol. 36 (3), 619-628 (2012).
- De Gregorio, E., et al. An immune-responsive Serpin regulates the melanization cascade in Drosophila. Dev Cell. 3 (4), 581-592 (2002).
- Kari, B., et al. The raspberry Gene Is Involved in the Regulation of the Cellular Immune Response in Drosophila melanogaster. PLoS One. 11 (3), 0150910(2016).
- Wu, A. R., et al. Quantitative assessment of single-cell RNA-sequencing methods. Nat Methods. 11 (1), 41-46 (2014).
- Buettner, F., et al. Computational analysis of cell-to-cell heterogeneity in single-cell RNA-sequencing data reveals hidden subpopulations of cells. Nat Biotechnol. 33 (2), 155-160 (2015).
- Nevil, M., Bondra, E. R., Schulz, K. N., Kaplan, T., Harrison, M. M. Stable Binding of the Conserved Transcription Factor Grainy Head to its Target Genes Throughout Drosophila melanogaster Development. Genetics. 205 (2), 605-620 (2017).
- Yang, C. P., et al. Transcriptomes of lineage-specific Drosophila neuroblasts profiled by genetic targeting and robotic sorting. Development. 143 (3), 411-421 (2016).
- Jaitin, D. A., et al. Dissecting Immune Circuits by Linking CRISPR-Pooled Screens with Single-Cell RNA-Seq. Cell. 167 (7), 1883-1896 (2016).
- Karaiskos, N., et al. The Drosophila embryo at single-cell transcriptome resolution. Science. 358 (6360), 194-199 (2017).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır