JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
미생물 감염 및 분석에 대 한 초파리 melanogaster 애벌레에서 Hemocytes의 추출
요약
이 메서드는 3 차원 (3D) 모델 곤충 세포로 병원 체 침입을 시각화 하는 방법을 보여 줍니다. 초파리 애벌레에서 hemocytes 바이러스 성 또는 세균성 병원 체, ex vivo 또는 vivo에서감염 되었습니다. 감염 된 hemocytes 다음 고정 되었고 confocal 현미경 및 후속 3D 셀룰러 재건 이미징 스테인드.
초록
초파리 melanogaster 의 병원 성 감염 시 hemocytes 감염을 통해 면역 반응에 중요 한 역할을 재생합니다. 따라서,이 프로토콜의 목표, 즉 hemocytes의 특정 면역에 병원 체 침입을 시각화 하는 방법을 개발 하는 것입니다. 여기, 3 × 10에 제시 된 방법을 사용 하 여6 라이브 hemocytes ex vivo 감염에 대 일 분에서 200 초파리 3rd 탈피 애벌레에서 얻을 수 있습니다. 또는, hemocytes는 감염 된 vivo에서 구명 hemocyte 추출에 의해 감염 된 후 24 시간에 3rd 탈피 애벌레의 주사를 통해 하실 수 있습니다. 이러한 감염된 1 차 셀 고정, 스테인드, 고 confocal 현미경 검사 법을 사용 하 여 몇 군데. 그럼, 3D 표현 병원 체 침입을 결정적으로 보여 이미지에서 생성 되었습니다. 또한, qRT-PCR에 대 한 높은-품질 RNA 병원 체 mRNA 다음의 탐지를 위해 얻어질 수 있다 감염, 그리고 충분 한 단백질 서쪽 오 점 분석에 대 한 이러한 셀에서 추출할 수 있습니다. 함께 찍은, 우리 병원 체 침입의 확실 한 조정 및 세균성과 바이러스 성 병원 체 종류와 hemocyte 추출 위한 효율적인 방법 초파리 에서 충분 한 라이브 hemocytes를 사용 하 여 감염의 확인 하는 방법 제시 vivo ex vivo에서 감염 실험의 애벌레
서문
초파리 melanogaster 타고 난 면제1의 연구에 대 한 기초가 튼튼한 모델 생물 이다. 타고 난 면역 반응 동안 hemocytes 병원 체 도전 하 응답에서 중요 한 역할을 재생합니다. Hemocytes는 캡슐화 기생충, 곰 팡이, 바이러스, 그리고 세균성 감염2,3중 phagocytic 행동을 통해 병원 체 퇴치에 중요 한 기능을가지고 위한 중요 합니다.
최고의 호스트의 병원 성 미생물 감염에 타고 난 면역 반응 이해, 그것은 병원 체 감염 시 호스트 셀을 침공 하는 방법을 시각화 하는 것이 중요. 이 시각화의 메커니즘의 이해에 기여 한다. 병원 체 세포내 지역화의 세부 사항 및 세포질 응답, 이러한 데이터는 감염 하는 미생물이 작용 하는 세포 세포 호스트 응답에 대 한 단서를 제공할 수 있습니다. 따라서, 영상 현미경 검사 법에 의해 후 3D 모델 재구성 호스트 세포에 병원 균의 정확한 위치를 확인 하려면 유용할 수 있습니다. 이 연구에서 우리는 Coxiella burnetii (C. burnetii), Q 열, 기본 초파리 hemocytes에 둘 다 인간과 동물 건강에 심각한 위협이 포즈 동물 매개 질병의 원인이 되는 대리인의 침공 시각. 최근에, 그것은 초파리 는 Biosafety 수준 2 9 마일 단계 II (NMII) 복제 4 C. burnetii 의 긴장과이 긴장은 초파리4를 복제할 수는 를 나타내는에 취약 입증 되었다 초파리 C. burnetii 병 인을 공부 하는 모델 생물으로 사용할 수 있습니다.
이전 연구는 호스트의 타고 난 면역 반응 검사를 hemocytes를 사용 했습니다. Hemocytes 형태학 관찰5,,67, 형태학 분석2,8, 먹어서 분석2,3, qRT-PCR2 사용 되었습니다. , 9, immunoprecipitation10,11, immunofluorescent 분석10,12, immunostaining13, immunoblotting3,10, 11 및 immunohistochemistry9,14. 초파리 S2 세포, 다양 한 생체 외에서 실험에 사용할 수도 있지만 immortalization 및 잠재적인 기존의 바이러스 감염 그들의 행동15,16변경. S2 세포 같은 불멸 하 게 셀 라인, 반대로 1 차 셀의 사용 수 있습니다 타고 난 면역 기능 연구에 대 한 시스템에서 전체 유기 체의 더 대표. 또한, hemocytes에서 vivo에서, 추출, 이전 감염 다른 호스트 단백질 및 조직, 비보 전 감염 전에 hemocytes의 추출에 비해 우위를 셀 수 있습니다. 다른 방법의 수는 hemocytes 살아8,17,,1819계속 시간의 짧은 기간에 hemocytes의 충분 한 수를 이용 되어 있다.
이 연구에서는 hemocytes C. burnetii, Listeria monocytogenes (Listeria), 또는 무척추동물 무지개 빛깔의 병원 성 미생물 감염에 대 한 초파리 3rd 탈피 애벌레에서 추출 하는 방법 소개 6 (IIV6) 바이러스입니다. Vivo에서 및 비보 전 hemocyte 감염에 대 한 방법을 설명합니다. Vivo에서-와 ex vivo-감염된 hemocytes confocal 현미경 검사 법으로 구상 되었고 C. burnetii 의 3D 모델을 구축 하는 데 사용. 또한, 프로토콜을 사용 하는 추출, ex vivo-감염된 hemocytes 유전자와 단백질 식에 사용 된 분석 실험. 특히, IIV6 및 Listeria감염의 정도 검사, 총 RNA 또는 단백질 했다 격리 qRT-PCR 또는 서쪽 오 점 분석에 대 한 셀에서. 함께 찍은, 프로토콜 빠르게 3rd 탈피 애벌레와 기본 hemocytes, vivo에서 또는 전 비보감염 증거에서 hemocytes의 높은 숫자를 수집 하는 메서드를 제공 합니다에 대 한 적합 한 플랫폼 미생물 병원 체 감염 연구 그리고 현미경 검사 법, transcriptomics, proteomics 등 해당 다운스트림 분석.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 감염 비보 전
- 매체 및 장비
- 무 균 조건 하에서 준비 신선한 초파리 Hemocyte 분리 매체 (작성자) 75% 슈나이더의 초파리 를 포함 보통 25%로 태아 둔감 한 혈 청 (FBS)와 필터 살 균 그것.
- 레이어는 stereomicroscope에서 10 cm x 10 cm 파라핀 영화의 2-3 조각.
- 유리 모 세관을 준비 합니다. 최대의 55%를 모 세관 끌어당기는 히터를 설정 합니다. 약 10 µ m의 날카로운 포인트를 모 세관 튜브를 당겨.
- 백필 미네랄 오일 모 세관입니다.
- Nanoinjector (그림 1A)에 채워진된 모 세관 튜브를 조립 하 고 집게 (그림 1B) 끝을 끊어서 융합된 세관 팁을 엽니다. 팁의 외부 직경은 hemocytes의 쉬운 이해를 위한 100 µ m 이어야 한다.
- 모 세관 튜브 끝에서 가능한 많은 기름 추출 다음 작성자와 작성. 최대 촬영 hemolymph와 오일의 테두리 쉽게 시각화, 포함 석유와 작성자 사이 공기 거품 (그림 1B').
- Hemolymph 추출
- 선택 3rd 탈피 초파리 애벌레 안쪽에서 음식의 벽 집게를 사용 하 여 부드럽게 리 바이 알 및 100 µ m 여과기 (그림 1C)에 그들을 배치. 3rd 탈피 애벌레는 성인 여성에 의해 누워 비옥한 계란을 다음 3-6 일 찾을 수 있습니다.
참고: 이러한 실험 사용 유전자 형, w1118; P {w+ mCHml GAL4.Δ =} 2, P {w+ mCUAS-2xEGFP =} AH2, 이후이 동물에서 hemocytes 표현 향상 된 녹색 형광 단백질 (EGFP) 현미경으로 세포의 식별에 도움. - 애벌레에 붓는 살 균 물의 5 mL와 5 미 장소 작업 지우기에 여과기 과잉의 물을 제거 하는 여과기를 흔들어 (그림 1C').
- Microcentrifuge 1.5 mL 튜브에 애벌레를 전송 합니다. 5 CO2 가스와 함께 그들을 anesthetize (그림 1D).
- 등-면 (그림 2A) 최대 stereomicroscope, 아래 파라핀 필름에 애벌레를 놓습니다.
- 제자리에 후부 표 피 중단을 장소 애벌레 후부 시체에 가볍게 모 세관 유리 정밀한 날카로운된 집게 (그림 2B)를 사용 하 여 엽니다.
- Hemolymph 파라핀 필름 (그림 2C)에 흐르는 것을 허용 한다.
- 파라핀 영화에 한 번에 20-50 애벌레에서 hemocytes를 포함 하는 hemolymph의 풀을 확인 합니다.
- 소요는 유리를 사용 하 여 풀링된 hemolymph nanoinjector (그림 2D)에 모 세관.
참고: hemolymph의 약 10-20 µ L을 하 고 있어야 합니다. - 작성자 (그림 2E)의 500 µ L을 포함 하는 1.5 mL microcentrifuge 관으로는 hemolymph를 꺼냅니다.
- 반복 단계 1.2.4)-1.2.9) 애벌레의 모든 일괄 처리에 대 한.
- 선택 3rd 탈피 초파리 애벌레 안쪽에서 음식의 벽 집게를 사용 하 여 부드럽게 리 바이 알 및 100 µ m 여과기 (그림 1C)에 그들을 배치. 3rd 탈피 애벌레는 성인 여성에 의해 누워 비옥한 계란을 다음 3-6 일 찾을 수 있습니다.
- Hemocytes의 수를 계산 합니다.
- 죽은 세포 얼룩 0.6 mL microcentrifuge 튜브에 0.4 %Trypan 블루 솔루션의 5 µ L 플라스틱 부드럽게 작성자와는 피 펫을 사용 하 여 1.5 mL 튜브에 hemocytes 0.6 mL microcentrifuge 튜브에 hemocytes를 포함 하 여 작성자의 5 µ L를 전송 하 고 부드럽게 혼합.
- 1:1 Trypan 파랑: hemocyte 혼합물에서 셀의 10 µ L는 hemocytometer에 플라스틱.
- 라이브 hemocytes는 하지로 얼룩진 Trypan 블루는 hemocytomter의 4 모서리 필드의 각을 계산 하는 수식을 사용 하 여 밀리 리터 당 hemocytes의 농도의 수를 계산:
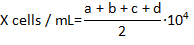
여기서 X는 밀리; 당 라이브 hemocytes의 농도 a, b, c, 그리고 d는 필드의 각 4 (Trypan 블루 제외 결정)로 라이브 셀 수는 hemocytometer에 계산. 셀 계산의 총 수의 2에 의해 Trypan 블루 셀의 1:1 희석 때문입니다. Trypan 푸른 물 셀 죽으로 간주 됩니다.
-
비보 전 감염
- Timepoints 및 생물에 따라 세포와 시드를 우물의 수 복제 각 실험에 필요한 결정 합니다. 5.0 × 104 hemocytes는 RNA와 단백질 정화 감염 다음 필요한.
- 작성자는 다음 수식을 사용 하 여 감염에 대 한 희석에 병원 체의 볼륨을 계산:
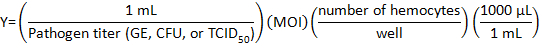
어디 감염 (MOI)의 다양성은 바이러스의 수 또는 박테리아 세포 당 원하는.
참고: 사용 하는 나는 개별 실험 및 분석 실험 수행에 따라 다릅니다. 여기, 10 게놈 등가물 (GE) / C. burnetii, Listeria의 10 CFU/셀 또는 IIV6의 1 TCID50/cell의 셀이 사용 되었다. - 튜브에 바이러스 성 또는 세균성 볼륨에 작성자의 적절 한 볼륨을 추가 하 여 24-잘 접시의 각 음에 대 한 병원 체 매체의 500 µ L를 준비 합니다.
- 장소는 12 m m 24-잘 접시의 우물에 덮개 유리 (두께 1) 라운드.
- 24-잘 접시의 우물에는 hemocytes를 포함 하 여 작성자를 분할.
- 잘에서 hemocytes에 병원 체 매체의 500 µ L를 추가 합니다.
- 1000 x g 5 분 동안에 격판덮개 원심
- 1 h 28 ° c.에 대 한 접시를 품 어 모든 15 분 부드럽게 앞, 다음 5 오른쪽 왼쪽 뒤에서 접시 기울기 손으로 s.
- 침공/첨부 파일 단계 1.4.8의 1 h), 후 부드럽게 병원 체 매체에서 플라스틱 세척 신선한 작성자와 hemocytes 그리고 신선한 작성자의 500 µ L 리필.
- 원하는 시간에 대 한 감염된 hemocytes를 품 어. 이러한 실험, C. burnetii에서-또는 IIV6에 감염 된 hemocytes는 24 시간, 및 Listeriaincubated-감염된 hemocytes 1, 2, 또는 4 h 알을 품는.
2. vivo에서 감염
- 감염
- 따뜻한 실 온 15 분 접시에서 초파리 과일 주스 천 배지 이전 만들어집니다20을설명 합니다.
- 물과 압력솥의 700 mL를 agar의 30 g 추가 40 분 동안 그것.
- 메 틸 paraben 절대 에탄올 10 mL에 0.5 g을 녹.
- 과일 주스 농축의 300 mL에 메 틸 paraben 솔루션을 추가 합니다.
- 신속 하 게 압력가 한 솔루션으로 농축 혼합 하 고 10 × 35 mm 페 트리 접시에 5 mL을 분배.
- 후 15 분 동안 냉각 판, 4 ° c.에서 그들을 저장합니다
- 3rd 탈피 애벌레 1.2.1 단계 준비)-1.2.3).
- 한 천 배지에서 효 모 반죽을 놓습니다. 애벌레 (그림 3A) 건조를 피하기 위해 마이그레이션할 수 한 천 배지에서 잘 컷을 확인 합니다. 파라핀 영화 (그림 3B, C)를 사용 하 여 집게를 들고와 0.001 m m 지적된 텅스텐 바늘을 조립.
- 높은 titer mCherry의 50 µ L 플라스틱 표현-C. burnetii (5.95 × 109 GE/mL)를 파라핀에 스테레오 현미경 영화 하 고 애벌레 박테리아의 수영장.
- 박테리아의 수영장으로 애벌레를 놓습니다. 텅스텐 바늘 (그림 3D) 애벌레를 찌 르 기. 한 천 배지 (그림 3E)에 애벌레를 전송 합니다.
- 한 접시에 나머지 병원 체 매체 전송 및 파라핀 영화와 함께 접시를 봉인.
- 원하는 시간 후 감염 (그림 3F)까지 습 한 공기에는 접시에 애벌레 계속. 이 실험에서 C. burnetii-24 h에 대 한 접시에는 감염 된 애벌레.
- 따뜻한 실 온 15 분 접시에서 초파리 과일 주스 천 배지 이전 만들어집니다20을설명 합니다.
- Hemolymph 추출 및 hemocytes의 도금
- 준비 단계 1.1 다음과 같은 장비와 매체).
- 장소는 12 m m 24-잘 접시의 우물에 덮개 유리 (두께 1) 라운드. 우물에 작성자의 500 µ L 플라스틱
- 에서 추출 하는 hemolymph 단계 1.2.4 감염 된 애벌레)-1.2.8).
- 그럼 다음에 hemolymph를 추출 단계 2.2.2).
- 2.2.3 반복) 및 2.2.4) 애벌레의 여러 일괄 처리에 대 한.
- 1000 x g 5 분 동안에 격판덮개 원심
3입니다. 시각화
- 담합 및 얼룩
- 우물에서 라운드 커버 유리에 hemocytes 수 있도록, 후 부드럽게 각 우물에서 매체를 제거 합니다.
- 부드럽게 정착된 hemocytes의 각 음에 4 %paraformaldehyde (PFA)의 200 µ L를 추가 합니다. 실 온에서 20 분 동안 hemocytes를 품 어.
- 4% 제거 PFA 부드럽게 0.1%를 포함 하는 PBS의 200 µ L을 추가 하 고 트라이 톤 X-100 그리고 1% 소 혈 청 알 부 민 (BSA) 각 잘 하. 실 온에서 10 분 동안 hemocytes를 품 어.
- PBS를 제거 하 고 부드럽게 200 µ L의 ' 1 × 4, 6-diamidino-2-phenylindole (DAPI)을 각 영역을 추가 합니다. 실 온에서 어둠 속에서 10 분 동안 hemocytes를 품 어.
- DAPI 솔루션을 제거 하 고 부드럽게 각 우물에 PBS를 추가. 실 온에서 5 분 동안 hemocytes를 품 어.
- 유리 현미경 슬라이드에서 antifade 설치 매체의 10 µ L를 드롭.
- 각 우물에서 PBS를 제거한 후 덮개 유리 잘 지적 집게를 사용 하 여 24-잘 접시에서 제거 합니다. 부드럽게 유리 슬라이드에 아래로 hemocytes antifade 장착 매체에 커버 유리 넣습니다.
- 어두운 하룻밤에 그것을 배치 하 여 건조를 허용 합니다.
- Confocal 영상
- DAPI, EGFP, 및 mCherry의 세 가지 컬러 이미징 공초점 현미경을 구성 합니다. 다음 설정 사용: (예) 405 DAPI 여기 nm, 방출 (em) 415-480 nm; 488 전 EGFP nm, em 493-564 nm; 587 ex mCherry nm, em 597-700 nm.
- 현미경과 63 X를 사용 하 여 샘플에 초점에 샘플 배치 / 1.4 수 가늠 구멍 (NA) 목표. 이미징에 대 한 보기 필드에에서 원하는 hemocytes를 찾습니다.
- 샘플의 적절 한 노출을 달성 레이저 파워 및 검출기 이익 조정 합니다. 여러 z-비행기 노출 수준 전체 샘플 두께 적합 한지를 확인 하십시오.
- 전체 hemocyte의 z 축에서 위쪽 및 아래쪽 위치를 찾아. Z 단면에 대 한 시작 및 끝 위치도이 위치를 설정 합니다.
- 검색 줌 이미지는 hemocyte에 포함 된 영역을 사용 합니다. 3 X의 확대/축소 요소는 자주 사용 하 고 있다.
- X-y 평면에서 1024 x 1024 픽셀 등 적절 한 해상도 이미지 시리즈와 z 차원에서 0.3 µ m 간격을 수집 합니다.
- 3D 모델 재구성
참고: 오픈 소스 소프트웨어는 3D 모델 재구성에 대 한 대부분의 아래에 설명 된 함수를 수행 하는 존재 합니다.- 3D 모델 재구성 confocal 현미경과 관련 된 소프트웨어에 z sectioned 이미지 시리즈 파일을 가져옵니다.
- DAPI와 mCherry C. burnetii 는 EGFP hemocyte 표현에 표현 스테인드 핵의 공동 지역화를 표시 하는 셀을 선택 합니다. 자르기만 단일 셀을 포함 하도록 이미지 시리즈.
- 3D 뷰어 옵션 소프트웨어의 사전 패키지 된 알고리즘을 사용 하 여 3D 모델을 재구성을 선택 합니다. 3D 표현 혼합, 표면, 및 혼합된 옵션 중 원하는 유형을 선택 합니다. 이 방법에서는, hemocytes, 핵, 및 C. burnetii 표시 됩니다 표면 모델을 사용 하 여.
- 마우스 버튼을 누른 화면 커서를 드래그 하 여 보기의 다양 한 위치에서 3D 복원된 셀을 관찰 합니다. 셀 방향 및 이미지를 최적화 하기 위해 모델된 광원의 위치를 조정 합니다. 불투명도, 최소 및 최대 임계값, 스 페 큘 러, 주위, Shineness, 및 감마에 대 한 다른 옵션 이미지를 최적화 하기 위해 존재 합니다.
- 횡단면은 hemocyte의 내부 내용을 시각화를 클리핑 및 단면 명령을 사용 하 여 모델을 가져가 라.
4입니다. 유전자 및 단백질 분석에 대 한 응용 프로그램
- 후속 qRT-PCR를 위한 세포를 lyse 다음 IIV6 및 Listeria, 감염 또는 서쪽 오 점 분석 앞에서 설명한 다음 제조업체의 지침과21 .
참고: qRT-PCR를 위한 뇌관 및 서쪽 오 점을 위해 항 체에 대 한 테이블의 자료 를 참조 하십시오. - 증폭된 제품의 적절 한 길이 있도록 agarose 젤 전기 이동 법, 앞에서 설명한22로 PCR 제품 분석.
Access restricted. Please log in or start a trial to view this content.
결과
수집 3 × 10에 ex vivo 감염에 대 한 hemocytes 살고6 hemocytes 200 초파리 3rd 탈피 애벌레에서 추출 되었다. 우리의 방법 개발, 다양 한 다른 기술 시도 했다. 개별 애벌레 해 부까지 1.5 h 걸릴 것 이라고 하 고 ~ 8000 셀의 평균이 방법18, 대부분의 컬렉션의 끝에 의해 살아 있던을 사용 하 여 얻은 했다. 다음, 우리는 hemocytes를 포함 하는 h...
Access restricted. Please log in or start a trial to view this content.
토론
잘 이해 하려면 어떻게 호스트 세포 감염 될, 이전 안 된 병원 체와 세포 유형 조합4에 실험 하는 경우에 특히 셀, 병원 체의 지역화를 명확 하 게 중요 하다. 동안 감염에 따라 세포질 응답 캐스케이드 공부 생산 병원 체 침입을 나타낼 수 있습니다, 이미징 및 세포 응답 데이터의 조합 병원 체 침입 및 감염을 필수적 이다. 호스트 세포에 병원 체의 2 차원 이미지를 보여 주는 보고?...
Access restricted. Please log in or start a trial to view this content.
공개
저자 들은 아무 경쟁 금융 관심사 선언 합니다.
감사의 말
우리는 표현 하는 mCherry Coxiella burnetii의 주식을 제공 하기 위한 박사 로버트 Heinzen에 감사입니다. 우리는 비행 주식 제공 무척 추 동물 무지개 빛깔 바이러스 6 및 블루밍턴 재고 센터 제공을 위한 닥터 루이스 테 세이 라 감사 합니다. 이 프로젝트는 NIH 부여 R00 AI106963 (A.G.G.)와 워싱턴 주립 대학에 의해 부분적으로 투자 되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Schneider's Drosophila Medium | Thermo Fisher Scientific (Gibco) | 21720024 | 1.1.1), 2.1.2) |
| Fetal Bovine Serum | GE Healthcare Life Sciences (HyClone) | SH30070.03HI | 1.1.1), 2.1.2) |
| Filter (0.22 µL) | RESTEK | 26158 | 1.1.1) |
| Strainer (100 µm) | Greiner bio-one | 542000 | 1.2.1), 2) |
| Stereo microscope | Amscope | SM-1BSZ-L6W | 1.2), 2) |
| Glass capillary | Fisher Scientific | 21-171-4 | 1.1), 1.2), 2) |
| Capillary puller | Narishige International USA, Inc. | PC-10 | 1.1.3) |
| Mineral oil | Snow River Products | 1.1.4) | |
| Nanoinjector | Drummond Scientific Company | 3-000-204 | 1.1), 1.2), 2.2) |
| Forceps | VWR | 82027-402 | 1.1.5), 1.2), 2), 3.1.7) |
| CO2 delivery apparatus | Genesee Scientific | 59-122BC | 1.2), 2) |
| Trypan Blue | Thermo Fisher Scientific (Gibco) | 15250061 | 1.3) |
| Hemocytometer | Hausser Scientific | 3100 | 1.3) |
| 24 well plate | Greiner bio-one | 662160 | 1.4), 2.2) |
| Coxiella burnetii - mCherry | Dr. Heinzen, R. | 1.4), 2.2) | |
| Drosophila fruit juice plates | Cold Spring Harbor Protocols | 2.1) http://cshprotocols.cshlp.org/content/2007/9/pdb.rec11113.full | |
| Agar | Fisher Bioreagents | BP1423-500 | 2.1.1.1) |
| Methyl paraben | Amresco | 0572-500G | 2.1.1.2) |
| Absolute ethanol | Fisher Bioreagents | BP2818-500 | 2.1.1.2) |
| Welch's 100% Grape juice frozen concentrate, 340 mL | Amazon | B0025UJVGM | 2.1.1.3) |
| Petri dishes, 10 x 35 mm | Fisher Scientific | 08-757-100A | 2.1.1.4) |
| Microscope cover glass | Fisher Scientific | 12-545-80 | 1.4.4), 2.2.2) |
| Yeast, Bakers Dried Active | MP Biomedicals | 0210140001 | 2.1) Add 2 parts of water to 1 part of yeast (v/v) |
| Tungsten needle | Fine Science Tools | 10130-20 | 2.1) |
| Holding forceps | VWR | HS8313 | 2.1) |
| Paraformaldehyde | Fisher Scientific | FLO4042-500 | 3.1.3) |
| Triton X-100 | Fisher Scientific | BP151-500 | 3.1.3) |
| Bovine Serum Albumin | Fisher Scientific | BP9706-100 | 3.1.3) |
| 4',6-diamidino-2-phenylindole | Thermo Fisher Scientific | 62247 | 3.1.4) |
| Antifade mounting medium | Thermo Fisher Scientific | P36930 | 3.1.6) |
| Confocal microsope | Leica | TCS SP8-X White Light Confocal Laser Scanning Microscope | 3.2) |
| 3D imaging reconstruction software | Leica | LASX with 3D visualization module | 3.3) |
| Microscope slides | Fisher Scientific | 12-552-3 | 3.1.6) |
| Invertebrate iridescent virus 6 (IIV6) | Dr. Teixeria, L. | 4) PLoS Biol, 6 (12), 2753-2763, doi: 10.1371/journal.pbio.1000002, (2008) | |
| Listeria monocytogenes | ATCC | strain: 10403S | 4) Listeria monocytogenes strain 10403S (Bishop and Hinrichs, 1987) was grown in Difco Brain-heart infusion (BHI) broth (BD Biosciences) containing 50 µg/ml streptomycin at 30 °C. |
| DNase I | Thermo Fisher Scientific(Invitrogen) | 18068015 | gDNA degradation |
| cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| IIV6_193R_F | IDT | qRT-PCR, 5'- TCT TGT TTT CAG AAC CCC ATT -3' | |
| IIV6_193R_R | IDT | qRT-PCR, 5'- CAC GAA GAA TGA CCA CAA GG -3' | |
| RpII_qRTPCR_fwd | SIGMA-ALDRICH | qRT-PCR, 5'- GAA GCG TTT CTC CAA ACG -AG | |
| RpII_qRTPCR_rev | SIGMA-ALDRICH | qRT-PCR, 5'- TTG AGC GTA AGC ATC ACC -TG | |
| SYBR Green qRT-PCR reagent | Thermo Fisher Scientific | K0251, K0252, K0253 | qRT-PCR |
| Real-Time PCR System | Thermo Fisher Scientific | 4351107, 7500 Software v2.0 | qRT-PCR |
| Anti-Listeria monocytogenes antibody | abcam | ab35132 | Western blot |
| Anti-Actin antibody produced in rabbit | SIGMA-ALDRICH | A2066 | Western blot |
| Anti-Rabbit IgG (H+L), HRP Conjugate | Promega | W4011 | Western blot |
참고문헌
- Hoffmann, J. A. The immune response of Drosophila. Nature. 426 (6962), 33-38 (2003).
- Regan, J. C., et al. Steroid hormone signaling is essential to regulate innate immune cells and fight bacterial infection in Drosophila. PLoS Pathog. 9 (10), 1003720(2013).
- Yano, T., et al. Autophagic control of listeria through intracellular innate immune recognition in Drosophila. Nat Immunol. 9 (8), 908-916 (2008).
- Bastos, R. G., Howard, Z. P., Hiroyasu, A., Goodman, A. G. Host and Bacterial Factors Control Susceptibility of Drosophila melanogaster to Coxiella burnetii Infection. Infect Immun. 85 (7), (2017).
- Kacsoh, B. Z., Schlenke, T. A. High hemocyte load is associated with increased resistance against parasitoids in Drosophila suzukii, a relative of D. melanogaster. PLoS One. 7 (4), 34721(2012).
- Tsuzuki, S., et al. Switching between humoral and cellular immune responses in Drosophila. is guided by the cytokine GBP. Nat Commun. 5, 4628(2014).
- Kurucz, E., et al. Definition of Drosophila. hemocyte subsets by cell-type specific antigens. Acta Biol Hung. 58, Suppl 95-111 (2007).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods. 68 (1), 116-128 (2014).
- Arefin, B., et al. Apoptosis in Hemocytes Induces a Shift in Effector Mechanisms in the Drosophila. Immune System and Leads to a Pro-Inflammatory State. PLoS One. 10 (8), 0136593(2015).
- Rus, F., et al. Expression pattern of Filamin-240 in Drosophila blood cells. Gene Expr Patterns. 6 (8), 928-934 (2006).
- Kurucz, E., et al. Hemese, a hemocyte-specific transmembrane protein, affects the cellular immune response in Drosophila. P Natl Acad Sci USA. 100 (5), 2622-2627 (2003).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. P Natl Acad Sci USA. 106 (12), 4805-4809 (2009).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biol Open. 4 (3), 355-363 (2015).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. P Natl Acad Sci USA. 101 (39), 14192-14197 (2004).
- Flynt, A., Liu, N., Martin, R., Lai, E. C. Dicing of viral replication intermediates during silencing of latent Drosophila viruses. P Natl Acad Sci USA. 106 (13), 5270-5275 (2009).
- Jovel, J., Schneemann, A. Molecular characterization of Drosophila cells persistently infected with Flock House virus. Virology. 419 (1), 43-53 (2011).
- Stoepler, T. M., Castillo, J. C., Lill, J. T., Eleftherianos, I. A simple protocol for extracting hemocytes from wild caterpillars. J Vis Exp. (69), e4173(2012).
- Sampson, C. J., Williams, M. J. Protocol for ex vivo incubation of Drosophila primary post-embryonic haemocytes for real-time analyses. Methods Mol Biol. 827, 359-367 (2012).
- Nehme, N. T., et al. A model of bacterial intestinal infections in Drosophila melanogaster. PLoS Pathog. 3 (11), 173(2007).
- Drosophila fruit juice egg plates. Cold Spring Harbor Protocols. (9), pdb.rec11113 (2007).
- Ahlers, L. R., Bastos, R. G., Hiroyasu, A., Goodman, A. G. Invertebrate Iridescent Virus 6, a DNA Virus, Stimulates a Mammalian Innate Immune Response through RIG-I-Like Receptors. PLoS One. 11 (11), 0166088(2016).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), (2012).
- Petraki, S., Alexander, B., Bruckner, K. Assaying Blood Cell Populations of the Drosophila melanogaster Larva. J Vis Exp. (105), (2015).
- Figliozzi, R. W., Chen, F., Chi, A., Hsia, S. C. Using the inverse Poisson distribution to calculate multiplicity of infection and viral replication by a high-throughput fluorescent imaging system. Virol Sin. 31 (2), 180-183 (2016).
- Rizki, T. M., Rizki, R. M. Lamellocyte differentiation in Drosophila. larvae parasitized by Leptopilina. Dev Comp Immunol. 16 (2-3), 103-110 (1992).
- Markus, R., Kurucz, E., Rus, F., Ando, I. Sterile wounding is a minimal and sufficient trigger for a cellular immune response in Drosophila melanogaster. Immunol Lett. 101 (1), 108-111 (2005).
- McCormack, R., et al. Perforin-2 Protects Host Cells and Mice by Restricting the Vacuole to Cytosol Transitioning of a Bacterial Pathogen. Infect Immun. 84 (4), 1083-1091 (2016).
- Ozgen, A., et al. Construction and characterization of a recombinant invertebrate iridovirus. Virus Res. 189, 286-292 (2014).
- Jakob, N. J., Muller, K., Bahr, U., Darai, G. Analysis of the first complete DNA sequence of an invertebrate iridovirus: coding strategy of the genome of Chilo iridescent virus. Virology. 286 (1), 182-196 (2001).
- Ghigo, E., Colombo, M. I., Heinzen, R. A. The Coxiella burnetii parasitophorous vacuole. Adv Exp Med Biol. 984, 141-169 (2012).
- Liu, F., et al. Drosophila melanogaster prophenoloxidases respond inconsistently to Cu2+ and have different activity in vitro. Dev Comp Immunol. 36 (3), 619-628 (2012).
- De Gregorio, E., et al. An immune-responsive Serpin regulates the melanization cascade in Drosophila. Dev Cell. 3 (4), 581-592 (2002).
- Kari, B., et al. The raspberry Gene Is Involved in the Regulation of the Cellular Immune Response in Drosophila melanogaster. PLoS One. 11 (3), 0150910(2016).
- Wu, A. R., et al. Quantitative assessment of single-cell RNA-sequencing methods. Nat Methods. 11 (1), 41-46 (2014).
- Buettner, F., et al. Computational analysis of cell-to-cell heterogeneity in single-cell RNA-sequencing data reveals hidden subpopulations of cells. Nat Biotechnol. 33 (2), 155-160 (2015).
- Nevil, M., Bondra, E. R., Schulz, K. N., Kaplan, T., Harrison, M. M. Stable Binding of the Conserved Transcription Factor Grainy Head to its Target Genes Throughout Drosophila melanogaster Development. Genetics. 205 (2), 605-620 (2017).
- Yang, C. P., et al. Transcriptomes of lineage-specific Drosophila neuroblasts profiled by genetic targeting and robotic sorting. Development. 143 (3), 411-421 (2016).
- Jaitin, D. A., et al. Dissecting Immune Circuits by Linking CRISPR-Pooled Screens with Single-Cell RNA-Seq. Cell. 167 (7), 1883-1896 (2016).
- Karaiskos, N., et al. The Drosophila embryo at single-cell transcriptome resolution. Science. 358 (6360), 194-199 (2017).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유