A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل خلايا Decidual البشرية الأولية من الأغشية الجنينية لمصطلح مترافق
In This Article
Summary
هذا البروتوكول يوضح طريقة لعزل الخلايا ديسيدوال البشرية الأولية التي تم جمعها من الأغشية الجنينية مترافق المدى الذي يمكن استخدامه لمجموعة متنوعة من التطبيقات (أي إيمونوسيتوتشيميستري، والتدفق الخلوي، إلخ) بهدف أن دراسة دور السكان خلية مختلفة في مضاعفات الحمل.
Abstract
أوروبية، يعرف أيضا باسم بطانة الرحم الحامل، أنسجة الإنجابية ذات أهمية حاسمة. خلايا ديسيدوال، وتتألف أساسا من الخلايا المناعية، وخلايا اللحمية ديسيدواليزيد المسؤولة عن إفراز العوامل الهرمونية وملهبة للمشاعر التي حاسمة بالنسبة لزرع الكيسة ناجحة، وضع المشيمة وتقوم بدور في بدء العمل في المصطلح والولادة قبل الأوان. يمكن أن تنشأ مضاعفات الحمل كثيرة من اضطرابات توازن دقيق للسكان خلية مختلفة تضم أوروبية. التعديلات بالنسبة لأنواع محددة من الخلايا ديسيدوال قد تعطل هذه العمليات الحاسمة وزيادة خطر الإصابة بالمضاعفات الخطيرة للحمل، مثل فشل غرس الأجنة، وتقييد النمو داخل الرحم، بريكلامبسيا و حزب العمل قبل الأوان. يوضح البروتوكول المبينة هنا التكلفة والوقت وسيلة فعالة لعزل الخلايا ديسيدوال البشرية الأولية التي تم جمعها من الأغشية الجنينية لمصطلح مترافق. من خلال الجمع بين الهضم الأنزيمي وتمزيق الأنسجة ديسيدوال الميكانيكية لطيف، تم الحصول على عائد عالية من الخلايا ديسيدوال مع تقريبا أي تلوث المشيمة. الأهم من ذلك، اتسمت بعزل الخلايا ديسيدوال (stromal خلايا (55-60 في المائة)، والكريات البيضاء (35 في المائة)، الظهارية (1%) أو الخلايا تروفوبلست (0.01 ٪)) والمحافظة على استمرارية عالية (80 في المائة) التي أكدها التصوير متعدد الألوان التدفق الخلوي بالانزيم. هذا البروتوكول هو محددة إلى parietalis أوروبية ويمكن تكييفها مترافق الاثلوث الأول والثاني. مرة واحدة معزولة، يمكن استخدام الخلايا ديسيدوال للعديد من تطبيقات تجريبية تهدف إلى فهم دور السكان الفرعية خلية ديسيدوال مختلفة في مضاعفات الحمل.
Introduction
بطانة الرحم، واحدة من الأنسجة الإناث الكبار الأكثر نشاطا، يخضع دراماتيكية إعادة عرض كل دورة الطمث في الاستجابة للتحفيز بهرمونات المبيض، الإستروجين (E2) وهرمون البروجسترون (P4). أوروبية، يعرف أيضا باسم بطانة الرحم الحامل، هو أنسجة الإنجابية حاسمة أهمية التي شكلتها نهاية مرحلة بوستوفولاتوري نتيجة لتمايز يحركها P4 عقب المرحلة التكاثري E2 المهيمنة. ديسيدوال الخلايا المسؤولة عن إفراز العوامل الهرمونية لزرع الكيسة الناجحة وتنمية واجهة الرحم المشيمة للحفاظ على التسامح الأمهات إلى allograft الجنين.
ديسيدواليزيشن مطلوب لغرس ويعيد البناء اللاحقة الشرايين دوامة ديسيدوال. الخلايا اللحمية الرحم الخضوع ديسيدواليزيشن، تحت سيطرة P4 والمخيم، أثناء الحيض المتأخر من دورة الطمث1. يتم بدء هذه العملية حول الأوعية الدموية وينتشر في جميع أنحاء ستروما، مما يشير إلى دورها في إعادة عرض المفرج والكريات البيض الاتجار بالتنظيم. يتسم هذا التحول الخلوي مورفولوجيا دائرية، والزيادة في حجم النووية، والتوسع في هيولى خشنة وجهاز غولجي2. ديسيدواليزيد الخلايا اللحمية هي قادرة على إنتاج عوامل paracrine دعم انغراس الكيسة وتتميز بإفراز العديد من الهرمونات (أي البرولاكتين)، عوامل نمو الأوعية، عامل نمو الأنسولين ملزمة البروتين-1 (إيجفبب-1)، البروستاغلاندين (PG) ﻫ (مشجعا لمخيم داخل الخلايا)، السيتوكينات، عناصر المصفوفة خارج الخلية والمغذيات الأساسية للمشيمة غرس وتنمية3،،من45،6 .
السكان decidual خلية لا تتألف فقط من الخلايا اللحمية ديسيدواليزيد ولكن يحتوي أيضا على السكان الكريات البيض ديسيدوال كبيرة، وخاصة بالحمل. ديسيدواليزيشن ينطوي على ذمة المترجمة عابرة وتدفق الخلايا (ناغورني كاراباخ) القاتل الطبيعي والخلايا التائية والخلايا الجذعية والضامة. يتدنى الكريات البيض أكبر من الخلايا ناغورني كاراباخ الرحم، تتألف من حوالي 50-70% من جميع الكريات البيضاء الأمهات تسلل أوروبية التي مصدر السيتوكينات والأوعية العوامل التي قد تساعد في عملية ديسيدواليزيشن وزيادة في عدد طوال فترة الحمل7. توجد حول موقع غرس الضامة، يجري يتدنى ثاني أكبر من الخلايا المناعية، وزيادة أثناء الحمل8. فمصدر السيتوكينات وعوامل النمو مثل مستعمرة حفز عامل (CSF-1)9وعامل نخر الورم α (TNFα)10 البروستاغلاندين (PG) ه11.
طوال فترة الحمل، وقبل فترة المخاض، أوروبية مصدرا رئيسيا من السيتوكينات والمستقطبات المسؤولة عن تنشيط الكريات البيض المحيطي الأمهات والهجرة اللاحقة في أنسجة الرحم الشروع في العمل. وأظهرت الدراسات الحيوانية أن السيتوكينات برو-التهابات عديدة أعلى-ينظم أوروبية الماوس أثناء العمل، مثل تنف-أ، 6-إيل، إيل-12، وايل-1b12. في أوروبية البشرية، يحمل برو-التهابات السيتوكينات إيل-1b، إيل-6، وايل-8 (chemoattractant العَدلات الرئيسية) التعبير أعلى أثناء العمل مقابل لا في العمل13. هذه يفرز نتيجة السيتوكينات في التنشيط وتدفق الكريات البيضاء في أنسجة ديسيدوال14؛ يعتبر زيادة في بلعم decidual وتسلل العَدلات في كلا الإنسان والفئران أثناء فترة العمل، مع تسلل decidual السابقة ميوميتريال 4-fold أكبر، مما يشير إلى سلسلة تنشيط بين أنسجة الرحم هذا اثنين المتاخمة 15. هذه تسلل الكريات البيضاء تنتج سرفيسز قادرة على تفعيل تقلصات متزامنة myometrium16، مصفوفة ميتالوبروتيناسيس (يتولى) الشروع في الغشاء تمزق18من17،، كذلك السيتوكينات برو التحريضية لتضخيم عملية تنشيط الرحم (سيتوكين العاصفة '').
بسبب العديد من الوظائف الهامة لخلايا ديسيدوال، مثل لعب دوراً حاسما في عملية زرع، والحفاظ على التسامح الأم الجنين في الحمل المبكر، والمشاركة في تنشيط العمل في الأجل، يمكن أن تنشأ الأمراض المختلفة خلال الحمل. على سبيل المثال، يمكن أن يؤدي العقم (1) بسبب فشل غرس المتكررة وفقدان الحمل المتكرر عن عدم نضج ديسيدوال؛ (2) تقييد نمو داخل الرحم (IUGR) وبريكلامبسيا بسبب التنمية غير لائق والخلل أوروبية/المشيمة أو المساس بها التحول الأوعية الدموية عند تقاطع decidual ميوميتريال؛ وكذلك الولادة قبل الأوان (3) التي يمكن أن تنجم عن التنشيط ديسيدوال سابق لأوانه.
وفي ضوء هذه الاضطرابات الرئيسية، إلى جانب القيود الأخلاقية والعملية للدراسات الإنسانية في فيفو ، إنشاء خطوط الخلايا ديسيدوال البشرية الأساسية ضروري للتحليل في المختبر بغية فهم أفضل و تحسين إدارة سريرية من مضاعفات الحمل. ولذلك، كان هدف البحث لوضع بروتوكول الذي يسمح لعزل الخلايا ديسيدوال البشرية الأولية مع خلية عالية المردود والجدوى التي تم جمعها من الأغشية الجنينية لمصطلح مترافق. هذا البروتوكول الحالي يصف بوضوح أسلوب الوقت--وفعالة من حيث التكلفة لعزل من أنواع فرعية محددة من ديسيدوال الخلايا التي يمكن استخدامها لمجموعة متنوعة من التحليلات في المختبر . وصف وفرة والنمط الظاهري للسكان الفرعية ديسيدوال في الأجل ومقارنة بالربع الأول أو الثاني أمر حاسم لتحديد أدوارهم في جميع أنحاء البشرية من الحمل.
Protocol
مترافق جمعت من الأجل صحية، لا في عمالة المرأة تمر بالقيصرية الاختيارية. جمع وتجهيز، والمتاح من العينات البشرية التقيد بالمبادئ التوجيهية لمجلس "جبل سيناء مستشفى الأخلاق". يتم الحصول على موافقة خطية من كل مريض. هذه الدراسة هو وافق عليها "المجلس أخلاقيات البحوث" في مستشفى جبل سيناء.
1-الأعمال التحضيرية
ملاحظة: يجب أن تتم جميع الخطوات تحت غطاء دخان ويجب تعقيم جميع المعدات الجراحية عبر اﻷوتوكﻻف قبل الإيداع في غطاء الدخان. يجب تعقيم جميع المواد الأخرى (الزجاجات، وأنابيب 50 مل، إلخ) مع محلول إيثانول 70%. دائماً في جميع الأوقات ارتداء معدات الوقاية الشخصية عند التعامل مع النفايات اوتوكلاف (معطف مختبر، والقفازات، والشعر الطويل مرتبطة إلى الوراء، إلخ).
-
الحل الهضم الأنزيمي (الحل النهائي: 200 مل)
- "الماصة؛" 180 مل من حبس--/--في كوب 500 مل، إضافة المغناطيس إثارة معقمة ووضع في إثارة لوحة في درجة حرارة الغرفة.
- تزن وإضافة ما يلي إلى حبس/الحل ببطء والتتابع: 20 مل FBS، 400 ملغ 2 كولاجيناز ([النهائي] = 2 مغ/مل)، 20 ملغ مثبط التربسين فول الصويا ([النهائي] = 0.1 مغ/مل)، 30 ملغ الدناز 1 ([النهائي] = 0.15 مغ/مل)، و 200 ملغ جيش صرب البوسنة ([النهائي] = 1 ملغ/مل)
- تعيين التحريك بسرعة متوسطة، والسماح الخليط لإثارة لمدة 10-20 دقيقة (تغطية بالقصدير إحباط أو البارافين الفيلم أثناء التحريك).
- صب الحل المختلط في زجاجة زجاج 250 مل باستخدام قمع بلاستيك وتوضع في غطاء الدخان.
- تمرير حل عن طريق وحدة ترشيح أعلى بلاستيك (0.22 ميكرومتر غشاء التصفية، 500 مل)، الكوة مل 20 إلى 50 مل أنابيب (المجموع 10 أنابيب) ومخزن في-20 درجة مئوية حتى الاستخدام.
-
وسائط RPMI 1640 (غسل الحل والمتوسطة النمو الكامل 10% 2%)
- الجمع بين RPMI 1640 و FBS في زجاجة زجاج في غطاء الدخان.
- بالنسبة 2% FBS الحل، دمج مل 490 من RPMI 1640 و 10 مل FBS.
- لحل FBS 10%، الجمع بين 450 مل RPMI 1640 و 50 مل FBS.
- "الماصة؛" 500 ميكروليتر من نورموسين في زجاجة زجاج 500 مل من الخطوة السابقة التي تحتوي على وسائط الإعلام ربمي و FBS (50 ملغم/مل 0.05 مغ/مل الأسهم، تركيز عمل).
- قم بتمرير وسائط الإعلام من خلال 0.22 ميكرومتر غشاء التصفية ومخزن في زجاجة زجاج 500 مل عند 4 درجة مئوية حتى الاستخدام.
- 30 دقيقة قبل البدء بالتجربة، ضع قاسمة 20 مل من تجميد الحل الهضم الأنزيمي في حمام حبة 37 درجة مئوية، ومكان 2% FBS والإعلام FBS RPMI 1640 10% في حمام حبة 37 درجة مئوية، بدوره في حوض ماء هزاز وتعيين إلى 37 درجة مئوية ، ز 2، ومجموعة درجة حرارة التي تسيطر أجهزة الطرد مركزي إلى 4 درجات مئوية.
2-جمع الأنسجة ديسيدوال من مصطلح الأغشية المشيمية
- ضع الزجاجات مع حبس + +، حبس--/--وخمسة أنابيب 50 مل في رف تحت غطاء الدخان. "الماصة؛" 25 مل حبس + + في أنبوب واحد.
-
استخدام الأيدي القفاز، إخراج المشيمة الأجل من الحاويات المستخدمة لنقله من المسرح غرفة العمليات. مكان المشيمة على لوح حفاضات (الأمهات الجانب الأعلى) وانتشرت في الأغشية الجنينية باستخدام مقص وملقط.
- وضع منصات حفاضات متداخلة على غطاء الدخان.
- استخدم حفاضات منفصلة للوجه المشيمة ذلك الجانب الأمهات هو الوجه.
- العثور على نقطة تمزق الأغشية وجعل شقوق للسماح للغشاء تتكشف ووضع مسطح على سطح فوميهود.
ملاحظة: حالما يتم سحبها الغشاء مرة أخرى من المشيمة، سيكون أوروبية الوجه حتى يستريح على طبقة المشيمة، مع طبقة amnion في الخلف.
- استخدام مكشطة بلاستيكية خلية، بعناية كشط الأنسجة decidual قبالة المشيمة ومكان في أنبوب 50 مل تحتوي على 25 مل حبس + +.
- كشط الغشاء مع ضغط معتدل. لا يتم تطبيق الكثير من الضغط كما أنه قد يسفر عن تلوث المشيمة. جمع الجلطات الدموية الصغيرة كذلك، وهذه تحتوي على بعض الخلايا ديسيدوال.
تنبيه: بعد جمع ديسيدوال والمشيمة يجب تعبئتها في حاوية بلاستيكية واقية والمجمدة في ثلاجة-20 درجة مئوية قبل التخلص المناسبة (وفقا للقواعد المؤسسية الخاصة بك). يجب ملفوفة في أكياس بلاستيكية ختم ضيق منصات حفاضات الدموية والتخلص منها في صندوق أمن للوقاية من الإخطار البيولوجية.
3-الغسيل والانزيميه هضم الأنسجة ديسيدوال
- غسل الأنسجة التي تم جمعها من خلال الهز أنبوب 50 مل باليد برفق ويمر من خلال غربال معدنية (250 ميكرومتر، مش حجم 60) 250 ميكرو يستريح على حاوية عينات عقيمة (البول).
- تكرار الغسيل مرتين مع حبس + + ومرتين مع حبس--/--في أنابيب جديدة لكل غسل. (يغسل النهائي مع هبس-/-يسمح لإزالة الكالسيوم والمغنيزيوم موجودة في هبس + +، والذي يتعارض مع عملية الهضم الأنزيمي التالية خلاف ذلك).
ملاحظة. خلال خطوات الغسيل، سيتضح تلوث أنسجة المشيمة كما الأنسجة ديسيدوال هو ضوء وردي اللون وغير متبلور، في حين المشيمة بيضاء وكثيفة، ومفتول العضلات. ولذلك، يمكن بسهولة إزالة تلوث المشيمة بالملقط. - بشكل اختياري، إذا كانت الأنسجة decidual سميكة، أنه نقل إلى طبق بتري معقم 10 سم قطر والشروع في فرم النسيج مع اثنين من المشارط المتعارضة في الطبق.
-
ضع الأنسجة غسلها في أنبوب 50 مل العقيمة التي تحتوي على 100 مغ من الأنسجة/مل من محلول الهضم الأنزيمي (انظر الأعمال التحضيرية).
- كنقطة مرجعية، ضمان أن يصل مستوى الأنسجة decidual علامة 5-10 مل في أنبوب 50 مل.
- استخدم ما يقرب من 20 مل من محلول الهضم الأنزيمي (أعدت في الخطوة 1، 1) لهضم أوروبية الإجمالية التي تم جمعها من غشاء الجنين مدة كلها.
- ختم غطاء الأنبوبة مع الفيلم البارافين (ختم الأنبوب محكم ولف الفيلم البارافين حول الغطاء والعلوي من الأنبوب) تحت الثقافة هود واحتضان الأنسجة ديسيدوال في 37 درجة مئوية لمدة 20 دقيقة في حمام مائي تهز (145 لفة في الدقيقة ، ز 2).
- بعد الحضانة، إزالة الفيلم البارافين وتعقيم سطح الأنبوب الذي يحتوي على أنسجة هضمها مع الإيثانول 70% وتحت غطاء الدخان. هز الأنبوب بإيجاز باليد.
- جمع تعليق خلية عن طريق منخل معدني (250 ميكرومتر، مش حجم 60) في حاوية عينة معقمة جديدة. تخفف من حجم متساوية (20 مل) ربمي + 10% FBS يحتوي على 0.1% نورموسين لوقف رد الفعل الأنزيمي. انتقل مباشرة إلى الخطوة الطرد المركزي 4.1.
- إذا لزم الأمر، ضع الأنسجة عسر الهضم المتبقية مرة أخرى إلى أنبوب 50 مل جديدة مع 20 مل من محلول الهضم الأنزيمي الطازجة وكرر الهضم (20 دقيقة, 37 درجة مئوية، والهز حمام المياه).
- إذا كان ضروري هضم ثاني، وضع الأنبوب الأول مع تعليق خلية على الجليد (الغطاء مع الفيلم البارافين للحفاظ على تعقيم). كرر الخطوات من 3.5-3.6 والجمع بين المعلقات خليتين.
4-توليد تعليق خلية مفردة
- الطرد المركزي بتعليق خلية (420 ز، 4 درجة مئوية، 11 دقيقة).
- إزالة المادة طافية وريسوسبيند الخلايا في 40 مل ربمي + 2% FBS يحتوي على 0.1% نورموسين ("المخزن المؤقت للمياه والصرف الصحي").
ملاحظة: سوف يكون فضفاض وهلامي بسبب تلوث خلايا الدم الحمراء بيليه الخلية، ونضح المادة طافية بحذر. قد يلزم إزالة المرحلة العليا مع ماصة يدوي. - تكرار استخدام الطرد المركزي في 420 ز عند 4 درجة مئوية لمدة 11 دقيقة.
- بعناية إزالة المادة طافية (كما ورد في المذكرة خطوة 4.2) وريسوسبيند بيليه الخلية في 5 مل من المخزن المؤقت للمياه والصرف الصحي وإضافة 35 مل من المخزن المؤقت لتحلل كرات الدم الحمراء في الأنبوب نفسه.
ملاحظة: إذا كان بيليه دموية جداً أو كبيرة، فإنه يمكن تقسيمها إلى أنبوبين لخطوة تحلل كرات الدم الحمراء بإضافة 10 مل من المخزن المؤقت للمياه والصرف الصحي، وعلى قدم المساواة في تقسيم اثنان أنابيب ثم إضافة 35 مل من المخزن المؤقت لتحلل كرات الدم الحمراء لكل أنبوبة. - تبني على الجليد ل 20 دقيقة بإيجاز دوامة tube(s) في البداية ونهاية الحضانة خلايا الدم الحمراء.
- الطرد المركزي في 420 ز لمدة 11 دقيقة في 4 درجات مئوية.
- بعناية إزالة المادة طافية وريسوسبيند بيليه في 40 مل من المخزن المؤقت للمياه والصرف الصحي.
- تمر الخلايا من خلال عامل تصفية نايلون ميكرومترات 70 لإزالة كتل الخلية.
- أجهزة الطرد المركزي في 420 ز لمدة 11 دقيقة في 4 درجات مئوية.
- إزالة المادة طافية وريسوسبيند بيليه الخلية في 10 مل متوسطة كاملة (ربمي FBS التي تحتوي على نورموسين 0.1% + 10%).
-
عد الخلايا باستخدام الإجراء هيموسيتوميتير الاستبعاد صبغة زرقاء تريبان كما هو موضح أدناه:
- تحت غطاء الثقافة بلطف "الماصة؛" تعليق خلية صعودا وهبوطاً 3 x من أجل مزيج دقيق قبل الجمع بين تريبان الأزرق. 1.5 مل أنبوب إعداد تعليق خلية، المخفف 1:2 (الجمع بين 20 ميكروليتر من حل تريبان الأزرق) و 20 ميكروليتر من تعليق خلية ديسيدوال. عناية مزيج تريبان الأزرق-خلية الحل قبل بيبيتينج صعودا وهبوطاً عدة مرات (هذا الحل غير معقمة).
- مكان هيموسيتوميتير في مرحلة المجهر مع ساترة زجاجية في أعلى.
ملاحظة: هيموسيتوميتير شريحة مجهر مع الشبكات على أن تعطي تسعة مربعات كبيرة مقسمة بخطوط ثلاثية. كل ساحة كبيرة تبلغ مساحتها 1 مم2، وعمق السائل في الدائرة 0.1 ملم. ولذلك، حجم السوائل التي يمكن ملء كل ساحة كبيرة 1 * 1 مم * 0.1 = 0.1 مم3= 10-4 مل. - إضافة 10 ميكروليتر من خليط تريبان الأزرق-الخلية ببطء في أخدود هيموسيتوميتير، مما يتيح عمل شعري لتفريق الخليط خلية على الشريحة بأكملها (وقف قبل أن يملأ الخليط جيدا).
- عرض الخلايا تحت مجهر (في 10 X التكبير) وعد كافة الخلايا البيضاء/الأخضر التي تستبعد تريبان الأزرق (وهذه هي خلايا قابلة للحياة) في أربعة مربعات الخارجي كبيرة هيموسيتوميتير. عند عد الخلايا التي تعمل باللمس على الخط، عد سوى تلك التي تعمل باللمس الحق والخطوط العلوية لكن تلك لا لمس يسار وأسفل خطوط. لا عد الخلايا زرقاء داكنة؛ اللون الأزرق يشير إلى أن الخلية ميتة كما يمكن بسهولة اختراق صبغ تريبان الأزرق عبر غشاء البلازما في السيتوبلازم.
- لحساب عدد الخلايا قابلة للتطبيق في 1 مل تعليق خلية (X):
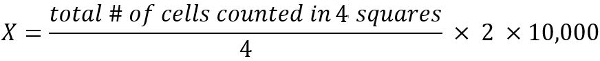
2 = عامل إضعاف
10,000 = معامل التحويل (1 مل = 1 سم3 = 10، 000 * 0.1 مم3)
- تمييع الخلايا ديسيدوال إلى تركيز نهائي المرغوب فيه في ربمي + 10% FBS (متوسط النمو).
ملاحظة: لزراعة الأنسجة والطلاء، "الماصة؛" 2 * 106 خلايا/بئر إلى لوحة 6-جيدا بلاستيك، 10 * 106 خلايا في صفيحة بلاستيكية 10 سم أو خلايا 75,000 إلى ساترة زجاج.
النتائج
للتحقق من كفاءة وسلامة الخلايا المعزولة، أنها اتسمت بطريقتين: التدفق الخلوي وإيمونوسيتوتشيميستري (المحكمة الجنائية الدولية). واستهدفت 4 خلية السكان؛ تم الكشف عن الخلايا اللحمية ديسيدواليزيد بالأجسام المضادة-فيمنتين، الكريات البيض عموم علامة CD45 استخدمت لتحديد الخلايا ...
Discussion
يوضح البروتوكول وصف هنا التكلفة والوقت وسيلة فعالة لعزل الخلايا ديسيدوال الأولية التي تم جمعها من الأغشية الجنينية للمصطلح البشري كله مترافق هو الوصول للغاية وواضحة. أن نجاح هذا البروتوكول يعتمد على اثنين من العوامل الحاسمة، (1) الكفاءة لإلغاء ديسيدوال من المشيمة طبقة من الأغشية الجنيني?...
Disclosures
الكتاب لا تمت بصلة إلى الكشف عن
Acknowledgements
الكتاب أود أن أشكر الجهات المانحة، في المصرف البيولوجي ركويه، ومستشفى جبل سيناء/فواز قسم طب التوليد وطب النساء والتوليد للعينات البشرية المستخدمة في هذه الدراسة. ونود أن نشكر أعضاء مختبر الغسول، ولا سيما الدكتور كارولين الغمر لمساعدتها في وضع أسلوب. هذا العمل يدعم "صندوق بوروز الترحيب" (منحة #1013759).
Materials
| Name | Company | Catalog Number | Comments |
| Hank’s balanced salt solution with calcium and magnesium | Prepared in facility (LTRI) | ||
| Hank’s balanced salt solution without calcium and magnesium | Prepared in facility (LTRI) | ||
| Diaper pads | Sigma-Aldrich | D9542 | |
| Large surgical scissors | AL Medical | 2018-12-20. | |
| Large surgical forceps | Fine Science Tools | 11000-18 | |
| Plastic disposable cell scraper (25 cm) | Sarstedt | 83.183 | |
| 250 mm (size 60 mesh) metal sieve | Sigma-Aldrich | S1020-5EA | |
| Disposable scalpel with plastic handle (#21) | Fisher Scientific | 08-927-5D | |
| Sterile plastic petri dish (diameter 10 cm) | Sarstedt | 82.1473.001 | |
| Sterile specimen container (urine cup, 4.5 oz) | VWR | 25384-146 | |
| Nylon filter (70 mm) | VWR/Corning | 21008-952 | |
| Erythrocyte lysis buffer | Qiagen | 79217 | |
| Trypan blue, 0.4% solution | Lonza | 17-942E | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Hemocytometer | Reichert | 1490 | |
| Roswell Park Memorial Institute (RPMI) 1640 culture media | Invitrogen | 11835-055 | |
| Fetal bovine serum | Wisent | 080-150 | |
| Normocin (50mg/ mL) | Invivogen | ant-nr-1 | |
| Plastic top filtration unit (0.22 mm membrane, 500 mL) | Millipore | SCGPT05RE | |
| Collagenase 2, lyophilized powder | Sigma-Aldrich | C6885 | |
| Soy bean trypsin inhibitor, powder | Sigma-Aldrich | T9003-250mg | |
| DNase powder | Roche | 10104159001 | |
| Bovine serum albumin (BSA powder) | Fisher Scientific | BP1600-100 | |
| Spinning disc confocal microscope - Leica DMI 6000B | Leica | ||
| Imaging Flow cytometer - Image Stream MK2 | Amnis | ||
| IDEA software | Millipore Sigma | ||
| APC-conjugated Vimentin antibody | R&D Systems | IC2105A | |
| APC H7-conjugated CD45 antibody | BD | 641399 | |
| FITC-conjugated Cytokeratin antibody | MACs Miltenyi Biotec | 130-080-101 | |
| PerCP -conjugated Cytokeratin 7 antibody | Novus | NBP2-47941PCP | |
| eFluor450 Fixable Viability dye | Thermo Fisher Scientific | 65-0863-14 | |
| Vimentin primary antibody | Santa Cruz | sc-7558 | |
| CD45 primary antibody | Dako | M0701 | |
| Cytokeratin primary antibody | Dako | M0821 | |
| Cytokeratin 7 primary antibody | Dako | M7018 | |
| Mouse IgG | Santa Cruz | sc-2025 | |
| Goat IgG | Santa Cruz | sc-2028 | |
| Alexa Fluor 546 secondary antibody | Invitrogen | A10036 | |
| Alexa Fluor 594 secondary antibody | Fisher Scientific | A-11058 | |
| DAPI | Sigma-Aldrich | D9542 |
References
- Brosens, N., Hayashi, N., White, J. O. Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells. Endocrinology. 140, 4809-4820 (1999).
- Bell, S. C., D'Arcangues, C., Frase, I. S., Newton, J. R., Odlind, V. . Decidualization and relevance to menstruation. , 187-212 (1990).
- Kariya, M. Interleukin-1 inhibits in vitro decidualization of human endometrial stromal cells. Journal of Clinical Endocrinology and Metabolism. 73, 1170-1174 (1991).
- Dimitriadis, E., Robb, L., Salamonsen, L. A. Interleukin 11 advances progesterone-induced decidualization of human endometrial stromal cells. Molecular and Human Reproduction. 8, 636-643 (2002).
- Wu, W. -. X., Brooks, J., Glasier, A. F., McNeilly, A. S. The relationship between decidualization and prolactin mRNA and production at different stages of human pregnancy. Society for Endocrinology. 14, 255-261 (1995).
- Bell, S. C. Synthesis and secretion of protein by the endometrium and decidua. Implantation: Biology and Clinical Aspects. , 95-118 (1988).
- Croy, B. A., Chantakru, S., Esadeg, S., Ashkar, A. A., Wei, Q. Decidual natural killer cells: key regulators of placental development. Journal of Reproductive Immunology. 57, 151-168 (2002).
- Smarason, A. K., Gunnarsson, A., Alfredsson, J. H., Valdimarsson, H. Monocytosis and monocytic infiltration of decidua in early pregnancy. Journal of Clinical and Laboratory Immunology. 21, 1-5 (1986).
- Daiter, E., Pampfer, S., Yeung, Y. G., Barad, D., Stanley, E. R., Pollard, J. W. Expression of colony- stimulating factor-1 in the human uterus and placenta. Journal of Clinical Endocrinology and Metabolism. 74, 850-858 (1992).
- Casey, M. L., Cox, S. M., Beutler, B., Milewich, L., MacDonald, P. C. Cachectin/tumor necrosis factor-alpha formation in human decidua. Potential role of cytokines in infection-induced preterm labor. Journal of Clinical Investigation. 83, 430-436 (1989).
- Lala, P. K., Kennedy, T. G., Parhar, R. S. Suppression of lymphocyte alloreactivity by early gestational human decidua. II. Characterization of the suppressor mechanisms. Cellular Immunology. 127, 368-381 (1988).
- Shynlova, O., Nedd-Roderique, T., Li, Y., Dorogin, A., Nguyen, T., Lye, S. J. Infiltration of myeloid cells into decidua is a critical early event in the labour cascade and post-partum uterine remodelling. Journal of Cellular and Molecular Medicine. 17, 311-324 (2013).
- Osman, I., Young, A., Ledingham, M. A., Thomson, A. J., Jordan, F., Greer, I. A., Norman, J. E. Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes, decidua, cervix and myometrium before and during labour at term. Molecular Human Reproduction. 9, 41-45 (2003).
- Farine, T., Lye, S. J., Shynlova, O. Peripheral maternal leukocytes are activated in response to cytokines secreted by uterine tissues of pregnant women. Journal of Cellular and Molecular Immunology. 14, 635-638 (2017).
- Hamilton, S., et al. Macrophages infiltrate the human and rat decidua during term and preterm labor: evidence that decidual inflammation precedes labor. Biology of Reproduction. 86, 39 (2011).
- Casey, M. L., Cox, S. M., Word, A., Macdonald, P. C. Cytokines and infection-induced preterm labour. Reprodution Fertility and Development. 2, 499-510 (1990).
- Yellon, S. M., Mackler, A. M., Kirby, M. A. The role of leukocyte traffic and activation in parturition. Journal of the Society for Gynecologic Investigation. 10, 323-338 (2003).
- Gomez-Lopez, N., StLouis, D., Lehr, M. S., Sanchez-Rodriguez, E. N., Arenas-Hernandez, M. Immune cells in term and preterm labor. Cellular & Molecular Immunology. 11, 571-581 (2014).
- Xu, Y., Plazyo, O., Romero, R., Hassan, S. S., Gomez-Lopez, N. Isolation of leukocytes from the human maternal-fetal interface. Journal of Visualized Experiments. 99, (2015).
- Trundley, T., Gardner, L., Northfield, J., Moffett, A. Methods for isolation of cells from the human fetal-maternal interface. Methods in Molecular Medicine. 122, 109-122 (2006).
- Jividen, K., Movassagh, M. J., Jazaeri, A., Li, H. Two methods for establishing primary human endometrial stromal cells from hysterectomy specimens. Journal of Visualized experiments. 87, (2014).
- Pelekanos, R. A., Sardesai, V. S., Futrega, K., Lott, W. B., Kuhn, M., Doran, M. R. Isolation and expansion of mesenchymal stem/stromal cells derived from human placenta tissue. Journal of Visualized experiments. 112, (2016).
- De Clercq, K., Hennes, A., Vrien, J. Isolation of mouse endometrial epithelial and stromal cells for in vitro decidualization. Journal of Visualized Experiments. 121, (2017).
- Zhang, J., Shynlova, O., Sabras, S., Bang, A., Briollais, L., Lye, S. J. Immunophenotyping and activation status of maternal and peripheral blood leukocytes during pregnancy and labour, both term and preterm. Journal of Cellular and Molecular Medicine. 10, 2386-2402 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved