Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento de células Decidual humanas primarias de las membranas fetales de la placenta de término
En este artículo
Resumen
Este protocolo muestra un método para el aislamiento de las células decidual humanas primarias recogidas de las membranas fetales de la placenta de término que puede ser utilizada para una variedad de aplicaciones (es decir, inmunocitoquímica, citometría de flujo, etc.) con el objetivo de para estudiar el papel de diferentes poblaciones celulares en complicaciones del embarazo.
Resumen
La decidua, también conocido como endometrio embarazada, es un tejido reproductivo críticamente importante. Las células decidual, conformadas principalmente por decidualized células del estroma y las células inmunes, son responsables de la secreción de factores inflamatorios y hormonales que son esenciales para la implantación del blastocisto exitosa, desarrollo placentario y desempeñar un papel en la iniciación del parto a término y prematuros. Muchas complicaciones en el embarazo pueden surgir de las perturbaciones del equilibrio de diferentes poblaciones celulares compuesto por decidua. Alteraciones en la proporción de tipos específicos de células decidual pueden interrumpir estos procesos cruciales y aumentar el riesgo de desarrollar complicaciones graves del embarazo, como la falta de implantación del embrión, restricción del crecimiento intrauterino, preeclampsia y trabajo de parto prematuro. El protocolo aquí descrito muestra un costo y el tiempo efectivo método para el aislamiento de las células decidual humanas primarias recogida de las membranas fetales de la placenta de término. Mediante la combinación de digestión enzimática y la interrupción mecánica suave del tejido decidual, se obtuvo un alto rendimiento de las células decidual con virtualmente ninguna contaminación del corion. Importante, se caracterizaron las células decidual aisladas (células estromales (55-60%), leucocitos (35%), epitelial (1%) o las células del trofoblasto (0.01%)) y mantiene viabilidad alta (80%), que fue confirmada por análisis de citometría de flujo imágenes multicolor. Este protocolo es específico para los parietalis de los decedentes y puede ser adaptado a las placentas de primer y segundo trimestres. Una vez aislado, las células decidual se pueden utilizar para multitud de aplicaciones experimentales con el objetivo de entender el papel de las subpoblaciones diferentes células decidual en complicaciones del embarazo.
Introducción
El endometrio, uno de los más activos tejidos femeninos adultos, sufre espectacular remodelación cada ciclo menstrual en respuesta a la estimulación por las hormonas ováricas, estrógenos (E2) y progesterona (P4). La decidua, también conocido como endometrio embarazada, es un tejido reproductivo críticamente importante que está formado por el final de la fase postovulatoria como resultado de la diferenciación basada en P4 después de la fase proliferativa de E2-dominante. Las células decidual son responsables de la secreción de factores hormonales para la implantación del blastocisto exitoso y para el desarrollo de la interfaz de útero-placentaria para el mantenimiento de la tolerancia al aloinjerto fetal.
Decidualization se requiere para la implantación y la subsecuente remodelación de las arterias en espiral decidual. Las células estromales del endometrio experimentan decidualization, bajo el control de P4 y campamento, durante la fase lútea tardía del ciclo menstrual1. Este proceso se inicia alrededor de los vasos sanguíneos y se extiende a lo largo del estroma, lo que sugiere su papel en la remodelación de la vasculatura y leucocito tráfico regulación. Esta transformación celular se caracteriza por una morfología circular, aumento del tamaño nuclear y expansión del retículo endoplásmico y aparato de Golgi2. Decidualized células estromales son capaces de producir factores paracrinos apoyando la implantación del blastocisto y caracterizan por la secreción de numerosas hormonas (es decir, prolactina), factores de crecimiento angiogénicos, factor de crecimiento insulínico binding protein-1 (IGFBP-1), prostaglandina (PG) E (estimulador de cAMP intracelular), citoquinas, componentes de la matriz extracelular y nutrientes esenciales para la placenta implantación y desarrollo3,4,5,6 .
La población de células decidual no se compone únicamente de células stromal decidualized pero también contiene poblaciones leucocitarias decidual grandes y específicos del embarazo. Decidualization incluye edema localizado transitorio y afluencia de células de naturales del asesinas (NK), células T, células dendríticas y macrófagos. La subpoblación más grande del leucocito es las células NK uterinas, que comprende aproximadamente el 50-70% de todos los leucocitos maternos la decidua que son una fuente de citocinas y factores angiogénicos que pueden ayudar en el proceso de decidualization y aumento de la infiltración número a lo largo del embarazo7. Macrófagos, siendo la segunda subpoblación de las células inmunes, se encuentran alrededor del sitio de implantación y aumentan durante el embarazo8. Son una fuente de citocinas y factores de crecimiento como colonia estimulante factor (CSF-1)9, factor de necrosis tumoral α (TNFα)10 y prostaglandina (PG) E11.
Durante el embarazo y antes de parto prematuro, la decidua es una fuente importante de citoquinas y quimioquinas responsables de activación leucocitaria periférica materna y posterior migración a los tejidos uterinos para iniciar el trabajo. Estudios en animales demostraron que numerosas citoquinas pro-inflamatorias son para arriba-regulados en la decidua de ratón durante el parto, tales como TNF-a, IL-6, IL-12 y IL-1b12. En la decidua humana, citoquinas proinflamatorias IL-1b, IL-6 e IL-8 (principales chemoattractant neutrófilo) exhiben mayor expresión durante el parto frente a no en el trabajo13. Estas Secretan citocinas resulta en una activación y afluencia de leucocitos en el tejido decidual14; un aumento de macrófagos decidual e infiltración neutrófila en ambos el ser humano y la rata se ve durante el parto de término, con infiltración decidual anterior myometrial 4 mayor, indicando una cascada de activación entre este los tejidos uterinos dos adyacentes 15. éstos infiltración leucocitos producen PGs capaces de activar las contracciones sincrónicas del miometrio16, metaloproteinasas de matriz (MMPs) para iniciar la membrana ruptura17,18, así como citoquinas proinflamatorias a amplificar el proceso de activación uterina ('tormenta del cytokine').
Debido a muchas funciones importantes de las células decidual, como jugando un papel fundamental en el proceso de implantación, mantener tolerancia materno fetal en la gestación temprana y participando en la activación del parto a término, pueden surgir diferentes patologías durante el embarazo. Por ejemplo, (1) infertilidad por fallo de implantación recurrente y pérdida recurrente de embarazo puede ser resultado de una falta de maduración decidual; (2) restricción del crecimiento intrauterino (RCIU) y preeclampsia debido al inadecuado desarrollo y disfunción de la decidua/placenta o transformación vascular comprometido en el cruce de decidual myometrial; Además de parto prematuro (3) que puede resultar de la activación decidual prematura.
A la luz de estos trastornos mayores, juntados con las limitaciones éticas y prácticas de estudios humano en vivo , establecimiento de líneas de células decidual humano primario es esencial para análisis en vitro con el fin de comprender mejor y mejorar el manejo clínico de las complicaciones del embarazo. Por lo tanto, el objetivo de nuestra investigación fue desarrollar un protocolo que permite el aislamiento de las células decidual primarias humanas con celular alto rendimiento y viabilidad de las membranas fetales de la placenta de término. Este protocolo actual claramente describe un método de tiempo y costo efectiva para aislar de subtipos específicos de decidual de las células que se utilizan para una variedad de análisis en vitro . Caracterización de la abundancia y el fenotipo de las subpoblaciones decidual en término y en comparación al primer o segundo trimestre es cruciales para definir sus funciones a lo largo de la gestación humana.
Protocolo
Se recoge la placenta de término sano, no en las mujeres de trabajo sometidas a cesáreas electivas. La colección, procesamiento y desechable de muestras humanas se adhieren a las directrices de la Junta del Mount Sinai Hospital ética. Se obtiene un consentimiento por escrito de cada paciente. Este estudio es aprobado por la Junta de ética de investigación en el Hospital Mount Sinai.
1. preparaciones
Nota: Todos los pasos deben llevarse a cabo bajo una campana de humos y todo el equipo quirúrgico debe ser esterilizado por autoclave antes de la colocación de la campana. Todos los demás materiales (botellas, tubos de 50 mL, etc.) deben ser esterilizados con solución de etanol 70%. Siempre use equipo de protección personal en todo momento al trabajar con residuos biopeligrosos (bata, guantes, cabello largo atado hacia atrás, etc.).
-
Solución de digestión enzimática (solución Final: 200 mL)
- Pipeta 180 mL de HBSS-/ - en un vaso de precipitados de 500 mL, añada imán agitación estéril y colocar sobre placa de agitación a temperatura ambiente.
- Pesar y agregar lo siguiente a la HBSS/solución lentamente y secuencialmente: 20 mL de SBF, 400 mg 2 de colagenasa ([final] = 2 mg/mL), 20 mg inhibidor de la tripsina de Soya bean ([final] = 0.1 mg/mL), 30 mg 1 DNasa ([final] = 0.15 mg/mL) y 200 mg de BSA ([final] = 1 mg/mL)
- Configurar la agitación a velocidad media y permiten la mezcla revolviendo durante 10-20 min (cubierta con película de papel o la parafina lata agitación).
- Vierta la solución mezclada en una botella de vidrio de 250 mL utilizando un embudo de plástico y colocar en la capilla del humo.
- Pasar la solución a través de una unidad de filtración superior plástico (0.22 μm filtro de membrana, 500 mL), alícuota 20 mL en tubos de 50 mL (10 tubos total) y almacenar a-20 ° C hasta su uso.
-
Medio RPMI 1640 (2% de lavado solución y medio completa 10%)
- Combine el RPMI 1640 y FBS en un frasco de vidrio en la campana.
- Solución al 2% FBS, combinan 490 mL de RPMI 1640 y 10 mL de SBF.
- Solución al 10% FBS, combinan 450 mL de RPMI 1640 y 50 mL de SBF.
- Pipetear 500 μL de normocin en la botella de vidrio de 500 mL del paso anterior que contiene los medios RPMI y FBS (50 mg/mL stock, 0.05 mg/mL trabajo concentración).
- Pasar los medios a través de un 0,22 μm filtro de membrana y tienda en una botella de vidrio de 500 mL a 4 ° C hasta su uso.
- 30 min antes de comenzar el experimento, colocar una alícuota de 20 mL de congelados solución de digestión enzimática en un baño de grano de 37 ° C, coloque el 2% FBS y los medios de comunicación 10% FBS RPMI 1640 en un baño de 37 ° C grano, encender el baño de agua oscilante y a 37 ° C , 2 g y establecer una centrifugadora de temperatura controlada de 4 ° C.
2. colección de tejido Decidual de las membranas placentarias de término
- Coloque botellas con HBSS + / +, HBSS-/-cinco tubos de 50 mL en un estante bajo la campana. Pipetear 25 mL de HBSS + / + en un tubo.
-
Con las manos enguantadas, sacar la placenta de término del envase utilizado para el transporte desde el teatro de sala de operaciones. Poner la placenta en el cojín del pañal (maternal hacia arriba) y extensión de las membranas fetales usando tijeras y pinzas.
- Poner cojines superpuestos de pañal en la campana.
- Utilice un pañal separado para voltear la placenta para que el lado materno está boca arriba.
- Encontrar el punto de ruptura de la membrana y hacer incisiones para permitir que la membrana desplegar y poner el plano en la superficie de fumehood.
Nota: Una vez que la membrana se tira detrás de la placenta, la decidua será boca arriba descansando sobre la capa del corion, con la capa de amnios en la parte posterior.
- Con un raspador de plástico celular, raspe con cuidado el tejido decidual del corion y lugar en el tubo de 50 mL conteniendo 25 mL HBSS + / +.
- Raspar la membrana con una presión moderada. No aplique demasiada presión ya que puede causar contaminación del corion. Recoger pequeños coágulos de sangre así como éstos contienen algunas células decidual.
PRECAUCIÓN: Después de colección decidual, placenta debe ser empaquetada en un cubo de plástico de biohazard y congelada en un congelador de-20 ° C antes de la eliminación apropiada (de acuerdo con las reglas institucionales). Pads pañal sangriento ser envuelto en una bolsa de plástico de cierre hermético y deben en una caja de seguridad de sustancias biopeligrosas.
3. lavadora y enzimática de la digestión del tejido Decidual
- Lavar los tejidos recogidos suavemente agitando el tubo de 50 mL con la mano y pasar por un tamiz metálico (250 μm, tamaño 60 mesh) de 250 μm descansando sobre un recipiente de muestra estéril (orina).
- Repetir el lavado dos veces con HBSS + / + y dos veces con HBSS-/ - en tubos de frescos para cada lavado. (final se lava con HBSS-/-permite la eliminación de calcio y magnesio presente en HBSS + / +, que de lo contrario interferiría con el proceso de digestión enzimática).
TENGA EN CUENTA. Durante los pasos de lavado, contaminación de tejido corión será evidente como el tejido decidual es luz color de rosa en color y amorfo, mientras que el corion es blanco, denso y fibroso. Por lo tanto, contaminación del corion puede eliminarse fácilmente con fórceps. - Opcionalmente, si el tejido decidual es grueso, transferirlo a una placa de Petri estéril 10 cm diámetro y proceder a partir del tejido con dos bisturíes opuestas en el plato.
-
Coloque el tejido lavado en tubo estéril de 50 mL que contienen 100 mg de tejido/mL de solución de digestión enzimática (ver preparación).
- Como punto de referencia, asegúrese de que el nivel de tejido decidual alcanza la marca de 5-10 mL en el tubo de 50 mL.
- Use aproximadamente 20 mL de solución de digestión enzimática (preparado en el paso 1.1) para digerir la decidua total recopilada de una membrana fetal de todo término.
- Sellar la tapa del tubo con la película de parafina (sellar herméticamente el tubo y envolver película de parafina alrededor de la tapa y la parte superior del tubo) bajo la campana y se incuba el tejido decidual a 37 ° C por 20 min en un baño (145 rpm 2 g).
- Después de la incubación, retirar la película de parafina y esterilizar la superficie del tubo que contiene el tejido digerido con etanol al 70% y bajo la campana. Agite el tubo brevemente con la mano.
- Recoger la suspensión celular por el tamiz de metal (250 μm, tamaño 60 mesh) en un nuevo contenedor de muestra estéril. Diluir con un volumen igual (20 mL) de RPMI + 10% FBS que contiene 0.1% normocin para detener la reacción enzimática. Proceder directamente al paso de centrifugación 4.1.
- Si es necesario, coloque el tejido restante no digerido en un nuevo tubo de 50 mL con 20 mL de solución de digestión enzimática fresco y repetir la digestión (20 min, 37 º C, agitación en baño de agua).
- Si una segunda digestión es necesaria, colocar el primer tubo con la suspensión celular en hielo (cubierta con la película de parafina para mantener estéril). Repita los pasos del 3.5-3.6 y combinar las suspensiones de dos células.
4. generar una suspensión unicelular
- Centrifugue la suspensión de células (420 g, 4 ° C, min 11).
- Quite el sobrenadante y resuspender las células en 40 mL de RPMI + 2% FBS que contiene 0,1% normocin ("buffer de lavado").
Nota: Precipitado de células sueltas y gelatinoso debido a la contaminación de eritrocitos, aspirar el sobrenadante con cuidado. Eliminación de la fase superior con una pipeta manual puede ser necesaria. - Repetir la centrifugación a 420 g a 4 ° C durante 11 minutos.
- Cuidadosamente Quite el sobrenadante (como se menciona en la nota paso 4.2) y resuspender el precipitado de células en 5 mL de tampón de lavado y añadir 35 mL de tampón de lisis de eritrocitos en el mismo tubo.
Nota: Si la pastilla es grande o muy sangriento, se puede dividir en dos tubos para el paso de lisis de eritrocitos al agregar 10 mL de tampón de lavado y dividir igualmente en dos tubos y luego agregar 35 mL de tampón de lisis de eritrocitos a cada tubo. - Incubar en hielo durante 20 min tubos de vórtice brevemente al principio y al final de la incubación para lisar los glóbulos rojos.
- Centrifugue a 420 g durante 11 minutos a 4 ° C.
- Con cuidado, quite el sobrenadante y resuspender el pellet en 40 mL de tampón de lavado.
- Pasar las células a través de un filtro de nylon μm 70 para quitar grumos de células.
- Centrifugar a 420 g durante 11 minutos a 4 ° C.
- Quite el sobrenadante y resuspender el precipitado de células en 10 mL de medio completo (RPMI 10% + SBF que contiene 0.1% normocin).
-
Contar las células mediante el procedimiento de hemocitómetro de exclusión de colorante azul de trypan como se describe a continuación:
- Bajo el capó de la cultura pipetee suavemente suspensión arriba y abajo 3 x para mezclar bien antes de combinar con azul tripán. De 1,5 mL tubo preparar suspensión celular, diluido 1:2 (combinar 20 μL de solución de azul tripán) y 20 μL de la suspensión celular decidual. Cuidadosamente mezcle trypan azul celular solución mediante pipeteo arriba y abajo un par de veces (esta solución no es estéril).
- Coloque el hemocitómetro sobre la platina del microscopio con cubreobjetos de cristal en la parte superior.
Nota: El hemocitómetro es un portaobjetos de microscopio con rejillas que dan nueve grandes plazas divididos por líneas triples. Cada cuadrado grande tiene una superficie de 1 mm2, y la profundidad de líquido en la cámara es de 0,1 mm. Por lo tanto, el volumen de líquido que puede llenar cada cuadrado grande es 1 mm * 1 mm * 0,1 mm = 0,1 mm3= 10-4 mL. - Lentamente agregar 10 μL de la mezcla de células azul trypan en la ranura del hemocitómetro, permitiendo la acción capilar dispersar la mezcla de células sobre la diapositiva entera (parada antes mezcla bien llena).
- Ver las células bajo el microscopio (con 10 aumentos) y contar todas las células de blanco/verde que excluyen trypan blue (son las células viables) en las cuatro plazas exteriores grandes del hemocitómetro. Al contar las células que tocan la línea, cuenta sólo ese toque el derecho y líneas superiores pero no los toca la izquierda y la líneas de fondo. No cuentan las células azul oscuras; color azul indica que la célula está muerta como colorante trypan azul puede penetrar fácilmente a través de la membrana plasmática en el citoplasma.
- Para calcular el número de células viables en 1 mL de la suspensión celular (X):
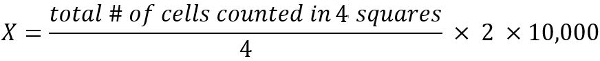
2 = factor de dilución
10.000 = factor de conversión (1 mL = 1 cm3 = 10, 000 * 0. 1 mm3)
- Diluir las células decidual a una concentración final deseable en RPMI + 10% FBS (medio de cultivo).
Nota: Para placas de cultivo de tejidos, pipetear 2 * 106 células/pozo en una placa plástica de pozo de 6, 10 * 106 células en una placa de plástico de 10 cm o 75.000 células a un cubreobjetos de vidrio.
Resultados
Para validar la eficiencia y la viabilidad de las células aisladas, se caracterizaron por dos métodos: flujo cytometry y la inmunocitoquímica (ICC). 4 poblaciones celulares fueron dirigidas; las células stromal decidualized fueron detectados por los anticuerpos anti-vimentina, marcador pan-leucocitos CD45 fue utilizado para identificar células inmunes decidual, cytokeratin fue utilizado para detectar células epiteliales/endoteliales y finalmente, el cytokeratin 7 fue utilizado para ...
Discusión
El protocolo aquí descrito muestra un costo y el tiempo efectivo método para aislar las células decidual primarias recogida de las membranas fetales de la placenta de término todo humano que es muy accesible y sencilla. El éxito de este protocolo depende de dos factores fundamentales, (1) eficiencia de decidual raspar de la capa del corion de las membranas fetales y (2) el cuidado con que se manejan las células decidual en el protocolo. Es importante que la contaminación de tejido del corion está controlada por a...
Divulgaciones
Los autores no tienen nada que revelar
Agradecimientos
Los autores desean agradecer a los donantes, el Banco de RCWIH y el Hospital Mount Sinai/UHN Departamento de Obstetricia y Ginecología por el especímenes humanos utilizados en este estudio. Nos gustaría agradecer a los miembros del laboratorio de lejía, particularmente el Dr. Caroline Dunk por su ayuda con el desarrollo del método. Este trabajo es apoyado por el fondo de la recepción de Burroughs (grant #1013759).
Materiales
| Name | Company | Catalog Number | Comments |
| Hank’s balanced salt solution with calcium and magnesium | Prepared in facility (LTRI) | ||
| Hank’s balanced salt solution without calcium and magnesium | Prepared in facility (LTRI) | ||
| Diaper pads | Sigma-Aldrich | D9542 | |
| Large surgical scissors | AL Medical | 2018-12-20. | |
| Large surgical forceps | Fine Science Tools | 11000-18 | |
| Plastic disposable cell scraper (25 cm) | Sarstedt | 83.183 | |
| 250 mm (size 60 mesh) metal sieve | Sigma-Aldrich | S1020-5EA | |
| Disposable scalpel with plastic handle (#21) | Fisher Scientific | 08-927-5D | |
| Sterile plastic petri dish (diameter 10 cm) | Sarstedt | 82.1473.001 | |
| Sterile specimen container (urine cup, 4.5 oz) | VWR | 25384-146 | |
| Nylon filter (70 mm) | VWR/Corning | 21008-952 | |
| Erythrocyte lysis buffer | Qiagen | 79217 | |
| Trypan blue, 0.4% solution | Lonza | 17-942E | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Hemocytometer | Reichert | 1490 | |
| Roswell Park Memorial Institute (RPMI) 1640 culture media | Invitrogen | 11835-055 | |
| Fetal bovine serum | Wisent | 080-150 | |
| Normocin (50mg/ mL) | Invivogen | ant-nr-1 | |
| Plastic top filtration unit (0.22 mm membrane, 500 mL) | Millipore | SCGPT05RE | |
| Collagenase 2, lyophilized powder | Sigma-Aldrich | C6885 | |
| Soy bean trypsin inhibitor, powder | Sigma-Aldrich | T9003-250mg | |
| DNase powder | Roche | 10104159001 | |
| Bovine serum albumin (BSA powder) | Fisher Scientific | BP1600-100 | |
| Spinning disc confocal microscope - Leica DMI 6000B | Leica | ||
| Imaging Flow cytometer - Image Stream MK2 | Amnis | ||
| IDEA software | Millipore Sigma | ||
| APC-conjugated Vimentin antibody | R&D Systems | IC2105A | |
| APC H7-conjugated CD45 antibody | BD | 641399 | |
| FITC-conjugated Cytokeratin antibody | MACs Miltenyi Biotec | 130-080-101 | |
| PerCP -conjugated Cytokeratin 7 antibody | Novus | NBP2-47941PCP | |
| eFluor450 Fixable Viability dye | Thermo Fisher Scientific | 65-0863-14 | |
| Vimentin primary antibody | Santa Cruz | sc-7558 | |
| CD45 primary antibody | Dako | M0701 | |
| Cytokeratin primary antibody | Dako | M0821 | |
| Cytokeratin 7 primary antibody | Dako | M7018 | |
| Mouse IgG | Santa Cruz | sc-2025 | |
| Goat IgG | Santa Cruz | sc-2028 | |
| Alexa Fluor 546 secondary antibody | Invitrogen | A10036 | |
| Alexa Fluor 594 secondary antibody | Fisher Scientific | A-11058 | |
| DAPI | Sigma-Aldrich | D9542 |
Referencias
- Brosens, N., Hayashi, N., White, J. O. Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells. Endocrinology. 140, 4809-4820 (1999).
- Bell, S. C., D'Arcangues, C., Frase, I. S., Newton, J. R., Odlind, V. . Decidualization and relevance to menstruation. , 187-212 (1990).
- Kariya, M. Interleukin-1 inhibits in vitro decidualization of human endometrial stromal cells. Journal of Clinical Endocrinology and Metabolism. 73, 1170-1174 (1991).
- Dimitriadis, E., Robb, L., Salamonsen, L. A. Interleukin 11 advances progesterone-induced decidualization of human endometrial stromal cells. Molecular and Human Reproduction. 8, 636-643 (2002).
- Wu, W. -. X., Brooks, J., Glasier, A. F., McNeilly, A. S. The relationship between decidualization and prolactin mRNA and production at different stages of human pregnancy. Society for Endocrinology. 14, 255-261 (1995).
- Bell, S. C. Synthesis and secretion of protein by the endometrium and decidua. Implantation: Biology and Clinical Aspects. , 95-118 (1988).
- Croy, B. A., Chantakru, S., Esadeg, S., Ashkar, A. A., Wei, Q. Decidual natural killer cells: key regulators of placental development. Journal of Reproductive Immunology. 57, 151-168 (2002).
- Smarason, A. K., Gunnarsson, A., Alfredsson, J. H., Valdimarsson, H. Monocytosis and monocytic infiltration of decidua in early pregnancy. Journal of Clinical and Laboratory Immunology. 21, 1-5 (1986).
- Daiter, E., Pampfer, S., Yeung, Y. G., Barad, D., Stanley, E. R., Pollard, J. W. Expression of colony- stimulating factor-1 in the human uterus and placenta. Journal of Clinical Endocrinology and Metabolism. 74, 850-858 (1992).
- Casey, M. L., Cox, S. M., Beutler, B., Milewich, L., MacDonald, P. C. Cachectin/tumor necrosis factor-alpha formation in human decidua. Potential role of cytokines in infection-induced preterm labor. Journal of Clinical Investigation. 83, 430-436 (1989).
- Lala, P. K., Kennedy, T. G., Parhar, R. S. Suppression of lymphocyte alloreactivity by early gestational human decidua. II. Characterization of the suppressor mechanisms. Cellular Immunology. 127, 368-381 (1988).
- Shynlova, O., Nedd-Roderique, T., Li, Y., Dorogin, A., Nguyen, T., Lye, S. J. Infiltration of myeloid cells into decidua is a critical early event in the labour cascade and post-partum uterine remodelling. Journal of Cellular and Molecular Medicine. 17, 311-324 (2013).
- Osman, I., Young, A., Ledingham, M. A., Thomson, A. J., Jordan, F., Greer, I. A., Norman, J. E. Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes, decidua, cervix and myometrium before and during labour at term. Molecular Human Reproduction. 9, 41-45 (2003).
- Farine, T., Lye, S. J., Shynlova, O. Peripheral maternal leukocytes are activated in response to cytokines secreted by uterine tissues of pregnant women. Journal of Cellular and Molecular Immunology. 14, 635-638 (2017).
- Hamilton, S., et al. Macrophages infiltrate the human and rat decidua during term and preterm labor: evidence that decidual inflammation precedes labor. Biology of Reproduction. 86, 39 (2011).
- Casey, M. L., Cox, S. M., Word, A., Macdonald, P. C. Cytokines and infection-induced preterm labour. Reprodution Fertility and Development. 2, 499-510 (1990).
- Yellon, S. M., Mackler, A. M., Kirby, M. A. The role of leukocyte traffic and activation in parturition. Journal of the Society for Gynecologic Investigation. 10, 323-338 (2003).
- Gomez-Lopez, N., StLouis, D., Lehr, M. S., Sanchez-Rodriguez, E. N., Arenas-Hernandez, M. Immune cells in term and preterm labor. Cellular & Molecular Immunology. 11, 571-581 (2014).
- Xu, Y., Plazyo, O., Romero, R., Hassan, S. S., Gomez-Lopez, N. Isolation of leukocytes from the human maternal-fetal interface. Journal of Visualized Experiments. 99, (2015).
- Trundley, T., Gardner, L., Northfield, J., Moffett, A. Methods for isolation of cells from the human fetal-maternal interface. Methods in Molecular Medicine. 122, 109-122 (2006).
- Jividen, K., Movassagh, M. J., Jazaeri, A., Li, H. Two methods for establishing primary human endometrial stromal cells from hysterectomy specimens. Journal of Visualized experiments. 87, (2014).
- Pelekanos, R. A., Sardesai, V. S., Futrega, K., Lott, W. B., Kuhn, M., Doran, M. R. Isolation and expansion of mesenchymal stem/stromal cells derived from human placenta tissue. Journal of Visualized experiments. 112, (2016).
- De Clercq, K., Hennes, A., Vrien, J. Isolation of mouse endometrial epithelial and stromal cells for in vitro decidualization. Journal of Visualized Experiments. 121, (2017).
- Zhang, J., Shynlova, O., Sabras, S., Bang, A., Briollais, L., Lye, S. J. Immunophenotyping and activation status of maternal and peripheral blood leukocytes during pregnancy and labour, both term and preterm. Journal of Cellular and Molecular Medicine. 10, 2386-2402 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados