需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
足月胎盘胎膜中原发性人蜕细胞的分离
摘要
该协议展示了一种从足月胎盘的胎儿细胞膜中分离出的主要人类蜕细胞的方法, 可用于各种应用 (即免疫细胞化学、流式术中、等), 目的是研究不同细胞群在妊娠并发症中的作用。
摘要
蜕膜, 也称为怀孕子宫内膜, 是至关重要的生殖组织。蜕细胞主要由 decidualized 基质细胞和免疫细胞组成, 负责分泌激素和炎症因子, 这些因素对于成功的囊胚植入、胎盘发育和在在足月和早产时开始分娩。许多妊娠并发症可能是由不同细胞种群的细微平衡的扰动引起的, 包括蜕膜。改变特定蜕细胞类型的比例可能会扰乱这些关键的过程, 并增加发生严重妊娠并发症的风险, 如胚胎植入失败, 宫内生长限制, 先兆子痫和早产。此处概述的协议说明了一种成本和时间有效的方法, 以隔离从足月胎盘的胎儿细胞膜收集的主要人类蜕细胞。结合酶消化和蜕组织的温和机械破坏, 获得了蜕细胞的高产, 几乎没有绒毛膜污染。重要的是, 分离的蜕细胞的特征 (基质细胞 (55-60%), 白细胞 (35%), 上皮 (1%) 或滋养层 (0.01%) 细胞) 和维持高生存能力 (80%), 这是由多色成像流式细胞仪检测证实。这个协议是特定于蜕膜颞骨, 可以适应第一和第二个月胎盘。一旦分离, 蜕细胞可用于众多的实验应用, 目的是了解不同蜕细胞亚群在妊娠并发症中的作用。
引言
子宫内膜是最活跃的成年女性组织之一, 通过对卵巢激素、雌激素 (E2) 和孕酮 (P4) 的刺激反应, 对每个月经周期进行戏剧性的重塑。蜕膜, 也称为怀孕子宫内膜, 是一个至关重要的生殖组织, 是由 postovulatory 阶段结束后形成的 P4-driven 分化后, E2-dominant 增生阶段。蜕细胞负责分泌的荷尔蒙因素, 成功的囊胚植入和发展的子宫-胎盘界面, 以保持产妇耐受胎儿移植。
蜕膜化是需要植入和随后重塑蜕螺旋动脉。子宫内膜基质细胞接受蜕膜化, 在 P4 和营地的控制下, 在月经周期的晚期黄体期1。这一过程是围绕血管和传播在整个基质, 表明其在血管重塑和白细胞贩运规则的作用。这种细胞转化的特点是圆形形态学, 增加核尺寸, 并扩大粗内质网和高尔基仪器2。Decidualized 基质细胞能够产生支持囊胚植入的分泌因子, 其特点是多种激素分泌 (即催乳素)、血管生成因子、胰岛素生长因子结合 protein-1(IGFBP-1), 前列腺素 (PG) E (细胞内的刺激器), 细胞因子, 细胞外基质成分和营养素为胎盘植入和发展所必需的3,4,5,6.
蜕细胞的数量不完全由 decidualized 基质细胞组成, 但也含有大量的、妊娠特异的蜕白细胞种群。蜕膜化包括短暂的局部水肿和自然杀伤细胞、T 细胞、树突状细胞和巨细胞的涌入。最大的白细胞亚群是子宫 NK 细胞, 包括大约50-70% 的所有母体白细胞浸润的蜕膜细胞因子和血管生成因子的来源, 这可能有助于蜕膜化过程中, 增加整个怀孕期间的数字7。巨噬细胞是免疫细胞的第二大亚群, 在植入部位周围发现并在妊娠期间增加8。它们是细胞因子和生长因子的来源, 如蜂群刺激因子 (CSF-1)9, 肿瘤坏死因子α (TNFα)10和前列腺素 (PG) E11。
在整个妊娠期和足月分娩之前, 蜕膜是细胞因子和趋化因子的主要来源, 负责孕产妇周围白细胞活化, 随后移入子宫组织以启动分娩。动物研究表明, 在分娩过程中, 老鼠蜕膜中有许多促炎性细胞因子被调节, 如 TNF a、IL-6、IL-12 和 IL-1b12。在人类蜕膜中, 促炎性细胞因子 IL-1b、IL-6 和 IL-8 (中性粒细胞趋化蛋白) 在分娩过程中表现出较高的表达, 而不是在劳动中13。这些分泌的细胞因子导致细胞的活化和流入蜕组织14;蜕巨噬细胞和中性粒细胞浸润在人和大鼠中的增加在足月劳动期间被看见, 与蜕入前浸润4倍更大, 表明在这两个相邻的子宫组织之间的激活级联15. 这些浸润白细胞产生的 PGs 能够激活子宫16, 基质金属蛋白酶 (基质) 的同步收缩, 以启动膜破裂17,18, 以及促炎性细胞因子放大子宫活化过程 ("细胞因子风暴")。
由于蜕细胞的许多重要功能, 如在植入过程中发挥关键作用, 在早期妊娠中保持孕产妇耐受性和参与分娩的激活, 不同的病理可能出现在妊娠。例如, (1) 因反复植入失败和复发性妊娠丢失而导致的不孕, 可能是蜕成熟失败所致;(2) 宫内生长限制 (IUGR) 和先兆子痫, 因发育不良和蜕膜/胎盘功能障碍或蜕-浸润交界的血管改变而受损;以及 (3) 早产可能是由于过早蜕激活所致。
鉴于这些主要疾病, 加上人类体内研究的伦理和实际局限性, 建立主要的人蜕细胞系对于体外分析是必不可少的, 目的是更好地了解和改善妊娠并发症的临床处理。因此, 我们的研究目的是制定一项协议, 允许隔离的人原蜕细胞高细胞产量和生存能力从胎儿细胞膜的足月胎盘。本协议明确描述了一种时间和经济高效的方法, 用于隔离用于各种体外分析的蜕细胞的特定子类型。蜕亚群的丰度和表型特征在足月和与第一或第二次妊娠的比较中是确定其在整个人类妊娠中的作用的关键。
研究方案
胎盘是从健康的术语中收集的, 而不是在接受选择性剖宫产的分娩妇女身上。人体样品的收集、处理和一次性使用遵循西奈医院伦理委员会的指导方针。每个病人都能得到书面同意。这项研究由西奈山医院的研究伦理学委员会批准。
1. 筹备工作
注: 所有步骤必须在通风罩下进行, 所有手术设备必须在放置在通风罩前通过高压釜消毒。所有其他材料 (瓶, 50 毫升管,等) 必须用70% 乙醇溶液灭菌。在与 biohazardous 废物 (实验室大衣, 手套, 长头发绑回,等) 工作时, 始终佩戴个人防护设备。
-
酶消化溶液 (最终溶液: 200 毫升)
- 吸管180毫升的 HBSS-/-成500毫升烧杯, 加入无菌搅拌磁铁, 并放置在搅拌板室温。
- 称量并添加以下的 HBSS/-解决方案缓慢和依次:20 毫升的血清, 400 毫克胶原酶 2 ([最终] = 2 毫克/毫升), 20 毫克大豆胰蛋白酶抑制剂 ([最终] = 0.1mg/毫升), 30 毫克 DNase 1 ([最终] = 0.15 毫克/毫升), 200 毫克 BSA ([最终] = 1 毫克/毫升)
- 将搅拌速度设置为中速, 并允许混合物搅拌10-20 分钟 (在搅拌时用锡纸或石蜡膜覆盖)。
- 将混合溶液倒入一个250毫升的玻璃瓶, 使用塑料漏斗和放置在通风罩。
- 通过一个塑料顶部过滤单元 (0.22 微米膜过滤器, 500 毫升), 整除20毫升到50毫升管 (10 管共计), 并存储在-20 °c, 直到使用的解决方案。
-
RPMI 1640 介质 (2% 洗涤液和10% 完全生长培养基)
- 结合 RPMI 1640 和在一个玻璃瓶中的烟雾罩。
- 对于2% 的血清溶液, 结合490毫升的 RPMI 1640 和10毫升的血清。
- 对于10% 的血清溶液, 结合450毫升 RPMI 1640 和50毫升的血清。
- 吸管 500 ul normocin 进入500毫升玻璃瓶从前一步包含 RPMI 媒体和血清 (50 毫克/毫升库存, 0.05 毫克/毫升工作浓度)。
- 通过0.22 微米膜过滤器和存储在500毫升玻璃瓶在4°c, 直到使用。
- 30分钟开始实验前, 在37°c 的珠浴中放置20毫升的冷冻酶消化液整除, 在10% 摄氏度的珠浴中放置2% 的血清和1640的 RPMI 37 介质, 打开摇摆水浴, 设置为37°c。, 2 克, 并设置温度控制离心机到4摄氏度。
2. 从足月胎盘膜中收集蜕组织
- 将瓶子与 HBSS +/+, HBSS 和五50毫升管在一个机架下的通风罩。在一管中吸管25毫升的 HBSS。
-
使用戴手套的手, 从使用的容器中取出胎盘, 从手术室剧院运送。将胎盘放在尿布垫上 (孕产妇侧), 用剪刀和镊子将胎儿膜张开。
- 在通风罩上放置重叠的尿布垫。
- 使用一个单独的尿布翻转胎盘, 使产妇一侧脸上。
- 找出膜破裂的点, 使切口允许膜在通风橱表面展开和平躺。
注: 一旦膜从胎盘中拉回, 将会在绒毛膜层上, 将羊膜层放在后面。
- 使用塑料细胞刮刀, 仔细刮蜕组织关闭绒毛膜和地方在50毫升管包含25毫升 HBSS ++。
- 用中等压力刮膜。不要施加太多的压力, 因为它可能导致绒毛膜污染。收集小血块以及, 因为这些含有一些蜕细胞。
注意: 在蜕收集后, 胎盘必须包装在一个生物危害塑料箱和冻结在-20 摄氏度冷藏之前, 适当处置 (根据您的机构规则)。血淋淋的尿布垫必须包裹在密封紧的塑料袋中, 并处置在一个生化安全箱。
3. 蜕组织的洗涤和酶消化
- 用手轻轻摇动50毫升管, 通过250微米金属筛 (250 微米, 大小60目) 在无菌标本 (尿) 容器上, 冲洗收集的组织。
- 重复洗两次与 HBSS +/+ 两次与 HBSS-/在新鲜管每洗。(HBSS 的最终洗涤--允许去除 HBSS 中存在的钙和镁, 否则会干扰下面的酶消化过程)。
注意。在洗涤步骤, 绒毛膜组织污染将明显, 因为蜕组织是淡粉红色的颜色和无定形, 而绒毛膜是白色, 致密, 和粘性。因此, 绒毛膜污染可以很容易地去除与镊子。 - 如果蜕组织是厚的, 将其转移到一个不育的10厘米直径培养皿, 并进行的组织与两个对立的手术刀在盘子里的肉。
-
将洗涤后的组织放置在50毫升的无菌管中, 含有100毫克的酶消化溶液 (见制剂)。
- 作为参考点, 确保蜕组织的水平达到50毫升管的5-10 毫升标记。
- 使用大约20毫升的酶消化溶液 (在步骤1.1 中制备), 以消化从一个完整的足月胎儿膜中收集的全膜。
- 用石蜡膜封住管帽 (密封管, 并在管帽和顶部周围涂上石蜡膜), 并在37摄氏度的水浴中孵化蜕组织20分钟 (145 rpm, 2 克)。
- 孵化后, 取出石蜡膜, 用70% 乙醇将含有消化组织的管表面消毒, 并将其置于油烟罩下。用手简单地摇动管子。
- 收集细胞悬浮通过金属筛 (250 微米, 大小60目) 成一个新的无菌标本容器。稀释与等量 (20 毫升) 的 RPMI + 10% 的血清含有 0.1% normocin, 以停止酶反应。直接进行离心步骤4.1。
- 如有必要, 将余下未消化的组织放回新的50毫升管中, 20 毫升新鲜酶消化溶液和重复消化 (20 分钟, 37 °c, 摇动水浴)。
- 如果第二次消化是必要的, 放置第一管与细胞悬浮在冰 (覆盖与石蜡膜保持无菌)。重复步骤 3.5-3.6, 并结合两个细胞悬浮。
4. 产生单个细胞悬浮液
- 离心机细胞悬浮液 (420 克, 4 °c, 11 分钟)。
- 移除上清和并用重悬40毫升的 RPMI + 2% 的血清中含有 0.1% normocin ("洗涤缓冲") 的细胞。
注: 细胞颗粒会因红细胞污染而松动和凝胶, 并慎吸上清液。可能需要使用手动吸管移除上部相。 - 重复离心在420克在4°c 11 分钟。
- 小心移除上清液 (如注步骤4.2 中所述), 并并用重悬5毫升洗涤缓冲器中的细胞颗粒, 并在同一管中添加35毫升的红细胞溶解缓冲液。
注: 如果颗粒大或非常血腥, 可将10毫升的洗涤缓冲液分成两个管, 然后将35毫升的红细胞溶解缓冲液分给各管, 以将其分解为红细胞裂解步骤。 - 在冰上孵育20分钟, 短暂的旋涡管在孵化开始和结束时溶解红细胞。
- 离心机在420克11分钟4摄氏度。
- 小心, 取出上清和并用重悬40毫升的洗涤缓冲颗粒。
- 通过70微米的尼龙过滤器来去除细胞团簇。
- 离心机在420克, 11 分钟4摄氏度。
- 取出上清液, 并用重悬10毫升的全培养基 (RPMI 10% + 0.1% normocin) 的细胞颗粒。
-
使用台盼蓝染料排除 hemocytometer 程序计数单元格, 如下所述:
- 在培养罩下轻轻吸管细胞悬浮向上和向下 3x, 以彻底混合前与台盼蓝结合。在1.5 毫升管准备细胞悬浮, 稀释 1:2 (结合 20 ul 的台盼蓝溶液和 20 ul 的蜕细胞悬浮)。仔细混合的台盼蓝细胞解决方案通过吹打上下两次 (这个解决方案是不育)。
- 将 hemocytometer 放在显微镜的舞台上, 玻璃盖玻片在上面。
注: Hemocytometer 是一个显微镜幻灯片与网格在它给九大正方形除以三重线。每个大正方形的面积为1毫米2, 腔内流体的深度为0.1 毫米。因此, 可以填充每个大正方形的流体体积是 1 mm*1 mm * 0.1 毫米 = 0.1 毫米3= 10-4 mL。 - 慢慢地将台盼蓝细胞混合物的 10 ul 添加到 hemocytometer 的凹槽中, 允许毛细管作用将细胞混合物分散在整个滑梯上 (在混合物填充好之前停止)。
- 查看显微镜下的细胞 (在10X 放大倍数) 和计数所有的白色/绿色的细胞, 排除台盼蓝 (这些是可行的细胞) 在四大的外广场的 hemocytometer。当计算接触线的单元格时, 只计算那些接触到右边和上面的线, 而不是那些接触到左和下线的细胞。不要数深蓝色细胞;蓝颜色表明, 当台盼蓝染料很容易穿透细胞膜进入细胞质时, 细胞就会死亡。
- 计算1毫升细胞悬浮液中存活细胞的数量 (X):
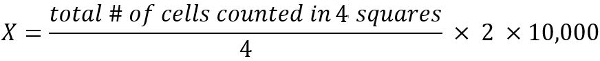
2 =稀释因子
1万 = 转换因子 (1 毫升 = 1 cm3 = 1万 * 0.1 mm3)
- 稀释蜕细胞到一个理想的最终浓度在 RPMI + 10% 血清 (生长培养基)。
注: 为组织培养电镀, 吸管 2 * 106细胞/井入塑料6井板材, 10 * 106细胞入 10 cm 塑料板材或7.5万个细胞到玻璃盖玻片。
结果
为验证分离细胞的有效性和生存能力, 采用流式细胞术和免疫组织化学 (ICC) 两种方法进行了表征。4个细胞数量被瞄准了;用抗波形抗体检测 decidualized 基质细胞, 用 pan 白细胞标记 CD45 识别蜕免疫细胞, 用角蛋白检测上皮/内皮细胞, 最后用角蛋白7检测任何潜在滋养层 (绒毛膜或胎盘) 污染。
对于多色成像流式细胞仪的表征, 新鲜分...
讨论
此处描述的协议说明了一种成本和时间有效的方法, 用于隔离从整个人类足月胎盘的胎儿细胞膜中收集的主要蜕细胞, 这是非常容易接近和直接的。该协议的成功取决于两个关键因素, (1) 蜕刮的效率从绒毛膜层的胎儿膜和 (2) 照顾, 蜕细胞处理整个议定书。重要的是, 绒毛膜组织污染的控制, 确保没有意外包括在蜕刮, 并确定和清除任何污染在洗涤步骤 (蜕膜和绒毛膜形态的差异允许容易去除的绒毛膜...
披露声明
作者没有什么可透露的
致谢
作者要感谢捐助者、RCWIH 生物库和西奈医院/--减压振动妇产科为本研究使用的人体标本。我们要感谢碱液实验室的成员, 特别是卡罗琳·扣篮博士对她的方法开发的帮助。这项工作得到了宝来欢迎基金 (赠款 #1013759) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Hank’s balanced salt solution with calcium and magnesium | Prepared in facility (LTRI) | ||
| Hank’s balanced salt solution without calcium and magnesium | Prepared in facility (LTRI) | ||
| Diaper pads | Sigma-Aldrich | D9542 | |
| Large surgical scissors | AL Medical | 2018-12-20. | |
| Large surgical forceps | Fine Science Tools | 11000-18 | |
| Plastic disposable cell scraper (25 cm) | Sarstedt | 83.183 | |
| 250 mm (size 60 mesh) metal sieve | Sigma-Aldrich | S1020-5EA | |
| Disposable scalpel with plastic handle (#21) | Fisher Scientific | 08-927-5D | |
| Sterile plastic petri dish (diameter 10 cm) | Sarstedt | 82.1473.001 | |
| Sterile specimen container (urine cup, 4.5 oz) | VWR | 25384-146 | |
| Nylon filter (70 mm) | VWR/Corning | 21008-952 | |
| Erythrocyte lysis buffer | Qiagen | 79217 | |
| Trypan blue, 0.4% solution | Lonza | 17-942E | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Hemocytometer | Reichert | 1490 | |
| Roswell Park Memorial Institute (RPMI) 1640 culture media | Invitrogen | 11835-055 | |
| Fetal bovine serum | Wisent | 080-150 | |
| Normocin (50mg/ mL) | Invivogen | ant-nr-1 | |
| Plastic top filtration unit (0.22 mm membrane, 500 mL) | Millipore | SCGPT05RE | |
| Collagenase 2, lyophilized powder | Sigma-Aldrich | C6885 | |
| Soy bean trypsin inhibitor, powder | Sigma-Aldrich | T9003-250mg | |
| DNase powder | Roche | 10104159001 | |
| Bovine serum albumin (BSA powder) | Fisher Scientific | BP1600-100 | |
| Spinning disc confocal microscope - Leica DMI 6000B | Leica | ||
| Imaging Flow cytometer - Image Stream MK2 | Amnis | ||
| IDEA software | Millipore Sigma | ||
| APC-conjugated Vimentin antibody | R&D Systems | IC2105A | |
| APC H7-conjugated CD45 antibody | BD | 641399 | |
| FITC-conjugated Cytokeratin antibody | MACs Miltenyi Biotec | 130-080-101 | |
| PerCP -conjugated Cytokeratin 7 antibody | Novus | NBP2-47941PCP | |
| eFluor450 Fixable Viability dye | Thermo Fisher Scientific | 65-0863-14 | |
| Vimentin primary antibody | Santa Cruz | sc-7558 | |
| CD45 primary antibody | Dako | M0701 | |
| Cytokeratin primary antibody | Dako | M0821 | |
| Cytokeratin 7 primary antibody | Dako | M7018 | |
| Mouse IgG | Santa Cruz | sc-2025 | |
| Goat IgG | Santa Cruz | sc-2028 | |
| Alexa Fluor 546 secondary antibody | Invitrogen | A10036 | |
| Alexa Fluor 594 secondary antibody | Fisher Scientific | A-11058 | |
| DAPI | Sigma-Aldrich | D9542 |
参考文献
- Brosens, N., Hayashi, N., White, J. O. Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells. Endocrinology. 140, 4809-4820 (1999).
- Bell, S. C., D'Arcangues, C., Frase, I. S., Newton, J. R., Odlind, V. . Decidualization and relevance to menstruation. , 187-212 (1990).
- Kariya, M. Interleukin-1 inhibits in vitro decidualization of human endometrial stromal cells. Journal of Clinical Endocrinology and Metabolism. 73, 1170-1174 (1991).
- Dimitriadis, E., Robb, L., Salamonsen, L. A. Interleukin 11 advances progesterone-induced decidualization of human endometrial stromal cells. Molecular and Human Reproduction. 8, 636-643 (2002).
- Wu, W. -. X., Brooks, J., Glasier, A. F., McNeilly, A. S. The relationship between decidualization and prolactin mRNA and production at different stages of human pregnancy. Society for Endocrinology. 14, 255-261 (1995).
- Bell, S. C. Synthesis and secretion of protein by the endometrium and decidua. Implantation: Biology and Clinical Aspects. , 95-118 (1988).
- Croy, B. A., Chantakru, S., Esadeg, S., Ashkar, A. A., Wei, Q. Decidual natural killer cells: key regulators of placental development. Journal of Reproductive Immunology. 57, 151-168 (2002).
- Smarason, A. K., Gunnarsson, A., Alfredsson, J. H., Valdimarsson, H. Monocytosis and monocytic infiltration of decidua in early pregnancy. Journal of Clinical and Laboratory Immunology. 21, 1-5 (1986).
- Daiter, E., Pampfer, S., Yeung, Y. G., Barad, D., Stanley, E. R., Pollard, J. W. Expression of colony- stimulating factor-1 in the human uterus and placenta. Journal of Clinical Endocrinology and Metabolism. 74, 850-858 (1992).
- Casey, M. L., Cox, S. M., Beutler, B., Milewich, L., MacDonald, P. C. Cachectin/tumor necrosis factor-alpha formation in human decidua. Potential role of cytokines in infection-induced preterm labor. Journal of Clinical Investigation. 83, 430-436 (1989).
- Lala, P. K., Kennedy, T. G., Parhar, R. S. Suppression of lymphocyte alloreactivity by early gestational human decidua. II. Characterization of the suppressor mechanisms. Cellular Immunology. 127, 368-381 (1988).
- Shynlova, O., Nedd-Roderique, T., Li, Y., Dorogin, A., Nguyen, T., Lye, S. J. Infiltration of myeloid cells into decidua is a critical early event in the labour cascade and post-partum uterine remodelling. Journal of Cellular and Molecular Medicine. 17, 311-324 (2013).
- Osman, I., Young, A., Ledingham, M. A., Thomson, A. J., Jordan, F., Greer, I. A., Norman, J. E. Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes, decidua, cervix and myometrium before and during labour at term. Molecular Human Reproduction. 9, 41-45 (2003).
- Farine, T., Lye, S. J., Shynlova, O. Peripheral maternal leukocytes are activated in response to cytokines secreted by uterine tissues of pregnant women. Journal of Cellular and Molecular Immunology. 14, 635-638 (2017).
- Hamilton, S., et al. Macrophages infiltrate the human and rat decidua during term and preterm labor: evidence that decidual inflammation precedes labor. Biology of Reproduction. 86, 39 (2011).
- Casey, M. L., Cox, S. M., Word, A., Macdonald, P. C. Cytokines and infection-induced preterm labour. Reprodution Fertility and Development. 2, 499-510 (1990).
- Yellon, S. M., Mackler, A. M., Kirby, M. A. The role of leukocyte traffic and activation in parturition. Journal of the Society for Gynecologic Investigation. 10, 323-338 (2003).
- Gomez-Lopez, N., StLouis, D., Lehr, M. S., Sanchez-Rodriguez, E. N., Arenas-Hernandez, M. Immune cells in term and preterm labor. Cellular & Molecular Immunology. 11, 571-581 (2014).
- Xu, Y., Plazyo, O., Romero, R., Hassan, S. S., Gomez-Lopez, N. Isolation of leukocytes from the human maternal-fetal interface. Journal of Visualized Experiments. 99, (2015).
- Trundley, T., Gardner, L., Northfield, J., Moffett, A. Methods for isolation of cells from the human fetal-maternal interface. Methods in Molecular Medicine. 122, 109-122 (2006).
- Jividen, K., Movassagh, M. J., Jazaeri, A., Li, H. Two methods for establishing primary human endometrial stromal cells from hysterectomy specimens. Journal of Visualized experiments. 87, (2014).
- Pelekanos, R. A., Sardesai, V. S., Futrega, K., Lott, W. B., Kuhn, M., Doran, M. R. Isolation and expansion of mesenchymal stem/stromal cells derived from human placenta tissue. Journal of Visualized experiments. 112, (2016).
- De Clercq, K., Hennes, A., Vrien, J. Isolation of mouse endometrial epithelial and stromal cells for in vitro decidualization. Journal of Visualized Experiments. 121, (2017).
- Zhang, J., Shynlova, O., Sabras, S., Bang, A., Briollais, L., Lye, S. J. Immunophenotyping and activation status of maternal and peripheral blood leukocytes during pregnancy and labour, both term and preterm. Journal of Cellular and Molecular Medicine. 10, 2386-2402 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。