É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de células humanas primárias do Decidual de membranas fetais de termo placentas
Neste Artigo
Resumo
Este protocolo demonstra um método para o isolamento de células de decidual humanas primários coletados de membranas fetais de placentas de termo que podem ser usadas para uma variedade de aplicações (ou seja, imunocitoquímica, citometria de fluxo, etc.) com o objetivo para estudar o papel das populações de células diferentes em complicações na gravidez.
Resumo
A decídua, também conhecida como o endométrio grávida, é um tecido reprodutivo criticamente importante. Células decidual, compostas principalmente de células do estroma decidualized e células do sistema imunológico, são responsáveis pela secreção de fatores hormonais e inflamatórias que são críticos para a implantação bem-sucedida do blastocisto, desenvolvimento da placenta e desempenhar um papel iniciação de trabalho a termo e prematuros. Muitas complicações na gravidez podem surgir de perturbações de um delicado equilíbrio de populações de células diferentes compreendendo decídua. Alterações na proporção de tipos específicos de célula decidual podem atrapalhar esses processos cruciais e aumentar o risco de desenvolver complicações graves de gravidez, tais como falha de implantação do embrião, restrição de crescimento intra-uterino, pré-eclâmpsia e trabalho de parto prematuro. O protocolo descrito aqui demonstra um custo e tempo método eficaz para o isolamento de células humanas primárias de decidual coletado de membranas fetais de placentas de termo. Combinando a digestão enzimática e gentil ruptura mecânica do tecido decidual, obteve-se um alto rendimento de células decidual com virtualmente nenhuma contaminação do córion. Importante, células isoladas decidual foram caracterizadas (células do estroma (55-60%), leucócitos (35%), epitelial (1%) ou as células do trofoblasto (0,01%)) e mantida alta viabilidade (80%), que foi confirmada por multicolor ensaio de citometria de fluxo de imagem. Este protocolo é específico para o parietalis decídua e pode ser adaptado a placentas de primeiro e segundo trimestre. Uma vez isolado, decidual células podem ser usadas para uma infinidade de aplicações experimentais com o objetivo de compreender o papel das subpopulações diferentes célula decidual em complicações na gravidez.
Introdução
O endométrio, um dos mais ativos tecidos femininos adultos, sofre remodelação dramática cada ciclo menstrual, em resposta à estimulação por hormônios ovarianos, estrógeno (E2) e progesterona (P4). A decídua, também conhecida como o endométrio grávida, é um tecido reprodutivo criticamente importante que é formado no final da fase de postovulatory como resultado de diferenciação P4-conduzidos seguindo a fase proliferativa E2-dominante. Decidual células são responsáveis pela secreção de fatores hormonais para implantação do blastocisto bem-sucedida e para o desenvolvimento da interface do utero-placentário para a manutenção de tolerância materna para a fetal aloenxerto.
Decidualization é necessário para a implantação e posterior remodelação das artérias espirais decidual. Células do estroma endometriais sofrem decidualization, sob o controle de P4 e acampamento, durante o final da fase lútea do ciclo menstrual1. Esse processo é iniciado em torno dos vasos sanguíneos e se espalha por todo o estroma, sugerindo seu papel na vasculatura remodelação e leucócitos tráfico de regulamento. Esta transformação celular é caracterizada por uma morfologia circular, aumento do tamanho nuclear e expansão do retículo endoplasmático rugoso e complexo de Golgi2. Decidualized células do estroma são capazes de produzir fatores parácrina, apoiando a implantação do blastocisto e caracteriza-se pela secreção de vários hormônios (ou seja, prolactina), fatores de crescimento angiogênico, fator de crescimento insulina ligação proteína-1 (IGFBP-1), prostaglandina (PG) E (estimulador de cAMP intracelular), citocinas, componentes da matriz extracelular e nutrientes essenciais para placentária implantação e desenvolvimento3,4,5,6 .
A população de célula decidual não é exclusivamente composta por células do estroma decidualized mas também contém populações grandes, gravidez específicos leucócitos decidual. Decidualization envolve edema localizada transitória e influxo de assassino naturais (NK) células, as células T, células dendríticas e macrófagos. A maior subpopulação de leucócitos é as células NK uterinas, compreendendo aproximadamente 50-70% de todos os leucócitos maternos infiltrando a decidua que são uma fonte de citocinas e fatores de angiogênico que podem auxiliar no processo de decidualization e aumento da número em toda gravidez7. Os macrófagos, sendo a segundo maior subpopulação de células do sistema imunológico, são encontrados ao redor do local de implantação e aumentam durante a gravidez8. Eles são uma fonte de citocinas e fatores de crescimento como colônia de factor (CSF-1)9, fator de necrose tumoral alfa (TNFa)10 e prostaglandina (PG) E11.
Durante toda a gravidez e antes do parto, a decídua é uma importante fonte de citocinas e quimiocinas responsáveis pela ativação dos leucócitos periféricos materna e subsequente migração para os tecidos uterinos para iniciar o trabalho de parto. Estudos em animais mostraram que numerosas citocinas pró-inflamatórias são acima-está regulada no decídua do rato durante o parto, tais como TNF-a, IL-6, IL-12 e IL-1b12. Na decídua humana, citocinas pró-inflamatórias IL-1b, IL-6 e IL-8 (principal neutrófilo quimiotático) apresentam maior expressão durante o parto, em comparação com não no trabalho13. Estas citocinas resulta em uma ativação e o influxo de leucócitos secretada de tecidos decidual14; um aumento no macrófago decidual e infiltração de neutrófilos em ambos os humanos e ratos é visto durante o parto, com infiltração decidual anterior myometrial 4-fold maior, indicando uma cascata de ativação entre este dois adjacentes tecidos uterinos 15. estes infiltração de leucócitos produzem capaz de ativar síncronas contrações do miométrio16PGs, metaloproteinases da matriz (MMPs) para iniciar a membrana rompem17,18, bem como citocinas pró-inflamatórias para amplificar o processo de ativação uterina (tempestade de citocinas).
Devido a muitas funções importantes das células decidual, como jogar um papel crítico no processo de implantação, manutenção de tolerância materno-fetal em gestação precoce e participa na ativação de trabalho a termo, diferentes patologias podem surgir durante a gravidez. Por exemplo, (1) infertilidade devido a falha de implantação recorrentes e perda recorrente da gravidez pode resultar de uma insuficiência de maturação decidual; (2) restrição de crescimento intra-uterino (IUGR) e pré-eclâmpsia devido ao desenvolvimento inadequado e disfunção da decídua/placenta ou comprometimento vascular transformação na junção decidual-myometrial; assim como o nascimento prematuro (3) que pode resultar de ativação prematura decidual.
À luz destes grandes transtornos, juntamente com as limitações éticas e práticas dos estudos humanos na vivo , estabelecer linhas de célula decidual humano primário é essencial para a análise em vitro com o objetivo de melhor compreensão e melhorar o manejo clínico de complicações na gravidez. Portanto, o objetivo da nossa pesquisa foi desenvolver um protocolo que permite o isolamento de células humanas de decidual primários com celular alto rendimento e viabilidade coletados de membranas fetais de placentas de termo. Este protocolo atual claramente descreve um método de tempo - e cost - effective para isolar dos subtipos específicos de decidual células que ser usado para uma variedade de análises em vitro . Caracterização da abundância e fenótipo de sub-populações decidual no termo e comparação com o primeiro ou segundo trimestre são cruciais para a definição de seus papéis ao longo da gestação humana.
Protocolo
Placentas são coletadas do termo saudável, não nas mulheres de trabalho passando por cesarianas eletivas. A coleção, processamento e descartável de amostras humanas seguir as diretrizes do Conselho Mount Sinai Hospital ética. Uma autorização por escrito é obtida a partir de cada paciente. Este estudo é aprovado pelo Conselho de ética de pesquisa no Hospital Monte Sinai.
1. preparações
Nota: Todas as etapas devem ser realizadas sob uma coifa e todos os equipamentos cirúrgicos devem ser esterilizados por autoclave antes da colocação na coifa. Todos os outros materiais (garrafas, tubos de 50 mL, etc.) devem ser esterilizados com solução de etanol 70%. Sempre usar equipamentos de proteção individual em todos os momentos quando se trabalha com resíduos biológicos perigosos (jaleco, luvas, cabelos longos amarrados atrás, etc.).
-
Solução de digestão enzimática (solução Final: 200 mL)
- Pipetar 180 mL de HBSS-/ - em um copo de 500 mL, adicionar estéril agita magnética e coloque na placa de agitação à temperatura ambiente.
- Pesar e adicionar o seguinte à HBSS-/-solução lentamente e sequencialmente: 20ml de FBS, 400 mg 2 colagenase ([final] = 2 mg/mL), 20 mg de inibidor de tripsina de feijão de soja ([final] = 0,1 mg/mL), 30 mg 1 DNase ([final] = 0,15 mg/mL) e 200 mg de BSA ([final] = 1 mg/mL)
- Definir a agitação de velocidade média e permita que a mistura mexa por 10-20 min (cubra com filme lata de folha ou parafina, agitando).
- Despeje a solução misturada em um frasco de vidro de 250 mL usando um funil de plástico e coloque a coifa.
- Passe a solução através de uma unidade de filtragem superior plástica (0,22 μm membrana filtrante, 500 mL), alíquota 20 mL em tubos de 50 mL (10 tubos totais) e loja a-20 ° C até o uso.
-
RPMI 1640 Media (2% solução e 10% completo crescimento médio de lavagem)
- Combine RPMI 1640 e FBS num frasco de vidro na coifa.
- Para a solução de 2% FBS, combine 490 mL de RPMI 1640 e 10ml FBS.
- Para a solução de 10% FBS, combine 450 mL de RPMI 1640 e 50ml FBS.
- Pipete 500 µ l de normocin para o frasco de vidro de 500 mL da etapa anterior, que contém a mídia RPMI e FBS (50mg/mL estoque, 0,05 mg/mL trabalho concentração).
- Transmitir mídia através de um 0,22 μm membrana filtrante e armazenar em um frasco de vidro de 500 mL a 4 ° C até o uso.
- 30 min antes de iniciar o experimento, coloque uma alíquota de 20 mL de congelados solução de digestão enzimática em um banho de grânulo de 37 ° C, coloque os 2% FBS e os meios de comunicação de FBS RPMI 1640 de 10% em um banho de grânulo de 37 ° C, prepara o banho de água a balanço e definir a 37 ° C , 2G e definir uma centrífuga de temperatura controlada a 4 ° C.
2. coleção de tecido Decidual do termo membranas da placenta
- Coloque garrafas com HBSS + / +, HBSS-/- e cinco tubos de 50 mL em um rack sob a coifa. Pipetar 25 mL de HBSS + + em um tubo.
-
Usando as mãos enluvadas, tire a placenta de termo do recipiente usado para transportá-la do teatro de sala de cirurgia. Coloque a almofada de fralda (maternal para cima) a placenta e espalhar as membranas fetais usando tesoura e pinça.
- Coloque almofadas de tecido sobrepostas sobre a coifa.
- Use uma fralda separada para virar a placenta por parte materna é cara.
- Encontrar o ponto de ruptura de membrana e fazer incisões para permitir que a membrana se desdobrar e deite-se na superfície do fumehood.
Nota: Uma vez que a membrana é puxada para trás da placenta, a decídua será virada para cima descansando sobre a camada do córion, com a camada de âmnio na parte de trás.
- Cuidadosamente com uma espátula de plástico celular, raspe o tecido decidual fora o córion e coloque no tubo de 50 mL contendo 25 mL HBSS + / +.
- Raspe a membrana com uma pressão moderada. Não aplique demasiada pressão pois pode resultar em contaminação do córion. Recolha pequenos coágulos de sangue também, porque estes contêm algumas células decidual.
Cuidado: Após a coleta decidual, placenta deve ser embalado em uma caixa plástica de risco biológico e congelado no congelador-20 ° C antes do descarte adequado (de acordo com suas regras institucionais). Almofadas sangrento da fralda devem ser envolto em um saco plástico de vedação estanque e alienadas em uma caixa de segurança de risco biológico.
3. lavagem e enzimática de digestão do tecido Decidual
- Lave os tecidos coletados suavemente agitando o tubo de 50 mL com a mão e passando-a através de uma peneira de metal (250 μm, malha tamanho 60) 250 μm repousando sobre um recipiente para amostras estéreis (urina).
- Repetir a lavagem duas vezes com HBSS + / + e duas vezes com HBSS-/ - em tubos frescos para cada lavagem. (final lava com HBSS-/-permite a remoção de cálcio e magnésio presente na HBSS + / +, que caso contrário iria interferir com o processo de digestão enzimática a seguir).
NOTA. Durante as etapas de lavagem, contaminação de tecido córion será aparente como o tecido decidual é luz rosa em cor e amorfo, enquanto o córion é branco, denso e pegajoso. Portanto, a contaminação do córion pode ser facilmente removida com fórceps. - Opcionalmente, se o tecido decidual é grosso, transfira para um prato de petri estéril de 10 cm de diâmetro e prossiga para picar do tecido com dois opostos bisturis no prato.
-
Coloque o tecido lavado em tubo estéril 50 mL contendo 100 mg de tecido/mL da solução de digestão enzimática (veja os preparativos).
- Como ponto de referência, certifique-se de que o nível do tecido decidual atinge a marca de 5-10 mL no tubo de 50 mL.
- Use cerca de 20 mL de solução de digestão enzimática (preparado na etapa 1.1) para digerir a total decídua coletada de uma membrana fetal de todo o período escolar.
- Feche a tampa do tubo com o filme de parafina (fechar o tubo firmemente e envolva película de parafina em torno da tampa e parte superior do tubo) sob a cultura capota e incubar decidual tecido a 37 ° C por 20 min em um tremendo banho de água (145 rpm 2G).
- Após a incubação, remova a película de parafina e esterilizar a superfície do tubo contendo tecido digerido com 70% de etanol e trazer sob a coifa. Agite o tubo momentaneamente à mão.
- Colete suspensão de células através da peneira de metal (250 μm, malha tamanho 60) em um novo recipiente para amostras estéreis. Dilua com igual volume (20 mL) de RPMI + 10% FBS contendo 0,1% normocin para parar a reação enzimática. Vá diretamente para a etapa de centrifugação 4.1.
- Se necessário, coloque o tecido restante não digerido volta para um novo tubo de 50 mL com 20 mL de solução de digestão enzimática fresco e repita a digestão (20 min, a 37 ° C, banho de água a tremer).
- Se uma segunda digestão é necessária, coloca o primeiro tubo com suspensão de células no gelo (cubra com filme de parafina para manter estéril). Repita as etapas de 3.5-3.6 e combinar as suspensões de duas células.
4. gerando uma única célula suspensão
- Centrifugar a suspensão de eritrócitos (420 g, 4 ° C, 11 min).
- Remover o sobrenadante e ressuspender as células em 40 mL de RPMI + 2% FBS contendo 0,1% normocin ("tampão de lavagem").
Nota: Centrifugado será solto e gelatinoso devido à contaminação de células vermelhas do sangue, aspirar o sobrenadante com cautela. Remoção da fase superior com uma pipeta manual pode ser necessária. - Repeti a centrifugação a 420 g a 4 ° C para 11 min.
- Retire cuidadosamente o sobrenadante (conforme mencionado na nota etapa 4.2) e ressuspender as células em 5 mL de tampão de lavagem e adicionar 35 mL de tampão de lise de eritrócitos no mesmo tubo.
Nota: Se a pelota é grande ou muito sangrenta, ele pode ser dividido em dois tubos para a etapa de lise de eritrócitos adicionando 10 mL de tampão de lavagem e dividindo-se igualmente em dois tubos e em seguida, adicionar 35 mL de tampão de lise de eritrócitos para cada tubo. - Incube no gelo por 20 min. brevemente vórtice tubos no início e no final de incubação para lisar células vermelhas do sangue.
- Centrifugar a 420 g por 11 minutos a 4 ° C.
- Cuidadosamente, remover o sobrenadante e ressuspender o precipitado em 40 mL de tampão de lavagem.
- Passe as células através de um filtro de nylon 70 μm para remover grupos de célula.
- Centrifugar 420g por 11 min a 4 ° C.
- Remover o sobrenadante e ressuspender as células em 10 mL de meio completo (RPMI 10% + FBS contendo 0,1% normocin).
-
Contar as células usando o procedimento de hemocytometer de exclusão-corante azul trypan conforme descrito abaixo:
- Sob o capô de cultura suavemente Pipete suspensão de células e descer 3 x fim misture bem antes de combinar com trypan azul. Em um 1,5 mL tubo preparar suspensão de células, diluído 1:2 (combinar 20 μL de solução de azul de Tripan) e 20 μL de suspensão de célula decidual. Misture cuidadosamente solução de célula azul trypan pipetando e descer algumas vezes (esta solução não é estéril).
- Coloque a hemocytometer no palco do microscópio com lamela de vidro na parte superior.
Nota: Hemocytometer é uma lâmina de microscópio com grades nele para dar nove grandes quadrados divididos por linhas triplas. Cada quadrado grande tem uma área de 1 mm2, e a profundidade do fluido na câmara é de 0,1 mm. Portanto, o volume de fluido que pode preencher cada quadrado grande é 1 mm * 1 mm * 0,1 mm = 0,1 mm3= 10-4 mL. - Lentamente, adicione 10 μL da mistura trypan azul-célula na ranhura da hemocytometer, permitindo a ação capilar dispersar a mistura de células sobre o slide inteiro (paragem antes de mistura preenche bem).
- Visualizar as células sob um microscópio (em ampliação de 10x) e contar todas as células de branco/verde que excluem trypan azul (Estas são as células viáveis) em quatro grandes quadrados exteriores a hemocytometer. Quando a contagem de células que toque a linha, conte apenas aqueles que toque o direito e as linhas superiores, mas não aqueles tocando a esquerda e linhas de fundo. Não contam células azuis escuras; cor azul indica que a célula está morta como corante trypan azul pode facilmente penetrar através da membrana plasmática citoplasma.
- Para calcular o número de células viáveis em 1 mL de suspensão de células (X):
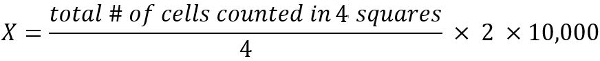
2 = fator de diluição
10.000 = fator de conversão (1 mL = 1 cm3 = 10, 000 * 0.1 mm3)
- Diluir decidual células a uma concentração final desejável em RPMI + 10% FBS (meio de crescimento).
Nota: Para o chapeamento de cultura de tecidos, pipete 2 * 106 células/poço para uma placa de plástico 6, 10 * 106 células em uma placa de plástico de 10 cm ou 75.000 células para uma lamela de vidro.
Resultados
Para validar a eficiência e a viabilidade das células isoladas, eles foram caracterizados por dois métodos: fluxo cytometry e imunocitoquímica (ICC). 4 populações de células foram alvo; células do estroma decidualized foram detectados pelo anticorpo antivimentina, marcador panleucócitos CD45 foi usado para identificar as células imunes decidual, citoqueratinas foi usada para detectar células epiteliais/endoteliais e finalmente, citoqueratina 7 foi usada para detectar qualquer t...
Discussão
O protocolo descrito aqui demonstra um custo e tempo eficaz método para isolar células decidual primárias coletado de membranas fetais de placentas termo humano altamente acessível e simples. O sucesso do presente protocolo é dependente de dois fatores críticos, (1) eficiência de raspagem decidual da camada córion das membranas fetais e (2) o cuidado com que as células decidual são tratadas em todo o protocolo. É importante que contaminação de tecido córion é controlada por garantir que nenhum é acidental...
Divulgações
Os autores não têm nada a divulgar
Agradecimentos
Os autores gostaria de agradecer os doadores, o biobanco de RCWIH e o Hospital Monte Sinai/UHN, departamento de obstetrícia e Ginecologia para os espécimes humanos utilizados neste estudo. Gostaríamos de agradecer aos membros do laboratório de soda cáustica, particularmente o Dr. Caroline Dunk por sua ajuda com o desenvolvimento do método. Este trabalho é apoiado pelo fundo de boas-vindas de Burroughs (grant #1013759).
Materiais
| Name | Company | Catalog Number | Comments |
| Hank’s balanced salt solution with calcium and magnesium | Prepared in facility (LTRI) | ||
| Hank’s balanced salt solution without calcium and magnesium | Prepared in facility (LTRI) | ||
| Diaper pads | Sigma-Aldrich | D9542 | |
| Large surgical scissors | AL Medical | 2018-12-20. | |
| Large surgical forceps | Fine Science Tools | 11000-18 | |
| Plastic disposable cell scraper (25 cm) | Sarstedt | 83.183 | |
| 250 mm (size 60 mesh) metal sieve | Sigma-Aldrich | S1020-5EA | |
| Disposable scalpel with plastic handle (#21) | Fisher Scientific | 08-927-5D | |
| Sterile plastic petri dish (diameter 10 cm) | Sarstedt | 82.1473.001 | |
| Sterile specimen container (urine cup, 4.5 oz) | VWR | 25384-146 | |
| Nylon filter (70 mm) | VWR/Corning | 21008-952 | |
| Erythrocyte lysis buffer | Qiagen | 79217 | |
| Trypan blue, 0.4% solution | Lonza | 17-942E | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Hemocytometer | Reichert | 1490 | |
| Roswell Park Memorial Institute (RPMI) 1640 culture media | Invitrogen | 11835-055 | |
| Fetal bovine serum | Wisent | 080-150 | |
| Normocin (50mg/ mL) | Invivogen | ant-nr-1 | |
| Plastic top filtration unit (0.22 mm membrane, 500 mL) | Millipore | SCGPT05RE | |
| Collagenase 2, lyophilized powder | Sigma-Aldrich | C6885 | |
| Soy bean trypsin inhibitor, powder | Sigma-Aldrich | T9003-250mg | |
| DNase powder | Roche | 10104159001 | |
| Bovine serum albumin (BSA powder) | Fisher Scientific | BP1600-100 | |
| Spinning disc confocal microscope - Leica DMI 6000B | Leica | ||
| Imaging Flow cytometer - Image Stream MK2 | Amnis | ||
| IDEA software | Millipore Sigma | ||
| APC-conjugated Vimentin antibody | R&D Systems | IC2105A | |
| APC H7-conjugated CD45 antibody | BD | 641399 | |
| FITC-conjugated Cytokeratin antibody | MACs Miltenyi Biotec | 130-080-101 | |
| PerCP -conjugated Cytokeratin 7 antibody | Novus | NBP2-47941PCP | |
| eFluor450 Fixable Viability dye | Thermo Fisher Scientific | 65-0863-14 | |
| Vimentin primary antibody | Santa Cruz | sc-7558 | |
| CD45 primary antibody | Dako | M0701 | |
| Cytokeratin primary antibody | Dako | M0821 | |
| Cytokeratin 7 primary antibody | Dako | M7018 | |
| Mouse IgG | Santa Cruz | sc-2025 | |
| Goat IgG | Santa Cruz | sc-2028 | |
| Alexa Fluor 546 secondary antibody | Invitrogen | A10036 | |
| Alexa Fluor 594 secondary antibody | Fisher Scientific | A-11058 | |
| DAPI | Sigma-Aldrich | D9542 |
Referências
- Brosens, N., Hayashi, N., White, J. O. Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells. Endocrinology. 140, 4809-4820 (1999).
- Bell, S. C., D'Arcangues, C., Frase, I. S., Newton, J. R., Odlind, V. . Decidualization and relevance to menstruation. , 187-212 (1990).
- Kariya, M. Interleukin-1 inhibits in vitro decidualization of human endometrial stromal cells. Journal of Clinical Endocrinology and Metabolism. 73, 1170-1174 (1991).
- Dimitriadis, E., Robb, L., Salamonsen, L. A. Interleukin 11 advances progesterone-induced decidualization of human endometrial stromal cells. Molecular and Human Reproduction. 8, 636-643 (2002).
- Wu, W. -. X., Brooks, J., Glasier, A. F., McNeilly, A. S. The relationship between decidualization and prolactin mRNA and production at different stages of human pregnancy. Society for Endocrinology. 14, 255-261 (1995).
- Bell, S. C. Synthesis and secretion of protein by the endometrium and decidua. Implantation: Biology and Clinical Aspects. , 95-118 (1988).
- Croy, B. A., Chantakru, S., Esadeg, S., Ashkar, A. A., Wei, Q. Decidual natural killer cells: key regulators of placental development. Journal of Reproductive Immunology. 57, 151-168 (2002).
- Smarason, A. K., Gunnarsson, A., Alfredsson, J. H., Valdimarsson, H. Monocytosis and monocytic infiltration of decidua in early pregnancy. Journal of Clinical and Laboratory Immunology. 21, 1-5 (1986).
- Daiter, E., Pampfer, S., Yeung, Y. G., Barad, D., Stanley, E. R., Pollard, J. W. Expression of colony- stimulating factor-1 in the human uterus and placenta. Journal of Clinical Endocrinology and Metabolism. 74, 850-858 (1992).
- Casey, M. L., Cox, S. M., Beutler, B., Milewich, L., MacDonald, P. C. Cachectin/tumor necrosis factor-alpha formation in human decidua. Potential role of cytokines in infection-induced preterm labor. Journal of Clinical Investigation. 83, 430-436 (1989).
- Lala, P. K., Kennedy, T. G., Parhar, R. S. Suppression of lymphocyte alloreactivity by early gestational human decidua. II. Characterization of the suppressor mechanisms. Cellular Immunology. 127, 368-381 (1988).
- Shynlova, O., Nedd-Roderique, T., Li, Y., Dorogin, A., Nguyen, T., Lye, S. J. Infiltration of myeloid cells into decidua is a critical early event in the labour cascade and post-partum uterine remodelling. Journal of Cellular and Molecular Medicine. 17, 311-324 (2013).
- Osman, I., Young, A., Ledingham, M. A., Thomson, A. J., Jordan, F., Greer, I. A., Norman, J. E. Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes, decidua, cervix and myometrium before and during labour at term. Molecular Human Reproduction. 9, 41-45 (2003).
- Farine, T., Lye, S. J., Shynlova, O. Peripheral maternal leukocytes are activated in response to cytokines secreted by uterine tissues of pregnant women. Journal of Cellular and Molecular Immunology. 14, 635-638 (2017).
- Hamilton, S., et al. Macrophages infiltrate the human and rat decidua during term and preterm labor: evidence that decidual inflammation precedes labor. Biology of Reproduction. 86, 39 (2011).
- Casey, M. L., Cox, S. M., Word, A., Macdonald, P. C. Cytokines and infection-induced preterm labour. Reprodution Fertility and Development. 2, 499-510 (1990).
- Yellon, S. M., Mackler, A. M., Kirby, M. A. The role of leukocyte traffic and activation in parturition. Journal of the Society for Gynecologic Investigation. 10, 323-338 (2003).
- Gomez-Lopez, N., StLouis, D., Lehr, M. S., Sanchez-Rodriguez, E. N., Arenas-Hernandez, M. Immune cells in term and preterm labor. Cellular & Molecular Immunology. 11, 571-581 (2014).
- Xu, Y., Plazyo, O., Romero, R., Hassan, S. S., Gomez-Lopez, N. Isolation of leukocytes from the human maternal-fetal interface. Journal of Visualized Experiments. 99, (2015).
- Trundley, T., Gardner, L., Northfield, J., Moffett, A. Methods for isolation of cells from the human fetal-maternal interface. Methods in Molecular Medicine. 122, 109-122 (2006).
- Jividen, K., Movassagh, M. J., Jazaeri, A., Li, H. Two methods for establishing primary human endometrial stromal cells from hysterectomy specimens. Journal of Visualized experiments. 87, (2014).
- Pelekanos, R. A., Sardesai, V. S., Futrega, K., Lott, W. B., Kuhn, M., Doran, M. R. Isolation and expansion of mesenchymal stem/stromal cells derived from human placenta tissue. Journal of Visualized experiments. 112, (2016).
- De Clercq, K., Hennes, A., Vrien, J. Isolation of mouse endometrial epithelial and stromal cells for in vitro decidualization. Journal of Visualized Experiments. 121, (2017).
- Zhang, J., Shynlova, O., Sabras, S., Bang, A., Briollais, L., Lye, S. J. Immunophenotyping and activation status of maternal and peripheral blood leukocytes during pregnancy and labour, both term and preterm. Journal of Cellular and Molecular Medicine. 10, 2386-2402 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados