Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolation von primären menschlichen Deziduale Zellen aus der fetalen Membranen der Begriff Plazentas
In diesem Artikel
Zusammenfassung
Dieses Protokoll zeigt eine Methode zur Isolierung von primären menschlichen deziduale Zellen gesammelt von den fetalen Membranen der Begriff plazentas, die für eine Vielzahl von Anwendungen (z. B. Immunocytochemistry, Durchflusszytometrie, etc.) verwendet werden können mit dem Ziel zur Untersuchung der Rolle von verschiedenen Zell-Populationen in Komplikationen während der Schwangerschaft.
Zusammenfassung
Die Decidua, auch bekannt als die schwangere Endometrium, ist ein entscheidender Bedeutung reproduktives Gewebe. Deziduale Zellen, hauptsächlich bestehend aus decidualized Stromazellen und immune Zellen sind verantwortlich für die Sekretion von hormonellen und entzündliche Faktoren sind entscheidend für eine erfolgreiche Blastozyste Implantation, plazentar Entwicklung und spielen eine Rolle bei der Einleitung der Arbeit am Begriff und Frühgeborenen. Viele Komplikationen während der Schwangerschaft können durch Störungen der eine feine Balance der unterschiedlichen Zellpopulationen bestehend aus Dezidua entstehen. Veränderungen im Verhältnis von bestimmten deziduale Zelltypen können diese entscheidenden Prozesse stören und erhöhen das Risiko für schwere Komplikationen der Schwangerschaft, wie Embryo Implantation Versagen, intrauterine Wachstumsretardierung, Präeklampsie und Preterm Arbeit. Die hier beschriebene Protokoll zeigt eine Kosten- und Zeitaufwand die fetalen Membranen der Begriff plazentas wirksame Methode für die Isolierung von primären humanen deziduale Zellen entnommen. Durch die Kombination von enzymatischen Verdauung und sanfte mechanische Störung des deziduale Gewebes, erhielt eine hohe Ausbeute an deziduale Zellen praktisch ohne Chorion-Kontamination. Wichtig ist, zeichneten sich isolierte deziduale Zellen (Stromazellen Zellen (55-60 %), Leukozyten (35 %), epithelialen (1 %) oder Trophoblast (0,01 %) Zellen) und hohe Tragfähigkeit (80 %) die durch mehrfarbige bildgebenden Flow Cytometry Assay bestätigt wurde. Dieses Protokoll ist spezifisch für die Dezidua Parietalis und an ersten und zweiten Trimester plazentas angepasst werden kann. Einmal isoliert, können deziduale Zellen für eine Vielzahl von experimentellen Anwendungen mit dem Ziel zu verstehen, die Rolle der verschiedenen deziduale Zelle Sub-Populationen in Komplikationen während der Schwangerschaft verwendet werden.
Einleitung
Das Endometrium, eines der aktivsten erwachsenen weiblichen Gewebe durchläuft dramatischen Umbau jedes Menstruationszyklus in Reaktion auf die Stimulation durch Eierstockhormone, Östrogen (E2) und Progesteron (P4). Die Decidua, auch bekannt als die schwangere Endometrium, ist ein entscheidender Bedeutung reproduktives Gewebe, das durch das Ende der postovulatorischen Phase infolge P4-driven Differenzierung nach der E2-dominante proliferative Phase entsteht. Deziduale Zellen sind verantwortlich für die Sekretion von hormonellen Faktoren für eine erfolgreiche Blastozyste Implantation und für die Entwicklung der Utero-plazentaren Schnittstelle für die Aufrechterhaltung der mütterlichen Toleranz gegenüber der fetale Allograft.
Decidualization ist für die Implantation und die anschließende Umgestaltung der deziduale Spirale Arterien erforderlich. Endometriale Stromazellen Zellen durchlaufen Decidualization, unter der Kontrolle der P4 und Lager, während der späten luteal Phase des Menstruationszyklus1. Dieser Prozess ist rund um die Blutgefäße und breitet sich im ganzen das Stroma, was seine Rolle im Gefäßsystem Umbau und Leukozyten Menschenhandel Verordnung eingeleitet. Diese zellulären Transformation zeichnet sich durch eine kreisförmige Morphologie, erhöhte Kerngröße und Erweiterung des rauen endoplasmatischen Retikulum und Golgi-Apparat2. Decidualized Stromazellen Zellen sind in der Lage, Parakrine Faktoren unterstützen die Einnistung der Blastozyste und zeichnet sich durch die Ausschüttung zahlreicher Hormone (z. B. Prolaktin), angiogene Wachstumsfaktoren, Insulin Wachstumsfaktor binding Protein-1 (IGFBP-1), Prostaglandin (PG) E (Stimulator der intrazellulären cAMP), Zytokine, Komponenten der extrazellulären Matrix und Nährstoffe essentiell für plazentare Einnistung und Entwicklung3,4,5,6 .
Die deziduale Zellpopulation besteht nicht nur aus decidualized Stromazellen Zellen enthält aber auch große, Schwangerschaft-spezifische deziduale Leukozyten Populationen. Decidualization beinhaltet die transiente lokalisierte Ödeme und Zustrom von natürlichen killer (NK)-Zellen, T-Zellen, Dendritische Zellen und Makrophagen. Die größten Leukozyten Teilgesamtheit ist die uterinen NK-Zellen, bestehend aus ca. 50-70 % aller mütterlichen Leukozyten infiltrieren die Dezidua die eine Quelle von Zytokinen und angiogenen Faktoren, die möglicherweise Hilfe bei der Decidualization-Prozess und Zunahme der Anzahl in der gesamten Schwangerschaft7. Makrophagen, wird die zweitgrößte Subpopulation von Immunzellen, befinden sich rund um den Implantationsort und während der Schwangerschaft8erhöhen. Sie sind eine Quelle von Zytokinen und Wachstum Faktoren wie Kolonie stimulierende Faktor (CSF-1)9, Tumor-Nekrose-Faktor α (TNF)10 und Prostaglandin (PG) E11.
Während der gesamten Schwangerschaft und vor der Wehentätigkeit ist der Dezidua eine Hauptquelle der Zytokine und Chemokine verantwortlich für mütterliche peripheren Leukozyten-Aktivierung und anschließende Migration in die Gebärmutter Gewebe, Arbeit zu initiieren. Tierstudien zeigten, dass zahlreiche Pro-inflammatorischen Zytokinen bis in die Maus Dezidua geregelt während der wehen, wie TNF-a, IL-6, IL-12 und IL-1 b12. In der menschlichen Dezidua weisen Pro-inflammatorische Zytokine IL-1 b, IL-6 und IL-8 (große Neutrophilen lockstoffgradient) höheren Ausdruck während der Wehen im Vergleich zu nicht im Labor13. Diese Zytokine führen zu einer Aktivierung und Zustrom von Leukozyten in deziduale Gewebe14abgesondert; eine Zunahme der deziduale Makrophagen und Neutrophilen Infiltration in der Mensch und Ratte ist während der Wehentätigkeit, mit deziduale Infiltration vor Myometrial 4-fach größer ist, zeigt eine Kaskade von Aktivierung zwischen diese zwei benachbarte uterine Gewebe gesehen. 15. diese infiltrieren Leukozyten produzieren PGs in der Lage, synchrone Kontraktionen der Gebärmutter16zu aktivieren, Matrix-Metalloproteinasen (MMPs) Membran initiieren Bruch17,18, sowie Pro-inflammatorischen Zytokinen, die uterine Aktivierung ("Zytokin-Sturm") zu verstärken.
Während können verschiedene Krankheiten durch viele wichtige Funktionen von deziduale Zellen, wie spielen eine entscheidende Rolle bei der Implantation Aufrechterhaltung mütterlich fötalen Toleranz in der frühen Schwangerschaft und die Teilnahme an der Aktivierung der Arbeit am Begriff auftreten. Schwangerschaft. (1) Unfruchtbarkeit aufgrund von wiederkehrenden Implantation Scheitern und wiederkehrende schwangerschaftverlust kann beispielsweise nach einem Ausfall der deziduale Reifung führen; (2) intrauterine Wachstumsretardierung (IUGR) und Präeklampsie durch unsachgemäße Entwicklungs- und Funktionsstörungen der Dezidua/Plazenta oder kompromittierten Gefäße Umgestaltung an der Kreuzung deziduale Myometrial; sowie (3) Frühgeburt, die von der vorzeitigen deziduale Aktivierung führen kann.
Vor dem Hintergrund dieser wichtigen Erkrankungen, gepaart mit den ethischen und praktischen Einschränkungen des menschlichen in-Vivo -Studien, zur Gründung von primären humanen deziduale Zelllinien ist essentiell für in-vitro- Analyse mit dem Ziel besser zu verstehen und Klinisches Management von Komplikationen während der Schwangerschaft zu verbessern. Daher war das Ziel unserer Forschung, ein Protokoll zu entwickeln, die für die Isolierung von menschlichen primären deziduale Zellen mit hohe Zellausbeute und Lebensfähigkeit, gesammelt von den fetalen Membranen der Begriff plazentas ermöglicht. Das aktuelle Protokoll klar beschreibt ein Zeit und Kosten wirtschaftlicheren Verfahren für bestimmte Subtypen von deziduale isolieren die Zellen für eine Vielzahl von in-vitro- Analysen verwendet werden. Charakterisierung der Fülle und Phänotyp der deziduale Sub-Populationen am Begriff und Vergleich zum ersten oder zweiten Trimester ist entscheidend für ihre Rollen in der gesamten menschlichen Schwangerschaft zu definieren.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Plazentas werden aus gesunden Begriff nicht in Arbeit Frauen elektiven Kaiserschnitt gesammelt. Die Sammlung, Verarbeitung und des humanen Proben Einweg Befolgen der Richtlinien des Mount Sinai Hospital Ethics Board. Jeder Patient ist eine schriftliche Einwilligung eingeholt. Diese Studie wird durch das Research Ethics Board am Mount Sinai Hospital genehmigt.
1. Vorbereitungen
Hinweis: Alle Schritte müssen durchgeführt werden, unter einer Abzugshaube und alle chirurgische Geräte per Autoklav vor der Platzierung in der Dunstabzugshaube sterilisiert werden muss. Alle anderen Materialien (50 mL-Tuben, Flaschen, etc.) müssen mit 70 % Ethanol sterilisiert werden. Immer jederzeit tragen persönlicher Schutzausrüstung bei der Arbeit mit biogefährlichen Abfällen (Kittel, Handschuhe, lange Haare zurück gebunden, etc.).
-
Enzymatische Verdauung Lösung (endgültige Lösung: 200 mL)
- 180 mL HBSS - Pipette / - in einen 500-mL-Becherglas, sterile rühren Magnet hinzufügen und platzieren Sie auf Platte bei Raumtemperatur rühren.
- Abwiegen und fügen Sie Folgendes zum HBSS/Lösung langsam und sequenziell: 20 mL FBS, 400 mg Kollagenase 2 ([final] = 2 mg/mL), 20 mg Soja-Bohne-Trypsin-Inhibitor ([final] = 0,1 mg/mL), 30 mg DNase-1 ([final] = 0,15 mg/mL), und 200 mg BSA ([final] = 1 mg/mL)
- Das Rühren auf mittlerer Geschwindigkeit festgelegt und lassen Sie die Mischung für 10-20 min (Abdeckung mit Zinn Folie oder Paraffin Film unter Rühren) gerührt.
- Gießen Sie die gemischte Lösung in einer 250 mL-Glasflasche mit einem Kunststoff-Trichter und in der Dunstabzugshaube.
- Übergeben Sie die Lösung durch ein Kunststoff Top Filteranlage (0,22 μm Membranfilter, 500 mL), aliquoten 20 mL in 50 mL Tuben (insgesamt 10 Rohre) und Speicher bei-20 ° C bis zur Verwendung.
-
RPMI 1640 Medien (2 % Lösung und 10 % komplette Wachstumsmedium waschen)
- RPMI 1640 und FBS in einer Glasflasche in der Dunstabzugshaube zu kombinieren.
- Kombinieren Sie für 2 % FBS Lösung 490 mL RPMI 1640 und 10 mL FBS.
- Kombinieren Sie für 10 % FBS Lösung 450 mL RPMI 1640 und 50 mL FBS.
- Pipette 500 μL des Normocin in der 500 mL Flasche aus dem vorherigen Schritt mit RPMI Medien und FBS (50 mg/mL Brühe, 0,05 mg/mL arbeiten Konzentration).
- Übergeben Sie Medien über eine 0,22 μm Membranfilter und speichern in einer 500 mL-Glasflasche bei 4 ° C bis zur Verwendung.
- 30 min vor Beginn des Experiments Platz eine 20 mL Aliquot der enzymatischen Verdauung Lösung in einem 37 ° C Perle Bad eingefroren, Platz 2 % FBS und 10 % FBS RPMI 1640 Medien in einem 37 ° C Perle Bad, schalten die rockigen Wasserbad und auf 37 ° C , 2 g und Satz einer Zentrifuge kontrollierter Temperatur um 4 ° C.
2. Sammlung von Deziduale Gewebe aus Begriff Plazentar Membranen
- Stellen Sie Flaschen mit HBSS + / +, HBSS-/- und fünf 50 mL Röhrchen in einem Rack unter dem Abzug. Pipette 25 mL HBSS + / + in eine Röhre.
-
Herausnehmen Sie die Begriff Plazenta mit behandschuhten Händen aus dem Behälter für den Transport vom OP-Saal Theater verwendet. Die Plazenta auf das Windel-Pad (mütterliche Seite nach oben) und verteilen Sie die fetalen Membranen, mit Schere und Pinzette.
- Legen Sie überlappende Windel-Pads auf der Dunstabzugshaube.
- Verwenden Sie eine separate Windel, um die Plazenta zu kippen, so dass die mütterliche Seite aufgedeckt ist.
- Finden Sie den Punkt des Bruches der Membran und Schnitte um die Membran zu nicht entfalten und flach auf der Oberfläche des Fumehood zu ermöglichen.
Hinweis: Sobald die Membran aus der Plazenta zurück gezogen wird, werden die Dezidua aufgedeckte ruht auf dem Chorion-Layer mit der Amnion-Schicht auf der Rückseite.
- Mit einem Schaber Kunststoff Zelle vorsichtig kratzen das deziduale Gewebe aus dem Chorion und in der 50 mL-Tube mit 25 mL HBSS + / +.
- Kratzen Sie die Membran mit mäßigem Druck. Gelten Sie nicht zu viel Druck, wie es Chorion Kontamination führen kann. Sammeln Sie kleine Blutgerinnsel sowie, als diese einige deziduale Zellen enthalten.
Achtung: Nach deziduale Sammlung, Plazenta muss verpackt in einem Plastikeimer Biohazard und im Eisschrank vor der entsprechenden Entsorgung (nach Ihren institutionellen Regeln)-20 ° C eingefroren. Blutige Windel Pads müssen in einer Dichtung-Dichte Plastiktüte verpackt und in ein Biohazard-Safe entsorgt werden.
3. Waschen und enzymatische Verdauung des Deziduale Gewebes
- Waschen Sie die gesammelten Gewebe indem sanft die 50 mL-Tube von hand schütteln und durch ein 250 μm metallsieb (250 μm, Größe 60 Mesh) ruhen auf einem sterilen Probe (Urin) Container übergeben.
- Wiederholen Sie das Waschen zweimal mit HBSS + / + und zweimal mit HBSS-/ - in frischen Rohre für jede Wäsche. (Finale wäscht mit HBSS-/-ermöglicht die Entfernung von Calcium und Magnesium in HBSS vorhanden + / +, die wäre sonst mit der folgenden enzymatische Verdauung stören).
HINWEIS. Während die Waschschritte werden Chorion Gewebe Kontamination offensichtlich, als das deziduale Gewebe ist hellrosa Farbe und amorph, während das Chorion ist weiß, dicht und strähnig. Chorion Kontamination kann daher leicht mit der Pinzette entfernt werden. - Optional, wenn das deziduale Gewebe dick ist, überträgt es auf eine sterile 10 cm Durchmesser Petrischale und gehen Sie zum Zerkleinern des Gewebes mit zwei gegnerischen Skalpelle in der Schale.
-
Legen Sie das gewaschene Gewebe in sterilen 50 mL-Tube mit 100 mg von Gewebe/mL enzymatische Verdauung Lösung (siehe Vorbereitungen).
- Als Bezugspunkt sicherzustellen Sie, dass die deziduale Gewebe zur 5-10 mL-Markierung auf die 50 mL Tube erreicht.
- Verwenden Sie ca. 20 mL der enzymatischen Verdauung Lösung (vorbereitet in Schritt 1.1), die insgesamt Dezidua gesammelt von einer gesamten Laufzeit fetalen Membran zu verdauen.
- Versiegeln Sie die Kappe des Rohres mit dem Paraffin-Film (die Röhre verschließen und wickeln Paraffin Film rund um die Kappe und die Oberseite des Rohres) unter die Kultur Haube und inkubieren Sie deziduale Gewebe bei 37 ° C für 20 min in einem schütteln Wasserbad (145 u/min 2 g).
- Entfernen Sie nach der Inkubation den Paraffin-Film zu und Sterilisieren Sie die Oberfläche des Rohres, die verdaute Gewebe mit 70 % Ethanol enthält und unter dem Abzug zu bringen. Schütteln Sie das Rohr von hand kurz.
- Sammeln Sie Zellsuspension durch metallsieb (250 μm, Größe 60 Mesh) in einen neuen sterilen Probe Behälter. Verdünnen Sie mit ein gleiches Volumen (20 mL) von RPMI + 10 % FBS mit 0,1 % Normocin enzymatische Reaktion zu stoppen. Gehen Sie direkt zu Zentrifugationsschritt 4.1.
- Bei Bedarf setzen Sie die restliche unverdaute Gewebe wieder in eine neue 50 mL-Tube mit 20 mL frische enzymatische Verdauung Lösung und wiederholen Sie Verdauung (20 min, 37 ° C, schütteln Wasserbad) zu.
- Wenn eine zweite Verdauung notwendig ist, legen Sie das erste Rohr mit Zellsuspension auf Eis (Abdeckung mit Paraffin-Film steril zu halten). Wiederholen Sie die Schritte 3,5-3,6 und kombinieren Sie die zwei Zellen-Suspensionen.
(4) erzeugen eine einzelne Zelle Suspension
- Zentrifugieren der Zellsuspension (420 g, 4 ° C, 11 min.).
- Entfernen Sie den überstand und Aufschwemmen der Zellen in 40 mL RPMI + 2 % FBS mit 0,1 % Normocin ("Waschpuffer").
Hinweis: Zelle Pellets werden lose und wegen der roten Blutzelle Verschmutzung gallertartig, Aspirieren überstand mit Vorsicht. Entfernung der oberen Phase mit einer manuellen Pipette kann erforderlich sein. - Wiederholen Sie die Zentrifugation bei 420 g bei 4 ° C für 11 min.
- Sorgfältig entfernen des Überstandes (wie in Anmerkung Schritt 4.2 erwähnt) und Aufschwemmen der Zelle Pellet in 5 mL Waschpuffer und 35 mL Erythrozyten Lyse Puffer im gleichen Rohr.
Hinweis: Wenn das Diabolo groß oder sehr blutig ist, kann es in zwei Röhren für den Erythrozyten Lyse Schritt aufgeteilt werden durch Hinzufügen von 10 mL Waschpuffer und Teilen gleich in zwei Röhren und dann 35 mL Erythrozyten Lyse Puffer für jedes Rohr. - Inkubation auf Eis für 20 min. kurz Wirbel Tube(n) am Anfang und am Ende der Inkubation, die roten Blutkörperchen lysiert.
- Zentrifugieren Sie bei 420 g für 11 Minuten bei 4 ° C.
- Sorgfältig, überstand zu entfernen und das Pellet in 40 mL Waschpuffer aufzuwirbeln.
- Durchlaufen Sie die Zellen einen 70 μm Nylon Filter, Zelle Klumpen zu entfernen.
- Zentrifuge bei 420 g für 11 min bei 4 ° C.
- Entfernen den überstand und Aufschwemmen der Zelle Pellet in 10 mL komplette Medium (RPMI 10 % + FBS mit 0,1 % Normocin).
-
Anzahl Zellen mit Hilfe der Trypan blau Farbstoff-Ausschlußverfahren Hemocytometer wie unten beschrieben:
- Unter der Haube Kultur pipette vorsichtig Zellsuspension nach oben und unten 3 X um gründlich vor dem kombinieren mit Trypan blau mischen. In einer 1,5 mL Tube bereiten Zellsuspension, verdünnt 1:2 (Mähdrescher 20 μL Trypan blau-Lösung) und 20 μL deziduale Zellsuspension. Mischen Sie durch nach oben und unten ein paar Mal (diese Lösung ist nicht steril) pipettieren Trypan blau-Zelle Lösung sorgfältig.
- Platzieren Sie die Hemocytometer auf der Bühne des Mikroskops mit Glas Deckglas an der Spitze.
Hinweis: Hemocytometer ist ein Mikroskop-Objektträger mit Gitter drauf, neun große Quadrate geteilt durch drei Linien geben. Jedes große Quadrat hat eine Fläche von 1 mm2, und die Flüssigkeit in der Kammer beträgt 0,1 mm. Daher ist das Volumen der Flüssigkeit, die jedes große Quadrat füllen kann 1 mm * 1 mm * 0,1 mm = 0,1 mm3= 10-4 mL. - Fügen Sie 10 μL der Trypan blau-Zelle Mischung langsam in die Nut des Hemocytometer, so dass Kapillarwirkung zu zerstreuen die Zelle-Mischung über die gesamte Folie (Stop bevor Mischung gut ausfüllt hinzu)
- Sehen Sie die Zellen unter dem Mikroskop (bei 10 X Vergrößerung) und zählen Sie alle weiß/grün-Zellen, die Trypan blau (diese sind der lebensfähigen Zellen) in den vier großen äußeren Quadraten von der Hemocytometer ausschließen. Wenn Zellen zählen, die die Linie berühren, zählen Sie nur diejenigen die Note der rechten und oberen Zeilen, nicht aber die Berührung der linken und unteren Zeilen. Zählen Sie nicht Dunkele blaue Zellen; blauer Farbe weist darauf hin, dass die Zelle tot ist, wie Trypan blau färben leicht über die Plasmamembran in das Zytoplasma eindringen kann.
- Berechnen Sie die Anzahl der lebensfähigen Zellen in 1 mL Zellsuspension (X):
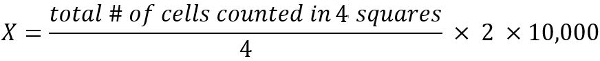
2 = Verdünnungsfaktor
10.000 = Umrechnungsfaktor (1 mL = 1 cm3 = 10, 000 * 0,1 mm3)
- Deziduale Zellen auf eine wünschenswerte Endkonzentration in RPMI + 10 % verdünnen FBS (Wachstumsmedium).
Hinweis: Für Gewebekultur Plating, pipette 2 * 106 Zellen/Brunnen in einen Kunststoff 6-Well-Platte, 10 * 106 Zellen in einer 10-cm-Kunststoffplatte oder 75.000 zu einem Glas deckgläschen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Um die Effizienz und Rentabilität der isolierten Zellen zu überprüfen, sie zeichneten sich durch zwei Methoden: flow Cytometry und Immunocytochemistry (ICC). 4-Zell-Populationen wurden gezielt; decidualized Stromazellen Zellen wurden von der Anti-Vimentin Antikörper erkannt, Pan-Leukozyten Marker CD45 wurde verwendet, um deziduale Immunzellen zu identifizieren, Cytokeratin wurde zur epithelialen/endothelial Zellen zu erkennen und schließlich Cytokeratin 7 wurde verwendet, um irgendwe...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das hier beschriebene Protokoll zeigt eine Kosten- und Zeit effektive Methode zur Isolierung von primärer deziduale Zellen gesammelt aus den fetalen Membranen des ganzen menschlichen Begriff plazentas, sehr zugänglich und unkompliziert ist. Der Erfolg dieses Protokolls ist abhängig von zwei entscheidende Faktoren, (1) die Effizienz der deziduale Schaben aus dem Chorion-Layer die fetalen Membranen und (2) die Pflege, mit der die deziduale Zellen im gesamten Protokoll behandelt werden. Es ist wichtig, dass Chorion Geweb...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts preisgeben
Danksagungen
Die Autoren möchten den Spendern, die RCWIH-BioBank und der Mount Sinai Hospital/UHN Abteilung für Geburtshilfe und Gynäkologie für die menschliche Exemplare in dieser Studie verwendeten danken. Wir möchten den Mitgliedern des Lauge Labor, insbesondere Dr. Caroline Dunk für ihre Hilfe bei der Methodenentwicklung danken. Diese Arbeit wird von der Burroughs-Willkommen-Fonds (Grant #1013759) unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Hank’s balanced salt solution with calcium and magnesium | Prepared in facility (LTRI) | ||
| Hank’s balanced salt solution without calcium and magnesium | Prepared in facility (LTRI) | ||
| Diaper pads | Sigma-Aldrich | D9542 | |
| Large surgical scissors | AL Medical | 2018-12-20. | |
| Large surgical forceps | Fine Science Tools | 11000-18 | |
| Plastic disposable cell scraper (25 cm) | Sarstedt | 83.183 | |
| 250 mm (size 60 mesh) metal sieve | Sigma-Aldrich | S1020-5EA | |
| Disposable scalpel with plastic handle (#21) | Fisher Scientific | 08-927-5D | |
| Sterile plastic petri dish (diameter 10 cm) | Sarstedt | 82.1473.001 | |
| Sterile specimen container (urine cup, 4.5 oz) | VWR | 25384-146 | |
| Nylon filter (70 mm) | VWR/Corning | 21008-952 | |
| Erythrocyte lysis buffer | Qiagen | 79217 | |
| Trypan blue, 0.4% solution | Lonza | 17-942E | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Hemocytometer | Reichert | 1490 | |
| Roswell Park Memorial Institute (RPMI) 1640 culture media | Invitrogen | 11835-055 | |
| Fetal bovine serum | Wisent | 080-150 | |
| Normocin (50mg/ mL) | Invivogen | ant-nr-1 | |
| Plastic top filtration unit (0.22 mm membrane, 500 mL) | Millipore | SCGPT05RE | |
| Collagenase 2, lyophilized powder | Sigma-Aldrich | C6885 | |
| Soy bean trypsin inhibitor, powder | Sigma-Aldrich | T9003-250mg | |
| DNase powder | Roche | 10104159001 | |
| Bovine serum albumin (BSA powder) | Fisher Scientific | BP1600-100 | |
| Spinning disc confocal microscope - Leica DMI 6000B | Leica | ||
| Imaging Flow cytometer - Image Stream MK2 | Amnis | ||
| IDEA software | Millipore Sigma | ||
| APC-conjugated Vimentin antibody | R&D Systems | IC2105A | |
| APC H7-conjugated CD45 antibody | BD | 641399 | |
| FITC-conjugated Cytokeratin antibody | MACs Miltenyi Biotec | 130-080-101 | |
| PerCP -conjugated Cytokeratin 7 antibody | Novus | NBP2-47941PCP | |
| eFluor450 Fixable Viability dye | Thermo Fisher Scientific | 65-0863-14 | |
| Vimentin primary antibody | Santa Cruz | sc-7558 | |
| CD45 primary antibody | Dako | M0701 | |
| Cytokeratin primary antibody | Dako | M0821 | |
| Cytokeratin 7 primary antibody | Dako | M7018 | |
| Mouse IgG | Santa Cruz | sc-2025 | |
| Goat IgG | Santa Cruz | sc-2028 | |
| Alexa Fluor 546 secondary antibody | Invitrogen | A10036 | |
| Alexa Fluor 594 secondary antibody | Fisher Scientific | A-11058 | |
| DAPI | Sigma-Aldrich | D9542 |
Referenzen
- Brosens, N., Hayashi, N., White, J. O. Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells. Endocrinology. 140, 4809-4820 (1999).
- Bell, S. C., D'Arcangues, C., Frase, I. S., Newton, J. R., Odlind, V. Decidualization and relevance to menstruation. , Cambridge University press. 187-212 (1990).
- Kariya, M. Interleukin-1 inhibits in vitro decidualization of human endometrial stromal cells. Journal of Clinical Endocrinology and Metabolism. 73, 1170-1174 (1991).
- Dimitriadis, E., Robb, L., Salamonsen, L. A. Interleukin 11 advances progesterone-induced decidualization of human endometrial stromal cells. Molecular and Human Reproduction. 8, 636-643 (2002).
- Wu, W. -X., Brooks, J., Glasier, A. F., McNeilly, A. S. The relationship between decidualization and prolactin mRNA and production at different stages of human pregnancy. Society for Endocrinology. 14, 255-261 (1995).
- Bell, S. C. Synthesis and secretion of protein by the endometrium and decidua. Implantation: Biology and Clinical Aspects. , 95-118 (1988).
- Croy, B. A., Chantakru, S., Esadeg, S., Ashkar, A. A., Wei, Q. Decidual natural killer cells: key regulators of placental development. Journal of Reproductive Immunology. 57, 151-168 (2002).
- Smarason, A. K., Gunnarsson, A., Alfredsson, J. H., Valdimarsson, H. Monocytosis and monocytic infiltration of decidua in early pregnancy. Journal of Clinical and Laboratory Immunology. 21, 1-5 (1986).
- Daiter, E., Pampfer, S., Yeung, Y. G., Barad, D., Stanley, E. R., Pollard, J. W. Expression of colony- stimulating factor-1 in the human uterus and placenta. Journal of Clinical Endocrinology and Metabolism. 74, 850-858 (1992).
- Casey, M. L., Cox, S. M., Beutler, B., Milewich, L., MacDonald, P. C. Cachectin/tumor necrosis factor-alpha formation in human decidua. Potential role of cytokines in infection-induced preterm labor. Journal of Clinical Investigation. 83, 430-436 (1989).
- Lala, P. K., Kennedy, T. G., Parhar, R. S. Suppression of lymphocyte alloreactivity by early gestational human decidua. II. Characterization of the suppressor mechanisms. Cellular Immunology. 127, 368-381 (1988).
- Shynlova, O., Nedd-Roderique, T., Li, Y., Dorogin, A., Nguyen, T., Lye, S. J. Infiltration of myeloid cells into decidua is a critical early event in the labour cascade and post-partum uterine remodelling. Journal of Cellular and Molecular Medicine. 17, 311-324 (2013).
- Osman, I., Young, A., Ledingham, M. A., Thomson, A. J., Jordan, F., Greer, I. A., Norman, J. E. Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes, decidua, cervix and myometrium before and during labour at term. Molecular Human Reproduction. 9, 41-45 (2003).
- Farine, T., Lye, S. J., Shynlova, O. Peripheral maternal leukocytes are activated in response to cytokines secreted by uterine tissues of pregnant women. Journal of Cellular and Molecular Immunology. 14, 635-638 (2017).
- Hamilton, S., et al. Macrophages infiltrate the human and rat decidua during term and preterm labor: evidence that decidual inflammation precedes labor. Biology of Reproduction. 86, 39(2011).
- Casey, M. L., Cox, S. M., Word, A., Macdonald, P. C. Cytokines and infection-induced preterm labour. Reprodution Fertility and Development. 2, 499-510 (1990).
- Yellon, S. M., Mackler, A. M., Kirby, M. A. The role of leukocyte traffic and activation in parturition. Journal of the Society for Gynecologic Investigation. 10, 323-338 (2003).
- Gomez-Lopez, N., StLouis, D., Lehr, M. S., Sanchez-Rodriguez, E. N., Arenas-Hernandez, M. Immune cells in term and preterm labor. Cellular & Molecular Immunology. 11, 571-581 (2014).
- Xu, Y., Plazyo, O., Romero, R., Hassan, S. S., Gomez-Lopez, N. Isolation of leukocytes from the human maternal-fetal interface. Journal of Visualized Experiments. 99, (2015).
- Trundley, T., Gardner, L., Northfield, J., Moffett, A. Methods for isolation of cells from the human fetal-maternal interface. Methods in Molecular Medicine. 122, 109-122 (2006).
- Jividen, K., Movassagh, M. J., Jazaeri, A., Li, H. Two methods for establishing primary human endometrial stromal cells from hysterectomy specimens. Journal of Visualized experiments. 87, (2014).
- Pelekanos, R. A., Sardesai, V. S., Futrega, K., Lott, W. B., Kuhn, M., Doran, M. R. Isolation and expansion of mesenchymal stem/stromal cells derived from human placenta tissue. Journal of Visualized experiments. 112, (2016).
- De Clercq, K., Hennes, A., Vrien, J. Isolation of mouse endometrial epithelial and stromal cells for in vitro decidualization. Journal of Visualized Experiments. 121, (2017).
- Zhang, J., Shynlova, O., Sabras, S., Bang, A., Briollais, L., Lye, S. J. Immunophenotyping and activation status of maternal and peripheral blood leukocytes during pregnancy and labour, both term and preterm. Journal of Cellular and Molecular Medicine. 10, 2386-2402 (2017).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten