このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
用語胎盤の胎児膜から主のひと脱落膜細胞の分離
要約
このプロトコルは、アプリケーション (すなわち免疫細胞化学、フローサイトメトリー、等) の様々 な使用することができます長期胎盤の胎児膜から収集した主のひと脱落膜細胞の分離方法を示しますを目指して妊娠合併症の異なる細胞集団の役割を研究。
要約
脱落膜、妊娠子宮内膜として知られている、非常に重要な生殖組織であります。脱落膜細胞は、主に decidualized の間質細胞と免疫細胞の構成は成功した胚盤胞移植、胎盤発育に欠かせないし、の役割を果たすホルモンや炎症性因子の分泌を担当されて、用語と早産で労働の開始。脱落膜を構成する異なる細胞集団の微妙なバランスの摂動から多くの妊娠合併症が生じる。脱落膜細胞の特定の種類の割合に変化がこれらの重要なプロセスを中断、妊娠、妊娠中毒症、子宮内胎児発育制限胚着床障害などの重篤な合併症の発症リスクを高めると早産。ここで説明されているプロトコルは、コストと時間的胎盤の胎児膜から収集した主のひと脱落膜細胞の隔離のための効果的な方法を示しています。酵素消化と脱落膜組織の穏やかな機械的破壊を組み合わせて、絨毛膜の汚染の事実上なしで脱落膜細胞の高収率が得られました。重要なは、孤立した脱落膜細胞が特徴付けられた (間質細胞 (55-60%)、白血球 (35%)、上皮 (1%) または (0.01%) 栄養膜細胞) マルチカラー イメージング流れ cytometry の試金によって確認された高い生存率 (80%) を維持。このプロトコルは脱落膜の parietalis に固有、最初と 2 番目の妊娠の胎盤に適応することができます。一度分離、脱落膜細胞は多数の妊娠合併症で別の脱落膜細胞集団の役割を理解することを目指して実験的アプリケーションを使用できます。
概要
子宮内膜、最も活発な大人女性組織の 1 つは、劇的改造卵巣ホルモン、エストロゲン (E2) とプロゲステロン (P4) によって刺激への応答の各月経周期を経る。脱落膜、妊娠子宮内膜として知られているは、E2 支配的な増殖期に続く P4 駆動型分化の結果として postovulatory のフェーズの終了によって形成される非常に重要な生殖組織です。脱落膜細胞が分泌ホルモンの要因成功した胚盤胞の着床、胎児移植する母体を維持するため子宮胎盤インタ フェースの開発を担当。
エストロージェンは、注入と脱落膜らせん動脈のそれに続く改造に必要です。子宮内膜間質細胞は、月経周期1の後半の黄体期における P4 とキャンプの制御の下でエストロージェンを受けます。このプロセスは、血管と血管リモデリングと規制を人身売買白血球におけるその役割を示唆している間質全体に広がる周り開始です。この携帯の変換は、円形の形態、核サイズの増加と粗面小胞体とゴルジ装置2の拡大が特徴です。Decidualized 間質細胞は胚盤胞移植を支援パラクライン因子を作り出すことができる、多数のホルモン (プロラクチンすなわち)、血管新生因子、インスリン成長因子結合蛋白質 1 の分泌によって特徴づけられる(IGFBP 1), プロスタグランジン (PG) E (細胞内 cAMP の刺激)、サイトカイン、細胞外マトリックス成分と胎盤注入と開発3,4,5,6 に不可欠な栄養素.
脱落膜細胞の人口が decidualized の間質細胞のみで構成されていないも大きく、妊娠特有の脱落膜白血球ポピュレーションが含まれています。エストロージェンには、ローカライズされた一過性の浮腫とナチュラル キラー (NK) 細胞、T 細胞、樹状細胞、大食細胞の流入が含まれます。最大白血球サブポピュレーションが子宮 NK 細胞は、サイトカインの源である脱落膜・血管新生因子エストロージェン プロセスの援助し、の増加可能性のある浸潤母体のすべての白血球の約 50-70% を構成します。妊娠7全体の数です。大食細胞、免疫細胞の二番目に大きい集団をされて、移植部位周辺、妊娠8の間に増加します。彼らはサイトカインの源であり、成長因子などコロニー刺激要因 (CSF-1)9、腫瘍壊死因子 (tnf α) α10とプロスタグランジン (PG) E11。
妊娠中、長期的な労働者の前に、両名はサイトカインやケモカイン母体末梢血白血球の活性化と労働を開始する子宮の組織への移行のための責任の主要なソースです。動物研究ことを示した多数のプロ炎症性サイトカイン マウス脱落膜の調整、労働中によう TNF は、IL-6、イリノイ-12 と IL-1 b12。ひと脱落膜における炎症性サイトカイン IL-1 b、IL-6 と IL-8 (主要な好中球走化性因子) は労働労働13ではなくに比べて高い発現を展示します。これら分泌されるサイトカインの活性化、白血球の流入の結果脱落膜組織14;脱落膜浸潤子宮 4 倍大きく、この 2 つが隣接して子宮組織の活性化のカスケードを示すの前で長期的な労働者中、見ると脱落膜マクロファージと両方人間の好中球浸潤およびラットの増加15. PGs16子宮筋の収縮を同期をアクティブ化することを作り出すこれら白血球の浸潤、マトリックスメタロプロテアーゼ (Mmp) 膜を開始する破裂17,18, と同様子宮アクティベーション プロセス (「サイトカイン ストーム」) を増幅する炎症性サイトカイン。
初期妊娠期では、労働力の活性化に参加することで母体・胎児の公差を維持注入プロセスで重要な役割を再生などの脱落膜細胞の多くの重要な機能のため異なることができます中に発生します。妊娠。脱落膜の成熟の障害から再発着床障害再発妊娠の損失の原因 (1) 不妊につながる例えば、(2) 子宮内の成長の制限 (IUGR) と不適切な開発と脱落膜・胎盤や子宮脱落膜ジャンクション; 妥協血管変形の機能不全による妊娠中毒症(3) 早産、早期脱落膜活性化起因することができます。
研究生体内で人間の倫理的、実用的な制限と相まって、これらの主要な疾患に照らして体外より良い理解を目的とした分析のため不可欠です主のひと脱落膜細胞株を確立して妊娠合併症の臨床管理を改善します。したがって、我々 の研究の目的細胞の高と生存期間胎盤の胎児膜から収集したひと脱落膜細胞の分離を可能にするプロトコルを開発することでした。現在このプロトコルを細胞の脱落膜の特定のサブタイプの分離の明確に時間と費用の有効な方法について説明します様々 な体外分析に使用します。豊かさの特性と用語と最初または 2 番目の妊娠との比較で脱落のサブ集団の表現型人間の妊娠の中で自分の役割を定義することが重要です。
Access restricted. Please log in or start a trial to view this content.
プロトコル
胎盤は、選択科目の帝王を受ける労働女性ではなく、健康的な用語から収集されます。収集、処理、およびひと試料の使い捨ては、マウント シナイ病院倫理委員会のガイドラインに従います。各患者からの書面による同意を得た本研究は、マウント シナイ病院研究倫理委員会で承認されています。
1. 準備
注: すべての手順は、ヒューム フードの下で行われなければならないし、すべての手術用機器は発煙のフードで配置する前にオートクレーブで滅菌する必要があります。(ボトル、50 mL の管、等) 他のすべての材料は、70% エタノールで消毒する必要があります。常に摩耗保護具は、バイオハザード廃棄物 (白衣、手袋、長い髪を後ろで結ぶ、等) を使用する場合すべての回します。
-
酵素消化ソリューション (最終的な解決: 200 mL)
- HBSS の 180 mL のピペット/- 500 mL ビーカーに滅菌攪拌磁石を追加し、室温で感動のプレートを配置。
- 重量を量り、ゆっくりと順番に次の HBSS/ソリューションに追加: FBS、20 mL、400 mg コラゲナーゼ 2 ([final] = 2 mg/mL)、20 mg 大豆豆トリプシンインヒビター ([final] = 0.1 mg/mL)、30 mg DNase 1 ([final] = 0.15 mg/mL)、および 200 mg BSA ([final] = 1 mg/mL)
- 中速に攪拌を設定し、10 ~ 20 分 (攪拌しながらスズ箔またはパラフィン フィルムでカバー) 攪拌混合物を許可します。
- プラスチックの漏斗を使用して 250 mL ガラス瓶の中に混合液を注ぎ、ヒューム フードに置きます。
- 50 mL チューブ (合計 10 管) と使用するまで-20 ° C でストアに分注 20 mL プラスチック トップろ過ユニット (0.22 μ m メンブラン フィルター、500 mL)、ソリューションを渡します。
-
RPMI 1640 メディア (2% 洗濯ソリューションと完全な成長媒体の 10%)
- RPMI 1640 とヒューム フードのガラス瓶の FBS を組み合わせます。
- FBS 溶液の 2%、490 mL RPMI 1640、10 mL FBS を組み合わせます。
- FBS 溶液の 10%、450 mL RPMI 1640 と 50 mL FBS を組み合わせます。
- RPMI メディアと FBS (50 mg/mL 在庫、0.05 mg/mL 作業濃度) を含む前の手順から 500 mL ガラス瓶の中に normocin の 500 μ L をピペットします。
- 使用するまで 4 ° C で 500 mL の瓶で 0.22 μ m のメンブラン フィルターとストアを介してメディアを渡します。
- 実験を開始する前に 30 分の 20 mL の約数を配置、37 ° C のビーズのお風呂で酵素分解酵素液を凍結、2% を置く政府短期証券と 37 ° C のビーズのお風呂で 10% FBS RPMI 1640 メディア ロッキング水浴を入れます、37 ° C に設定、2 g および 4 ° C に温度制御された遠心分離機のセット
2. 長期胎盤膜の脱落膜組織のコレクション
- HBSS のボトルを配置 + +、HBSS-/- とヒューム フードの下のラックに 5 つの 50 mL チューブ。HBSS の 25 mL をピペット + + 1 つの管で。
-
手袋をはめた手を使って、満期胎盤から取り出す手術室劇場から輸送に使用されるコンテナー。おむつパッド (を母体側) の胎盤を置き、はさみとピンセットを使用して胎児膜を拡散します。
- ヒューム フードの重複のおむつパッドを置きます。
- おむつを使用して、母体側は表向きになり、胎盤を反転します。
- 膜破裂のポイントを検索し、見つけ、展開しドラフト表面に平らになった膜を許可するように切開します。
注: 膜は胎盤から返したが、一度脱落膜顔になります後ろに羊膜層に、絨毛膜層に休憩を。
- 絨毛膜と 25 mL HBSS を含む 50 の mL の管の場所から脱落膜組織をこすりプラスチック電池スクレーパーを使用して慎重に + +。
- 適度な圧力で膜をこすり。絨毛膜汚染で起因するかもしれないのであまりプレッシャーは適用されません。同様に、これらはいくつかの脱落膜細胞を含んでいる小さな血塊を収集します。
注意: 脱落膜のコレクションの後胎盤バイオハザード プラスチック箱にパッケージ化、(あなたの制度的規則) に従って適切に廃棄する前に-20 ° C のフリーザーで凍結します。血まみれのおむつパッドを密閉ビニール袋に包まれ、バイオハザード安全ボックス内に配置する必要があります。
3. 洗浄、酵素消化脱落膜組織の
- 優しく手で 50 mL のチューブを揺すり、無菌検体 (尿) コンテナー上休憩 250 μ m (250 μ m、サイズ 60 メッシュ) 金属製ふるいを通過によって収集された組織を洗浄します。
- HBSS で 2 回洗浄を繰り返す +/+ と 2 回 HBSS-/- 新鮮な管内各洗浄のため。(最終洗浄 HBSS-/-カルシウムやマグネシウムの HBSS の存在の除去では、+ +、次の酵素の消化力プロセスを妨害だろうそれ以外の場合)。
注意してください。洗浄のステップの間に絨毛膜組織汚染が脱落膜組織がうっすらとピンク色と白、密で、糸は非晶質、絨毛膜中、明らかにします。したがって、鉗子で絨毛膜汚染を簡単に削除することができます。 - 必要に応じて、脱落膜組織が厚い場合、滅菌 10 cm 径シャーレに転送して皿に 2 つの反対のメスと組織のミンチに進みます。
-
組織/mL の酵素消化溶液の 100 mg を含む滅菌 50 mL チューブに洗浄ティッシュを置き (準備を参照してください)。
- 基準点として脱落膜組織のレベルの 50 mL チューブに 5-10 mL マークに達することを確認します。
- 全期間胎児膜から収集された合計脱落膜を消化する酵素消化液 (1.1 の手順で準備) 約 20 mL を使用します。
- パラフィン フィルム チューブのキャップ シール (チューブをしっかりとシールし、キャップとチューブの上部の周りパラフィン フィルムをラップ)、文化の下でフードし、振動水浴 (145 rpm で 20 分間 37 ° C で脱落膜組織を孵化させなさい、2 g)。
- インキュベーション後、パラフィンの膜を削除して消化組織の 70% エタノールを含むチューブの表面を殺菌してヒューム フードの下でもたらします。手で簡単にチューブを振る。
- 金属ふるい (250 μ m、サイズ 60 メッシュ) を通じて新しい無菌検体容器に細胞懸濁液を収集します。酵素反応を停止する RPMI + 10 %fbs 含む 0.1 %normocin の等しいボリューム (20 mL) で希釈します。遠心分離のステップ 4.1 に直接進みます。
- 必要に応じて、残りの未消化の組織を 20 ml の新鮮な酵素消化ソリューションの新しい 50 mL のチューブに配置し、消化 (20 分、37 ° C の水浴を揺れ) を繰り返します。
- 2 番目の消化が必要な場合、氷 (滅菌を維持するパラフィン フィルムでカバー) に細胞懸濁液の最初の管を配置します。3.5 3.6 の手順を繰り返し、二つの細胞懸濁液を結合します。
4. 単一細胞懸濁液を生成します。
- 遠心分離機の細胞懸濁液 (420 g、4 ° C、11 分)。
- 上澄みを除去し、RPMI + 2 %fbs 含む 0.1 %normocin (「洗浄バッファー」) の 40 mL の細胞を再懸濁します。
注: 細胞ペレットに緩いと赤血球の混入によるゼラチン状、注意して上清を吸引します。手動ピペットの上部の段階の除去が必要な可能性があります。 - 11 分の 4 ° C で 420 g で遠心分離を繰り返します。
- 慎重に (前述の注の手順 4.2)、上清を削除 5 mL の洗浄バッファーで細胞ペレットを再懸濁し、同じ管で 35 mL の赤血球溶解バッファーを追加します。
注: 大規模なまたは非常に血なまぐさいペレットになった場合、それに分割できます赤血球溶解ステップの 2 つのチューブ 10 mL の洗浄バッファーを追加して、2 つの管に均等に分割各管に赤血球換散バッファーの 35 mL を追加して。 - 20 分赤の血液細胞を溶解するインキュベーションの前後で簡単に渦尿管の氷の上を孵化させなさい。
- 4 ° C で 11 分 420 g で遠心します。
- 慎重に、上澄みを除去し、洗浄バッファーの 40 mL にペレットを再懸濁します。
- セルをセルの塊を除去する 70 μ m ナイロン フィルターに通過します。
- 420 g で 4 ° C で 11 分間遠心
- 上澄みを除去し、10 mL の完全培地で細胞ペレットを再懸濁します (RPMI 10% + FBS 0.1 %normocin を含む)。
-
トリパン ブルー色素排除の検定手順次のようを使用してセルをカウントします。
- 文化フードの下でそっとトリパン ブルー色素と結合する前に徹底的に混ぜるために 3 x 上下細胞懸濁液をピペットします。1.5 mL チューブを準備細胞懸濁液、1:2 (結合トリパン ブルー溶液 20 μ L) と脱落膜細胞懸濁液 20 μ L を希釈します。慎重に (このソリューションは滅菌されていない) 数回上下ピペットでトリパン ブルー携帯ソリューションをミックスします。
- 場所の上にガラス基板を顕微鏡のステージ上の検定。
注: 検定はトリプル ライン割った 9 つの大きな正方形をみるためにグリッドを顕微鏡スライドです。それぞれの大きな広場は 1 mm2の面積を有し、チャンバー内の液体の深さは 0.1 mm。したがって、それぞれの大きな広場を埋めることができる液量は 1 mm * 1 mm * 0.1 mm = 0.1 mm3= 10 の-4 mL。 - ゆっくりと全体スライド (ストップ混合物いっぱいでなくなる前に) 細胞の混合物を分散させるために毛細管をできるように、検定の溝にトリパン青細胞混合物の 10 μ L を追加します。
- (10 倍) で顕微鏡下で細胞を表示し、トリパン ブルー (これらは実行可能なセル)、検定の 4 つの大きい外側の四角を除外するすべてのホワイト/グリーン セルをカウントします。線に接するセルをカウントするときは、そのタッチの右と上の行が左と下の線に触れるものではなくのみカウントします。暗い青いセルはカウントされません。青い色は、トリパン ブルー色素が、簡単に細胞膜細胞質に侵入すると、細胞は死んでいることを示します。
- 細胞懸濁液 (X) の 1 mL 中の生菌数の数を計算するには。
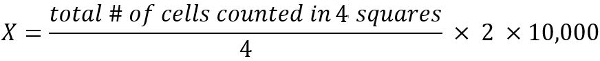
2希釈倍率を =
10,000 = 変換係数 (1 mL = 1 cm3 = 10、000 * 0.1 mm3)
- 望ましい最終的な濃度 RPMI + 10% に脱落膜細胞を希釈 FBS (成長中)。
注: 組織培養めっき用ピペットの 2 * 106細胞/ウェル プラスチック 6 ウェル プレート、10 cm プラスチック プレート 10 * 106セルまたはガラス基板に 75,000 セルに。
Access restricted. Please log in or start a trial to view this content.
結果
効率性と隔離されたセルの実行可能性を検証するため、彼らは 2 つの方法により特徴づけられた: 流れの cytometry と免疫細胞化学 (ICC)。4 細胞集団を対象としました。decidualized 間質細胞は抗ビメンチン抗体によって検出された汎白血球マーカー CD45 は脱落膜免疫細胞を識別するために使用された、サイトケラチンは、上皮・内皮細胞の検出に使用された、サイトケラチ...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここで説明されているプロトコルは、非常に身近で簡単な一次脱落膜細胞を分離するための効果的な方法で採集された全体ひと満期胎盤の胎児膜時間とコストを示しています。このプロトコルの成功は 2 つの重要な要因、(1) (2) プロトコルを通して脱落膜細胞の処理とケアと胎児膜の絨毛膜層から脱落膜を削りの効率に依存しています。絨毛膜組織汚染がどれもが誤って含まれて脱落膜をこ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者がある何も開示するには
謝辞
著者は、この研究で使用される人間の標本のドナー、RCWIH バイオバンク マウント シナイ病院/UHN 産科婦人科を感謝したいです。灰汁ラボ、特に博士キャロラインのダンク シュート法開発と彼女の助けのためのメンバーに感謝したいと思います。この作品はバロウズようこそ基金 (グラント #1013759) によってサポートされます。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Hank’s balanced salt solution with calcium and magnesium | Prepared in facility (LTRI) | ||
| Hank’s balanced salt solution without calcium and magnesium | Prepared in facility (LTRI) | ||
| Diaper pads | Sigma-Aldrich | D9542 | |
| Large surgical scissors | AL Medical | 2018-12-20. | |
| Large surgical forceps | Fine Science Tools | 11000-18 | |
| Plastic disposable cell scraper (25 cm) | Sarstedt | 83.183 | |
| 250 mm (size 60 mesh) metal sieve | Sigma-Aldrich | S1020-5EA | |
| Disposable scalpel with plastic handle (#21) | Fisher Scientific | 08-927-5D | |
| Sterile plastic petri dish (diameter 10 cm) | Sarstedt | 82.1473.001 | |
| Sterile specimen container (urine cup, 4.5 oz) | VWR | 25384-146 | |
| Nylon filter (70 mm) | VWR/Corning | 21008-952 | |
| Erythrocyte lysis buffer | Qiagen | 79217 | |
| Trypan blue, 0.4% solution | Lonza | 17-942E | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Hemocytometer | Reichert | 1490 | |
| Roswell Park Memorial Institute (RPMI) 1640 culture media | Invitrogen | 11835-055 | |
| Fetal bovine serum | Wisent | 080-150 | |
| Normocin (50mg/ mL) | Invivogen | ant-nr-1 | |
| Plastic top filtration unit (0.22 mm membrane, 500 mL) | Millipore | SCGPT05RE | |
| Collagenase 2, lyophilized powder | Sigma-Aldrich | C6885 | |
| Soy bean trypsin inhibitor, powder | Sigma-Aldrich | T9003-250mg | |
| DNase powder | Roche | 10104159001 | |
| Bovine serum albumin (BSA powder) | Fisher Scientific | BP1600-100 | |
| Spinning disc confocal microscope - Leica DMI 6000B | Leica | ||
| Imaging Flow cytometer - Image Stream MK2 | Amnis | ||
| IDEA software | Millipore Sigma | ||
| APC-conjugated Vimentin antibody | R&D Systems | IC2105A | |
| APC H7-conjugated CD45 antibody | BD | 641399 | |
| FITC-conjugated Cytokeratin antibody | MACs Miltenyi Biotec | 130-080-101 | |
| PerCP -conjugated Cytokeratin 7 antibody | Novus | NBP2-47941PCP | |
| eFluor450 Fixable Viability dye | Thermo Fisher Scientific | 65-0863-14 | |
| Vimentin primary antibody | Santa Cruz | sc-7558 | |
| CD45 primary antibody | Dako | M0701 | |
| Cytokeratin primary antibody | Dako | M0821 | |
| Cytokeratin 7 primary antibody | Dako | M7018 | |
| Mouse IgG | Santa Cruz | sc-2025 | |
| Goat IgG | Santa Cruz | sc-2028 | |
| Alexa Fluor 546 secondary antibody | Invitrogen | A10036 | |
| Alexa Fluor 594 secondary antibody | Fisher Scientific | A-11058 | |
| DAPI | Sigma-Aldrich | D9542 |
参考文献
- Brosens, N., Hayashi, N., White, J. O. Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells. Endocrinology. 140, 4809-4820 (1999).
- Bell, S. C., D'Arcangues, C., Frase, I. S., Newton, J. R., Odlind, V. Decidualization and relevance to menstruation. , Cambridge University press. 187-212 (1990).
- Kariya, M. Interleukin-1 inhibits in vitro decidualization of human endometrial stromal cells. Journal of Clinical Endocrinology and Metabolism. 73, 1170-1174 (1991).
- Dimitriadis, E., Robb, L., Salamonsen, L. A. Interleukin 11 advances progesterone-induced decidualization of human endometrial stromal cells. Molecular and Human Reproduction. 8, 636-643 (2002).
- Wu, W. -X., Brooks, J., Glasier, A. F., McNeilly, A. S. The relationship between decidualization and prolactin mRNA and production at different stages of human pregnancy. Society for Endocrinology. 14, 255-261 (1995).
- Bell, S. C. Synthesis and secretion of protein by the endometrium and decidua. Implantation: Biology and Clinical Aspects. , 95-118 (1988).
- Croy, B. A., Chantakru, S., Esadeg, S., Ashkar, A. A., Wei, Q. Decidual natural killer cells: key regulators of placental development. Journal of Reproductive Immunology. 57, 151-168 (2002).
- Smarason, A. K., Gunnarsson, A., Alfredsson, J. H., Valdimarsson, H. Monocytosis and monocytic infiltration of decidua in early pregnancy. Journal of Clinical and Laboratory Immunology. 21, 1-5 (1986).
- Daiter, E., Pampfer, S., Yeung, Y. G., Barad, D., Stanley, E. R., Pollard, J. W. Expression of colony- stimulating factor-1 in the human uterus and placenta. Journal of Clinical Endocrinology and Metabolism. 74, 850-858 (1992).
- Casey, M. L., Cox, S. M., Beutler, B., Milewich, L., MacDonald, P. C. Cachectin/tumor necrosis factor-alpha formation in human decidua. Potential role of cytokines in infection-induced preterm labor. Journal of Clinical Investigation. 83, 430-436 (1989).
- Lala, P. K., Kennedy, T. G., Parhar, R. S. Suppression of lymphocyte alloreactivity by early gestational human decidua. II. Characterization of the suppressor mechanisms. Cellular Immunology. 127, 368-381 (1988).
- Shynlova, O., Nedd-Roderique, T., Li, Y., Dorogin, A., Nguyen, T., Lye, S. J. Infiltration of myeloid cells into decidua is a critical early event in the labour cascade and post-partum uterine remodelling. Journal of Cellular and Molecular Medicine. 17, 311-324 (2013).
- Osman, I., Young, A., Ledingham, M. A., Thomson, A. J., Jordan, F., Greer, I. A., Norman, J. E. Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes, decidua, cervix and myometrium before and during labour at term. Molecular Human Reproduction. 9, 41-45 (2003).
- Farine, T., Lye, S. J., Shynlova, O. Peripheral maternal leukocytes are activated in response to cytokines secreted by uterine tissues of pregnant women. Journal of Cellular and Molecular Immunology. 14, 635-638 (2017).
- Hamilton, S., et al. Macrophages infiltrate the human and rat decidua during term and preterm labor: evidence that decidual inflammation precedes labor. Biology of Reproduction. 86, 39(2011).
- Casey, M. L., Cox, S. M., Word, A., Macdonald, P. C. Cytokines and infection-induced preterm labour. Reprodution Fertility and Development. 2, 499-510 (1990).
- Yellon, S. M., Mackler, A. M., Kirby, M. A. The role of leukocyte traffic and activation in parturition. Journal of the Society for Gynecologic Investigation. 10, 323-338 (2003).
- Gomez-Lopez, N., StLouis, D., Lehr, M. S., Sanchez-Rodriguez, E. N., Arenas-Hernandez, M. Immune cells in term and preterm labor. Cellular & Molecular Immunology. 11, 571-581 (2014).
- Xu, Y., Plazyo, O., Romero, R., Hassan, S. S., Gomez-Lopez, N. Isolation of leukocytes from the human maternal-fetal interface. Journal of Visualized Experiments. 99, (2015).
- Trundley, T., Gardner, L., Northfield, J., Moffett, A. Methods for isolation of cells from the human fetal-maternal interface. Methods in Molecular Medicine. 122, 109-122 (2006).
- Jividen, K., Movassagh, M. J., Jazaeri, A., Li, H. Two methods for establishing primary human endometrial stromal cells from hysterectomy specimens. Journal of Visualized experiments. 87, (2014).
- Pelekanos, R. A., Sardesai, V. S., Futrega, K., Lott, W. B., Kuhn, M., Doran, M. R. Isolation and expansion of mesenchymal stem/stromal cells derived from human placenta tissue. Journal of Visualized experiments. 112, (2016).
- De Clercq, K., Hennes, A., Vrien, J. Isolation of mouse endometrial epithelial and stromal cells for in vitro decidualization. Journal of Visualized Experiments. 121, (2017).
- Zhang, J., Shynlova, O., Sabras, S., Bang, A., Briollais, L., Lye, S. J. Immunophenotyping and activation status of maternal and peripheral blood leukocytes during pregnancy and labour, both term and preterm. Journal of Cellular and Molecular Medicine. 10, 2386-2402 (2017).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved