A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
سوبراماكسيمال كثافة ممارسة التاكسج، وتقييم وظيفة الأوعية الدموية في الفئران
In This Article
Summary
تدريب عالية الكثافة في نقص هو بروتوكول التي ثبت تكرار للحث على الأوعية الدموية التكيفات يحتمل أن تكون مفيدة في بعض المرضى وتحسين الرياضيين قدرة العدو. هنا، نحن اختبار جدوى تدريب الفئران باستخدام البروتوكول وتحديد تلك التعديلات الأوعية الدموية باستخدام السابقين فيفو التقييم وظيفة الأوعية الدموية.
Abstract
ممارسة التدريب استراتيجية هامة للحفاظ على الصحة والوقاية من العديد من الأمراض المزمنة. هو السطر الأول من العلاج الذي أوصت به المبادئ التوجيهية الدولية للمرضى الذين يعانون من أمراض القلب والأوعية الدموية، وبشكل أكثر تحديداً، خفض أمراض الشريان أقصى، حيث يتم تعديلها إلى حد كبير في قدرة المرضى المشي، التي تؤثر على نوعية الحياة.
وقد استخدمت تقليديا، انخفاض ممارسة مستمرة وفترة التدريب. في الآونة الأخيرة، كما تبين سوبراماكسيمال التدريب لتحسين أداء الرياضيين عبر التكيفات الأوعية الدموية، بين آليات أخرى. يمكن أن يؤدي الجمع بين هذا النوع من التدريب مع نقص تأثير إضافية و/أو تقليب، التي يمكن أن تكون ذات فائدة لبعض الأمراض. هنا، نحن تصف كيفية تنفيذ دورات تدريبية كثافة سوبراماكسيمال في نقص في الفئران صحية في 150% السرعة القصوى، باستخدام حلقة مفرغة مزودة بمحركات ومربع التاكسج. نعرض أيضا كيفية تشريح الماوس من أجل استرداد الأجهزة للاهتمام، لا سيما في الشريان الرئوي والشريان الاورطي البطني وشريان حرقفي. وأخيراً، نحن تظهر كيفية إجراء السابقين فيفو التقييم وظيفة الأوعية الدموية على السفن التي تم استردادها، استخدام دراسات التوتر متساوي القياس.
Introduction
في نقص، وتناقص الكسر مستوحاة من الأكسجين (O2) يؤدي إلى نقص تاكسج الدم (انخفاض الضغط الشرياني في نقص) وتغيير س2 نقل قدرة1. نقص حاد يدفع مضيق للأوعية متعاطفة مع زيادة نشاط موجها نحو الهيكل العظمى والعضلات2 والتوسع 'تعويضي' تعارض.
في الوقت هذا التوسع 'التعويضي'، بالنسبة إلى نفس المستوى من ممارسة تحت ظروف نورموكسيك، سوبماكسيمال كثافة في نقص، راسخة3. توسع الأوعية هذا أمر ضروري لضمان تدفق الدم المتزايدة وصيانة (أو تحد من تحوير) لإيصال الأوكسجين إلى العضلات النشطة. وأبدى الادينوسين ليس لها دور مستقل في هذا الرد، بينما أكسيد النيتريك (لا) يبدو غشائي المصدر الرئيسي حيث أحبطت هامة للتوسع زيادة ذكر مع تثبيط أكسيد النيتريك synthase (NOS) أثناء التاكسج ممارسة4. العديد من المواد فعال في الأوعية الأخرى المحتمل أن تلعب دوراً في التوسع التعويضي خلال ممارسة التاكسج.
هذا شظوي تعزيز ممارسة التاكسج غير متناسب إلى الانخفاض الناجم عن نقص في المحتوى2 س الشرياني وهو أكبر كما يزيد من شدة العملية، على سبيل المثال أثناء ممارسة التمرينات الرياضية تزايدي في نقص.
ينظم المكون لا بوساطة من التوسع تعويضية من خلال مسارات مختلفة مع تزايد كثافة التمرين3: إذا ادريناليه بيتا مستقبلات-حفز لا مكون يظهر أهمية قصوى أثناء ممارسة التاكسج المنخفضة الكثافة ، مصدرا للا المساهمة في توسيع تعويضي يبدو أقل اعتماداً على آليات ادريناليه بيتا كما يزيد من شدة العملية. وهناك مرشحين آخرين لحفز الإفراج عن لا أثناء ممارسة التاكسج أعلى كثافة، مثل ATP صدر من الكريات الحمراء و/أو البروستاغلاندينات المستمدة من بطانية.
ممارسة سوبراماكسيمال في نقص (اسمه عدو تكرار التدريب في نقص [RSH] في الأدب علم وظائف الأعضاء ممارسة) هو مؤخرا تدريب أسلوب5 يوفر تعزيز الأداء في الرياضة الجماعية أو مضرب اللاعبين. يختلف هذا الأسلوب عن الفاصل الزمني للتدريب في نقص في أو قرب السرعة القصوى6 (Vmax) منذ RSH المنجز في الشدة القصوى يقود أكبر العضلات نضح والأوكسجين7 وعضلة محددة النسخي 8من الردود. واقترحت عدة آليات تفسير فعالية RSH: خلال السباقات في نقص، توسع الأوعية تعويضية ويرتبط ارتفاع تدفق الدم ستستفيد سريع نشل الألياف أكثر من الألياف نشل بطيئة. ونتيجة لذلك، الكفاءة RSH يرجح أن يكون نوع الألياف انتقائية وتعتمد كثافة. يمكننا التكهن بأن تحسين استجابة نظام الأوعية الدموية أمر بالغ الأهمية في RSH.
ودرست التدريب ممارسة على نطاق واسع في الفئران، كل من الأشخاص الأصحاء والماوس المرضية نماذج9،10. هو الطريقة الأكثر شيوعاً لتدريب الفئران باستخدام حلقة مفرغة القوارض، وهو نظام يستخدم تقليديا التدريب المنخفضة الكثافة، في 40% – 60% من الخامسكحد أقصى (تحديد باستخدام اختبار مطحنة تزايدي11)، 30 – 60 دقيقة12،13 ،،من1415. الكثافة القصوى فترة التدريب وأثرها على الأمراض وقد درست على نطاق واسع في الفئران16،17؛ وهكذا، تم وضع الفاصل الزمني للتدريب البروتوكولات قيد التشغيل للفئران. تلك البروتوكولات وعادة ما تتألف من حوالي 10 نوبات من تشغيل في 80%-100% من الخامسكحد أقصى في حلقة مفرغة يجهز القوارض، لدقيقة 1 – 4، تتخللها بقية الإيجابي أو السلبي16،18.
يأتي الاهتمام بالفئران التي تمارس في شدة سوبراماكسيمال (أي، أعلاه الخامسكحد أقصى) في نقص من النتائج السابقة أن التعويضات فاسوديلاتوري ميكروفاسكولار وأداء ممارسة متقطعة على حد سواء أكثر زيادة في سوبراماكسيمال مما في الشدة القصوى أو معتدلة. ومع ذلك، على حد علمنا، هناك لا تقرير سابق بروتوكول التدريب سوبراماكسيمال في الفئران، أما في نورموكسيا أو في نقص.
وكان الهدف الأول من هذه الدراسة لاختبار جدوى التدريب كثافة سوبراماكسيمال في الفئران وتحديد بروتوكول مقبولة وكافية (كثافة، مدة السباق، والانتعاش، إلخ.). وكان الهدف الثاني لتقييم آثار نظام التدريب المختلفة في نورموكسيا ونقص في وظيفة الأوعية الدموية. ولذلك، نقوم باختبار الفرضيات أن الفئران (1) تحمل أيضا ممارسة سوبراماكسيمال في نقص، و (2) أن هذا البروتوكول الحث على تحسين وظيفة الأوعية الدموية بشكل أكبر من ممارسة في نورموكسيا ولكن أيضا من ممارسة في نقص في كثافة أقل.
Protocol
اللجنة المحلية للدولة رعاية الحيوان (خدمة de la لﻻستهﻻك et des Affaires Vétérinaires [سكاف]، لوزان، سويسرا) وافق جميع التجارب (إذن VD3224؛ 01.06.2017) وجميع التجارب التي أجريت وفقا لذات الصلة المبادئ التوجيهية والأنظمة.
1-الحيوان الإسكان وإعداد
- 6 البيت إلى C57BL/6J الأسبوع عمره 8 ذكور الفئران في مرفق الحيوان لمدة أسبوع واحد على الأقل قبل بدء التجارب في الترتيب للفئران للتعود على ظروف سكنهم الجديد. ولأسباب عملية، يتم عادة إيواء الفئران في نفس المجموعة التجريبية معا.
- تبقى الفئران في غرفة التحكم في درجة الحرارة (22 ± 1 درجة مئوية) مع دورة ضوء/الظلام ح 12 مع متواصلة للوصول إلى الغذاء والماء.
2-تحديد السرعة القصوى وتقييم موحدة لتحسين الأداء بالاختبار الإضافية المطحنة
ملاحظة: الخطوات التالية ضرورية لإتمام البروتوكولات التدريب.
- استخدم حلقة مفرغة يجهز للفئران حيث يمكن أن يكون في ممرات متعددة جنبا إلى جنب مع بعضها البعض، مع ميل 0° الفئران ومزودة شبكة الكهرباء إلى 0.2 mA في الجزء الخلفي من الممر، تشجيعا للفئران لتشغيل.
-
قبل الاختبار الأول، يقدم الفئران إلى 4 أيام تأقلم إلى حلقة مفرغة، وفقا لبروتوكول التالية.
- في اليوم 1، لدى الفئران التي تم تشغيلها لمدة 10 دقائق في 4.8 م/دقيقة.
- في اليوم 2، لدى الفئران تشغيل لمدة 10 دقائق في 6 م/دقيقة.
- في يوم 3، لدى الفئران تشغيل لمدة 10 دقائق في 7.2 م/دقيقة.
- في يوم 4، لدى الفئران تشغيل لمدة 10 دقائق في 8.4 م/دقيقة.
-
في يوم 5، يقدم الفئران لاختبار التزايدية إلى استنفاد، وفقا لبروتوكول التالية.
- واسمحوا الفئران الحار لمدة 5 دقائق في 4.8 م/دقيقة (في ميل 0 °).
- زيادة السرعة من 1.2 متر/دقيقة كل دقيقة 3 (مثلاً، 5 دقيقة في 4.8 م/دقيقة، ثم 3 دقيقة في 6 م/دقيقة، 3 دقيقة في 7.2 م/دقيقة، 3 دقيقة في 8.4 م/دقيقة، وما إلى ذلك) حتى استنفاد، التي تم التوصل إليها عند الماوس أما تنفق 3 ثوان على التوالي على الشبكة الكهربائية أو ويتلقى الصدمات 100 (عرض الجهاز).
- كتابة السرعة المحققة (يعتبر الخامسكحد أقصى)، المدة، والمسافة، وعدد من الصدمات، والوقت الإجمالي المستغرق في الشبكة.
ملاحظة: عادة، كان الخامسماكس 28.8 ± 3.7 م/دقيقة. - التدريب منتصف، تعيد الفئران لهذا الاختبار من أجل تكييف بسرعة للتدريب إلى تحديث الخامسكحد أقصى من الفئران (مثلاً، إذا كان البروتوكول التدريب يستمر 8 أسابيع، ثم إجراء اختبار تدريب منتصف تزايدي في 4 أسابيع. في هذه الحالة، استبدال واحدة من دورات تدريبية مجدولة قبل الاختبار)، ونفعل ذلك مرة أخرى في نهاية الدراسة بغية تقييم تحسينات في الأداء.
- تنفيذ فترة راحة 48 ساعة قبل وبعد هذا الاختبار.
ملاحظة: أجريت جميع التجارب الإضافية في الصباح.
3-التاكسج البيئة
- لدورات تدريبية في نقص، ضع حلقة مفرغة في مربع التاكسج (الشكل 1) مرتبطة خلاط غاز. استخدام التاكسج معايرة للتحكم بانتظام الكسر المحيطة للأكسجين (وأناس2 [أي مستوى نقص]) في المربع.
- تعيين خلاط الغاز على 100% نيتروجين (N2) واستخدم في التاكسج للتحقق من مستوى نقص. مرة واحدة وأناس2 = 0.13، قم بتغيير معلمة خلاط الغاز من 100% N2 إلى 13% O2.
- بغية تفادي التعرض السلبي لنقص فترات طويلة، وضع الفئران في قفص أصغر مؤقتة مع القمامة والإثراء، وسرعان ما وضعه في المربع مرة واحدة وأناس2 = تم التوصل إلى 0.13. تحقق من أن البيئة لا تزال في 13% O2 بعد وضع القفص في؛ إذا لم يكن الأمر كذلك، تصحيح ذلك.
- التحقق من مستوى س2 بانتظام على مدى دورة تدريبية للتأكد من أنه لا يزال فيiO و2 = 0.13 ± 0.002.
4-نورموكسيك البيئة
- لدورات تدريبية في نورموكسيا، تبقى حلقة مفرغة في مربع التاكسج، ولكن إزالة القفازات حتى لا يكون هناك الهواء المحيط (وأناس2 = 0.21). ويهدف إلى إعادة إنشاء بيئة التدريب نفسها كالفئران في نقص.
5-سوبراماكسيمال كثافة التدريب
-
وضع الفئران في الممرات الفردية في حلقة مفرغة (في ميل 0°) وتقديمها إلى البروتوكول التالية.
- لدى الفئران الحار لمدة 5 دقائق في 4.8 م/دقيقة، تليها 5 دقائق في 9 م/دقيقة.
- تعيين سرعة السباقات إلى 150 في المائة من سبق تحديدها الخامسكحد أقصى.
ملاحظة: عادة، كانت سرعة السباق 42.1 ± 5.5 م/دقيقة. - تدريب الفئران لأربع مجموعات من 5 × 10 s السباقات مع 20 ثانية راحة بين كل سباق. إينتيرسيت والباقي 5 دقيقة (الشكل 2).
ملاحظة: إضافة فترة تباطوء إذا عبء العمل الإجمالي للدورة التدريبية يجب أن يتطابق مع مجموعة أخرى من التدريب.
- القيام بهذا التدريب x 3 في الأسبوع، ويفضل أن يكون 48 ح بين دورات تدريبية.
- استخدام مسحات القطن كوسيلة تكميلية لصدمات كهربائية لتشجيع الفئران لتشغيل. ضع مسحه القطن في فتحه في الجزء العلوي من الممر، بين الماوس والشبكة الكهربائية، ودفع بلطف الماوس عندما يصل إلى الجزء الخلفي من حلقة مفرغة. هذا سوف تجنب إيصال التيار الكهربائي وحفز الفئران لتشغيل بطريقة أكثر ليونة.
6-التدريب منخفض الكثافة
-
وضع الفئران في الممرات الفردية في حلقة مفرغة (في ميل 0°) وتقديمها إلى البروتوكول التالية.
- لدى الفئران الحار لمدة 5 دقائق في 4.8 م/دقيقة، تليها 5 دقائق في 7.2 م/دقيقة.
- تعيين سرعة دورة التشغيل المستمر إلى 40% من سبق تحديدها الخامسكحد أقصى.
ملاحظة: بشكل عام، كانت سرعة التشغيل المستمر 9.9 م/دقيقة. - تدريب الفئران لمدة 40 دقيقة.
- القيام بهذا التدريب x 3 في الأسبوع مع يفضل 48 ح بين دورات تدريبية.
- استخدام مسحات القطن كوسيلة تكميلية لصدمات كهربائية لتشجيع الفئران لتشغيل.
7-الفئران القتل الرحيم واستخراج الجهاز
- في نهاية التدريب البروتوكول ومالا يقل عن 24 ساعة بعد آخر اختبار التزايدية، تخدير الماوس في دائرة التعريفي استخدام إيسوفلوراني (4%-5% في س2 للحث على التخدير، و 1% – 2% في 100% س2 للمحافظة على التخدير). تأكيد أنيسثيتيزيشن المناسب استخدام منعكس سحب مخلب (قرصه بشدة مخلب الحيوان؛ ويعتبر التخدير المناسب عند الحيوان لا تستجيب للتحفيز).
- باستخدام إبرة ز 25، تنفيذ ثقب القلب عن طريق الجلد، لجمع حجم الحد الأقصى من الدم كما هو موضح سابقا19.
- أداء اضطراب عنق الرحم وإزالة جلد الماوس بالقطع من خلال الطبقة الأولى من الجلد على البطن مع مقص نصيحة الجولة وسحب على الجانبين من الشق (نحو الرأس والذيل).
- قطع طريق الصفاق تحت القفص الصدري الجانب الأيسر للماوس مع مقص رقيقة-نقطة-تلميح للوصول إلى الطحال واستخراج فإنه إذا لزم الأمر.
ملاحظة: تشريح خارج العضلات إذا لزم الأمر. -
تشريح خارج الشريان الرئوي.
- باستخدام مقص صغير والملقط، إزالة القفص الصدري ومسح منطقة القلب والرئة.
- مع ملاقط "الإغلاق الذاتي"، قرصه القلب في أقرب وقت ممكن إلى ذروة وسحب بلطف على امتداد قاعدة القوس الاورطي والشريان الرئوي.
- باستخدام اليد اليمنى، إدراج ملاقط منحنية تحت الشريان الرئوي والشريان الاورطي وثم نقل الملقط العودة قليلاً للاحتفاظ فقط الشريان الرئوي (الشكل 3).
- استخدام اليد اليسرى لإدراج آخر زوج من ملاقط لتحل محل عقد مع اليد اليمنى.
- استخدام ميكروسسيسورس مستقيمة حادة في اليد اليمنى، تشريح الشريان الرئوي كقريب من قلب قدر الإمكان على جانب واحد، وبعيدا قدر الإمكان على الجانب الآخر.
ملاحظة: فإنه لا يهم اليد التي يحمل فيها الصك، على الرغم من أننا قد وجدت أنه من الأسهل قطع باليد اليمنى من اليسار. - وضعت في أنبوب 2 مل مع الباردة مخزنة الفوسفات العازلة (PBS) المالحة والحفاظ على الجليد.
-
أداء التروية الجسم كله.
- في الجزء العلوي من أطرافهم السفلية اليمنى من الماوس، استخدام الملقط لمسح خارج شريان حرقفي حق الخارجية الداخلية وصولاً إلى شريان فخذي الأيسر (تحت الرباط الآربي). باستخدام ميكروسسيسورس مستقيمة حادة، جعل قطع كامل في شريان فخذي.
- إدراج المحاقن ز 25 مل 5 مليئة ببرنامج تلفزيوني الباردة في البطين الأيسر للقلب وحقن بلطف برنامج تلفزيوني الباردة لإزالة الدم المتبقي من السفن.
ملاحظة: بسبب استخراج الشريان الرئوي، فمن الممكن أن برنامج تلفزيوني لا يعمم وصولاً إلى الشق.
- باستخدام الملقط، إزالة الأنسجة الناعمة المحيطة بالشريان الاورطي من الأربطة حق الاربية واليسرى للقلب دقة قدر الإمكان.
ملاحظة: ويمكن استخراج القلب لمزيد من التحليل إذا لزم الأمر. - استخدام الملقط وميكروسسيسورس، تشريح من القلب تصل إلى أدنى نقطة من شريان حرقفي خارجي (في أطرافه اليمنى واليسرى) ووضع المقطع بتشريح تماما في صحن قطره 10 سم مع برنامج تلفزيوني الباردة.
- استخدام الملقط و/أو ميكروسسيسورس، الانتهاء من تنظيف الدهون المتبقية حول الشريان الاورطي والشرايين بلطف سحب أو قطع عليه بعيداً عن السفن.
- باستخدام ميكروسسيسورس، قطع شريان حرقفي الأيسر في التشعب شريان حرقفي اليسار واليمين وتخزينها لمزيد من التحليل.
- باستخدام ميكروسسيسورس، قطع الشريان الاورطي البطني تحت الشريان الكلوي الأيسر، ومكان السفينة المستخرجة في المخزن المؤقت لبرنامج تلفزيوني الباردة على الجليد (الشكل 4).
- تبقى السفينة تنظيفها المتبقية، من قوس الاورطي إلى اليمين فوق الشريان الكلوي الأيسر، في مخزن لمزيد من التحليل.
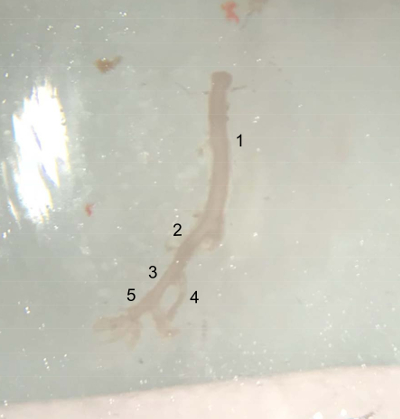
الشكل 4 : صورة السفن تشريح. السفينة المستخرجة من الجزء العلوي من الابهر البطني (تحت الشريان الكلوي الأيسر) إلى نهاية شريان حرقفي الحق، جاهزة لوضعها في المخزن المؤقت برنامج تلفزيوني الباردة على الجليد. (1) البطن الشريان الاورطي. (2) حق شريان حرقفي المشتركة. (3) الخارجية شريان حرقفي. (4) الداخلية شريان حرقفي. (5) شريان فخذي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
8-السابقين فيفو التقييم وظيفة الأوعية الدموية
ملاحظة: يغسل يناظر تفريغ وإعادة الملء للدوائر مع كريبس.
- وفقا لبروتوكول هو موضح سابقا20، مقطعة حلقات الأوعية الدموية من 1.0 – 2.0 مم طويلة معزولة الشريان الرئوي والشريان الاورطي البطني، وشرائح شريان حرقفي الحق وتحميل كل حلقة على جانب الركاب اثنين 0.1 مم تم تمريرها من خلال التجويف.
- تعليق الخواتم السفينة في دوائر الجهاز عمودي مليئة 10 مل من تعديل حل بيكربونات كريبس-المسابقة (118.3 مم كلوريد الصوديوم و 4.7 مم بوكل، كاكل 2.5 ملم2، 1.2 مم MgSO4، 1.2 مم خ2ص4، 25.0 مم ناكو3و 11.1 ملم الجلوكوز) الإبقاء على 37 درجة مئوية، والرغوة مع 95% O2-5% أول أكسيد الكربون2 (الرقم الهيدروجيني 7.4). واحد الركاب يرتكز على الجزء السفلي من الدائرة الجهاز والآخر متصل بمقياس الضغط لقياس قوة متساوي القياس بالجرام.
- تجلب هذه السفن للتوتر الراحة المثلى: تمتد الخواتم إلى 0.5 ز للشريان الرئوي و 1.5 ز لشريان حرقفي ز 2 للشريان الاورطي البطني، وغسلها بعد فترة 20 دقيقة للموازنة. كرر تمتد-الموازنة-الغسيل الخطوات 1 x.
- لاختبار صلاحية السفن، عقد الحلقات مع 235 ميليلتر من بوكل (10-1 م) لمدة 10 دقائق، غسلها لآخر 10 دقيقة، والتعاقد مرة أخرى مع 235 ميليلتر من بوكل (10-1 م) لحوالي 20 دقيقة حتى وصلت إلى هضبة.
- غسل الأوعية مرة أخرى لمدة 10 دقائق وإضافة 58.4 ميليلتر من الاندوميثاسين (10-5 م) (مثبطات السيكلواوكسيجيناز النشاط) لمدة 20 دقيقة على الأقل لتجنب أي تداخل محتمل من بروستانويدس الذاتية.
- إضافة الجرعات التراكمية من فينيليفريني (Phe) من 10-9 (10 ميليلتر) إلى 10-4 م (أو 10-9 إلى 10-5 م للشريان الرئوي؛ 9 ميليلتر لجميع التركيزات أعلاه 10-9 م) للتعاقد السفن.
- بعد آخر جرعة من الفنيل ألانين، انتظر حوالي 1 ساعة حتى السفن التي تصل إلى حالة انكماش مستقرة نسبيا (هضبة).
- إضافة الجرعات التراكمية من أستيل وعائي تعتمد على البطانة (ACh)، من 10-9 إلى 10-4 م (58.4 ميليلتر ل 10-9 م، والتناوب 12.6 ميليلتر وميليلتر 40 لجميع التركيزات أعلاه 10-9 م) للحث على النيتريك أكسيد (NO)-بوساطة الاسترخاء.
- في نهاية المنحنى الاسترخاء، غسل هذه السفن لمدة 10 دقائق، وإضافة 58.4 ميليلتر من الاندوميثاسين (10-5 م)، فضلا عن ميليلتر 184 من الحرس الوطني-نيترو-ارجينين (NLA، 10-4 م)، ومثبطات NOS، لمدة 20 دقيقة على الأقل.
- العقد السفن مرة أخرى مع جرعة فريدة من 10 ميليلتر من Phe (10-5 و 10-4 م للشريان الرئوي و 10-4 م للشريان الاورطي البطني وشريان حرقفي) ح 1، للحث على انكماش مستقرة نسبيا.
- إضافة جرعة فريدة من 40 ميليلتر من منظمة العمل ضد الجوع (10-4 م) حتى وصلت إلى هضبة.
- غسل الأوعية مرة أخرى عن 10 دقيقة، قبل إضافة 58.4 ميليلتر من الاندوميثاسين (10-5 M) و 184 ميليلتر من جيش التحرير الوطني (10-4 م) لمدة 20 دقيقة.
- العقد السفن مع 10 ميليلتر من الفنيل ألانين (10-5 و 10-4 م) ح 1.
- إضافة الجرعات التراكمية (10-9 [58.4 ميليلتر] إلى 10-4 م [40 ميليلتر لجميع التركيزات أعلاه 10-9 م]) تعمل الجهات المانحة لا (DEA)/لا، من أجل تقييم الاسترخاء الناجم عن عدم البطانة مستقلة.
- في نهاية التجربة، تخزين السفن في النتروجين السائل للتحليلات المقبلة إذا لزم الأمر.
النتائج
على حد علمنا، هذه الدراسة هي الأولى لوصف برنامج التدريب كثافة سوبراماكسيمال في نورموكسيا وفي نقص للفئران. في هذا البروتوكول، ركض الفئران أربع مجموعات من السباقات الخمسة 10 s مع انتعاش s 20 ما بين كل سباق. المجموعات كانت تتخللها دقيقة 5 فترات الانتعاش. أنه غير معروف ما إذا كان...
Discussion
وكان الهدف الأول لهذه الدراسة تقييم جدوى التدريب عالية الكثافة التاكسج في الفئران وتحديد خصائص كافية للبروتوكول الذي يسمح بشكل جيد بالفئران. عمدا، حيث لا توجد بيانات باستخدام سوبراماكسيمال (أي أكثر من الخامسكحد أقصى) كثافة التدريب في الفئران، اضطررنا إلى إجراء المحاكمات استناداً ?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
المؤلف يود أن يشكر جابين دانيلو والتاوس ستيفان من ورشة ميكانيكية مستشفى جامعة لوزان (CHUV) للمساعدة في إنشاء برنامج الإعداد التاكسج. الكتاب أيضا يود أن يشكر ديان ماكابريي وميلاني سبيون لمساعدتهم مع تدريب الحيوانات.
Materials
| Name | Company | Catalog Number | Comments |
| Cotton swab | Q-tip | ||
| Gas mixer Sonimix 7100 | LSI Swissgas, Geneva, Switzerland | Gas-flow: 10 L/min and 1 L/min for O2 and CO2, respectively | |
| Hypoxic Box | Homemade | Made in Plexiglas | |
| Motorized rodents treadmill Panlab LE-8710 | Bioseb, France | ||
| Oximeter Greisinger GOX 100 | GREISINGER electronic Gmbh, Regenstauf, Germany | ||
| Sedacom software | Bioseb, France | ||
| Strain gauge | PowerLab/8SP; ADInstruments |
References
- Calbet, J. A., et al. Determinants of maximal oxygen uptake in severe acute hypoxia. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 284 (2), 291-303 (2003).
- Hanada, A., Sander, M., González-Alonso, J. Human skeletal muscle sympathetic nerve activity, heart rate and limb haemodynamics with reduced blood oxygenation and exercise. The Journal of Physiology. 551, 635-647 (2003).
- Casey, D. P., Joyner, M. J. Compensatory vasodilatation during hypoxic exercise: mechanisms responsible for matching oxygen supply to demand. The Journal of Physiology. 590 (24), 6321-6326 (2012).
- Casey, D. P., et al. Nitric oxide contributes to the augmented vasodilatation during hypoxic exercise. The Journal of Physiology. 588, 373-385 (2010).
- Girard, O., Brocherie, F., Millet, G. P. Effects of Altitude/Hypoxia on Single- and Multiple-Sprint Performance: A Comprehensive Review. Sports Medicine. 47 (10), 1931-1949 (2017).
- Faiss, R., Girard, O., Millet, G. P. Advancing hypoxic training in team sports: from intermittent hypoxic training to repeated sprint training in hypoxia. British Journal of Sports Medicine. 47, 45-50 (2013).
- Brocherie, F., Girard, O., Faiss, R., Millet, G. P. Effects of Repeated-Sprint Training in Hypoxia on Sea-Level Performance: A Meta-Analysis. Sports Medicine.(Auckland, N.Z). 47 (8), 1651-1660 (2017).
- Brocherie, F., et al. Repeated maximal-intensity hypoxic exercise superimposed to hypoxic residence boosts skeletal muscle transcriptional responses in elite team-sport athletes. Acta Physiologica. 222 (1), 12851 (2018).
- Pellegrin, M., et al. New insights into the vascular mechanisms underlying the beneficial effect of swimming training on the endothelial vasodilator function in apolipoprotein E-deficient mice. Atherosclerosis. 190 (1), 35-42 (2007).
- Picard, M., et al. Acute exercise remodels mitochondrial membrane interactions in mouse skeletal muscle. Journal of Applied Physiology. 115 (10), 1562-1571 (2013).
- Ayachi, M., Niel, R., Momken, I., Billat, V. L., Mille-Hamard, L. Validation of a Ramp Running Protocol for Determination of the True VO2max in Mice. Frontiers in Physiology. 7, (2016).
- Pellegrin, M., et al. Running Exercise and Angiotensin II Type I Receptor Blocker Telmisartan Are Equally Effective in Preventing Angiotensin II-Mediated Vulnerable Atherosclerotic Lesions. Journal of Cardiovascular Pharmacology and Therapeutics. 22 (2), (2016).
- Semin, I., Acikgöz, O., Gönenc, S. Antioxidant enzyme levels in intestinal and renal tissues after a 60-minute exercise in untrained mice. Acta Physiologica Hungarica. 88 (1), 55-62 (2001).
- Cho, J., et al. Treadmill Running Reverses Cognitive Declines due to Alzheimer Disease. Medicine & Science in Sports & Exercise. 47 (9), 1814-1824 (2015).
- Schill, K. E., et al. Muscle damage, metabolism, and oxidative stress in mdx mice: Impact of aerobic running. Muscle & Nerve. 54 (1), 110-117 (2016).
- Cho, J., Kim, S., Lee, S., Kang, H. Effect of Training Intensity on Nonalcoholic Fatty Liver Disease. Medicine & Science in Sports & Exercise. 47 (8), 1624-1634 (2015).
- Sabatier, M. J., Redmon, N., Schwartz, G., English, A. W. Treadmill training promotes axon regeneration in injured peripheral nerves. Experimental Neurology. 211 (2), 489-493 (2008).
- Rolim, N., et al. Aerobic interval training reduces inducible ventricular arrhythmias in diabetic mice after myocardial infarction. Basic Research in Cardiology. 110 (4), 44 (2015).
- Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database Available from: https://www.jove.com/science-education/10246/blood-withdrawal-i (2018)
- Peyter, A. -. C., et al. Muscarinic receptor M1 and phosphodiesterase 1 are key determinants in pulmonary vascular dysfunction following perinatal hypoxia in mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 295 (1), 201-213 (2008).
- Faiss, R., et al. Significant Molecular and Systemic Adaptations after Repeated Sprint Training in Hypoxia. PLOS ONE. 8 (2), (2013).
- Faiss, R., et al. Repeated Double-Poling Sprint Training in Hypoxia by Competitive Cross-country Skiers. Medicine & Science in Sports & Exercise. 47 (4), 809-817 (2015).
- Billat, V. L., Mouisel, E., Roblot, N., Melki, J. Inter- and intrastrain variation in mouse critical running speed. Journal of Applied Physiology. 98 (4), 1258-1263 (2005).
- Ferguson, S. K., et al. Effects of living at moderate altitude on pulmonary vascular function and exercise capacity in mice with sickle cell anemia. The Journal of Physiology. , (2018).
- Lightfoot, J. T., Turner, M. J., Debate, K. A., Kleeberger, S. R. Interstrain variation in murine aerobic capacity. Medicine & Science in Sports & Exercise. 33 (12), (2001).
- Wojewoda, M., et al. Running Performance at High Running Velocities Is Impaired but V'O2max and Peripheral Endothelial Function Are Preserved in IL-6-/- Mice. PLOS ONE. 9 (2), (2014).
- Muller, C. R., Américo, A. L. V., Fiorino, P., Evangelista, F. S. Aerobic exercise training prevents kidney lipid deposition in mice fed a cafeteria diet. Life Sciences. 211, 140-146 (2018).
- Petrosino, J. M., et al. Graded Maximal Exercise Testing to Assess Mouse Cardio-Metabolic Phenotypes. PLOS ONE. 11 (2), 0148010 (2016).
- Poole, D. C., Jones, A. M. Oxygen Uptake Kinetics. Comprehensive Physiology. , (2012).
- Copp, S. W., Hirai, D. M., Musch, T. I., Poole, D. C. Critical speed in the rat: implications for hindlimb muscle blood flow distribution and fibre recruitment. The Journal of Physiology. 588, 5077-5087 (2010).
- Kregel, K., et al. . Resource Book for the Design of Animal Exercise Protocols. , (2006).
- Lamy, S., et al. Air puffs as refinement of electric shocks for stimulation during treadmill exercise test. The FASEB Journal. 30, 1014 (2016).
- Koenen, K., et al. Sprint Interval Training Induces A Sexual Dimorphism but does not Improve Peak Bone Mass in Young and Healthy Mice. Scientific Reports. 7, (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved