JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Supramaximal 강도 Hypoxic 운동과 쥐에 혈관 기능 평가
요약
Hypoxia에서 고 강도 훈련 프로토콜 입증 된 일부 환자에서 잠재적으로 유리한 혈관 적응을 유도 하 고 선수를 개선 하기 위해 반복 스 프린트 능력 이다. 여기, 우리는 프로토콜을 식별 비보 관 기능 평가 전을 사용 하 여 이러한 혈관 적응 훈련 마우스 사용 하 여의 타당성을 테스트 합니다.
초록
운동 훈련은 건강을 유지 하 고 많은 만성 질병을 방지 하기 위한 중요 한 전략 이다. 그것은 심장 혈관 질병, 더 구체적으로, 고통 받는 환자 낮은 말단 동맥 질환, 어디는 환자의 걷는 용량 상당히 변경에 대 한 국제 가이드라인에서 권장 하는 치료의 첫 번째 줄에 영향을 미치는 그들의 질의 생활입니다.
전통적으로, 낮은 지속적인 운동과 간격 훈련을 모두 사용 되었습니다. 최근, supramaximal 훈련 또한 선수 공연을 통해 혈관 각 색 한, 다른 메커니즘 들을 개선 하기 위해 표시 되었습니다. Hypoxia 훈련의이 종류의 조합을 수 있습니다 특정 pathologies에 대 한 관심의 추가 또는 synergic 효과 가져올 수 있었다. 여기, 우리는 자동화 된 디딜 방 아와 hypoxic 상자를 사용 하 여 그들의 최대 속도의 150%에서 건강 한 쥐에 hypoxia에서 supramaximal 강도 훈련 세션을 수행 하는 방법을 설명 합니다. 우리는 또한 관심의 장기를 찾기 위해 마우스 해 부 하는 방법을 보여 특히 폐 동맥, 복 부 대동맥과 장 골 동맥. 마지막으로, 우리는 아이소메트릭 긴장 연구를 사용 하 여 검색 된 혈관에 비보 관 기능 평가 전 수행 하는 방법을 보여줍니다.
서문
저 산소 증, 산소 (O2)의 감소 영감된 분수 hypoxemia (hypoxia에서 낮춘된 동맥 압력)와 변경 된 O2 전송 용량1리드. 급성 저 산소 증은 골격 근육2 와 반대 '보상' vasodilatation 감독 증가 공감 vasoconstrictor 활동을 유도 합니다.
Hypoxia에서 submaximal 강도,이 '보상' vasodilatation, , normoxic 조건 운동의 동일한 레벨 기준으로 잘 설립된3입니다. 이 혈관은 증강된 혈액 흐름 및 유지 보수 (또는 변경 제한) 필수적 이다 활성 근육에 산소 공급의. 아데노신이 없는 독립적인 역할이이 응답에서 산화 질소 (NO) 때문에 hypoxic 중 산화 질소 synthase (NOS) 억제로 알려졌다 증강된 vasodilatation의 중요 한 blunting 기본 내 피 소스 것 표시 했다 4운동. 다른 여러 vasoactive 물질은 가능성이 재생 역할에 보상 vasodilatation hypoxic 운동을 하는 동안.
이 향상 된 hypoxic 운동 충 hypoxia 유발 하는을에 비례 동맥 O2 콘텐츠에서 이며 운동 강도가 증가할수록 큰 예 hypoxia에서 강렬한 증분 운동을 하는 동안.
보상 vasodilatation 아니 중재 구성 요소 증가 운동 강도3다른 경로 통해 통제 된다: β-아드레날린 수용 체-자극 없이 구성 하는 경우 낮은 강도 hypoxic 운동 동안 파라마운트 나타납니다 보상 팽창에 기여 하는 아무 소스 운동 강도 증가 β-아드레날린 메커니즘에 덜 의존 것으로 보인다. 적혈구 및 내 피 파생 prostaglandins 발표 ATP 등 강도 높은 hypoxic 운동을 하는 동안 아무 릴리스를 자극에 대 한 다른 후보 있다.
저 산소 증 (hypoxia [RSH]에서 반복된 스 프린트 훈련 운동 생리학 문학에서 이라는)에 Supramaximal 운동은 이다는 최근 훈련 방법5 팀 또는 라켓 스포츠 선수에 성능 향상을 제공. 이 방법은 다른 간격 hypoxia에서 수행에 훈련에서 또는 최대 속도6 (V최대) 근처에서 RSH 수행 후 최대 강도에 이르게 큰 근육 관류와 산소7 와 특정 근육 transcriptional 응답8. RSH의 효과 설명 하기 위해 몇 가지 메커니즘 제안: hypoxia에서 달리기, 동안 보상 혈관 확장 및 관련 된 높은 혈액 흐름 도움이 될 것 이라고 빠른 트 위치 섬유 보다는 더 느린 트 위치 섬유. 따라서, RSH 효율성 섬유 유형 선택 및 강도 종속 될 것입니다. 우리 혈관 시스템의 향상 된 응답성은 RSH에 답해야 추측.
운동 훈련은 쥐, 둘 다 건강 한 개인에서 병 적인 마우스 모델9,10에 광범위 하 게 연구 되었습니다. 쥐를 훈련 하는 가장 일반적인 방법은 설치류 디딜 방 아를 사용 하 고 전통적으로 사용 된 처방은 낮은-강도 훈련, V최대 (증분 디딜 방 아 시험11를 사용 하 여 결정)의 40%-60%에서 30-60 분12,13 ,,1415. 최대 강도 간격 훈련과 pathologies에 미치는 영향 널리 연구 쥐16,17; 따라서, 간격 훈련 마우스 실행 프로토콜 개발 되었습니다. 이러한 프로토콜은 일반적으로 설치류 자동화 된 디딜 방 아, 1-4 분, 나머지는 활성 또는 수동16,18interspersed V최대 의 80%-100%에서 실행의 약 10 복싱의 구성.
Hypoxia에서 (즉, 위는 V최대) supramaximal 강도에서 운동 하는 쥐에 관심 microvascular vasodilatory 보상 및 간헐적 운동 성능을 모두 더에서 증가 이전 결과에서 온다 supramaximal 보다 최대한 또는 적당 한 농도. 그러나, 우리의 지식, 생쥐, normoxia 또는 hypoxia에서에서 supramaximal 훈련 프로토콜의 이전 보고서가입니다.
현재 연구의 첫 번째 목표는 마우스와 쾌활 하 고 적절 한 프로토콜 (강도, 스 프린트 기간, 복구, 등)의 결정에 supramaximal 강도 훈련의 타당성을 테스트 했다. 두 번째 목표는 혈관 기능에 normoxia와 hypoxia에서 다른 훈련 식이요법의 효과 평가 했다. 따라서, 우리는 (1) 쥐 hypoxia, supramaximal 운동을 잘 용납 하 고이 프로토콜 보다 더 낮은 농도에 산소에 운동 뿐만 아니라 normoxia에 운동 보다는 혈관 기능에 큰 개선 유도 (2) 가설을 테스트 합니다.
프로토콜
현지 국가의 동물 보호 위원회 (서비스 드 라 소비 외 데 레 아 페르 Vétérinaires [SCAV], 로잔, 스위스) 모든 실험을 승인 (승인 VD3224; 01.06.2017) 및 모든 실험 관련에 따라 실시 했다 지침 및 규정
1. 동물 주택 및 준비
- 하우스 6 8 주 오래 된 C57BL/6J 남성 쥐 쥐에 실험 시작 전에 적어도 1 주 동안 동물 시설에 그들의 새로운 주택 조건에 사용. 실용적인 이유로, 동일한 실험적인 그룹의 마우스는 일반적으로 보관 되어 함께.
- 음식과 물에는 온도 제어 룸 (22 ± 1 ° C) ad libitum 액세스와 12 h 명암 주기에서에서 생쥐를 유지.
2. 최대 속도 및 성능 향상 증분 테스트 디딜 방 아의 표준 평가의 결정
참고: 다음 단계는 훈련 프로토콜을 완료 하려면 중요 합니다.
- 쥐 쥐 0 ° 경사와 함께, 여러 차선에 있을 수 있습니다와 전기 그리드와 탑재 0.2로 설정 자동화 된 디딜 방 아를 사용 하 여 실행 하려면 마우스를 촉진 하기 위해 차선 뒤 엄마.
-
첫 번째 테스트 전에 다음 프로토콜에 따라, 디딜 방 아에 순응의 4 일 쥐를 제출 합니다.
- 하루에 1, 4.8 m/분에서 10 분 동안 실행 하는 마우스를 있다.
- 하루에 2, 6 m/분에서 10 분 동안 실행 하는 생쥐를 있다.
- 3 일에 7.2 m/분에서 10 분 동안 실행 하는 생쥐를 있다.
- 하루에 4, 8.4 m/분에서 10 분 동안 실행 하는 생쥐를 있다.
-
5 일에 피로, 다음 프로토콜에 따라 증분 테스트에 마우스를 제출 합니다.
- 워밍업 5 분 4.8 m/분 (0 ° 경사)에 쥐를 보자.
- 때 마우스는 중 전기 그리드에서 3 년 연속 초 지출에 도달 하면 피로까지 1.2 m/분 마다 3 분 (예: 4.8 m/min, 다음 3에서 6 m/분, 7.2 m/분, 8.4 m/분, 등에서 3 분 3 분에서 5 분) 하 여 속도 증가 또는 (표시는 장치에 의해) 100 충격을 받습니다.
- 그리고 격자에 소요 된 총 시간 기간, 거리, 충격, 수 달성된 속도 (V최대으로 간주)를 적어 둡니다.
참고: 일반적으로, V최대 은 28.8 ± 3.7 m/분. - 중간 훈련 (예를 들어, 경우 훈련 프로토콜 8 주 지속 다음 4 주 중반 교육 증분 테스트를 수행에 업데이트 된 V최대 생쥐의 훈련의 속도 조정 하기 위해이 테스트에 마우스를 다시 제출 합니다. 그 경우에, 대체 예정된 교육 중 테스트에 의해), 그리고 성능 향상을 평가 연구의 끝에 이렇게 다시 할.
- 이 테스트 전후 48 h 휴식 기간을 구현 합니다.
참고: 모든 증분 테스트 아침에 수행 했다.
3. 산소가 적은 환경
- Hypoxia에서 훈련 세션에 대 한 디딜 방 아 hypoxic 상자 (그림 1)에서 가스 믹서에 연결 장소. 보정된 속도도 사용 하 여 정기적으로 상자에 산소 (FiO2 [즉, 산소의 수준])의 주변 부분을 제어.
- 질소 (N2)의 100%에 가스 믹서를 설정 하 고 산소의 수준을 확인 하는 속도도 사용. 일단 FiO2 = 0.13, 13% O2를 100% N2 가스 믹서의 매개 변수를 변경.
- Hypoxia에 장기간된 수동 노출 피하려면 쥐에 쓰레기와 농축, 임시 작은 케이지 하 고 신속 하 게 배치 상자에서 한 번 FiO2 = 0.13에 도달 했습니다. 환경 인지 확인 13% O2 에 아직도; 감 금 소를 두기 후에 그렇지 않으면, 그것을 조정.
- 정기적으로 그것은 FiO2 에 남아 있는지 확인 하는 훈련의 과정을 통해 O2 의 레벨을 확인 0.13 ± 0.002 =.
4. Normoxic 환경
- Normoxia에서 훈련 세션에 대 한 hypoxic 상자에 디딜 방 아를 유지 하지만 그렇게 거기에 주변 공기 장갑 제거 (FiO2 = 0.21). 목표는 hypoxia에서 쥐로 같은 교육 환경을 재현 하는.
5. Supramaximal 강도 훈련
-
(0 ° 경사)에 디딜 방 아에 개별 차선에 쥐를 놓고 다음과 같은 프로토콜에 그들을 제출 합니다.
- 5 분 워밍업 쥐 4.8 m/분, 9 m/분에서 5 분 뒤에 있다.
- 달리기의 속도는 이전 결정 V최대의 150%로 설정 합니다.
참고: 일반적으로 스 프린트 속도 42.1 ± 5.5 m/분. - 5 x 10의 달리기 20의 4 세트에 대 한 생쥐 기차 각 스 프린트 사이 나머지의 s. Interset 나머지는 5 분 (그림 2).
참고: 훈련 세션의 총 작업 다른 훈련 그룹의 일치 하는 경우 cooldown 기간을 추가 합니다.
- 이 선호 48 h 훈련 세션 사이 주당 3 배 훈련을 수행 합니다.
- 전기 충격에 보완적인 방법으로 면봉을 사용 하 여 실행 하려면 마우스를 격려. 마우스와 전기 그리드 사이 레인 맨 슬릿에 면봉을 놓고 부드럽게 디딜 방 아의 뒷면에 도달 하면 마우스를 이동 합니다. 이 전기 충격의 전달을 방지 하 고 부드러운 방식으로 실행 하려면 마우스를 자극.
6. 낮은-강도 훈련
-
(0 ° 경사)에 디딜 방 아에 개별 차선에 쥐를 놓고 다음과 같은 프로토콜에 그들을 제출 합니다.
- 5 분 워밍업 쥐 4.8 m/min, 7.2 m/분에서 5 분 뒤에 있다.
- 40%는 이전 결정 V최대의 지속적인 실행 중인 세션의 속도 설정 합니다.
참고: 일반적으로, 연속 실행 속도 9.9 m/분 이었다. - 40 분 동안 쥐를 훈련.
- 이 선호 48 h 훈련 세션 사이 주당 3 배 훈련을 수행 합니다.
- 전기 충격에 보완적인 방법으로 면봉을 사용 하 여 실행 하려면 마우스를 격려.
7. 마우스 안락사와 장기 추출
- 훈련 프로토콜 및 마지막 증분 테스트 후 적어도 24 시간의 끝에 있는 유도 챔버에서 isoflurane (4%-5% O2 마 취를 유도 하 고 마 취를 유지 하기 위해 100% O2 에서 1%-2%)를 사용 하 여 마우스 anesthetize. 적절 한 anesthetization 발 도피 반사를 사용 하 여 확인 (동물의 발을 단단히 꼬집어; 동물 자극에 반응 하지 않는 경우 마 취에 적절 한 간주 됩니다).
- 25g 바늘을 사용 하 여 앞에서 설명한19로 최대 혈액 볼륨을 수집 경 피 적인 심장 펑크를 수행 합니다.
- 자 궁 경부 전위를 수행 하 고 라운드 팁 위 복 부에 피부의 첫 번째 레이어를 통해 절단 및 (쪽으로 머리와 꼬리) 절 개의 양쪽에서 당기는 마우스의 피부를 제거.
- 얇은 포인트 팁이 위는 비장에 도달 하 고 필요 하다 면 그것을 추출 하는 마우스의 왼쪽에 흉 곽 아래 복 통해 잘라.
참고: 필요한 경우 근육 해 부. -
폐 동맥에 밖으로 해 부.
- 작은 위, 겸 자 사용 하, 흉부 케이지를 제거 하 고 심장-폐 영역 선택을 취소.
- "자동 닫기" 족집게로 꼭대기를 부드럽게 스트레칭 대동맥 아치와 폐 동맥의 기본을 최대한 가까이 마음을 꼬집어.
- 오른손을 사용 하 여, 폐 동맥 및 대동맥, 및 다음 이동 핀셋 삽입 곡선된 핀셋 폐 동맥 (그림 3)만을 조금 다시.
- 왼손을 사용 하 여 오른쪽으로 하나를 대체 하는 핀셋의 또 다른 쌍을 삽입.
- 오른손에서 날카로운 직선 microscissors를 사용 하 여, 1 개의 측에 그리고 멀리 가능한 다른 쪽에에 가능한 마음으로 폐 동맥 해 부.
참고: 그것은 중요 하지 않습니다 어느 손이 어떤 악기를 보유 하 고 있지만 우리는 왼쪽 보다 오른쪽 손으로 잘라 쉽게 나타났습니다. - 그것 차가운 인산 염 버퍼 식 염 수 (PBS) 버퍼 2 mL 튜브에 넣고 얼음에 계속.
-
전신 관류를 수행 합니다.
- 마우스의 오른쪽 하단 다리의 상단에 핀셋을 사용 하 여 (사 타 구니 인 대) 아래 오른쪽 대 퇴 동맥으로 외부 내부 오른쪽 장 골 동맥을 취소. 날카로운 직선 microscissors를 사용 하 여 대 퇴 동맥에 전체 컷을 확인 합니다.
- 심장의 좌 심 실에서 차가운 PBS 가득 5 mL 25 G 주사기를 넣고 부드럽게 혈관에서 나머지 혈액을 제거 하는 차가운 PBS를 주입 합니다.
참고: 때문에 폐 동맥의 추출, PBS는 절 개를 순환 하지 않는 가능 하다.
- 족집게를 사용 하 여 가능한 철저 하 게 마음에 왼쪽 및 오른쪽 사 타 구니 인 대에서 대동맥 주변 부드러운 조직을 제거 합니다.
참고: 필요한 경우 추가 분석에 대 한 마음을 추출할 수 있습니다. - 족집게와 microscissors를 사용 하, 가장 낮은 지점 (왼쪽 및 오른쪽 사지)에 외부 장 골 동맥의 심장 밖으로 해 부 고 차가운 PBS로 10 cm 직경 접시에 완전히 해 부 아웃 섹션을 놓습니다.
- 핀셋 / microscissors using, 부드럽게 당기 거 나 혈관에서 절단 하 여 대동맥과 동맥 주위 나머지 지방 청소 완료.
- Microscissors를 사용 하 여 왼쪽 오른쪽 장 골 동맥 분기에서 왼쪽된 장 골 동맥을 잘라 고 추가 분석을 위해 그것을 저장 합니다.
- Microscissors를 사용 하 여 왼쪽된 신장 동맥 아래 복 부 대동맥을 잘라 고 얼음 (그림 4)에 차가운 PBS 버퍼에 추출 된 선박을 배치.
- 추가 분석에 대 한 저장소에서 왼쪽된 신장 동맥 위에 오른쪽 대동맥 아치에서 나머지 청소 용기를 유지.
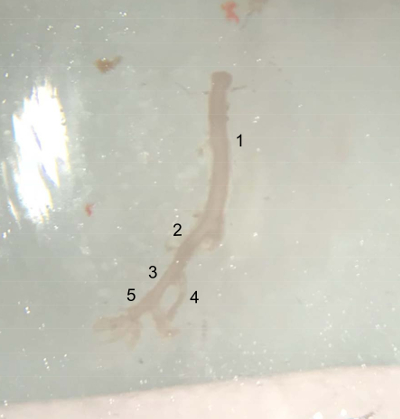
그림 4 : 해 부 혈관의 그림. 오른쪽 장 골 동맥, 얼음 차가운 PBS 버퍼에 배치 될 준비가 끝에 복 부 대동맥 (아래 왼쪽된 신장 동맥)의 상단에서 추출 된 용기. (1) 복 대동맥입니다. (2) 바로 일반적인 장 골 동맥 (3) 외부의 장 골 동맥 (4) 내부의 장 골 동맥 (5) 대 퇴 동맥입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
8. 전 비보 관 기능 평가
참고: 세척은 비우는 및 Krebs와 챔버의 채우는에 해당 합니다.
- 앞에서 설명한 프로토콜20에 따라 격리 된 폐 동맥, 복 부 대동맥, 그리고 오른쪽 장 골 동맥 세그먼트 긴 1.0-2.0 m m의 혈관 고리를 잘라내어 두 0.1 m m 직경 등 통과 루멘에 각 반지를 탑재.
- 수정된 Krebs 벨소리 중 탄산염 솔루션 (118.3 m m NaCl, 4.7 m m KCl, 2.5 m m CaCl2, 1.2 m m MgSO4, 1.2 m m KH2포4, 25.0 m m NaHCO3및 11.1 mM의 10 mL 가득 수직 기관 실에서 배 링 일시 중단 포도 당) 37 ° C에서 유지 하 고 화난 95% O2-5% CO2 (pH 7.4). 한 등 자 기관 챔버의 바닥에 고정 되 고 다른 하나는 그램에서 아이소메트릭 힘의 측정에 대 한 스트레인 게이지에 연결 되어.
- 그들의 최적의 휴식 긴장을 혈관을가지고: 0.5 g 폐 동맥, 장 골 동맥에 대 한 1.5 g 및 복 부 대동맥에 대 한 2 g 고리를 스트레칭 하 고 평형의 20 분 후 씻어. 스트레치-평형-워시 1 x 단계를 반복 합니다.
- 혈관의 생존 능력을 테스트 하기 위해 고리 KCl의 235 µ L 계약 (10-1 M) 10 분, 또 다른 10 분 동안 그들을 세척 하 고 KCl의 235 µ L와 다시 계약 (10-1 M) 고원 도달까지 약 20 분.
- 다시 10 분 동안 배를 세척 하 고 내 생 prostanoids의 가능한 간섭을 방지 하기 위해 적어도 20 분 동안 58.4 µ L indomethacin (10-5 M)의 (cyclooxygenase 활동의 억제제)를 추가.
- 10-4 M를 10-9 (10 µ L)에서 phenylephrine (Phe)의 누적 복용량을 추가 (또는 10-5 M 폐 동맥; 대 하 10-9 10-9 M 이상의 모든 농도 대 한 9 µ L) 혈관을 계약.
- 혈관 (고원) 상대적으로 안정적인 수축 상태에 도달 될 때까지 페의 마지막 복용 후 약 1 시간에 대 한 기다립니다.
- 추가 누적 복용량은 endothelium 종속 vasodilator 아 세 틸 콜린 (ACh), 10-4 M에 10-9 에서 (58.4 µ L 10-9 M, 대 고 번갈아 12.6 µ L 40 µ L 10-9 M 이상의 모든 농도 대 한), 질소 유도 하 산화물 (NO)-중재 하는 휴식.
- 이완 곡선의 끝에, 10 분, 배를 세척 하 고 NG-니트로-L-아르기닌 (NLA, 10-4 M)은 적어도 20 분 동안 해의 억제제의 184 µ L indomethacin (10-5 M)의 58.4 µ L을 추가.
- 다시 페 (10-5 및 10-4 M 고 폐 동맥에 대 한 10-4 복 부 대동맥과 장 골 동맥에 대 한 M) 1 시간에 대 한 상대적으로 안정적인 수축 유도 하의 10 µ L의 독특한 복용량과 함께 선박을 계약.
- ACh의 40 µ L의 독특한 복용량을 추가 (10-4 M) 고원 도달까지.
- Indomethacin (10-5 M)의 58.4 µ L를 추가 하기 전에 10 분 동안 다시 용기를 세척 및 NLA의 184 µ L (10-4 M) 20 분.
- 1 시간에 대 한 페 (10-5 및 10-4 M)의 10 µ L로 선박을 계약.
- 추가 누적 복용량 (10-9 [58.4 µ L] 10-4 M를 [10-9 M 이상의 모든 농도 대 한 40 µ L]) 아니 기증자 diethylamine (마약)의 / 아니, endothelium 독립 없음 유도 휴식을 평가 하기 위해서는.
- 실험의 끝에, 필요한 경우 향후 분석을 위해 액체 질소에 혈관을 저장 합니다.
결과
우리의 지식을 하려면, 현재 연구 normoxia와 hypoxia 마우스 supramaximal 강도 훈련 프로그램을 설명 하기 위해 처음 이다. 이 프로토콜에서 마우스 각 스 프린트 사이 20 s 복구 5 10의 달리기의 4 세트를 달렸다. 세트의 복구 기간 5 분 interspersed 했다. 그것은 여부 쥐 같은 프로토콜을 유지 할 수 있을 것이 고 제대로 완료 알려지지 않았다. 그러나, 그림 5에 따...
토론
이 연구의 첫 번째 목적은 마우스에 hypoxic 강도 높은 훈련의 타당성을 평가 하 고 쥐에 의해 잘 용납 될 것입니다 프로토콜의 적절 한 특성을 결정 했다. 고의로, 쥐에 supramaximal (즉, 보다 더 많은 V최대) 강도 훈련을 사용 하 여 데이터가 있기 때문에, 우리가 수행 했다 선수, 4 ~ 5 세트 5 전면적인 달리기 (약 200%의의와 개발 이전 프로토콜에 기반으로 하는 재판 V최대), 5 분
공개
저자는 공개 없다.
감사의 말
저자는 다닐로 Gubian과 스테판 Altaus hypoxic 설치를 만들에 대 한 로잔 대학 병원 (CHUV) 기계 워크숍에서 감사 하 고 싶습니다. 저자 또한 다이앤 Macabrey와 멜 라 니 Sipion 동물 훈련 그들의 도움에 감사 하 고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Cotton swab | Q-tip | ||
| Gas mixer Sonimix 7100 | LSI Swissgas, Geneva, Switzerland | Gas-flow: 10 L/min and 1 L/min for O2 and CO2, respectively | |
| Hypoxic Box | Homemade | Made in Plexiglas | |
| Motorized rodents treadmill Panlab LE-8710 | Bioseb, France | ||
| Oximeter Greisinger GOX 100 | GREISINGER electronic Gmbh, Regenstauf, Germany | ||
| Sedacom software | Bioseb, France | ||
| Strain gauge | PowerLab/8SP; ADInstruments |
참고문헌
- Calbet, J. A., et al. Determinants of maximal oxygen uptake in severe acute hypoxia. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 284 (2), 291-303 (2003).
- Hanada, A., Sander, M., González-Alonso, J. Human skeletal muscle sympathetic nerve activity, heart rate and limb haemodynamics with reduced blood oxygenation and exercise. The Journal of Physiology. 551, 635-647 (2003).
- Casey, D. P., Joyner, M. J. Compensatory vasodilatation during hypoxic exercise: mechanisms responsible for matching oxygen supply to demand. The Journal of Physiology. 590 (24), 6321-6326 (2012).
- Casey, D. P., et al. Nitric oxide contributes to the augmented vasodilatation during hypoxic exercise. The Journal of Physiology. 588, 373-385 (2010).
- Girard, O., Brocherie, F., Millet, G. P. Effects of Altitude/Hypoxia on Single- and Multiple-Sprint Performance: A Comprehensive Review. Sports Medicine. 47 (10), 1931-1949 (2017).
- Faiss, R., Girard, O., Millet, G. P. Advancing hypoxic training in team sports: from intermittent hypoxic training to repeated sprint training in hypoxia. British Journal of Sports Medicine. 47, 45-50 (2013).
- Brocherie, F., Girard, O., Faiss, R., Millet, G. P. Effects of Repeated-Sprint Training in Hypoxia on Sea-Level Performance: A Meta-Analysis. Sports Medicine.(Auckland, N.Z). 47 (8), 1651-1660 (2017).
- Brocherie, F., et al. Repeated maximal-intensity hypoxic exercise superimposed to hypoxic residence boosts skeletal muscle transcriptional responses in elite team-sport athletes. Acta Physiologica. 222 (1), 12851 (2018).
- Pellegrin, M., et al. New insights into the vascular mechanisms underlying the beneficial effect of swimming training on the endothelial vasodilator function in apolipoprotein E-deficient mice. Atherosclerosis. 190 (1), 35-42 (2007).
- Picard, M., et al. Acute exercise remodels mitochondrial membrane interactions in mouse skeletal muscle. Journal of Applied Physiology. 115 (10), 1562-1571 (2013).
- Ayachi, M., Niel, R., Momken, I., Billat, V. L., Mille-Hamard, L. Validation of a Ramp Running Protocol for Determination of the True VO2max in Mice. Frontiers in Physiology. 7, (2016).
- Pellegrin, M., et al. Running Exercise and Angiotensin II Type I Receptor Blocker Telmisartan Are Equally Effective in Preventing Angiotensin II-Mediated Vulnerable Atherosclerotic Lesions. Journal of Cardiovascular Pharmacology and Therapeutics. 22 (2), (2016).
- Semin, I., Acikgöz, O., Gönenc, S. Antioxidant enzyme levels in intestinal and renal tissues after a 60-minute exercise in untrained mice. Acta Physiologica Hungarica. 88 (1), 55-62 (2001).
- Cho, J., et al. Treadmill Running Reverses Cognitive Declines due to Alzheimer Disease. Medicine & Science in Sports & Exercise. 47 (9), 1814-1824 (2015).
- Schill, K. E., et al. Muscle damage, metabolism, and oxidative stress in mdx mice: Impact of aerobic running. Muscle & Nerve. 54 (1), 110-117 (2016).
- Cho, J., Kim, S., Lee, S., Kang, H. Effect of Training Intensity on Nonalcoholic Fatty Liver Disease. Medicine & Science in Sports & Exercise. 47 (8), 1624-1634 (2015).
- Sabatier, M. J., Redmon, N., Schwartz, G., English, A. W. Treadmill training promotes axon regeneration in injured peripheral nerves. Experimental Neurology. 211 (2), 489-493 (2008).
- Rolim, N., et al. Aerobic interval training reduces inducible ventricular arrhythmias in diabetic mice after myocardial infarction. Basic Research in Cardiology. 110 (4), 44 (2015).
- Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database Available from: https://www.jove.com/science-education/10246/blood-withdrawal-i (2018)
- Peyter, A. -. C., et al. Muscarinic receptor M1 and phosphodiesterase 1 are key determinants in pulmonary vascular dysfunction following perinatal hypoxia in mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 295 (1), 201-213 (2008).
- Faiss, R., et al. Significant Molecular and Systemic Adaptations after Repeated Sprint Training in Hypoxia. PLOS ONE. 8 (2), (2013).
- Faiss, R., et al. Repeated Double-Poling Sprint Training in Hypoxia by Competitive Cross-country Skiers. Medicine & Science in Sports & Exercise. 47 (4), 809-817 (2015).
- Billat, V. L., Mouisel, E., Roblot, N., Melki, J. Inter- and intrastrain variation in mouse critical running speed. Journal of Applied Physiology. 98 (4), 1258-1263 (2005).
- Ferguson, S. K., et al. Effects of living at moderate altitude on pulmonary vascular function and exercise capacity in mice with sickle cell anemia. The Journal of Physiology. , (2018).
- Lightfoot, J. T., Turner, M. J., Debate, K. A., Kleeberger, S. R. Interstrain variation in murine aerobic capacity. Medicine & Science in Sports & Exercise. 33 (12), (2001).
- Wojewoda, M., et al. Running Performance at High Running Velocities Is Impaired but V'O2max and Peripheral Endothelial Function Are Preserved in IL-6-/- Mice. PLOS ONE. 9 (2), (2014).
- Muller, C. R., Américo, A. L. V., Fiorino, P., Evangelista, F. S. Aerobic exercise training prevents kidney lipid deposition in mice fed a cafeteria diet. Life Sciences. 211, 140-146 (2018).
- Petrosino, J. M., et al. Graded Maximal Exercise Testing to Assess Mouse Cardio-Metabolic Phenotypes. PLOS ONE. 11 (2), 0148010 (2016).
- Poole, D. C., Jones, A. M. Oxygen Uptake Kinetics. Comprehensive Physiology. , (2012).
- Copp, S. W., Hirai, D. M., Musch, T. I., Poole, D. C. Critical speed in the rat: implications for hindlimb muscle blood flow distribution and fibre recruitment. The Journal of Physiology. 588, 5077-5087 (2010).
- Kregel, K., et al. . Resource Book for the Design of Animal Exercise Protocols. , (2006).
- Lamy, S., et al. Air puffs as refinement of electric shocks for stimulation during treadmill exercise test. The FASEB Journal. 30, 1014 (2016).
- Koenen, K., et al. Sprint Interval Training Induces A Sexual Dimorphism but does not Improve Peak Bone Mass in Young and Healthy Mice. Scientific Reports. 7, (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유