Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Гипоксическая тренировка Supramaximal интенсивности и сосудистая функция оценки в мышей
В этой статье
Резюме
Высокой интенсивности обучения в гипоксия — это протокол, который был доказан, чтобы побудить сосудистой адаптации потенциально полезным в некоторых пациентов и улучшить спортсменов неоднократное спринте способность. Здесь мы проверить целесообразность подготовки мышей с использованием протокола и выявления тех сосудов адаптации с помощью ex vivo сосудистой функции оценки.
Аннотация
Учебные упражнения является важной стратегией для поддержания здоровья и предотвращения многих хронических заболеваний. Это первая линия лечения, рекомендованные международными руководящими принципами для пациентов, страдающих от сердечно-сосудистых заболеваний, в частности, Нижняя конечность артерии болезни, где пешеходные возможностей пациентов значительно изменены, влияющих на их качество жизни.
Традиционно были использованы низкой непрерывного упражнения и тренировки интервала. Недавно supramaximal обучения также было показано для улучшения выступления спортсменов через сосудистые адаптаций, среди других механизмов. Сочетание этого типа обучения с гипоксией может принести дополнительные и/или синергический эффект, который может представлять интерес для некоторых патологий. Здесь мы опишем, как для выполнения supramaximal интенсивности тренировок в гипоксии на здоровых мышей на 150% от их максимальной скорости, с помощью моторизованных беговой дорожки и поле гипоксии. Мы также показать, как вскрыть мышь с целью извлечения органов, представляющих интерес, особенно в легочной артерии, брюшной аорты и подвздошных артерии. Наконец мы покажем, как выполнять ex vivo сосудистой функции оценки на Проверено сосуды, используя Изометрические напряжения исследования.
Введение
В гипоксии снижение вдохновили фракция кислорода (O2) приводит к гипоксемии (снижение артериального давления при гипоксии) и изменены O2 транспортного потенциала1. Острая гипоксия индуцирует увеличение симпатичная(ый) вазоконстриктора деятельность направлена на скелетных мышц2 и против «компенсационные» вазодилатации.
При субмаксимальных интенсивности в гипоксии этот «компенсационные» сосудов, по отношению к такой же уровень осуществления в условиях нормоксические, является хорошо установленным3. Этот vasodilation имеет важное значение для обеспечения расширенной кровотока и техническое обслуживание (или ограничить изменения) доставки кислорода к активной мышцы. Аденозин была показана не иметь независимую роль в этом ответе, в то время как оксида азота (NO) кажется первоисточником эндотелия, поскольку значительные притупления дополненной вазодилатация сообщили с ингибирование синтазы (NOS) оксида азота во время гипоксических Упражнение4. Скорее всего, несколько других вазоактивных веществ играют роль в компенсационные сосудов во время гипоксических тренировок.
Это расширение гипоксических упражнения гиперемия пропорциональн к гипоксии индуцированной падения в артериальной O2 содержание и больше, как увеличивается интенсивность упражнений, например во время интенсивной добавочные упражнения в гипоксии.
NO-опосредованной компонент компенсационного вазодилатация регулируется различными путями с растущей интенсивности упражнение3: Если β-адренергических рецепторов стимулировали компонент не появляется исключительно во время низкой интенсивности гипоксических тренировок , источник не способствуя компенсационные дилатации кажется менее зависимыми от β-адренергических механизмов с увеличением интенсивности упражнений. Есть другие кандидаты для стимулирования не релиз во время гипоксических упражнения более высокой интенсивности, как СПС, освобожден из эритроцитов и/или эндотелия производные простагландинов.
Supramaximal упражнение в гипоксии (названный неоднократные спринт подготовки в гипоксии [RSH] в литературе физиологии упражнений) является недавно обучения метод5 обеспечивая повышение производительности в команде или ракетка спортивных игроков. Этот метод отличается от интервала, обучение в гипоксии, выступал на или вблизи максимальная скорость6 (VМакс) так как RSH, выполняемые на максимальной интенсивности приводит к большей мышечной перфузии и оксигенации7 и конкретных мышц транскрипционный анализ 8ответов. Несколько механизмов было предложено разъяснить эффективность RSH: во время спринтов в гипоксии, компенсационные вазодилатацию и связанные выше кровотока выиграют быстро сокращающиеся волокна более медленно сокращающиеся волокна. Следовательно эффективность RSH-видимому выборочный тип волокна и зависит от интенсивности. Мы предположить, что улучшение оперативности сосудистой системы имеет первостепенное значение в RSH.
Учебные упражнения широко изучены в мышей, как у здоровых лиц, так и в патологических мыши модели9,10. Наиболее распространенный способ обучить мышей является использование грызунов беговой дорожке, и традиционно используется режим низк интенсивности обучения, на 40%-60% от VМакс (определяется с помощью испытаний добавочного беговая дорожка11), за 30-60 мин12,13 ,14,15. Максимальная интенсивность тренировки интервала и ее влияние на патологии широко изучены в мышей16,17; Таким образом были разработаны интервал подготовки работающие протоколы для мышей. Эти протоколы обычно состоят из около 10 приступы работает на 80 – 100% VМакс на грызунов моторизованных беговой дорожке, для 1-4 мин, перемежаются с активным или пассивным отдыха16,18.
Интерес к мышей в supramaximal интенсивности (то есть, выше VМакс) в гипоксии происходит от предыдущих результатов, которые микрососудистой сосудорасширяющих компенсации и прерывистый упражнения производительность и более увеличение на supramaximal чем на максимальное или умеренной интенсивности. Однако насколько нам известно, существует нет предыдущего доклада supramaximal подготовки протокола в мышей, в normoxia или в гипоксии.
Первой целью настоящего исследования было проверить целесообразность supramaximal интенсивности обучения в мышей и определение терпимым и адекватного протокола (интенсивность, продолжительность спринта, восстановление, и т.д.). Вторая цель заключалась в оценке воздействия различных учебных режима в normoxia и гипоксии на функции сосудистого. Таким образом мы испытания гипотез, что (1) мышах переносят хорошо supramaximal упражнения в гипоксии, и (2), что этот протокол вызывает большие улучшения в функции сосудистого чем упражнение в normoxia, но и чем упражнение в гипоксии на нижней интенсивности.
протокол
Комитет местного государственного ухода за животными (сервис-де-ла положениями et des Affaires сотрудниками [SCAV], Лозанна, Швейцария) одобрил все эксперименты (авторизация VD3224; 01.06.2017) и все эксперименты проводились с соблюдением соответствующих руководящие принципы и правила.
1. стойлового содержания скота и подготовка
- Дом 6-8 недели старый C57BL/6J самцов мышей в объекте животных по крайней мере за 1 неделю до начала экспериментов в порядке для мышей привыкнуть к их новых жилищных условий. По практическим соображениям мышей той же экспериментальной группы обычно располагаются вместе.
- Держите мышей в комнате с контролируемой температурой (22 ± 1 ° C) с циклом свет/темно 12 h с ad libitum доступ к продовольствию и воде.
2. Определение максимальной скорости и стандартной оценки повышения производительности путем дополнительных тредмил-тест
Примечание: Следующие шаги имеют решающее значение для завершения подготовки протоколов.
- Используйте моторизованных беговой дорожкой для мышей, где мышей может быть на несколько полос рядом друг с другом, с наклоном 0° и смонтированы с электрической сетки значение 0,2 мА на задней полосу, с тем чтобы поощрять мышей для запуска.
-
До первого теста представить мышей до 4 дней акклиматизации на беговой дорожке, по словам следующий протокол.
- День 1 у мышей, баллотироваться на 10 мин на 4,8 м/мин.
- На 2 день у мышей, баллотироваться на 10 мин, 6 м/мин.
- День 3 у мышей, баллотироваться на 10 мин на 7,2 м/мин.
- На 4-й день у мышей, баллотироваться на 10 мин на 8,4 м/мин.
-
На 5 день отправьте мышей добавочного тест для высасывания, согласно следующий протокол.
- Пусть мышей прогреться в течение 5 мин на 4,8 м/мин (при 0 ° наклонение).
- Увеличить скорость 1,2 м/мин каждые 3 мин (например, 5 мин на 4,8 м/мин, затем 3 на 6 м/мин, 3 на 7,2 м/мин., 3 мин на 8,4 м/мин и т.д.) до изнеможения, который достигается, когда мыши либо тратит 3 последовательных секунд на электрической сети или Получает 100 ударов (отображается аппаратом).
- Запишите достигается скорость, (рассматривается в качестве VМакс), время, расстояние, количество ударов, и общее время, затраченное на сетке.
Примечание: Как правило, VМакс составила 28,8 ± 3,7 м/мин. - Середине обучения, повторно мышей этот тест для того, чтобы скорректировать скорость обучения, чтобы обновленный VМакс мышей (например, если протокол обучение длится 8 недель, а затем выполнить добавочное тест среднего обучения на 4 недели. В этом случае, заменить один из запланированных тренингов тест) и делать так снова в конце исследования с целью оценки улучшения производительности.
- Реализуйте период отдыха 48 ч до и после этого испытания.
Примечание: Все дополнительные испытания были проведены в первой половине дня.
3. гипоксических условий
- Для учебных занятий в гипоксии место беговой дорожке в поле гипоксической (рис. 1) связано с газовый смеситель. Используйте калиброванный оксиметр регулярно контролировать окружающего фракция кислорода (F,яO2 [т.е. уровень гипоксии]) в поле.
- Установите газовый смеситель на 100% азота (N2) и используйте оксиметр для проверки уровня гипоксии. После F,яO2 = 0,13, измените параметр газовый смеситель от 100% N2 на 13% O2.
- Во избежание длительного пассивного воздействия гипоксии, место мышей в клетке временной меньше мусора и обогащения и быстро поместить в поле после F,яO2 = 0,13 был достигнут. Убедитесь, что окружающей среды все еще находится на 13% O2 после сдачи клетке в; Если нет, то корректировать его.
- Регулярно проверять уровень O2 в ходе подготовки сессии чтобы убедиться, что он по-прежнему FiO2 = 0,13 ± 0,002.
4. нормоксические среды
- Для занятий в normoxia, держите беговой дорожке в поле гипоксических, но снять перчатки, так что есть окружающего воздуха (F,яO2 = 0,21). Целью является для воссоздания той же среде обучения как мышей в гипоксии.
5. Supramaximal интенсивности обучения
-
Поместите мышь на отдельных полос движения на беговой дорожке (при 0° наклонение) и представить их следующие протокола.
- У мышей прогреться в течение 5 мин в 4,8 м/мин, а затем 5 минут, 9 м/мин.
- Установите скорость Спринт на 150% от ранее определенных VМакс.
Примечание: Как правило, скорость Спринт был 42.1 ± 5,5 м/мин. - Поезд мышей для четырех наборов 5 x 10 s спринты с 20 s отдыха между каждой Спринт. Остальная Витебска-5 мин (рис. 2).
Примечание: Добавьте период времени восстановления, если общего объема работы учебной сессии должна соответствовать другой группы профессиональной подготовки.
- Выполните это обучение 3 x в неделю, с предпочтительно 48 h между учебных занятий.
- Используйте ватные тампоны как дополнительный метод электрическим током для поощрения мыши для запуска. Поместите ватный тампон в разрез в верхней полосе, между мышью и электросети и нежно подталкивать мыши, когда он достигает задней части беговой дорожки. Это будет избежать доставки электрическим током и стимулировать мышей для запуска мягким способом.
6. низк интенсивности обучения
-
Поместите мышь на отдельных полос движения на беговой дорожке (при 0° наклонение) и представить их следующие протокола.
- У мышей прогреться в течение 5 мин в 4,8 м/мин, после чего 5 мин на 7,2 м/мин.
- Установите скорость непрерывной работы сессии до 40% от ранее определенных VМакс.
Примечание: Как правило непрерывной работает скорость составила 9,9 м/мин. - Поезд мышей за 40 мин.
- Выполните это обучение 3 x в неделю с предпочтительно 48 h между учебных занятий.
- Используйте ватные тампоны как дополнительный метод электрическим током для поощрения мыши для запуска.
7. мышей эвтаназии и извлечение органа
- В конце подготовки протокола и по крайней мере 24 часа после последнего добавочного испытания анестезировать мышь в камеру всасывание с помощью изофлюрановая (4-5% в2 O побудить анестезии и 1%-2% в 100% O2 для поддержания анестезии). Подтверждение правильного анестезии, используя рефлекс Ретракция лапы (твердо щепотка лапы животного; анестезии считается надлежащим, когда животное не реагирует на раздражитель).
- С помощью иглы 25 G, выполните прокол перкутанная сердца, для сбора крови максимального объема как описано19.
- Выполните шейки матки вывихов и снять кожу мыши, проходящем через первый слой кожи на животе с круглым кончиком ножниц и потянув на обеих сторонах разреза (в сторону головы и хвоста).
- Вырежьте через брюшину под грудной клетки на левой стороне мыши с тонкой точка наконечник ножницы для достижения селезенки и распакуйте его при необходимости.
Примечание: Вскрыть из мышц, при необходимости. -
Вскрыть из легочной артерии.
- Используя маленькие ножницы и щипцы, удалите грудной клетки и очистить область легочное сердце.
- С помощью пинцета, «самозакрывающиеся» щепотка сердце как можно ближе к вершине и тянуть осторожно, чтобы растянуть основания аорты и легочной артерии.
- С помощью правой рукой, изогнутый пинцет вставки под легочной артерии и аорты, а затем переместите пинцет обратно немного провести только легочной артерии (рис. 3).
- Используете левую руку для вставки еще пару пинцетом, чтобы заменить один с правой рукой.
- Используя острые прямо microscissors в правой руке, вскрыть легочной артерии как близко к сердцу как можно, с одной стороны и как далеко, как можно на другой стороне.
Примечание: Неважно, какой рукой держит какой инструмент, хотя мы нашли его легче вырезать с правой рукой, чем с левой. - Положите его в 2-мл пробирку с холодной фосфат амортизированное saline (PBS) буфера и держать на льду.
-
Выполнение всего тела перфузии.
- В верхней части правой нижней конечности мыши используйте пинцет, чтобы очистить внешний внутренний правой подвздошной артерии вниз правой бедренной артерии (под паховой связки). Используя острые прямой microscissors, сделайте полный разрез в бедренной артерии.
- Вставьте шприц 5 мл 25 G заполнены с холодной PBS в левый желудочек сердца и осторожно вставляют холодной PBS для удаления оставшихся крови из сосудов.
Примечание: Из-за добычи легочной артерии вполне возможно, что PBS не распространить всю дорогу разрез.
- С помощью пинцета удалите мягких тканей, окружающих аорты от левой и правой паховой связки в сердце как можно тщательнее.
Примечание: Сердце может быть извлечено для дальнейшего анализа, в случае необходимости. - С помощью пинцета и microscissors, вскрыть из сердца до самой низкой точки наружной подвздошной артерии (в левой и правой конечности) и секции полностью разобрал выход в 10 см диаметр блюдо с холодной PBS.
- С помощью пинцета и/или microscissors, закончите уборку оставшийся жир вокруг аорты и артерий, осторожно потянув или резки его от суда.
- С помощью microscissors, вырезать левой подвздошной артерии на бифуркации левой правой подвздошной артерии и сохраните его для дальнейшего анализа.
- С помощью microscissors, вырезать брюшной аорте под левой почечной артерии и поместить извлеченные судна в холодных PBS буфера на льду (рис. 4).
- Сохранить оставшиеся уборка судна, от аорты правой над левой почечной артерии, в хранилище для дальнейшего анализа.
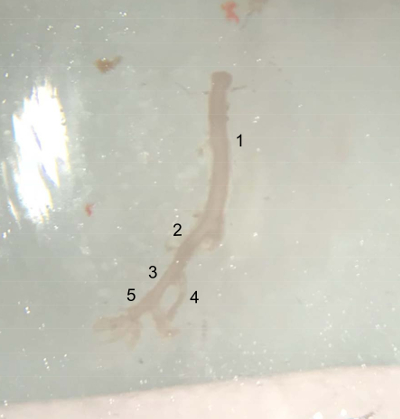
Рисунок 4 : Картина расчлененных судов. Извлеченный судно от верхней части брюшной аорты (под левой почечной артерии) до конца правой подвздошной артерии, готовы быть помещены в холодной PBS буфера на льду. (1) брюшной аорты. (2) право общие подвздошные артерии. (3) внешние подвздошные артерии. (4) внутренняя подвздошная артерия. (5) бедренной артерии. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
8. ex Vivo сосудистой функции оценки
Примечание: Мыть соответствует опорожнения и наполнения палат с Кребс.
- Согласно ранее описанных протокол20изолированные легочной артерии, брюшной аорты и сегментов правой подвздошной артерии нарезать сосудистого кольца 1,0 – 2,0 мм длиной и смонтировать каждое кольцо на двух 0,1 мм диаметр стремена, через просвет.
- Приостановить судно кольца в вертикальный орган камеры заполнены с 10 мл раствора модифицированных бикарбонат Кребса-звонарь (118.3 мм NaCl, 4.7 мм KCl, CaCl 2,5 мм2, 1,2 мм MgSO4, 1,2 мм х2PO4, 25,0 мм NaHCO3и 11,1 мм глюкоза) поддерживается при 37 ° C и пористый с 95% O2-5% CO2 (рН 7,4). Одно стремя прикреплен к нижней части камеры орган и другой подключен к Тензометрический датчик для измерения изометрической силы в граммах.
- Принесите судов для их оптимального отдыха напряженности: растянуть кольца 0,5 g для легочной артерии, 1.5 g для подвздошных артерии и 2 g для брюшной аорты и мыть их после 20 минут уравновешивания. Повторите стрейч уравновешивания мыть шаги 1 x.
- Для проверки жизнеспособности судов, договор кольца с 235 мкл рабочего раствора KCl (10-1 М) за 10 мин, мыть их еще 10 минут и снова контракт с 235 мкл рабочего раствора KCl (10-1 М) для около 20 мин до достижения плато.
- Мыть судов снова за 10 мин и мкл 58,4 индометацина (10-5 M) (ингибитор циклооксигеназы деятельности) для по крайней мере 20 минут для того, чтобы избежать возможного вмешательства эндогенного prostanoids.
- Добавить кумулятивными дозами фенилэфрина (ПТО) от 10-9 (10 мкл) 10-4 М (или 10-9 -10-5 M для легочной артерии; 9 мкл для всех концентрации выше 10-9 M) к контракту судов.
- После введения последней дозы Phe дождитесь около 1 h сосуды достичь состояния относительно стабильным сужением (плато).
- Добавление кумулятивными дозами эндотелий зависимой сосудорасширяющим ацетилхолина (ACh), от 10-9 до 10-4 М (58,4 мкл для 10-9 M и поочередно 12.6 мкл и 40 мкл для всех концентрации выше 10-9 M), чтобы побудить азотной окиси азота (NO)-опосредованной релаксации.
- В конце кривой релаксации мыть судов за 10 мин и добавить 58,4 мкл индометацина (10-5 М), а также 184 мкл нг нитро L-аргинин (НОА, 10-4 М), который является ингибитором NOS, по крайней мере 20 мин.
- Договор судов снова с уникальным дозе 10 мкл Phe (10-5 и 10-4 М для легочной артерии и 10-4 М для брюшной аорты и подвздошных артерии) за 1 ч, чтобы побудить относительно стабильным сужением.
- Добавьте уникальный дозе 40 мкл ACh (10-4 М) до достижения плато.
- Мыть судов снова за 10 мин, перед добавлением 58,4 мкл индометацина (10-5 М) и 184 мкл Ноа (10-4 М) за 20 мин.
- Договор судов с 10 мкл Phe (10-5 и 10-4 М) за 1 ч.
- Добавить кумулятивными дозами (10-9 [58,4 мкл] до 10-4 M [40 мкл для всех концентрации выше 10-9 M]) диэтиламина доноров NO (DEA) / нет, для того чтобы оценить NO-индуцированной релаксации эндотелий независимые.
- В конце эксперимента Храните судов в жидком азоте для будущего анализа при необходимости.
Результаты
К нашему знанию настоящее исследование является первым для описания программы supramaximal интенсивности обучения в normoxia и гипоксии для мышей. В этом протоколе мышей побежал четыре набора из пяти 10 s спринты с 20 s восстановления между каждой Спринт. Наборы были interspersed с 5 мин ...
Обсуждение
Первая цель этого исследования было оценить целесообразность гипоксических высокой интенсивности обучения у мышей и определить адекватные характеристики протокола, который бы хорошо переносится на мышей. Намеренно так как нет никаких данных, с помощью supramaximal (то есть, больше, чем V?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы поблагодарить Данило Gubian и Стефан Altaus от Лозанны университетской больницы (CHUV) Механическая мастерская для помогая создать гипоксических установки. Авторы хотели бы также поблагодарить Диана Macabrey и Мелани Sipion за их помощь в подготовке животных.
Материалы
| Name | Company | Catalog Number | Comments |
| Cotton swab | Q-tip | ||
| Gas mixer Sonimix 7100 | LSI Swissgas, Geneva, Switzerland | Gas-flow: 10 L/min and 1 L/min for O2 and CO2, respectively | |
| Hypoxic Box | Homemade | Made in Plexiglas | |
| Motorized rodents treadmill Panlab LE-8710 | Bioseb, France | ||
| Oximeter Greisinger GOX 100 | GREISINGER electronic Gmbh, Regenstauf, Germany | ||
| Sedacom software | Bioseb, France | ||
| Strain gauge | PowerLab/8SP; ADInstruments |
Ссылки
- Calbet, J. A., et al. Determinants of maximal oxygen uptake in severe acute hypoxia. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 284 (2), 291-303 (2003).
- Hanada, A., Sander, M., González-Alonso, J. Human skeletal muscle sympathetic nerve activity, heart rate and limb haemodynamics with reduced blood oxygenation and exercise. The Journal of Physiology. 551, 635-647 (2003).
- Casey, D. P., Joyner, M. J. Compensatory vasodilatation during hypoxic exercise: mechanisms responsible for matching oxygen supply to demand. The Journal of Physiology. 590 (24), 6321-6326 (2012).
- Casey, D. P., et al. Nitric oxide contributes to the augmented vasodilatation during hypoxic exercise. The Journal of Physiology. 588, 373-385 (2010).
- Girard, O., Brocherie, F., Millet, G. P. Effects of Altitude/Hypoxia on Single- and Multiple-Sprint Performance: A Comprehensive Review. Sports Medicine. 47 (10), 1931-1949 (2017).
- Faiss, R., Girard, O., Millet, G. P. Advancing hypoxic training in team sports: from intermittent hypoxic training to repeated sprint training in hypoxia. British Journal of Sports Medicine. 47, 45-50 (2013).
- Brocherie, F., Girard, O., Faiss, R., Millet, G. P. Effects of Repeated-Sprint Training in Hypoxia on Sea-Level Performance: A Meta-Analysis. Sports Medicine.(Auckland, N.Z). 47 (8), 1651-1660 (2017).
- Brocherie, F., et al. Repeated maximal-intensity hypoxic exercise superimposed to hypoxic residence boosts skeletal muscle transcriptional responses in elite team-sport athletes. Acta Physiologica. 222 (1), 12851 (2018).
- Pellegrin, M., et al. New insights into the vascular mechanisms underlying the beneficial effect of swimming training on the endothelial vasodilator function in apolipoprotein E-deficient mice. Atherosclerosis. 190 (1), 35-42 (2007).
- Picard, M., et al. Acute exercise remodels mitochondrial membrane interactions in mouse skeletal muscle. Journal of Applied Physiology. 115 (10), 1562-1571 (2013).
- Ayachi, M., Niel, R., Momken, I., Billat, V. L., Mille-Hamard, L. Validation of a Ramp Running Protocol for Determination of the True VO2max in Mice. Frontiers in Physiology. 7, (2016).
- Pellegrin, M., et al. Running Exercise and Angiotensin II Type I Receptor Blocker Telmisartan Are Equally Effective in Preventing Angiotensin II-Mediated Vulnerable Atherosclerotic Lesions. Journal of Cardiovascular Pharmacology and Therapeutics. 22 (2), (2016).
- Semin, I., Acikgöz, O., Gönenc, S. Antioxidant enzyme levels in intestinal and renal tissues after a 60-minute exercise in untrained mice. Acta Physiologica Hungarica. 88 (1), 55-62 (2001).
- Cho, J., et al. Treadmill Running Reverses Cognitive Declines due to Alzheimer Disease. Medicine & Science in Sports & Exercise. 47 (9), 1814-1824 (2015).
- Schill, K. E., et al. Muscle damage, metabolism, and oxidative stress in mdx mice: Impact of aerobic running. Muscle & Nerve. 54 (1), 110-117 (2016).
- Cho, J., Kim, S., Lee, S., Kang, H. Effect of Training Intensity on Nonalcoholic Fatty Liver Disease. Medicine & Science in Sports & Exercise. 47 (8), 1624-1634 (2015).
- Sabatier, M. J., Redmon, N., Schwartz, G., English, A. W. Treadmill training promotes axon regeneration in injured peripheral nerves. Experimental Neurology. 211 (2), 489-493 (2008).
- Rolim, N., et al. Aerobic interval training reduces inducible ventricular arrhythmias in diabetic mice after myocardial infarction. Basic Research in Cardiology. 110 (4), 44 (2015).
- Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database Available from: https://www.jove.com/science-education/10246/blood-withdrawal-i (2018)
- Peyter, A. -. C., et al. Muscarinic receptor M1 and phosphodiesterase 1 are key determinants in pulmonary vascular dysfunction following perinatal hypoxia in mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 295 (1), 201-213 (2008).
- Faiss, R., et al. Significant Molecular and Systemic Adaptations after Repeated Sprint Training in Hypoxia. PLOS ONE. 8 (2), (2013).
- Faiss, R., et al. Repeated Double-Poling Sprint Training in Hypoxia by Competitive Cross-country Skiers. Medicine & Science in Sports & Exercise. 47 (4), 809-817 (2015).
- Billat, V. L., Mouisel, E., Roblot, N., Melki, J. Inter- and intrastrain variation in mouse critical running speed. Journal of Applied Physiology. 98 (4), 1258-1263 (2005).
- Ferguson, S. K., et al. Effects of living at moderate altitude on pulmonary vascular function and exercise capacity in mice with sickle cell anemia. The Journal of Physiology. , (2018).
- Lightfoot, J. T., Turner, M. J., Debate, K. A., Kleeberger, S. R. Interstrain variation in murine aerobic capacity. Medicine & Science in Sports & Exercise. 33 (12), (2001).
- Wojewoda, M., et al. Running Performance at High Running Velocities Is Impaired but V'O2max and Peripheral Endothelial Function Are Preserved in IL-6-/- Mice. PLOS ONE. 9 (2), (2014).
- Muller, C. R., Américo, A. L. V., Fiorino, P., Evangelista, F. S. Aerobic exercise training prevents kidney lipid deposition in mice fed a cafeteria diet. Life Sciences. 211, 140-146 (2018).
- Petrosino, J. M., et al. Graded Maximal Exercise Testing to Assess Mouse Cardio-Metabolic Phenotypes. PLOS ONE. 11 (2), 0148010 (2016).
- Poole, D. C., Jones, A. M. Oxygen Uptake Kinetics. Comprehensive Physiology. , (2012).
- Copp, S. W., Hirai, D. M., Musch, T. I., Poole, D. C. Critical speed in the rat: implications for hindlimb muscle blood flow distribution and fibre recruitment. The Journal of Physiology. 588, 5077-5087 (2010).
- Kregel, K., et al. . Resource Book for the Design of Animal Exercise Protocols. , (2006).
- Lamy, S., et al. Air puffs as refinement of electric shocks for stimulation during treadmill exercise test. The FASEB Journal. 30, 1014 (2016).
- Koenen, K., et al. Sprint Interval Training Induces A Sexual Dimorphism but does not Improve Peak Bone Mass in Young and Healthy Mice. Scientific Reports. 7, (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены