需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠低血压运动的下位强度及血管功能评估
摘要
低氧高强度训练是一种方案, 已被证明能诱导一些患者可能有益的血管适应, 提高运动员的反复冲刺能力。在这里, 我们测试使用该方案训练小鼠的可行性, 并使用体外血管功能评估确定这些血管适应。
摘要
运动训练是保持健康、预防多种慢性病的重要策略。这是国际指南为患有心血管疾病的患者推荐的一线治疗方法, 更具体地说, 是下肢动脉疾病患者的行走能力发生了很大的变化, 影响了患者的行走能力。生活质量。
传统上, 无论是低连续锻炼还是间歇训练都使用过。最近, 海马上训练也被证明可以通过血管适应等机制来提高运动员的表现。这种类型的训练与缺氧的结合可以带来额外的和/或协同作用, 这可能是对某些病理感兴趣的。在这里, 我们描述如何执行在缺氧中的健康小鼠以150% 的最大速度, 使用电动跑步机和低氧盒。我们还展示了如何解剖小鼠, 以检索感兴趣的器官, 特别是肺动脉, 腹主动脉, 和胫骨动脉。最后, 我们展示了如何对被回收的血管进行体外血管功能评估, 并利用等距张力研究。
引言
在缺氧时, 氧 (o2) 的启发分数减少会导致低氧血症 (缺氧时动脉压力降低) 和 o2 输运能力改变1。急性缺氧诱导针对骨骼肌2的交感神经血管收缩活性增加, 并导致相反的 "补偿性" 血管舒张。
在缺氧的亚最大强度下, 相对于正常条件下相同水平的运动, 这种 "补偿性" 血管舒张是公认的3。这种血管扩张是必不可少的, 以确保增加血液流动和维持 (或限制改变) 氧气输送到活跃的肌肉。腺苷被证明在这一反应中没有独立的作用, 而一氧化氮 (NO) 似乎是主要的内皮源, 因为在缺氧期间, 一氧化氮合酶 (NOS) 抑制的增强血管舒张反应明显减弱练习4。在低氧运动中, 其他几种血管活性物质可能在补偿性血管舒张中起到一定作用。
这种增强的低氧运动充血与低氧引起的动脉 o2 含量下降成正比,随着运动强度的增加而增大, 例如在缺氧的剧烈增量运动中。
补偿性血管舒张的 no 介导的成分通过不同的途径调节, 运动强度增加 3: 如果β-肾上腺素能受体-刺激 no 成分在低强度低氧运动中显得最重要, 随着运动强度的增加, NO 的来源对β肾上腺素能机制的依赖程度似乎较低。在高强度低氧运动中, 还有其他刺激 no 释放的候选药物, 如从红细胞和内皮衍生前列腺素释放的 ATP。
缺氧中的上脑组织运动 (在运动生理学文献中称为缺氧重复短跑训练) 是最近的训练方法5 , 为团队或机架运动运动员提供了性能提升。这种方法不同于在最大速度6 (v 最大) 或接近最大速度 6 (v 最大) 时进行的低氧间歇训练, 因为 rsh 在最大强度下进行的训练会导致更大的肌肉灌注和氧合7以及特定的肌肉转录反应 8。有几种机制可以解释 RSH 的有效性: 在缺氧的冲刺过程中, 补偿性血管扩张和相关的较高血流比慢抽搐纤维更有利于快速抽搐纤维。因此, RSH 效率很可能是纤维类型的选择性和强度的依赖。我们推测, 血管系统反应能力的提高在 RSH 中是最重要的。
运动训练已在小鼠中进行了广泛的研究, 包括健康个体和病理小鼠模型9,10.训练老鼠最常见的方法是使用啮齿类动物跑步机, 传统上使用的方案是低强度训练, 最大 v 的 40%-60% (使用增量跑步机测试11确定), 为 30-60分钟 12,13 ,14,15。在16,17小鼠中, 最大强度间歇训练及其对病理的影响得到了广泛的研究;因此, 为小鼠开发了间歇训练运行协议。这些协议通常包括大约10回合运行在80%–100% 的 v 最大在啮齿类动物电动跑步机上, 1-4分钟, 穿插与主动或被动休息16,18。
缺氧中小鼠对在超甲强度 (即在 V最大值以上) 运动的兴趣来自于先前的研究结果, 即微血管血管舒张补偿和间歇性运动性能在以下情况下都有更大的提高。超大比在最大或中等强度。然而, 据我们所知, 无论是在诺莫夏还是缺氧, 都没有关于小鼠超脑组织训练方案的报告。
本研究的第一个目的是测试小鼠超乙酰强度训练的可行性, 以及确定一个可容忍和适当的协议 (强度、冲刺持续时间、恢复等)。第二个目的是评估诺莫夏和缺氧不同训练方案对血管功能的影响。因此, 我们测试的假设是: (1) 小鼠在缺氧时耐受良好的超脑运动, (2) 该协议在诺莫夏的血管功能得到了比运动更大的改善, 但也比低强度的低氧运动更大。
研究方案
当地国家动物护理委员会 (瑞士洛桑省 VÉTÉRINAIRES 协会 (SCAV) 批准了所有实验 (授权 VD3224; 01.06.2017), 所有实验都是根据相关的准则和法规。
1. 动物住房和准备
- 在实验开始前, 6 至8周龄的 C57BL/6J 雄性老鼠在动物设施中至少有1周的时间, 以便这些老鼠适应新的住房条件。出于实际原因, 同一实验组的小鼠通常被安置在一起。
- 将小鼠保持在温控的房间 (22±1°c), 有12小时的光/暗周期, 并能获得食物和水。
2. 跑步机增量试验确定最大速度和性能改进的标准评定
请注意:以下步骤对于完成培训协议至关重要。
- 为老鼠使用机动跑步机, 老鼠可以在多个车道上并排, 有0°的倾斜度, 并安装在车道后面设置为 0.2 mA 的电网, 以鼓励老鼠奔跑。
-
在第一次测试之前, 按照以下程序将小鼠提交到4天的适应跑步机。
- 在第一天, 让老鼠以 4.8/分钟的速度跑10分钟。
- 第2天, 让老鼠在 6点/分钟跑10分钟。
- 第3天, 让老鼠在 7.2 m/min 处跑10分钟。
- 第4天, 让老鼠在 8.4 m/min 处跑10分钟。
-
第5天, 根据下面的协议, 将老鼠提交到一个增量测试中, 以耗尽。
- 让小鼠在 4.8 m/min (在0°倾角下) 加热5分钟。
- 每3分钟将速度提高 1.2 m/min (例如, 4.8 m/min 5分钟, 6 m/min 3分钟, 7.2 m/min 3分钟, 8.5分钟, 8.4/min 等 3分钟), 直到耗尽, 当鼠标在电网上连续花费3秒或受到100次冲击 (由仪器显示)。
- 记下实现的速度 (被视为 V最大值)、持续时间、距离、冲击次数和在网格上花费的总时间。
请注意:通常情况下, V最大值为 28.8±3.7 m/2 分钟。 - 在训练中期, 将小鼠重新提交到此测试, 以便重新调整训练速度, 使其达到更新后的最大 V值(例如, 如果训练协议持续 8周, 然后在4周内进行训练中期增量测试。在这种情况下, 用测试取代其中一项预定的培训), 并在研究结束时再次这样做, 以评估业绩的改善情况。
- 在此测试前后实施48小时的休息时间。
请注意:所有的增量测试都是在上午进行的。
3. 缺氧环境
- 对于缺氧的训练课程, 将跑步机放在连接到气体混合器的缺氧箱 (图 1) 中。使用校准的血氧仪定期控制盒子中氧气的环境分数 (fio 2 [即缺氧水平])。
- 将气体混合器设置在100% 的氮气 (n2) 上, 并使用血氧仪验证缺氧水平。一旦 Fio2 = 0.13, 将气体混合器的参数从 100% n2 改为13% o 2.
- 为了避免长时间被动暴露在缺氧环境中, 将小鼠放在一个临时较小的笼子里, 有垃圾和浓缩, 一旦达到 fio2 = 0.13, 就迅速将其放在盒子里。在将保持架放入时, 验证环境仍处于 13% o2;如果没有, 请重新调整它。
- 在训练过程中定期验证 o2 的水平, 以确保它保持在 Fi i2= 0.13±0.002.
4. 规范环境
- 对于诺莫夏的训练课程, 请将跑步机放在低氧箱中, 但请卸下手套, 以便有环境空气 (Fio2 = 0.21)。其目的是在缺氧的情况下重建与老鼠相同的训练环境。
5. 自杀强度训练
-
将小鼠放置在跑步机中的单个车道上 (在0°倾角下), 并将其提交给以下协议。
- 让小鼠在 4.8 m/min 热身 5分钟, 然后在 9 m/min 加热5分钟。
- 将冲刺速度设置为先前确定的 V最大值的150%。
请注意:通常情况下, 冲刺速度为 42.1±5.5 m/min。 - 训练老鼠进行四套 5x10 s 冲刺, 每次冲刺之间休息20秒。联组休息时间为 5分钟 (图 2)。
请注意:如果培训课程的总工作量需要与其他培训组的工作量相匹配, 请添加冷却时间。
- 每周进行3次培训, 最好在两次培训之间进行48小时。
- 用棉签作为电击的补充方法, 以鼓励老鼠奔跑。将棉签放在车道顶部的缝隙中, 在鼠标和电网之间, 当鼠标到达跑步机的背面时, 轻轻地推动它。这将避免电击的传递, 并刺激老鼠以更柔软的方式运行。
6. 低强度训练
-
将小鼠放置在跑步机中的单个车道上 (在0°倾角下), 并将其提交给以下协议。
- 让小鼠在 4.8 m/min 热身 5分钟, 然后在 7.2 m/min 加热5分钟。
- 将连续运行会话的速度设置为先前确定的 V最大值的40%。
请注意:通常情况下, 连续运行速度为 9.9 m/min。 - 训练老鼠40分钟。
- 每周进行3次培训, 最好在两次培训之间进行48小时。
- 用棉签作为电击的补充方法, 以鼓励老鼠奔跑。
7. 小鼠安乐死和器官摘除
- 在训练协议结束时和最后一次增量试验后至少 24小时, 使用异氟醚 (在 O2中为 4%-5% 诱导麻醉, 在 100% o2 中引入 1%-2%, 以维持麻醉), 将小鼠麻醉至诱导室.使用爪缩回反射确认适当的麻醉 (牢固地捏动物的爪子; 当动物对刺激没有反应时, 麻醉被认为是适当的)。
- 使用 25 G 针, 进行经皮心脏穿刺, 以收集最大血量, 如前面所述19。
- 通过用圆尖剪刀切开腹部第一层皮肤, 并拉扯切口两侧 (朝向头部和尾部), 进行颈椎脱位并去除小鼠的皮肤。
- 用薄点剪刀穿过老鼠左侧胸腔下的腹膜, 到达脾脏, 并在需要时提取。
请注意:必要时解剖出肌肉。 -
解剖出肺动脉。
- 使用小剪刀和钳子, 取出胸腔笼, 清除心肺区域。
- 用 "自闭" 推子, 尽可能靠近先端, 轻轻拉, 拉长主动脉弓和肺动脉的底部。
- 用右手, 在肺动脉和主动脉下插入弯曲的推子, 然后将推子向后移动一点, 只容纳肺动脉 (图 3)。
- 用左手插入另一对子, 用右手代替拿着的子。
- 在右手用锋利的直剪刀, 一边尽可能靠近心脏, 一边尽可能远的地方解剖肺动脉。
请注意:哪只手拿着哪只乐器并不重要, 尽管我们发现用右手切割比用左手切割更容易。 - 将其放入一个2毫升的管与冷磷酸盐缓冲盐 (PBS) 缓冲和保持在冰上。
-
进行全身灌注。
- 在小鼠右下肢的顶部, 使用推子清除内侧右胫骨动脉下到右股动脉 (腹股沟韧带下)。使用锋利的直剪刀, 使股动脉充分切割。
- 在心脏左心室插入装有冷 PBS 的5毫升 25 g 注射器, 然后轻轻注射冷 PBS, 从血管中取出剩余的血液。
请注意:由于肺动脉的提取, 有可能是 PBS 不循环的所有方式到切口。
- 使用推拿器, 尽可能彻底地将主动脉周围的软组织从左腹股沟和右腹股沟韧带取出到心脏。
请注意:如有必要, 可以提取心脏进行进一步分析。 - 使用推拿子和微剪刀, 解剖心脏到臀部外动脉的最低点 (左和右两腿), 并将完全解剖的部分在一个10厘米直径的盘子与冷 PBS。
- 使用推子和/或微剪刀, 通过轻轻地将主动脉和动脉周围的脂肪从血管中轻轻拉或割开, 完成对其的清洁。
- 用微剪刀, 在左、右的胫骨动脉分叉处割断左胫骨动脉, 并将其存放作进一步分析。
- 使用微剪刀, 切断左肾动脉下的腹主动脉, 并将提取的血管放置在冷 PBS 缓冲液在冰上 (图 4)。
- 将剩余的清洁血管, 从主动脉弓到左肾动脉右上方, 存放, 以便进一步分析。
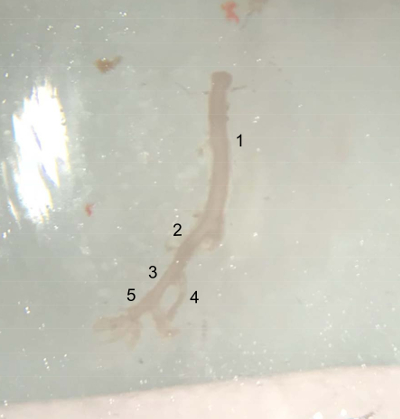
图 4: 解剖船只的图片.从腹主动脉顶部 (左肾动脉下方) 提取血管至右胫骨动脉末端, 准备放置在冰上的冷 PBS 缓冲液中。(1) 腹主动脉。(2) 右髋关节动脉。(3) 外侧胫骨动脉。(4) 胫骨内动脉。(5) 股动脉。请点击这里查看此图的较大版本.
8. 体内血管功能评估
请注意:洗涤对应于空腔和加满房间与 Krebs。
- 根据前面描述的协议20, 将孤立的肺动脉、腹主动脉和右胫骨动脉段切割成 1.0-2.0 mm 长的血管环, 并将每个环安装在两个直径 0.1 mm 的马刺上, 通过管腔。
- 将血管环悬浮在垂直器官腔中, 其中装有10毫升改性的克瑞格-林格碳酸氢盐溶液 (1118.3 mM Ncl, 4.7 mM KCl, 2.5 mM Ccl2, 1.2 mm MgSO4, 1.2 mm kh h 2 po 4,25.0mm nahco3和 11.1 mm葡萄糖) 保持在 37°c, 并加气与 95% o 2-2% 二氧化碳 (ph 7.4 ).一个马刺锚定在器官室的底部, 另一个被连接到应变片, 以克为指标测量等距力。
- 使血管达到最佳的静息张力: 肺动脉的环拉伸至 0.5 g, 腹腔动脉1.5 克, 腹主动脉2克, 20分钟后进行平衡清洗。重复拉伸等隔水洗步骤1x。
- 为了测试船只的可行性, 将环与235μl 的 KCl (10-1 m ) 收缩 10分钟, 再清洗 10分钟, 并再次与235Μl 的 kcl (10-1 m) 收缩约 20分钟,直到到达高原。
- 再次清洗血管 10分钟, 并添加588.4μl 的消炎痛 (10-5 m) (环氧合酶活性抑制剂) 至少 20分钟, 以避免可能干扰内源性前列腺素。
- 添加 10-9 (10Μl) 至10-4 m (或10-9 至 10-5 m 的总剂量----苯乙胺 (phe) ; 10-9 m 以上所有浓度为 9μl ) 以收缩血管。
- 最后剂量后, 等待约 1小时, 直到血管达到相对稳定的收缩状态 (高原)。
- 添加与内皮依赖性的血管扩张剂乙酰胆碱 (ACh) 的累积剂量, 从10-9到 10-4 m (10-9 m 为 588.4条. l, 所有浓度超过 10-9 m 的累积剂量为12.6μl 和 40μl), 以诱导出一氧化氮氧化物 (NO) 介导的放松。
- 在松弛曲线的末端, 清洗容器 10分钟, 并添加 588.4条 Xl 的消炎痛 (10-5 m), 以及 184μl 的 Ng-nit-l-精氨酸 (nla, 10-4 m),这是 nos 的抑制剂, 至少20分钟。
- 将血管与独特剂量为10μl 的 Phe (肺动脉为 10-5和10-4 m, 腹主动脉和腹腔动脉为 10-4 m) 再收缩 1小时, 以诱导相对稳定的收缩.
- 加入独特剂量为40μl 的 ach (10-4 m), 直到到达高原。
- 再次清洗血管 10分钟, 然后加入588.4μl 的消炎痛 (10-5 m) 和184ΜL 的 nla (10-4 m) 20分钟。
- 用10μl 的 Phe (10-5和10-4 m) 将船舶承包1小时。
- 添加 no 供体二乙胺 (dea)/no的累积剂量 (10-9 [584条-l] 至 10-4 m [所有浓度超过 10-9M]), 以评估与内皮独立的 no诱导松弛.
- 在实验结束时, 将容器储存在液氮中, 以便将来根据需要进行分析。
结果
据我们所知, 本研究首次描述了小鼠诺莫夏和缺氧的超脑度强度训练方案。在这个协议中, 老鼠在每次冲刺之间跑了四组 5 1 s 冲刺, 恢复了 2 0。这些套被穿插在5分钟的恢复期。目前尚不清楚这些老鼠是否有能力维持这样的协议并适当地完成它。然而, 根据图 5, 接受上血强度训练的小鼠体重增加与诺莫夏和缺氧小鼠的体重增加相似。
讨论
这项研究的第一个目的是评估小鼠低氧高强度训练的可行性, 并确定该协议的适当特征, 这些特征对小鼠的耐受性很高。有目的, 由于没有数据使用超大鼠 (即超过 V 最大值) 的小鼠强度训练, 我们不得不根据以前与运动员开发的协议进行试验, 其中包括四到五套五套全能冲刺 (约为V最大值), 穿插了20秒的活动恢复, 交错活动恢复为 5分21秒,22...
披露声明
作者没有什么可透露的。
致谢
作者要感谢来自洛桑大学医院 (CHUV) 机械车间的达尼洛·古比安和斯蒂芬·阿勒图斯帮助创建了低氧装置。作者还要感谢黛安·马卡布里和梅勒妮·西皮翁在训练动物方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Cotton swab | Q-tip | ||
| Gas mixer Sonimix 7100 | LSI Swissgas, Geneva, Switzerland | Gas-flow: 10 L/min and 1 L/min for O2 and CO2, respectively | |
| Hypoxic Box | Homemade | Made in Plexiglas | |
| Motorized rodents treadmill Panlab LE-8710 | Bioseb, France | ||
| Oximeter Greisinger GOX 100 | GREISINGER electronic Gmbh, Regenstauf, Germany | ||
| Sedacom software | Bioseb, France | ||
| Strain gauge | PowerLab/8SP; ADInstruments |
参考文献
- Calbet, J. A., et al. Determinants of maximal oxygen uptake in severe acute hypoxia. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 284 (2), 291-303 (2003).
- Hanada, A., Sander, M., González-Alonso, J. Human skeletal muscle sympathetic nerve activity, heart rate and limb haemodynamics with reduced blood oxygenation and exercise. The Journal of Physiology. 551, 635-647 (2003).
- Casey, D. P., Joyner, M. J. Compensatory vasodilatation during hypoxic exercise: mechanisms responsible for matching oxygen supply to demand. The Journal of Physiology. 590 (24), 6321-6326 (2012).
- Casey, D. P., et al. Nitric oxide contributes to the augmented vasodilatation during hypoxic exercise. The Journal of Physiology. 588, 373-385 (2010).
- Girard, O., Brocherie, F., Millet, G. P. Effects of Altitude/Hypoxia on Single- and Multiple-Sprint Performance: A Comprehensive Review. Sports Medicine. 47 (10), 1931-1949 (2017).
- Faiss, R., Girard, O., Millet, G. P. Advancing hypoxic training in team sports: from intermittent hypoxic training to repeated sprint training in hypoxia. British Journal of Sports Medicine. 47, 45-50 (2013).
- Brocherie, F., Girard, O., Faiss, R., Millet, G. P. Effects of Repeated-Sprint Training in Hypoxia on Sea-Level Performance: A Meta-Analysis. Sports Medicine.(Auckland, N.Z). 47 (8), 1651-1660 (2017).
- Brocherie, F., et al. Repeated maximal-intensity hypoxic exercise superimposed to hypoxic residence boosts skeletal muscle transcriptional responses in elite team-sport athletes. Acta Physiologica. 222 (1), 12851 (2018).
- Pellegrin, M., et al. New insights into the vascular mechanisms underlying the beneficial effect of swimming training on the endothelial vasodilator function in apolipoprotein E-deficient mice. Atherosclerosis. 190 (1), 35-42 (2007).
- Picard, M., et al. Acute exercise remodels mitochondrial membrane interactions in mouse skeletal muscle. Journal of Applied Physiology. 115 (10), 1562-1571 (2013).
- Ayachi, M., Niel, R., Momken, I., Billat, V. L., Mille-Hamard, L. Validation of a Ramp Running Protocol for Determination of the True VO2max in Mice. Frontiers in Physiology. 7, (2016).
- Pellegrin, M., et al. Running Exercise and Angiotensin II Type I Receptor Blocker Telmisartan Are Equally Effective in Preventing Angiotensin II-Mediated Vulnerable Atherosclerotic Lesions. Journal of Cardiovascular Pharmacology and Therapeutics. 22 (2), (2016).
- Semin, I., Acikgöz, O., Gönenc, S. Antioxidant enzyme levels in intestinal and renal tissues after a 60-minute exercise in untrained mice. Acta Physiologica Hungarica. 88 (1), 55-62 (2001).
- Cho, J., et al. Treadmill Running Reverses Cognitive Declines due to Alzheimer Disease. Medicine & Science in Sports & Exercise. 47 (9), 1814-1824 (2015).
- Schill, K. E., et al. Muscle damage, metabolism, and oxidative stress in mdx mice: Impact of aerobic running. Muscle & Nerve. 54 (1), 110-117 (2016).
- Cho, J., Kim, S., Lee, S., Kang, H. Effect of Training Intensity on Nonalcoholic Fatty Liver Disease. Medicine & Science in Sports & Exercise. 47 (8), 1624-1634 (2015).
- Sabatier, M. J., Redmon, N., Schwartz, G., English, A. W. Treadmill training promotes axon regeneration in injured peripheral nerves. Experimental Neurology. 211 (2), 489-493 (2008).
- Rolim, N., et al. Aerobic interval training reduces inducible ventricular arrhythmias in diabetic mice after myocardial infarction. Basic Research in Cardiology. 110 (4), 44 (2015).
- Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database Available from: https://www.jove.com/science-education/10246/blood-withdrawal-i (2018)
- Peyter, A. -. C., et al. Muscarinic receptor M1 and phosphodiesterase 1 are key determinants in pulmonary vascular dysfunction following perinatal hypoxia in mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 295 (1), 201-213 (2008).
- Faiss, R., et al. Significant Molecular and Systemic Adaptations after Repeated Sprint Training in Hypoxia. PLOS ONE. 8 (2), (2013).
- Faiss, R., et al. Repeated Double-Poling Sprint Training in Hypoxia by Competitive Cross-country Skiers. Medicine & Science in Sports & Exercise. 47 (4), 809-817 (2015).
- Billat, V. L., Mouisel, E., Roblot, N., Melki, J. Inter- and intrastrain variation in mouse critical running speed. Journal of Applied Physiology. 98 (4), 1258-1263 (2005).
- Ferguson, S. K., et al. Effects of living at moderate altitude on pulmonary vascular function and exercise capacity in mice with sickle cell anemia. The Journal of Physiology. , (2018).
- Lightfoot, J. T., Turner, M. J., Debate, K. A., Kleeberger, S. R. Interstrain variation in murine aerobic capacity. Medicine & Science in Sports & Exercise. 33 (12), (2001).
- Wojewoda, M., et al. Running Performance at High Running Velocities Is Impaired but V'O2max and Peripheral Endothelial Function Are Preserved in IL-6-/- Mice. PLOS ONE. 9 (2), (2014).
- Muller, C. R., Américo, A. L. V., Fiorino, P., Evangelista, F. S. Aerobic exercise training prevents kidney lipid deposition in mice fed a cafeteria diet. Life Sciences. 211, 140-146 (2018).
- Petrosino, J. M., et al. Graded Maximal Exercise Testing to Assess Mouse Cardio-Metabolic Phenotypes. PLOS ONE. 11 (2), 0148010 (2016).
- Poole, D. C., Jones, A. M. Oxygen Uptake Kinetics. Comprehensive Physiology. , (2012).
- Copp, S. W., Hirai, D. M., Musch, T. I., Poole, D. C. Critical speed in the rat: implications for hindlimb muscle blood flow distribution and fibre recruitment. The Journal of Physiology. 588, 5077-5087 (2010).
- Kregel, K., et al. . Resource Book for the Design of Animal Exercise Protocols. , (2006).
- Lamy, S., et al. Air puffs as refinement of electric shocks for stimulation during treadmill exercise test. The FASEB Journal. 30, 1014 (2016).
- Koenen, K., et al. Sprint Interval Training Induces A Sexual Dimorphism but does not Improve Peak Bone Mass in Young and Healthy Mice. Scientific Reports. 7, (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。