Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Supramaximalen hypoxischer Intensität und Gefäßfunktion Bewertung bei Mäusen
In diesem Artikel
Zusammenfassung
High-Intensity-Training in Hypoxie ist ein Protokoll, die potenziell vorteilhaft bei einigen Patienten vaskuläre Anpassungen zu induzieren und Athleten zu verbessern Sprint Fähigkeit wiederholt bewährt hat. Hier testen wir die Machbarkeit der Ausbildung Mäuse verwenden, das Protokoll und die vaskulären Anpassungen mit ex-Vivo Gefäßfunktion Bewertung zu identifizieren.
Zusammenfassung
Übung-Training ist eine wichtige Strategie zur Erhaltung der Gesundheit und Prävention vieler chronische Krankheiten. Es ist die erste Linie der Behandlung von internationalen Leitlinien empfohlen für Patienten mit Herz-Kreislauf-Krankheiten, genauer gesagt, wo die Patienten zu Fuß Kapazität erheblich verändert ist, Extremität Arterie Krankheiten, niedrigere Auswirkungen auf ihre Verbesserung der Lebensqualität.
Traditionell haben niedrige kontinuierliche Übung und Intervall-Training eingesetzt. Vor kurzem, nachweislich supramaximalen Training auch Athleten Leistungen über vaskuläre Anpassungen, unter anderen Mechanismen zu verbessern. Die Kombination dieser Art von Training mit Hypoxie bringen könnte eine zusätzliche und/oder synergistische Wirkung, die für bestimmte Krankheiten von Interesse sein könnten. Hier beschreiben wir, wie supramaximalen Intensität Trainingseinheiten in Hypoxie auf gesunde Mäuse mit 150 % ihre maximale Geschwindigkeit ausführen ein motorisiertes Laufband mit einer hypoxischen Box. Wir auch zeigen, wie Sie die Maus zu sezieren, um Abrufen von Organen von Interesse, besonders der Lungenarterie, der Bauchschlagader und der Beckenkamm Arterie. Schließlich zeigen wir, wie ex-Vivo Gefäßfunktion Bewertung auf den abgerufenen Schiffen durchführen mit isometrischer Anspannung Studien.
Einleitung
In Hypoxie führt die verminderte inspiriert Teil Sauerstoff (O2) zu Hypoxämie (gesenkten Blutdruck in Hypoxie) und eine veränderte O2 Transport Kapazität1. Akute Hypoxie induziert eine erhöhte sympathische Vasokonstriktor Tätigkeit richtet sich an Skelettmuskulatur2 und eine gegen "Ausgleichsmaßnahmen" Vasodilatation.
Bei submaximalen Intensität in Hypoxie ist dieser "Ausgleichsmaßnahmen" Vasodilatation bezogen auf das gleiche Maß an Übung inklusieve Bedingungen, , gut etablierte3. Diese Vasodilatation gilt, sorgen für einen erweiterten Blutfluss und Wartung (oder die Änderung zu begrenzen) der Sauerstoffzufuhr zu den aktiven Muskeln. Adenosin zeigte sich nicht haben eine eigenständige Rolle in dieser Antwort, während Stickstoffmonoxid (NO) die endotheliale Primärquelle scheint, da erhebliche Abstumpfung der augmented Gefäßerweiterung mit Stickoxid-Synthase (NOS) Hemmung während hypoxischen gemeldet wurde Übung4. Einige andere vasoaktive Substanzen spielen wahrscheinlich eine Rolle in der kompensatorischen Vasodilatation während eines hypoxischen Trainings.
Diese erhöhten hypoxischen Bewegung Hyperämie ist proportional zur Hypoxie-induzierten Herbst im arteriellen O2 -Gehalt und ist größer als die Übung Intensität zunahmen, zum Beispiel während intensivem inkrementelle Training in Hypoxie.
Die NO-vermittelten Bestandteil der kompensatorischen Gefäßerweiterung ist über verschiedene Wege mit zunehmender Übung Intensität3geregelt: Wenn β-adrenergen Rezeptor-keine Komponente angeregt wird während des niedrigen hypoxischen Trainings von größter Bedeutung , die Quelle kein Beitrag zur kompensatorische Dilatation scheint weniger abhängig von β-adrenerge Mechanismen wie die Trainingsintensität erhöht. Es gibt andere Kandidaten zur Stimulation keine Freigabe während des hypoxischen Trainings höhere Intensität, wie ATP aus Erythrozyten und/oder endotheliale abgeleitet Prostaglandine freigesetzt.
Supramaximalen Übung in Hypoxie (wiederholte Sprint Training in Hypoxie [RSH] in der Übung Physiologie Literatur genannt) ist ein den letzten Training Methode5 bietet Leistungssteigerung im Mannschaftssport oder Schläger Spieler. Diese Methode unterscheidet sich von Intervall-training in Hypoxie durchgeführt oder in der Nähe von max. Geschwindigkeit6 (Vmax) da RSH durchgeführt maximaler Intensität führt zu eine stärkere Muskel-Durchblutung und Sauerstoffversorgung7 und bestimmten Muskel transkriptionelle Antworten-8. Mehrere Mechanismen sind vorgeschlagen worden, um die Wirksamkeit der RSH zu erklären: während der Sprints in Hypoxie, die kompensatorische Vasodilatation und damit verbundenen höheren Blutfluss würden profitieren die Fast-Twitch-Fasern über die slow-Twitch-Fasern. Infolgedessen dürfte RSH Effizienz Fasertyp selektive und Intensität abhängig sein. Wir spekulieren, dass die verbesserte Reaktionsfähigkeit des Gefäßsystems in RSH von größter Bedeutung ist.
Übung Schulung wurde ausgiebig in den Mäusen, in gesunden und pathologischen Maus Modelle9,10untersucht. Der häufigste Weg, um Mäuse zu trainieren ist ein Nagetier Laufband verwenden und die traditionell verwendete Therapie ist geringer Intensität Training, bei 40 – 60 % der Vmax (anhand eines inkrementellen Laufband Test11), für 30 – 60 min.12,13 ,14,15. Maximale Intensität Intervall-Training und ihre Auswirkungen auf Pathologien sind weit verbreitet in Mäusen16,17untersucht worden; So wurden Intervalltraining ausgeführten Protokolle für Mäuse entwickelt. Diese Protokolle bestehen meist aus ca. 10 Kämpfe laufen bei 80 – 100 % der V-max auf einem Nagetier motorisiertes Laufband, für 1 – 4 min, durchsetzt mit aktiven oder passiven Rest16,18.
Das Interesse an Mäusen mit supramaximalen Intensität (d. h. über die Vmax) in Hypoxie Ausübung kommt aus früheren Ergebnissen, denen die mikrovaskuläre gefäßerweiternde Vergütung und die intermittierende Trainingsleistung mehr erhöhte auf beides supramaximalen als maximal- bzw. mäßiger Intensität. Allerdings gibt es nach unserer Kenntnis keinen vorherigen Bericht von einer supramaximalen Trainingsprotokoll bei Mäusen, entweder in Normoxiezustand oder in Hypoxie.
Das erste Ziel der vorliegenden Studie war es, die Machbarkeit der supramaximalen Intensity Training bei Mäusen und die Bestimmung eines erträglich und angemessene Protokolls (Intensität, Sprintdauer, Erholung usw.) zu testen. Das zweite Ziel war, die Bewertung der Auswirkungen der verschiedenen Trainingsplan in Normoxiezustand und Hypoxie auf die Gefäßfunktion. Daher testen wir die Hypothese, dass (1) Mäuse vertragen supramaximalen Übung in Hypoxie und (2) dieses Protokoll eine größere Verbesserung der Gefäßfunktion als Übung in Normoxiezustand, sondern auch als Übung in Hypoxie bei niedriger Intensität induziert.
Protokoll
Der lokale Zustand Tierbetreuung Ausschuss (Service De La Consommation et des Affaires Vétérinaires [SCAV], Lausanne, Schweiz) genehmigt alle Experimente (Autorisierung VD3224; 01.06.2017) und alle Versuche wurden durchgeführt, im Einklang mit den einschlägigen Richtlinien und Vorschriften.
1. Tierhaltung und Vorbereitung
- Haus 6 bis 8 Wochen alten C57BL/6J männliche Mäuse in der Tierhaltung für mindestens 1 Woche vor Beginn der Experimente in Reihenfolge für die Mäuse zu ihren neuen Wohnverhältnissen zu gewöhnen. Aus praktischen Gründen sind in der Regel Mäuse derselben experimentellen Gruppe zusammen untergebracht.
- Halten Sie die Mäuse in einem temperierten Raum (22 ± 1 ° C) mit einem 12 h hell/dunkel-Zyklus mit ad libitum Zugang zu Nahrungsmitteln und Trinkwasser.
2. Bestimmung der maximalen Geschwindigkeit und Standard Bewertung der Performance-Verbesserung von Laufband-Stufentest
Hinweis: Die folgenden Schritte sind entscheidend für die Trainingsprotokolle abschließen.
- Verwenden Sie ein motorisiertes Laufband für Mäuse wo Mäuse können auf mehrere Bahnen nebeneinander, mit einer 0°-Neigung und mit einem elektrischen Netz montiert auf 0,2 mA auf der Rückseite der Spur, um die Mäuse zu laufen zu fördern.
-
Unterbreiten Sie vor der ersten Prüfung die Mäuse an 4 Tagen der Gewöhnung an das Laufband so das folgende Protokoll.
- Am 1. Tag haben Sie Mäuse mit 4,8 m/min für 10 min laufen.
- Am 2. Tag haben Sie die Mäuse bei 6 m/min für 10 min laufen.
- Am 3. Tag haben Sie die Mäuse mit 7,2 m/min für 10 min laufen.
- Am 4. Tag haben Sie die Mäuse mit 8,4 m/min für 10 min laufen.
-
Am 5. Tag reichen Sie die Mäuse ein Stufentest bis zur Erschöpfung, nach das folgende Protokoll.
- Lassen Sie die Mäuse warm-up für 5 min bei 4,8 m/min (bei einer Neigung von 0°).
- Erhöhen Sie die Geschwindigkeit von 1,2 m/min alle 3 min (z. B. 5 min bei 4,8 m/min, dann 3 Minuten bei 6 m/min, 3 min bei 7,2 m/min, 3 min bei 8,4 m/min, etc.) bis zur Erschöpfung, die erreicht wird, wenn die Maus entweder 3 aufeinanderfolgende Sekunden auf das elektrische Rasterfeld verbringt oder erhält 100 Schocks (angezeigt durch den Apparat).
- Notieren Sie sich die erreichte Geschwindigkeit (als die V-max), Dauer, Entfernung, Anzahl der Schocks, und Gesamt Zeit in der Startaufstellung.
Hinweis: In der Regel Vmax betrug 28,8 ± 3,7 m/min. - Mitte des Trainings erneut die Mäuse zu diesem Test um passen Sie die Geschwindigkeit der Ausbildung auf die aktualisierte Vmax der Mäuse (z.B. wenn das Trainingsprotokoll dauert 8 Wochen und führen Sie dann eine Mitte Training Stufentest 4 Wochen. In diesem Fall ersetzen Sie eine der geplanten Schulungen durch den Test), und wiederholen Sie also am Ende der Studie um Leistungsverbesserungen zu bewerten.
- Implementieren Sie eine 48 h Ruhezeit vor und nach diesem Test.
Hinweis: Die inkrementellen Tests wurden am Morgen durchgeführt.
(3) hypoxischen Umwelt
- Platzieren Sie für das Training in Hypoxie das Laufband im Feld hypoxischen (Abbildung 1) zu einem Gas Mixer verbunden. Verwenden Sie einen kalibrierten Oximeter, um regelmäßig ambient Bruchteil von Sauerstoff (FichO2 [d. h. die Höhe der Hypoxie]) im Feld steuern.
- Der Gasmischer auf 100 % Stickstoff (N2) und verwenden Sie das Oximeter, um das Niveau der Hypoxie zu überprüfen. Einmal FichO2 = 0,13, ändern Sie die Parameter der Gasmischer aus 100 % N2 auf 13 % O2.
- Um längere passive Exposition gegenüber Hypoxie zu vermeiden, legen Sie die Mäuse in einem temporären kleiner Käfig mit Einstreu und Bereicherung und schnell platzieren Sie es im Feld einmal FichO2 = 0,13 erreicht wurde. Stellen Sie sicher, dass die Umwelt immer noch bei 13 % O2 nach dem Aufsetzen des Käfigs in; Wenn dies nicht der Fall ist, passen Sie es.
- Prüfen Sie regelmäßig die Höhe der O2 , im Laufe einer Trainingseinheit um sicherzustellen, dass es FiO2 bleibt = 0,13 ± 0,002.
(4) inklusieve Umwelt
- Für das Training in Normoxiezustand, das Laufband im hypoxischen Feld halten, aber die Handschuhe zu entfernen, so dass es Umgebungsluft (FichO2 = 0,21). Ziel ist es, die gleiche Ausbildung Umwelt als die Mäuse in Hypoxie neu.
5. supramaximalen-Intensity-Training
-
Legen Sie die Mäuse auf einzelne Spuren in der Tretmühle (bei einer 0° Neigung) und legt sie auf das folgende Protokoll.
- Haben Sie die Mäuse 5 min warmlaufen mit 4,8 m/min, gefolgt von 5 min bei 9 m/min.
- Stellen Sie die Geschwindigkeit der Sprints auf 150 % der die zuvor ermittelte Vmax.
Hinweis: In der Regel die Sprint-Geschwindigkeit war 42.1 ± 5,5 m/min. - Trainieren Sie die Mäuse für vier Gruppen von 5 x 10 s Sprints mit 20 s Pause zwischen jedem Sprint. Der interset Rest ist 5 min (Abbildung 2).
Hinweis: Fügen Sie eine Abklingzeit, wenn die gesamte Arbeitsbelastung des Trainings mit einer anderen Ausbildungsgruppe übereinstimmen muss.
- Führen Sie das training 3 X pro Woche, mit vorzugsweise 48 h zwischen den Trainingseinheiten.
- Verwenden Sie Wattestäbchen als eine ergänzende Methode, um elektrische Schläge um zu ermutigen, die Mäuse zu laufen. Legen Sie ein Wattestäbchen in einen Schlitz an der Spitze der Gasse zwischen der Maus und dem elektrischen Netz und schubsen Sie sanft die Maus, wenn sie die Rückseite des Laufbandes erreicht. Die Lieferung der elektrischen Schlag vermeiden wird und die Mäuse laufen in einer weicheren Weise zu stimulieren.
(6) Low-Intensity-Training
-
Legen Sie die Mäuse auf einzelne Spuren in der Tretmühle (bei einer 0° Neigung) und legt sie auf das folgende Protokoll.
- Haben Sie die Mäuse 5 min warmlaufen mit 4,8 m/min, gefolgt von 5 min bei 7,2 m/min.
- Stellen Sie die Geschwindigkeit der kontinuierlich laufenden Sitzung zu 40 % von den vorher festgelegten Vmax.
Hinweis: In der Regel war die kontinuierliche laufende Geschwindigkeit 9,9 m/min. - Die Mäuse für 40 min zu trainieren.
- Führen Sie das training 3 X pro Woche mit vorzugsweise 48 h zwischen den Trainingseinheiten.
- Verwenden Sie Wattestäbchen als eine ergänzende Methode, um elektrische Schläge um zu ermutigen, die Mäuse zu laufen.
(7) Mäuse Euthanasie und Orgel Extraktion
- Am Ende der Ausbildung Protokoll und mindestens 24 Stunden nach dem letzten inkrementellen Test betäuben Sie die Maus in eine Induktion-Kammer mit Isofluran (4 – 5 % O2 induzieren Anästhesie und 1 – 2 % 100 % O2 weiterhin Anästhesie). Ordnungsgemäße Anesthetization mit der Pfote Retraktion Reflex zu bestätigen (fest kneifen des Tieres Pfote; Anästhesie wird richtige betrachtet, wenn das Tier nicht auf den Reiz reagiert).
- Mit einer 25 G Nadel, führen Sie eine perkutane Herzpunktion, um maximale Blutvolumen als zuvor beschriebenen19zu sammeln.
- Führen Sie eine zervikale Dislokation und entfernen Sie die Haut der Maus, indem Sie die erste Schicht der Haut auf dem Bauch mit einer Runde-Tip Schere durchschneiden und auf beiden Seiten des Schnittes (in Richtung der Kopf und die Rute).
- Schnitt durch das Peritoneum unter den Brustkorb auf der linken Seite der Maus mit dünn-Punkt-Tip Schere zu erreichen die Milz und entpacken Sie es, wenn nötig.
Hinweis: Sezieren Sie, Muskeln, wenn nötig. -
Sezieren Sie, der Lungenarterie.
- Mit kleinen Scheren und Pinzetten, entfernen Sie den Brustkorb und die Herz-Lungen-Bereich.
- Kneifen Sie mit "selbstschließend" Pinzette die Herzen so nah wie möglich an die Spitze und ziehen Sie sanft an die Basis der Aortenbogen und der Lungenarterie zu dehnen.
- Mit der rechten Hand, zurück gebogenen Pinzette einfügen unter der Lungenarterie und der Aorta und bewegen Sie die Pinzette ein wenig zu halten Sie nur die Lungenarterie (Abbildung 3).
- Verwenden Sie die linke Hand, um ein weiteres paar Pinzette, die statt mit der rechten Hand ersetzen einzufügen.
- Mit scharfen geraden Microscissors in der rechten Hand, sezieren der Lungenarterie als sehr am Herzen wie möglich auf der einen Seite, und so weit wie möglich auf der anderen Seite.
Hinweis: Es spielt keine Rolle welche Hand welches Instrument hält, obwohl wir es leichter zu schneiden Sie mit der rechten Hand als mit der linken Seite gefunden zu haben. - Legen Sie es in eine 2 mL-Tube mit kalten Phosphat-gepufferte Kochsalzlösung (PBS) Puffer und halten Sie auf dem Eis.
-
Führen Sie eine Ganzkörper-Perfusion.
- Benutzen Sie an der Spitze der rechten unteren Extremität der Maus eine Pinzette um die externe interne rechts Beckenkamm Arterie bis die richtige Femoral Arterie (unter der inguinalen Ligamentum) zu löschen. Mit scharfen geraden Microscissors, machen Sie einen vollen Schnitt in die Femoral Arterie.
- Legen Sie eine 5 mL 25 G Spritze gefüllt mit kaltem PBS in den linken Ventrikel des Herzens und injizieren Sie kalten PBS um das restliche Blut aus den Gefässen entfernen sanft zu.
Hinweis: Durch die Gewinnung von der Lungenarterie ist es möglich, dass PBS nicht ganz nach dem Schnitt im Umlauf ist.
- Mit einer Pinzette, entfernen Sie das weiche Gewebe rund um die Aorta aus dem linken und rechten leisten-Bänder ins Herz so gründlich wie möglich.
Hinweis: Das Herz kann bei Bedarf zur weiteren Analyse extrahiert werden. - Mit Pinzette und Microscissors, sezieren Sie das Herz bis zum niedrigsten Punkt der externen Beckenkamm Arterie (in der linken und rechten Gliedmaßen) und komplett zerlegt-Abschnitt in einem 10 cm-Durchmesser Teller mit kaltem PBS.
- Beenden Sie mit Hilfe einer Pinzette und/oder Microscissors, Reinigung der restlichen Fett um die Aorta und die Arterien durch sanft ziehen oder schneiden es weg von den Schiffen.
- Mit Microscissors, Schneiden der linken Beckenkamm Arterie an der Bifurkation Beckenkamm Arterie links-rechts und zur weiteren Analyse zu speichern.
- Mit Microscissors, Schneiden der Bauchschlagader unter der linken Nierenarterie, und stellen Sie das extrahierte Gefäß in kaltem PBS-Puffer auf dem Eis (Abbildung 4).
- Halten Sie die verbleibenden gereinigte Behälter aus dem Aortenbogen nach rechts oberhalb der linken Nierenarterie im Speicher für die weitere Analyse.
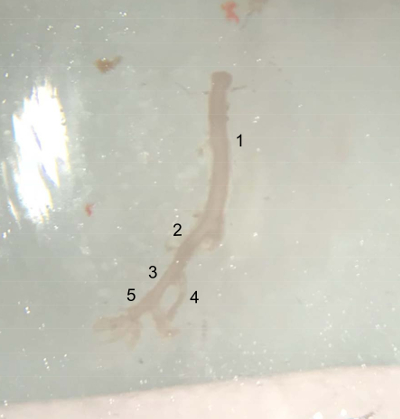
Abbildung 4 : Bild der seziert Schiffe. Extrahierten Schiff von der Spitze der Bauchschlagader (unterhalb der linken Nierenarterie) bis zum Ende der rechten Beckenkamm Arterie, bereit, in kaltem PBS-Puffer auf Eis gelegt werden. (1) Abdominal Aorta. (2) rechts gemeinsame Beckenkamm Arterie. (3) externe Beckenkamm Arterie. (4) innere Beckenkamm Arterie. (5) Femoral Arterie. Bitte klicken Sie hier für eine größere Version dieser Figur.
(8) ex Vivo Gefäßfunktion Bewertung
Hinweis: Eine Wäsche entspricht die Entleerung und Befüllung der Kammern mit Krebs.
- Nach einer zuvor beschriebenen Protokoll20vaskulären Ringe von 1,0-2,0 mm lang die isolierte Lungenarterie, Bauchaorta und rechten Beckenkamm Arterie Segmente geschnitten und jeder Ring auf zwei 0,1 mm Durchmesser Steigbügel durchlief das Lumen zu montieren.
- Aussetzen der Schiff-Ringe in vertikalen Orgel Kammern gefüllt mit 10 mL der modifizierte Krebs-Ringer-Bikarbonat-Lösung (118,3 mM NaCl, 4,7 mM KCl, 2,5 mM CaCl2, 1,2 mM MgSO4, 1,2 mM KH2PO4, 25,0 mM Nahco33und 11,1 mM Glukose) bei 37 ° C gepflegt und belüftet mit 95 % O2-5 % CO2 (pH 7,4). Ein Steigbügel an der Unterseite der Orgel Kammer verankert ist und die ander ist ein DMS zur Messung der isometrischen Kraft in Gramm an.
- Die Schiffe bringen ihre optimale ruhende Spannung: Ringe 0,5 g für die Lungenarterie, 1,5 g für den Beckenkamm Arterie und 2 g für die Bauchaorta zu dehnen, und waschen Sie sie nach einer 20 min Gleichgewichtherstellung. Wiederholen Sie die Dehnung-Gleichgewichtherstellung-Wash die Schritte 1 X.
- Um die Tragfähigkeit der Schiffe zu testen, schrumpfen die Ringe mit 235 µL KCl (10-1 M) für 10 min, waschen Sie sie für weitere 10 min, und Vertrag wieder mit 235 µL KCl (10-1 M) für ca. 20 min bis zum Erreichen einer Hochebene.
- Waschen Sie die Schiffe wieder für 10 min. und fügen Sie 58,4 µL von Indometacin (10-5 M) (Hemmstoff der Cyclooxygenase-Aktivität) für mindestens 20 Minuten hinzu, um mögliche Störungen der endogenen Prostanoide zu vermeiden.
- 10-4 M kumulativen Dosen von Phenylephrin (Phe) aus 10-9 (10 µL) hinzufügen (oder 10-9 bis 10-5 M für die Lungenarterie; 9 µL für alle Konzentrationen über 10-9 M) auf die Gefäße zusammenziehen.
- Warten Sie nach der letzten Dosis von Phe ca. 1 h, bis die Schiffe einen relativ stabilen Kontraktion Zustand (Plateau) zu erreichen.
- Hinzufügen von kumulativen Dosen von der Endothel-abhängigen gefäßerweiternde Acetylcholin (ACh) aus 10-9 bis 10-4 M (58,4 µL für 10-9 M, und abwechselnd 12,6 µL und 40 µL für alle Konzentrationen über 10-9 M), induzieren Salpetersäure Stickoxid (NO)-Entspannung vermittelt.
- Am Ende der Kurve Entspannung waschen Sie die Gefäße für 10 min und fügen Sie 58,4 µL von Indometacin (10-5 M) sowie 184 µL NG-Nitro-L-Arginin (NLA, 10-4 M), die ein Inhibitor von NOS, mindestens 20 min lang ist.
- Vertrag die Schiffe wieder mit einer einmaligen Dosis von 10 µL Phe (10-5 und 10-4 M für die Lungenarterie und 10-4 M für die Bauchaorta und der Beckenkamm Arterie) für 1 h, induzieren eine relativ stabile Kontraktion.
- Fügen Sie eine einmalige Dosis von 40 µL von ACh (10-4 M) bis zum Erreichen einer Hochebene.
- Waschen Sie die Gefäße wieder für 10 min. vor dem Hinzufügen von 58,4 µL von Indometacin (10-5 M) und 184 µL der NLA (10-4 M) für 20 Minuten.
- Zusammenziehen der Gefäße mit 10 µL Phe (10-5 und 10-4 M) 1 h.
- Hinzufügen von kumulativen Dosen (10-9 [58,4 µL] bis 10-4 M [40 µL für alle Konzentrationen über 10-9 M]) kein Spender Diethylamine (DEA) / Nein, bestellen die Endothel-unabhängige NO-induzierte Entspannung zu beurteilen.
- Am Ende des Experiments speichern Sie die Schiffe in flüssigem Stickstoff für zukünftige Analysen bei Bedarf.
Ergebnisse
Nach unserer Kenntnis ist die vorliegende Studie die erste, eine Programm der supramaximalen Intensity Training in Normoxiezustand und Hypoxie bei Mäusen zu beschreiben. In diesem Protokoll lief Mäuse vier Sätzen von fünf 10 s Sprints mit einer 20 s Erholung zwischen jedem Sprint. Die Sätze wurden mit 5 min von Erholungsphasen durchsetzt. Es war unbekannt, ob die Mäuse wäre in der Lage ein solches Protokoll und füllen Sie es richtig. Die Gewichtszunahme der Mäuse die supramaximal...
Diskussion
Das erste Ziel dieser Studie war der Durchführbarkeit des hypoxischen hoch intensives Training bei Mäusen und die ausreichende Eigenschaften des Protokolls zu bestimmen, die von Mäusen gut vertragen würde. Absichtlich, da keine Daten mit supramaximalen (d.h. mehr als V-max)-Intensity-Training bei Mäusen, mussten wir führen Studien basierend auf vorangegangenen Protokolle entwickelt mit Athleten, bestehend aus vier bis fünf Sätze von fünf all-out Sprints (ca. 200 % des Vmax), durchsetzt mit ...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchten danken Danilo Gubian und Stephane Altaus aus der Lausanne University Hospital (CHUV) mechanische Werkstatt für die Unterstützung der hypoxische Einrichtung zu erstellen. Die Autoren möchten auch Diane Macabrey und Melanie Sipion Danke für ihre Hilfe bei der Ausbildung der Tiere.
Materialien
| Name | Company | Catalog Number | Comments |
| Cotton swab | Q-tip | ||
| Gas mixer Sonimix 7100 | LSI Swissgas, Geneva, Switzerland | Gas-flow: 10 L/min and 1 L/min for O2 and CO2, respectively | |
| Hypoxic Box | Homemade | Made in Plexiglas | |
| Motorized rodents treadmill Panlab LE-8710 | Bioseb, France | ||
| Oximeter Greisinger GOX 100 | GREISINGER electronic Gmbh, Regenstauf, Germany | ||
| Sedacom software | Bioseb, France | ||
| Strain gauge | PowerLab/8SP; ADInstruments |
Referenzen
- Calbet, J. A., et al. Determinants of maximal oxygen uptake in severe acute hypoxia. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 284 (2), 291-303 (2003).
- Hanada, A., Sander, M., González-Alonso, J. Human skeletal muscle sympathetic nerve activity, heart rate and limb haemodynamics with reduced blood oxygenation and exercise. The Journal of Physiology. 551, 635-647 (2003).
- Casey, D. P., Joyner, M. J. Compensatory vasodilatation during hypoxic exercise: mechanisms responsible for matching oxygen supply to demand. The Journal of Physiology. 590 (24), 6321-6326 (2012).
- Casey, D. P., et al. Nitric oxide contributes to the augmented vasodilatation during hypoxic exercise. The Journal of Physiology. 588, 373-385 (2010).
- Girard, O., Brocherie, F., Millet, G. P. Effects of Altitude/Hypoxia on Single- and Multiple-Sprint Performance: A Comprehensive Review. Sports Medicine. 47 (10), 1931-1949 (2017).
- Faiss, R., Girard, O., Millet, G. P. Advancing hypoxic training in team sports: from intermittent hypoxic training to repeated sprint training in hypoxia. British Journal of Sports Medicine. 47, 45-50 (2013).
- Brocherie, F., Girard, O., Faiss, R., Millet, G. P. Effects of Repeated-Sprint Training in Hypoxia on Sea-Level Performance: A Meta-Analysis. Sports Medicine.(Auckland, N.Z). 47 (8), 1651-1660 (2017).
- Brocherie, F., et al. Repeated maximal-intensity hypoxic exercise superimposed to hypoxic residence boosts skeletal muscle transcriptional responses in elite team-sport athletes. Acta Physiologica. 222 (1), 12851 (2018).
- Pellegrin, M., et al. New insights into the vascular mechanisms underlying the beneficial effect of swimming training on the endothelial vasodilator function in apolipoprotein E-deficient mice. Atherosclerosis. 190 (1), 35-42 (2007).
- Picard, M., et al. Acute exercise remodels mitochondrial membrane interactions in mouse skeletal muscle. Journal of Applied Physiology. 115 (10), 1562-1571 (2013).
- Ayachi, M., Niel, R., Momken, I., Billat, V. L., Mille-Hamard, L. Validation of a Ramp Running Protocol for Determination of the True VO2max in Mice. Frontiers in Physiology. 7, (2016).
- Pellegrin, M., et al. Running Exercise and Angiotensin II Type I Receptor Blocker Telmisartan Are Equally Effective in Preventing Angiotensin II-Mediated Vulnerable Atherosclerotic Lesions. Journal of Cardiovascular Pharmacology and Therapeutics. 22 (2), (2016).
- Semin, I., Acikgöz, O., Gönenc, S. Antioxidant enzyme levels in intestinal and renal tissues after a 60-minute exercise in untrained mice. Acta Physiologica Hungarica. 88 (1), 55-62 (2001).
- Cho, J., et al. Treadmill Running Reverses Cognitive Declines due to Alzheimer Disease. Medicine & Science in Sports & Exercise. 47 (9), 1814-1824 (2015).
- Schill, K. E., et al. Muscle damage, metabolism, and oxidative stress in mdx mice: Impact of aerobic running. Muscle & Nerve. 54 (1), 110-117 (2016).
- Cho, J., Kim, S., Lee, S., Kang, H. Effect of Training Intensity on Nonalcoholic Fatty Liver Disease. Medicine & Science in Sports & Exercise. 47 (8), 1624-1634 (2015).
- Sabatier, M. J., Redmon, N., Schwartz, G., English, A. W. Treadmill training promotes axon regeneration in injured peripheral nerves. Experimental Neurology. 211 (2), 489-493 (2008).
- Rolim, N., et al. Aerobic interval training reduces inducible ventricular arrhythmias in diabetic mice after myocardial infarction. Basic Research in Cardiology. 110 (4), 44 (2015).
- Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database Available from: https://www.jove.com/science-education/10246/blood-withdrawal-i (2018)
- Peyter, A. -. C., et al. Muscarinic receptor M1 and phosphodiesterase 1 are key determinants in pulmonary vascular dysfunction following perinatal hypoxia in mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 295 (1), 201-213 (2008).
- Faiss, R., et al. Significant Molecular and Systemic Adaptations after Repeated Sprint Training in Hypoxia. PLOS ONE. 8 (2), (2013).
- Faiss, R., et al. Repeated Double-Poling Sprint Training in Hypoxia by Competitive Cross-country Skiers. Medicine & Science in Sports & Exercise. 47 (4), 809-817 (2015).
- Billat, V. L., Mouisel, E., Roblot, N., Melki, J. Inter- and intrastrain variation in mouse critical running speed. Journal of Applied Physiology. 98 (4), 1258-1263 (2005).
- Ferguson, S. K., et al. Effects of living at moderate altitude on pulmonary vascular function and exercise capacity in mice with sickle cell anemia. The Journal of Physiology. , (2018).
- Lightfoot, J. T., Turner, M. J., Debate, K. A., Kleeberger, S. R. Interstrain variation in murine aerobic capacity. Medicine & Science in Sports & Exercise. 33 (12), (2001).
- Wojewoda, M., et al. Running Performance at High Running Velocities Is Impaired but V'O2max and Peripheral Endothelial Function Are Preserved in IL-6-/- Mice. PLOS ONE. 9 (2), (2014).
- Muller, C. R., Américo, A. L. V., Fiorino, P., Evangelista, F. S. Aerobic exercise training prevents kidney lipid deposition in mice fed a cafeteria diet. Life Sciences. 211, 140-146 (2018).
- Petrosino, J. M., et al. Graded Maximal Exercise Testing to Assess Mouse Cardio-Metabolic Phenotypes. PLOS ONE. 11 (2), 0148010 (2016).
- Poole, D. C., Jones, A. M. Oxygen Uptake Kinetics. Comprehensive Physiology. , (2012).
- Copp, S. W., Hirai, D. M., Musch, T. I., Poole, D. C. Critical speed in the rat: implications for hindlimb muscle blood flow distribution and fibre recruitment. The Journal of Physiology. 588, 5077-5087 (2010).
- Kregel, K., et al. . Resource Book for the Design of Animal Exercise Protocols. , (2006).
- Lamy, S., et al. Air puffs as refinement of electric shocks for stimulation during treadmill exercise test. The FASEB Journal. 30, 1014 (2016).
- Koenen, K., et al. Sprint Interval Training Induces A Sexual Dimorphism but does not Improve Peak Bone Mass in Young and Healthy Mice. Scientific Reports. 7, (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten