È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sopramassimale intensità di esercizio Hypoxic e valutazione di funzione vascolare in topi
In questo articolo
Riepilogo
Allenamento di alta intensità nell'ipossia è un protocollo che è stato dimostrato per indurre gli adattamenti vascolari potenzialmente utili in alcuni pazienti e migliorare degli atleti ripetuto capacità di sprint. Qui, verifichiamo la fattibilità dei topi di formazione utilizzando che il protocollo e identificare tali adeguamenti vascolare utilizzando ex vivo valutazione di funzione vascolare.
Abstract
L'allenamento è una strategia importante per mantenere la salute e prevenire molte malattie croniche. È la prima linea di trattamento raccomandato dalle linee guida internazionali per i pazienti affetti da malattie cardiovascolari, in particolare, più bassi delle arterie dell'arto, dove capacità di camminata dei pazienti è notevolmente alterato, che interessano loro qualità della vita.
Tradizionalmente, sono stati utilizzati sia basso continuo esercizio e allenamento. Recentemente, sopramassimale addestramento inoltre è stato indicato per migliorare le prestazioni degli atleti attraverso adattamenti vascolari, tra altri meccanismi. La combinazione di questo tipo di formazione con ipossia potrebbe portare un effetto aggiuntivo e/o sinergico, che potrebbe essere di interesse per alcune patologie. Qui, descriviamo come eseguire sessioni di allenamento di intensità agonistica in ipossia su topi sani al 150% della loro velocità massima, usando una pedana mobile motorizzata ed una scatola ipossica. Mostriamo anche come dissezionare il mouse al fine di recuperare gli organi di interesse, in particolare l'arteria polmonare, aorta addominale e dell'arteria iliaca. Infine, vi mostriamo come eseguire valutazione di funzione vascolare vivo sui vasi Estratto, ex utilizzando studi di tensione isometrica.
Introduzione
In ipossia, la frazione ispirata in diminuzione di ossigeno (O2) conduce a ipossiemia (pressione arteriosa abbassata in ipossia) e un'alterata O2 trasporto capacità1. Ipossia acuta induce un'attività aumentata vasocostrittore simpatico diretta verso il muscolo scheletrico2 e una vasodilatazione 'compensativa' contrari.
Ad intensità submassimale in ipossia, questa vasodilatazione 'compensativa', , riguardante lo stesso livello di esercizio in condizioni di normossia, è affermata3. Questa vasodilatazione è essenziale per garantire un flusso sanguigno aumentata e manutenzione (o per limitare l'alterazione) della consegna dell'ossigeno ai muscoli attivi. Adenosina ha dimostrato di non avere un ruolo indipendente in questa risposta, mentre l'ossido nitrico (NO) sembra la fonte primaria di endoteliale poiché significativo smussamento di vasodilatazione aumentata è stato segnalato con l'ossido nitrico sintasi (NOS) inibizione durante ipossia esercizio4. Parecchie altre sostanze vasoattive probabilmente svolgono un ruolo importante nella vasodilatazione compensatoria durante un esercizio hypoxic.
Questo esercizio hypoxic migliorata l'iperemia è proporzionale alla caduta indotta da ipossia arteriosa O2 contenuto ed è più grande come gli aumenti di intensità di esercizio, ad esempio durante l'esercizio intenso incrementale in ipossia.
Il componente di NO--mediata di vasodilatazione compensatoria è regolato attraverso diversi percorsi con crescente intensità di esercizio3: se β-adrenergici del ricevitore-non stimolata nessun componente appare fondamentale durante l'esercizio a bassa intensità ipossica , la fonte di non contribuire alla dilatazione compensatoria sembra meno dipendente da β-adrenergici meccanismi Man mano che aumenta l'intensità dell'esercizio. Ci sono altri candidati per non stimolare il rilascio di durante l'esercizio hypoxic di maggiore intensità, come ATP rilasciato da eritrociti e/o prostaglandine endothelial-derivato.
Sopramassimale esercizio in ipossia (denominata formazione sprint ripetuti in ipossia [RSH] nella letteratura esercizio Fisiologia) è un recente formazione metodo5 fornire miglioramento delle prestazioni in giocatori di sport di squadra o di racchetta. Questo metodo differisce dall'intervallo di allenamento in ipossia eseguita presso o vicino (Vmax) velocità massima6 poiché RSH eseguita a intensità massima conduce ad una maggiore muscolare perfusione e ossigenazione7 e muscolare specifico trascrizionale le risposte8. Parecchi meccanismi sono stati proposti per spiegare l'efficacia di RSH: durante gli sprint in ipossia, la vasodilatazione compensatoria e flusso di sangue maggiore associato avvantaggerebbe le fibre a contrazione rapida, più che le fibre a contrazione lenta. Di conseguenza, l'efficienza RSH rischia di essere selettivo di fibra-tipo e intensità dipendente. Speculiamo che la reattività del sistema vascolare è fondamentale in RSH.
L'allenamento è stato ampiamente studiato in topi, sia nei soggetti sani e patologici del mouse modelli9,10. Il modo più comune per addestrare topi utilizza un tapis roulant roditore, e il regime tradizionalmente usato è formazione di bassa intensità, al 40 – 60% di Vmax (determinato mediante un test incrementale tapis roulant11), per 30 – 60 min12,13 ,14,15. Allenamento di intensità massima e il suo impatto sulle patologie ampiamente sono stati studiati in topi16,17; così, intervallo di allenamento in esecuzione protocolli per topi è stato sviluppato. Tali protocolli consistono solitamente di circa 10 attacchi dell'esecuzione a 80%-100% di Vmax su una pedana mobile motorizzata del roditore, per 1 – 4 min, intervallate da riposo attivo o passivo16,18.
L'interesse in topi che esercita a intensità agonistica (cioè sopra il Vmax) nell'ipossia deriva dai risultati precedenti che la compensazione vasodilatatoria microvascolare e la prestazione di esercizio intermittente sono entrambi più aumentato a sopramassimale rispetto a massimo e/o moderata intensità. Tuttavia, a nostra conoscenza, non c'è nessun rapporto precedente di un protocollo di allenamento sopramassimale nei topi, in normoxia oppure in ipossia.
Il primo obiettivo del presente studio era di verificare la fattibilità di un allenamento di intensità agonistica in topi e la determinazione di un protocollo tollerabile e adeguata (intensità, durata di sprint, recupero, ecc.). Il secondo obiettivo era di valutare gli effetti del regime di allenamento differenti in normoxia e ipossia sulla funzione vascolare. Di conseguenza, ci prova l'ipotesi che (1) topi tollerano bene esercizio sopramassimale in ipossia, e (2) che questo protocollo induce un miglioramento più grande nella funzione vascolare di esercizio in normoxia, ma anche che esercizio di ipossia a bassa intensità.
Protocollo
Il locale comitato dello stato cura degli animali (Service de la Consommation et des Affaires Vétérinaires [SCAV], Losanna, Svizzera) ha approvato tutti gli esperimenti (autorizzazione VD3224; 01.06.2017) e tutti gli esperimenti sono stati effettuati conformemente alle linee guida e regolamenti.
1. stabulazione e preparazione
- Casa 6-8 settimana C57BL/6J topi del maschio nella struttura animali per almeno 1 settimana prima dell'inizio degli esperimenti in ordine per i topi per abituarsi alle loro nuove condizioni di alloggiamento. Per motivi pratici, topi dello stesso gruppo sperimentale sono generalmente alloggiati insieme.
- Tenere i topi in una camera a temperatura controllata (22 ± 1 ° C) con un ciclo luce/buio di 12 h con ad libitum accesso a cibo e acqua.
2. determinazione della velocità massima e Standard di valutazione del miglioramento delle prestazioni di Test incrementale tapis roulant
Nota: I seguenti passaggi sono fondamentali per completare i protocolli di allenamento.
- Utilizzare una pedana mobile motorizzata per topi dove topi possono essere su corsie multiple uno accanto a altro, con un'inclinazione di 0° e montato con una rete elettrica è impostata da 0,2 mA sul retro la corsia, al fine di incoraggiare i topi per eseguire.
-
Prima della prima prova, presentare i topi a 4 giorni di acclimatazione per il tapis roulant, secondo il seguente protocollo.
- Il giorno 1, avere topi Esegui per 10 min a 4,8 m/min.
- Il giorno 2, hanno i topi Esegui per 10 min a 6 m/min.
- Il giorno 3, hanno i topi Esegui per 10 min a 7,2 m/min.
- Il giorno 4, hanno i topi Esegui per 10 min a 8.4 m/min.
-
Il giorno 5, presentare i topi a un test incrementale ad esaurimento, secondo il seguente protocollo.
- Lasciate che i topi riscaldare per 5 minuti, a 4,8 m/min (a un'inclinazione di 0 °).
- Aumentare la velocità di 1,2 m/min ogni 3 minuti (ad es., 5 min a 4,8 m/min, poi 3 min a 6 m/min, 3 min a 7,2 m/min, 3 min a 8.4 m/min, ecc.) fino ad esaurimento, che si raggiunge quando il mouse passa neanche 3 secondi consecutivi sulla griglia elettrica o riceve 100 colpi (visualizzati dall'apparato).
- Annotare la velocità raggiunta (considerata come Vmax), durata, distanza, numero di urti e tempo totale trascorso sulla griglia di partenza.
Nota: In genere, Vmax era 28,8 ± 3,7 m/min. - Mid-formazione, ripresentare i topi di questo test al fine di riaggiustare le velocità di formazione per l'aggiornamento Vmax dei topi (ad esempio, se il protocollo di allenamento dura 8 settimane, quindi eseguire un test incrementale di Mid-formazione a 4 settimane. In tal caso, sostituire uno dei corsi di formazione pianificate dal test) e farlo di nuovo alla fine dello studio, al fine di valutare i miglioramenti delle prestazioni.
- Implementare un periodo di riposo di 48 h prima e dopo questo test.
Nota: Tutti i test incrementali sono stati effettuati al mattino.
3. ambiente ipossico
- Per le sessioni di allenamento in ipossia, posiziona il tapis roulant nella casella hypoxic (Figura 1) collegato ad un mixer di gas. Utilizzare un ossimetro calibrato per controllare regolarmente l'ambiente frazione di ossigeno (FioO2 [vale a dire, il livello di ipossia]) nella casella.
- Impostare il mixer di gas sul 100% di azoto (N2) e utilizzare il saturimetro per verificare il livello di ipossia. Una volta FioO2 = 0,13, modificare il parametro del miscelatore gas da 100% N2 a 13% O2.
- Al fine di evitare l'esposizione prolungata passiva all'ipossia, posizionare i topi in una gabbia più piccola temporanea con lettiera e arricchimento e rapidamente inserirlo nella casella una volta FioO2 = 0.13 è stato raggiunto. Verificare che l'ambiente è ancora al 13% O2 dopo aver messo la gabbia in; in caso contrario, regolarlo.
- Verificare regolarmente il livello di O2 nel corso di una sessione di allenamento per assicurarsi che rimanga a FiO2 = 0,13 ± 0,002.
4. condizioni di normossia ambiente
- Per le sessioni di formazione in normoxia, mantenere il tapis roulant nella finestra hypoxic, ma rimuovere i guanti in modo che vi sia dell'aria ambiente (FioO2 = 0,21). L'obiettivo è quello di ricreare lo stesso ambiente di formazione come i topi in ipossia.
5. sopramassimale intensità allenamento
-
Posizionare i topi su singole corsie per il tapis roulant (a un'inclinazione di 0°) e li trasmette al seguente protocollo.
- Hanno i topi scaldare per 5 min a 4,8 m/min, seguita da 5 min a 9 m/min.
- Impostare la velocità degli sprint al 150% della determinata in precedenza Vmax.
Nota: In genere, la velocità di sprint è stato 42.1 ± 5,5 m/min. - Addestrare i topi per quattro serie di Sprint di s di 5 x 10 con 20 s di riposo tra ogni sprint. Il resto interset è 5 min (Figura 2).
Nota: Aggiungere un periodo di tempo di recupero se il carico di lavoro totale della sessione di allenamento deve corrispondere a quella di un altro gruppo di formazione.
- Eseguire questo allenamento 3 volte a settimana, con preferibilmente 48h tra sessioni di formazione.
- Utilizzare tamponi di cotone come metodo complementare a scariche elettriche per incoraggiare i topi per eseguire. Posizionare un tampone di cotone in una fessura nella parte superiore della corsia, tra il mouse e la rete elettrica e spingi delicatamente il mouse quando raggiunge il retro del tapis roulant. Questo eviterà la consegna di scosse elettriche e stimolare i topi per eseguire in maniera più morbida.
6. basso-intensità allenamento
-
Posizionare i topi su singole corsie per il tapis roulant (a un'inclinazione di 0°) e li trasmette al seguente protocollo.
- Hanno i topi scaldare per 5 min a 4,8 m/min, seguita da 5 min a 7,2 m/min.
- Impostare la velocità della sessione corrente continua al 40% della determinata in precedenza Vmax.
Nota: In genere, la velocità di esecuzione continua era 9,9 m/min. - I topi per 40 min di treno.
- Eseguire questo allenamento 3 volte a settimana con preferibilmente 48h tra sessioni di formazione.
- Utilizzare tamponi di cotone come metodo complementare a scariche elettriche per incoraggiare i topi per eseguire.
7. topi l'eutanasia e l'estrazione dell'organo
- Alla fine del protocollo di allenamento e almeno 24 ore dopo l'ultimo test incrementale, anestetizzare il mouse in un'aula di induzione utilizzando isoflurano (4 – 5%, O2 per indurre l'anestesia e 1-2% a 100% O2 per mantenere l'anestesia). Confermare la corretta amputate utilizzando il riflesso di retrazione della zampa (saldamente un pizzico della zampa dell'animale; l'anestesia è considerata corretta quando l'animale non reagisce allo stimolo).
- Utilizzando un ago 25 G, eseguire una puntura percutanea cardiaca, per raccogliere sangue massimo volume come descritto in precedenza19.
- Eseguire una dislocazione cervicale e rimuovere la pelle del mouse taglio attraverso il primo strato di pelle sull'addome con forbici di turno-punta e tirando sui due lati dell'incisione (verso la testa e la coda).
- Tagliare attraverso il peritoneo sotto la gabbia toracica sul lato sinistro del mouse con le forbici sottili-punto-punta a raggiungere la milza ed estrarlo se necessario.
Nota: Sezionare i muscoli se necessario. -
Sezionare l'arteria polmonare.
- Utilizzando sia piccole forbici e pinze, rimuovere la gabbia toracica e cancellare l'area di cuore-polmoni.
- Con "chiusura automatica" pinzette, pizzicare il cuore più vicino possibile al apex e tirare delicatamente per allungare la base dell'arco aortico e l'arteria polmonare.
- Usando la mano destra, inserto Pinzette curve sotto l'arteria polmonare e aorta e quindi spostare le pinzette indietro un poco per tenere solo l'arteria polmonare (Figura 3).
- Utilizzare la mano sinistra per inserire un altro paio di pinzette per sostituire quello tenuto con la mano destra.
- Utilizzando taglienti microforbici dritto nella mano destra, sezionare l'arteria polmonare come vicino al cuore come possibile da un lato e più lontano possibile da altro lato.
Nota: Non importa quale mano tiene la quale strumento, anche se abbiamo trovato più facile da tagliare con la mano destra che con la sinistra. - Metterlo in una provetta da 2 mL con tampone fosfato salino (PBS) tampone di refrigerato e tenere sul ghiaccio.
-
Eseguire un'aspersione del corpo intero.
- Nella parte superiore dell'arto inferiore destro del mouse, è possibile utilizzare pinzette per cancellare l'esterno-interno arteria iliaca di destra verso il basso per l'arteria femorale di destra (sotto il legamento inguinale). Utilizzando tagliente dritto microforbici, fare un taglio completo nell'arteria femorale.
- Inserire una siringa di 25 G 5 mL riempita con PBS freddo nel ventricolo sinistro del cuore e iniettare delicatamente il PBS freddo per rimuovere il sangue rimanente dai vasi.
Nota: Dovuto l'estrazione dell'arteria polmonare, è possibile che PBS non circola tutto il senso all'incisione.
- Con una pinzetta, togliere il tessuto molle che circonda l'aorta dai legamenti inguinali destra e sinistro al cuore nel miglior modo possibile.
Nota: Il cuore può essere estratto per un'ulteriore analisi se necessario. - Utilizzando una pinzetta e microforbici, sezionare il cuore fino al punto più basso dell'arteria iliaca esterna (negli arti destro e sinistro) e posizionare la sezione completamente sezionato in un piatto di 10 cm di diametro con PBS freddo.
- Utilizzando pinzette e/o microforbici, finisci di pulire il grasso rimanente intorno l'aorta e le arterie delicatamente tirando o tagliarla lontano i vasi.
- Utilizzando microforbici, tagliare l'arteria iliaca sinistra alla biforcazione dell'arteria iliaca di sinistra-destra e memorizzarlo per ulteriori analisi.
- Utilizzando microforbici, tagliare l'aorta addominale sotto l'arteria renale di sinistra e mettere il recipiente Estratto in tampone PBS freddo sul ghiaccio (Figura 4).
- Tenere il vaso pulito rimanente, dall'arco aortico di destra sopra l'arteria renale di sinistra, in deposito per un'ulteriore analisi.
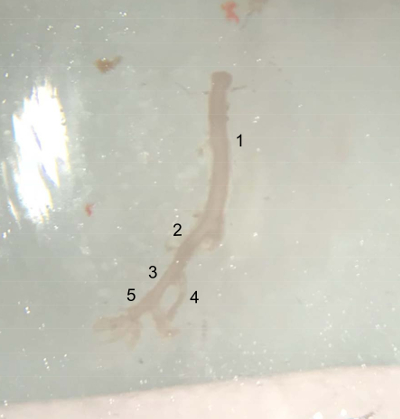
Figura 4 : Foto delle navi dissecate. Nave estratta dalla parte superiore dell'aorta addominale (sotto l'arteria renale di sinistra) alla fine dell'arteria iliaca destra, pronto per essere immessi in tampone PBS freddo sul ghiaccio. (1), Abdominal aorta. (2) a destra dell'arteria iliaca comune. (3) esterno dell'arteria iliaca. (4) interna dell'arteria iliaca. (5) dell'arteria femorale. Clicca qui per visualizzare una versione più grande di questa figura.
8. Vivo funzione vascolare valutazione ex
Nota: Un lavaggio corrisponde per lo svuotamento e riempimento degli alloggiamenti con Krebs.
- Secondo un protocollo descritto in precedenza20, tagliate l'isolato dell'arteria polmonare, aorta addominale e dell'arteria iliaca destra segmenti di anelli vascolari di 1.0 – 2.0 mm di lunghezza e montare ogni anello su due 0,1 mm-diametro staffe passati attraverso il lume.
- Sospendere gli anelli di nave in organo verticale camere riempite con 10 mL di soluzione di bicarbonato della Krebs-soneria modificata (118,3 mM NaCl, 4,7 mM KCl, 2,5 mM CaCl2, 1,2 mM MgSO4, 1,2 mM KH2PO4, 25,0 mM NaHCO3e 11,1 mM il glucosio) mantenuta a 37 ° C e aerato con 95% O2-5% CO2 (pH 7.4). Una staffa è ancorato alla parte inferiore dell'alloggiamento dell'organo ed altro quello è collegato con un estensimetro per la misurazione della forza isometrica in grammi.
- Portare i vasi alla loro tensione di riposo ottimale: allungare gli anelli a 0,5 g per l'arteria polmonare, 1,5 g per l'arteria iliaca e 2 g per l'aorta addominale e lavarli dopo un periodo di 20 min di equilibrazione. Il tratto-equilibratura-lavaggio di ripetere i passaggi 1 x.
- Per verificare la fattibilità dei vasi, contratto gli anelli con 235 µ l di KCl (10-1 M) per 10 min, lavarli per altri 10 min e ancora un contratto con 235 µ l di KCl (10-1 M) per circa 20 min fino a raggiungere un plateau.
- Lavare i vasi ancora per 10 minuti e aggiungere 58,4 µ l di indometacina (10-5 M) (un inibitore dell'attività del ciclo-ossigenasi) per almeno 20 min al fine di evitare possibili interferenze dei prostanoidi endogeni.
- Aggiungere dosi cumulative di fenilefrina (Phe) dal 10-9 (10 µ l) al 10-4 M (o 10-9 a 10-5 M per l'arteria polmonare; 9 µ l per tutte le concentrazioni superiori a 10-9 M) a contrarre i vasi.
- Dopo l'ultima dose di Phe, attendere per circa 1 ora fino a quando i vasi raggiungono uno stato di contrazione relativamente stabile (altopiano).
- Aggiungere dosi cumulative dell'acetilcolina vasodilatatore dipendente dall'endotelio (ACh), dal 10-9 al 10-4 M (58,4 µ l per 10-9 M e alternativamente µ l 12,6 e 40 µ l per tutte le concentrazioni superiori a 10-9 M), per indurre nitrico ossido (NO)-mediata relax.
- Alla fine della curva relax, lavare i vasi per 10 min e aggiungere 58,4 µ l di indometacina (10-5 M), come pure 184 µ l di NG-nitro-L-arginina (NLA, 10-4 M), che è un inibitore del NOS, per almeno 20 min.
- Contratto i vasi nuovamente con una dose unica di 10 µ l di Phe (10-5 e 10-4 M per l'arteria polmonare e 10-4 M per l'aorta addominale e dell'arteria iliaca) per 1 h, per indurre una contrazione relativamente stabile.
- Aggiungere una dose unica di 40 µ l di ACh (10-4 M) fino a raggiungere un plateau.
- Lavare i vasi ancora per 10 minuti, prima di aggiungere 58,4 µ l di indometacina (10-5 M) e µ l 184 di NLA (10-4 M) per 20 min.
- Contratto i vasi con 10 µ l di Phe (10-5 e 10-4 M) per 1 h.
- Aggiungere dosi cumulative (10-9 [58,4 µ l] a 10-4 M [40 µ l per tutte le concentrazioni superiori a 10-9 M]) il dietilammina di donatori di NO (DEA) / NO, in ordine per valutare il rilassamento indotto da NO-indipendente dall'endotelio.
- Alla fine dell'esperimento, conservare i vasi in azoto liquido per future analisi se necessario.
Risultati
A nostra conoscenza, lo studio presente è il primo a descrivere un programma di allenamento di intensità agonistica in normoxia e nell'ipossia per topi. In questo protocollo, topi ha funzionato da quattro serie di Sprint di cinque 10 s con un recupero di s 20 tra ogni sprint. I set sono stati sparpagliati con 5 min di periodi di recupero. Era sconosciuto se i topi sarebbero in grado di sostenere tale protocollo e completarlo correttamente. Tuttavia, secondo la Figur...
Discussione
Il primo obiettivo di questo studio era di valutare la fattibilità di allenamento di alta intensità hypoxic in topi e per determinare le adeguate caratteristiche del protocollo, che potrebbe essere ben tollerato dai topi. Volutamente, poiché non sono presenti dati utilizzando un allenamento di intensità agonistica (cioè, più di Vmax) in topi, abbiamo dovuto eseguire prove sulla base di precedenti protocolli sviluppati con gli atleti, che consisteva di quattro o cinque set di cinque sprint a tutto campo (...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori vorrei ringraziare Danilo Gubian e Stephane Altaus dall'officina meccanica ospedale universitario di Losanna (CHUV) per aiutare a creare il setup hypoxic. Gli autori inoltre ringraziare Diane Macabrey e Melanie Sipion per il loro aiuto con gli animali di addestramento.
Materiali
| Name | Company | Catalog Number | Comments |
| Cotton swab | Q-tip | ||
| Gas mixer Sonimix 7100 | LSI Swissgas, Geneva, Switzerland | Gas-flow: 10 L/min and 1 L/min for O2 and CO2, respectively | |
| Hypoxic Box | Homemade | Made in Plexiglas | |
| Motorized rodents treadmill Panlab LE-8710 | Bioseb, France | ||
| Oximeter Greisinger GOX 100 | GREISINGER electronic Gmbh, Regenstauf, Germany | ||
| Sedacom software | Bioseb, France | ||
| Strain gauge | PowerLab/8SP; ADInstruments |
Riferimenti
- Calbet, J. A., et al. Determinants of maximal oxygen uptake in severe acute hypoxia. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 284 (2), 291-303 (2003).
- Hanada, A., Sander, M., González-Alonso, J. Human skeletal muscle sympathetic nerve activity, heart rate and limb haemodynamics with reduced blood oxygenation and exercise. The Journal of Physiology. 551, 635-647 (2003).
- Casey, D. P., Joyner, M. J. Compensatory vasodilatation during hypoxic exercise: mechanisms responsible for matching oxygen supply to demand. The Journal of Physiology. 590 (24), 6321-6326 (2012).
- Casey, D. P., et al. Nitric oxide contributes to the augmented vasodilatation during hypoxic exercise. The Journal of Physiology. 588, 373-385 (2010).
- Girard, O., Brocherie, F., Millet, G. P. Effects of Altitude/Hypoxia on Single- and Multiple-Sprint Performance: A Comprehensive Review. Sports Medicine. 47 (10), 1931-1949 (2017).
- Faiss, R., Girard, O., Millet, G. P. Advancing hypoxic training in team sports: from intermittent hypoxic training to repeated sprint training in hypoxia. British Journal of Sports Medicine. 47, 45-50 (2013).
- Brocherie, F., Girard, O., Faiss, R., Millet, G. P. Effects of Repeated-Sprint Training in Hypoxia on Sea-Level Performance: A Meta-Analysis. Sports Medicine.(Auckland, N.Z). 47 (8), 1651-1660 (2017).
- Brocherie, F., et al. Repeated maximal-intensity hypoxic exercise superimposed to hypoxic residence boosts skeletal muscle transcriptional responses in elite team-sport athletes. Acta Physiologica. 222 (1), 12851 (2018).
- Pellegrin, M., et al. New insights into the vascular mechanisms underlying the beneficial effect of swimming training on the endothelial vasodilator function in apolipoprotein E-deficient mice. Atherosclerosis. 190 (1), 35-42 (2007).
- Picard, M., et al. Acute exercise remodels mitochondrial membrane interactions in mouse skeletal muscle. Journal of Applied Physiology. 115 (10), 1562-1571 (2013).
- Ayachi, M., Niel, R., Momken, I., Billat, V. L., Mille-Hamard, L. Validation of a Ramp Running Protocol for Determination of the True VO2max in Mice. Frontiers in Physiology. 7, (2016).
- Pellegrin, M., et al. Running Exercise and Angiotensin II Type I Receptor Blocker Telmisartan Are Equally Effective in Preventing Angiotensin II-Mediated Vulnerable Atherosclerotic Lesions. Journal of Cardiovascular Pharmacology and Therapeutics. 22 (2), (2016).
- Semin, I., Acikgöz, O., Gönenc, S. Antioxidant enzyme levels in intestinal and renal tissues after a 60-minute exercise in untrained mice. Acta Physiologica Hungarica. 88 (1), 55-62 (2001).
- Cho, J., et al. Treadmill Running Reverses Cognitive Declines due to Alzheimer Disease. Medicine & Science in Sports & Exercise. 47 (9), 1814-1824 (2015).
- Schill, K. E., et al. Muscle damage, metabolism, and oxidative stress in mdx mice: Impact of aerobic running. Muscle & Nerve. 54 (1), 110-117 (2016).
- Cho, J., Kim, S., Lee, S., Kang, H. Effect of Training Intensity on Nonalcoholic Fatty Liver Disease. Medicine & Science in Sports & Exercise. 47 (8), 1624-1634 (2015).
- Sabatier, M. J., Redmon, N., Schwartz, G., English, A. W. Treadmill training promotes axon regeneration in injured peripheral nerves. Experimental Neurology. 211 (2), 489-493 (2008).
- Rolim, N., et al. Aerobic interval training reduces inducible ventricular arrhythmias in diabetic mice after myocardial infarction. Basic Research in Cardiology. 110 (4), 44 (2015).
- Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database Available from: https://www.jove.com/science-education/10246/blood-withdrawal-i (2018)
- Peyter, A. -. C., et al. Muscarinic receptor M1 and phosphodiesterase 1 are key determinants in pulmonary vascular dysfunction following perinatal hypoxia in mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 295 (1), 201-213 (2008).
- Faiss, R., et al. Significant Molecular and Systemic Adaptations after Repeated Sprint Training in Hypoxia. PLOS ONE. 8 (2), (2013).
- Faiss, R., et al. Repeated Double-Poling Sprint Training in Hypoxia by Competitive Cross-country Skiers. Medicine & Science in Sports & Exercise. 47 (4), 809-817 (2015).
- Billat, V. L., Mouisel, E., Roblot, N., Melki, J. Inter- and intrastrain variation in mouse critical running speed. Journal of Applied Physiology. 98 (4), 1258-1263 (2005).
- Ferguson, S. K., et al. Effects of living at moderate altitude on pulmonary vascular function and exercise capacity in mice with sickle cell anemia. The Journal of Physiology. , (2018).
- Lightfoot, J. T., Turner, M. J., Debate, K. A., Kleeberger, S. R. Interstrain variation in murine aerobic capacity. Medicine & Science in Sports & Exercise. 33 (12), (2001).
- Wojewoda, M., et al. Running Performance at High Running Velocities Is Impaired but V'O2max and Peripheral Endothelial Function Are Preserved in IL-6-/- Mice. PLOS ONE. 9 (2), (2014).
- Muller, C. R., Américo, A. L. V., Fiorino, P., Evangelista, F. S. Aerobic exercise training prevents kidney lipid deposition in mice fed a cafeteria diet. Life Sciences. 211, 140-146 (2018).
- Petrosino, J. M., et al. Graded Maximal Exercise Testing to Assess Mouse Cardio-Metabolic Phenotypes. PLOS ONE. 11 (2), 0148010 (2016).
- Poole, D. C., Jones, A. M. Oxygen Uptake Kinetics. Comprehensive Physiology. , (2012).
- Copp, S. W., Hirai, D. M., Musch, T. I., Poole, D. C. Critical speed in the rat: implications for hindlimb muscle blood flow distribution and fibre recruitment. The Journal of Physiology. 588, 5077-5087 (2010).
- Kregel, K., et al. . Resource Book for the Design of Animal Exercise Protocols. , (2006).
- Lamy, S., et al. Air puffs as refinement of electric shocks for stimulation during treadmill exercise test. The FASEB Journal. 30, 1014 (2016).
- Koenen, K., et al. Sprint Interval Training Induces A Sexual Dimorphism but does not Improve Peak Bone Mass in Young and Healthy Mice. Scientific Reports. 7, (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon