É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Supramaximal intensidade exercício hipóxica e avaliação da função Vascular em ratos
Neste Artigo
Resumo
Treinamento de alta intensidade em hipóxia é um protocolo que tem sido comprovado para induzir as adaptações vasculares potencialmente benéficas em alguns pacientes e melhorar dos atletas repetiram a capacidade de sprint. Aqui, nós testamos a viabilidade de ratos de formação usando protocolo e identificar essas adaptações vasculares usando ex vivo avaliação de função vascular.
Resumo
Treinamento físico é uma importante estratégia para manter a saúde e prevenir muitas doenças crônicas. É a primeira linha de tratamento recomendado pelas diretrizes internacionais para pacientes que sofrem de doenças cardiovasculares, mais especificamente, reduzir doenças das artérias de extremidade, onde pouca capacidade dos pacientes é consideravelmente alterada, afetando sua qualidade de vida.
Tradicionalmente, tanto baixo exercício contínuo e treinamento intervalado têm sido utilizados. Recentemente, supramaximal formação também foi mostrada para melhorar as performances dos atletas através de adaptações vasculares, entre outros mecanismos. A combinação deste tipo de treinamento com hipóxia pode trazer um efeito adicional e/ou sinérgico, que poderia ser de interesse para determinadas patologias. Aqui, descrevemos como realizar sessões de treinamento de intensidade supramaximal em hipóxia em ratos saudáveis em 150% da sua velocidade máxima, usando uma esteira motorizada e uma caixa de hipoxia. Também mostramos como dissecar o mouse a fim de recuperar os órgãos de interesse, particularmente a artéria pulmonar, aorta abdominal e artéria ilíaca. Finalmente, mostramos como executar ex vivo avaliação de função vascular nos vasos obtidas, usando estudos de tensão isométrica.
Introdução
Hipóxia, a diminuição da fração inspirada de oxigênio (O2) leva à hipoxemia (diminuição da pressão arterial em hipóxia) e um alterado O2 transporte capacidade1. Hipóxia aguda induz uma atividade aumentada vasoconstritor simpático direcionada para o músculo esquelético2 e uma vasodilatação contra 'compensatória'.
A intensidade submáxima em hipóxia, esta vasodilatação 'compensatória', em relação ao mesmo nível do exercício sob condições normoxic, é bem estabelecida3. Esta vasodilatação é essencial para garantir uma circulação sanguínea aumentada e a manutenção (ou limitar a alteração) da entrega de oxigênio para os músculos ativos. Adenosina foi mostrada não ter um papel independente nesta resposta, enquanto o óxido nítrico (NO) parece a fonte primária de endotelial desde significativo embotamento da vasodilatação aumentada foi relatado com óxido nítrico sintase (NOS) inibição durante a hipóxia exercício4. Várias outras substâncias vasoativas provavelmente desempenham um papel na vasodilatação compensatória durante um exercício de hipoxia.
Este exercício hipóxica reforçada hiperemia é proporcional à queda induzida por hipóxia arterial teor de O2 e é maior como os aumentos de intensidade de exercício, por exemplo, durante o exercício incremental intenso em hipóxia.
O componente não-mediada da vasodilatação compensatória é regulamentado através de caminhos diferentes, com aumento de intensidade de exercício3: se β-adrenérgico receptor-não estimulada nenhum componente aparece primordial durante o exercício hipóxico de baixa intensidade , a fonte de não contribuir para dilatação compensatória parece menos dependente de mecanismos de β-adrenérgicos como a intensidade do exercício aumenta. Existem outros candidatos para não estimular nenhuma liberação durante o exercício de maior intensidade hipóxico, como o ATP liberado de eritrócitos e/ou prostaglandinas endoteliais derivadas.
Supramaximal exercício de hipóxia (chamado repetidas sprint treino em hipóxia [RSH] na literatura de fisiologia do exercício) é um recente treinamento método5 fornecer aprimoramento de desempenho em jogadores ou raquete-esporte de equipe. Esse método difere do intervalo de formação em hipóxia, realizada em ou perto de velocidade máxima-6 (Vmax) desde RSH realizado em máxima intensidade leva a uma maior perfusão muscular e oxigenação7 e músculo específico transcricional respostas8. Vários mecanismos têm sido propostos para explicar a eficácia de RSH: durante sprints em hipóxia, a vasodilatação compensatória e maior fluxo de sangue associado beneficiaria as fibras de contração rápida mais do que as fibras de contração lenta. Por conseguinte, eficiência RSH é susceptível de ser selectivo de fibra-tipo e intensidade dependente. Podemos especular que a capacidade de resposta melhorada do sistema vascular é fundamental no RSH.
Treinamento de exercício tem sido estudado extensivamente em camundongos, ambos em indivíduos saudáveis e patológicas do mouse modelos9,10. A maneira mais comum para treinar os ratos é usando uma esteira de roedor, e o regime utilizado tradicionalmente é treino de baixa intensidade, em 40%-60% de Vmáx (determinado usando um teste de esteira incremental11), por 30 a 60 min12,13 de14, ,15. Treinamento intervalado de intensidade máxima e seu impacto nas patologias têm sido amplamente estudadas em ratos16,,17; assim, desenvolveram-se intervalo de formação protocolos de execução para os ratos. Esses protocolos geralmente consistem de cerca de 10 episódios de correr em 80%-100% de Vmáx em uma esteira motorizada roedor, por 1-4 min, intercalada com descanso ativo ou passivo16,18.
O interesse em camundongos exercitando na intensidade de supramaximal (ou seja, acima do Vmáx) em hipóxia vem de resultados anteriores que a compensação vasodilatador microvascular e o desempenho do exercício intermitente são ambos mais aumento no supramaximal do que em intensidades moderadas ou máximas. No entanto, a nosso conhecimento, não há nenhum relatório anterior de um protocolo de treinamento de supramaximal em ratos, em normoxia ou em hipóxia.
O primeiro objectivo do presente estudo foi testar a viabilidade de supramaximal intensidade do treinamento em ratos e a determinação de um protocolo tolerável e adequada (intensidade, duração da sprint, recuperação, etc.). O segundo objetivo foi avaliar os efeitos do regime de treinamento diferente em normoxia e hipóxia na função vascular. Portanto, vamos testar as hipóteses que ratos (1) toleram bem supramaximal exercício de hipóxia, e (2) que este protocolo induz uma maior melhora da função vascular do que exercício de normoxia mas também do exercício de hipóxia em intensidades menores.
Protocolo
Comitê de cuidados de animais do estado local (serviço de la Consommation et des Affaires Vétérinaires [SCAV], Lausanne, Suíça) aprovou todos os experimentos (autorização VD3224; 01.06.2017) e todos os experimentos foram realizados em conformidade com as pertinentes Diretrizes e regulamentos.
1. animal habitação e preparação
- Casa de 6 a 8 semanas de idade C57BL/6J ratos masculinos na instalação de animais pelo menos 1 semana antes do início dos experimentos para que os ratos se acostumar com as novas condições de habitação. Por razões práticas, ratos do mesmo grupo experimental são normalmente alojados juntos.
- Manter os ratos em uma sala de temperatura controlada (22 ± 1 ° C) com um ciclo de 12 h claro/escuro com acesso ad libitum para comida e água.
2. determinação da velocidade máxima e padrão avaliação de melhoria de desempenho pelo teste Incremental de esteira
Nota: As seguintes etapas são essenciais para completar os protocolos de treinamento.
- Use uma esteira motorizada para camundongos onde ratos podem ser em várias vias, lado a lado, com uma inclinação de 0° e montagem com uma grade elétrica definido como 0,2 mA na parte de trás da pista, a fim de incentivar os ratos para correr.
-
Antes do primeiro teste, envie os ratos para 4 dias de aclimatação para a esteira, de acordo com o seguinte protocolo.
- No dia 1, têm ratos executados por 10 min em 4,8 m/min.
- No dia 2, tem os ratos executados por 10 min em 6 m/min.
- No dia 3, já os ratos executados por 10 min em 7.2 m/min.
- No dia 4, tem os ratos executados por 10 min em 8,4 m/min.
-
No dia 5, submeta os ratos para um teste incremental até a exaustão, de acordo com o seguinte protocolo.
- Deixe-os aquecer por 5 min em 4,8 m/min (com uma inclinação de 0 °) de ratos.
- Aumentar a velocidade em 1,2 m/min a cada 3 min (por exemplo, 5 min a 4,8 m/min, em seguida a 3 min a 6 m/min, 3 min em 7.2 m/min, 3 min em 8,4 m/min, etc.) até a exaustão, que é alcançado quando o mouse passa também 3 segundos consecutivos na grelha elétrica ou recebe 100 choques (exibidos pelo aparelho).
- Escreva a velocidade alcançada (considerada como o Vmáx), duração, distância, número de choques, e o tempo total gasto no grid.
Nota: Normalmente, Vmáximo foi de 28,8 ± 3,7 m/min. - Meio da formação, reenviar os ratos para este teste a fim de reajustar as velocidades de treinamento para o atualizado Vmáximo dos ratos (por exemplo, se o protocolo de treinamento dura 8 semanas e, em seguida, executar um teste incremental de formação média em 4 semanas. Nesse caso, substituir um dos treinamentos agendados pelo teste) e fazê-lo novamente no final do estudo para avaliar melhorias de desempenho.
- Implemente um período de descanso de 48h antes e após este teste.
Nota: Todos os testes incrementais foram realizados pela manhã.
3. hipóxica ambiente
- Para as sessões de treinamento em hipóxia, lugar da esteira na caixa hipóxica (Figura 1) ligado a um misturador de gás. Use um oxímetro calibrado regularmente, controlar a ambiente fração de oxigênio (FeuO2 [ou seja, o nível de hipóxia]) na caixa.
- Definir o misturador de gás com 100% de nitrogênio (N2) e use o oxímetro para verificar o nível de hipóxia. Uma vez FeuO2 = 0.13, altere o parâmetro do misturador de gás de 100% N2 para 13% O2.
- Para evitar exposição passiva prolongada à hipóxia, coloque os ratos em uma gaiola menor temporária com maca e enriquecimento e rapidamente Coloque-o na caixa uma vez FeuO2 = 0.13 foi alcançado. Verifique se o ambiente está ainda em 13% O2 depois de colocar a gaiola em; Se não, reajuste-a.
- Verificar regularmente o nível de O2 ao longo de uma sessão de treinamento para garantir que ele permaneça em FiO2 = 0,13 ± 0,002.
4. Normoxic ambiente
- Para as sessões de treinamento em normoxia, manter a esteira na caixa hipóxica, mas remover as luvas para que haja ar ambiente (FeuO2 = 0,21). O objectivo é recriar o mesmo ambiente de treinamento como os ratos em hipóxia.
5. Supramaximal intensidade do treinamento
-
Coloque os ratos em pistas individuais em esteira (com uma inclinação de 0°) e submetê-los para o seguinte protocolo.
- Tem os ratos aquecer por 5 min em 4,8 m/min, seguido por 5 min em 9 m/min.
- Defina a velocidade das sprints a 150% do previamente determinado Vmáx.
Nota: Normalmente, a velocidade de sprint foi 42,1 ± 5,5 m/min. - Treinar os ratos para quatro conjuntos de 5 x 10 sprints de s com 20 s de descanso entre cada sprint. O resto interset é 5 min (Figura 2).
Nota: Adicione um período do cooldown se a carga horária total da sessão de treinamento precisa coincidir com o de outro grupo de treinamento.
- Execute este treino 3 x por semana, com preferência de 48h entre as sessões de treinamento.
- Use cotonetes de algodão como um método complementar de choques eléctricos para incentivar os ratos para correr. Coloque um cotonete em uma fenda na parte superior da faixa, entre o rato e a rede elétrica e deslocar suavemente o mouse quando ele atinge a parte de trás da esteira. Isto irá evitar a entrega de choques elétricos e estimular os ratos para executar de forma mais suave.
6. baixo-intensidade do treinamento
-
Coloque os ratos em pistas individuais em esteira (com uma inclinação de 0°) e submetê-los para o seguinte protocolo.
- Tem os ratos aquecer por 5 min em 4,8 m/min, seguido por 5 min em 7.2 m/min.
- Defina a velocidade da sessão em execução contínua para 40% do que o previamente determinado Vmáx.
Nota: Normalmente, a velocidade de execução contínua foi de 9,9 m/min. - Treine os ratos por 40 min.
- Execute este treino 3 x por semana com preferencialmente 48h entre as sessões de treinamento.
- Use cotonetes de algodão como um método complementar de choques eléctricos para incentivar os ratos para correr.
7. ratos eutanásia e extração do órgão
- No final do protocolo de treinamento e pelo menos 24 h após o último teste incremental, anestesia o mouse em uma câmara de indução utilizando isoflurano (4 – 5% de O2 para induzir anestesia e 1%-2% em 100% O2 para manter a anestesia). Confirmar anesthetization adequada usando o reflexo de retração de pata (aperte firmemente a pata do animal; anestesia é considerada adequada quando o animal não reage ao estímulo).
- Usando uma agulha 25g, realize uma punção cardíaca percutânea, para coletar o volume máximo de sangue como descrito anteriormente,19.
- Executar um deslocamento cervical e retire a pele do rato corte através da primeira camada de pele no abdômen com uma tesoura de ponta redonda e puxando nos dois lados da incisão (em direção a cabeça e a cauda).
- Corte o peritônio debaixo da caixa torácica no lado esquerdo do mouse com uma tesoura de ponta fina-ponto para alcançar o baço e extraí-lo, se necessário.
Nota: Disse músculos se necessário. -
Disse para fora a artéria pulmonar.
- Usando tesouras pequenas e fórceps, remover a caixa torácica e limpar a área de coração-pulmão.
- Com uma pinça "Self-closing", aperte o coração tão próximo quanto possível para o ápice e puxe-o suavemente para esticar a base da aorta e a artéria pulmonar.
- Usando a mão direita, inserir pinças curvas sob a artéria pulmonar e a aorta e depois mover as pinças de volta um pouco para segurar somente a artéria pulmonar (Figura 3).
- Use a mão esquerda para inserir outro par de pinças para substituir a realizada com a mão direita.
- Usando micro-tesouras reta afiadas na mão direita, disse a artéria pulmonar, como perto do coração, quanto possível, de um lado e o mais longe possível do outro lado.
Nota: Não importa qual mão segura qual instrumento, embora encontrámo-lo mais fácil de cortar com a mão direita do que com a esquerda. - Colocá-lo em um tubo de 2 mL com tampão fosfato salino (PBS) buffer a frio e manter no gelo.
-
Execute uma perfusão de corpo inteiro.
- Na parte superior do membro inferior direito do mouse, use uma pinça para limpar a artéria ilíaca direita externo-interno até a artéria femoral direita (sob o ligamento inguinal). Usando micro-tesouras reta afiadas, fazer um corte total na artéria femoral.
- Inserir uma seringa de 5 mL 25 G cheia de frio PBS no ventrículo esquerdo do coração e injetar suavemente a PBS fria para remover o restante do sangue dos vasos.
Nota: Devido a extração da artéria pulmonar, é possível que a PBS não circular até a incisão.
- Usando uma pinça, remova os tecidos moles em torno da aorta de ligamentos inguinais direita e esquerdas do coração tão completamente quanto possível.
Nota: O coração pode ser extraído para uma análise mais profunda, se necessário. - Usando uma pinça e micro-tesouras, dissecar o coração até o ponto mais baixo da artéria ilíaca externa (em membros de esquerda e direita) e coloque a secção inteiramente dissecado-para fora em um prato de 10 cm de diâmetro com PBS frio.
- Usando uma pinça e/ou micro-tesouras, termine de limpar a gordura restante em torno da aorta e artérias suavemente ou cortá-lo longe dos vasos.
- Usando micro-tesouras, cortar a artéria ilíaca esquerda na bifurcação da artéria ilíaca esquerda-direita e armazená-lo para posterior análise.
- Usando micro-tesouras, cortar a aorta abdominal sob a artéria renal esquerda e coloque o recipiente extraído no frio tampão PBS no gelo (Figura 4).
- Manter o recipiente limpo restante, do arco aórtico para a direita acima da artéria renal esquerda, em armazenamento para uma análise mais aprofundada.
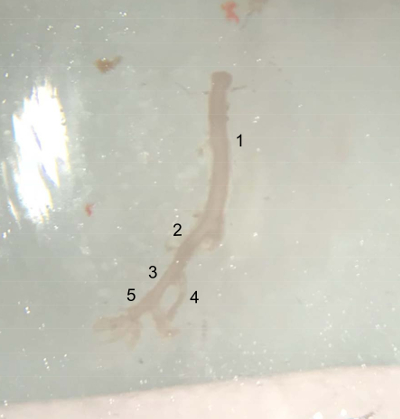
Figura 4 : Imagens dos vasos dissecados. Embarcação extraída da parte superior da aorta abdominal (abaixo da artéria renal esquerda) até o fim da artéria ilíaca direita, pronto para ser colocado no frio tampão PBS no gelo. (1) Abdominal aorta. (2) direita artéria ilíaca comum. Artéria ilíaca (3) externo. (4) interna artéria ilíaca. (5) artéria Femoral. Clique aqui para ver uma versão maior desta figura.
8. ex Vivo da função Vascular avaliação
Nota: Uma lavagem corresponde o esvaziamento e enchimento da câmara com Krebs.
- De acordo com um protocolo descrito anteriormente20, corte o isolado de artéria pulmonar, aorta abdominal e artéria ilíaca direita segmentos em anéis vasculares de 1.0-2.0 mm de comprimento e montar cada anel em estribos de dois 0,1 mm de diâmetro, passados através do lúmen.
- Suspender os anéis de navio em câmaras verticais órgão preenchidos com 10 mL de solução de bicarbonato Krebs-Ringer modificada (118,3 mM NaCl, 4,7 mM KCl, 2,5 mM CaCl2, 1,2 mM de MgSO4, 1,2 mM KH2PO4, 25,0 mM NaHCO3e 11,1 mM glicose) mantido a 37 ° C e ventilado com 95% O2-5% CO2 (pH 7,4). Um estribo é ancorado ao fundo da câmara de órgão e o outro é conectado a um calibre de tensão para a medição da força isométrica em gramas.
- Trazer os vasos de sua tensão de repouso ideal: esticar os anéis de 0,5 g para a artéria pulmonar, 1,5 g para a artéria ilíaca e 2G para a aorta abdominal e lave-os após um período de 20 min de equilibração. O trecho-equílibrio-lavagem de repita os passos 1 x.
- Para testar a viabilidade dos vasos, contrato os anéis com 235 µ l de KCl (10-1 M) por 10 min, lavá-los para outro 10 min e contrato novo com 235 µ l de KCl (10-1 M) por cerca de 20 min até atingir um platô.
- Lave os vasos novamente por 10 min e adicionar 58,4 µ l de indometacina (10-5 M) (um inibidor da atividade da ciclo-oxigenase) pelo menos 20 min, a fim de evitar uma possível interferência de prostanoids endógenas.
- Adicione doses cumulativas de fenilefrina (Phe) de 10-9 (10 µ l) de 10-4 M (ou 10-9 a 10-5 M para a artéria pulmonar; 9 µ l para todas as concentrações acima de 10-9 M) para contrair os vasos.
- Após a última dose de Phe, espere cerca de 1h até os vasos alcançar um estado de contração relativamente estável (planalto).
- Acrescente doses cumulativas de acetilcolina o endotélio-dependente vasodilatador (ACh), de 10-9 a 10-4 M (58,4 µ l por 10-9 M e alternadamente 12.6 µ l e 40 µ l para todas as concentrações acima de 10-9 M), para induzir nítrico óxido de (n)-mediada de relaxamento.
- No final da curva de relaxamento, lave os vasos por 10 min e adicionar 58,4 µ l de indometacina (10-5 M), bem como µ l 184 de NG-nitro-L-arginina (NLA, 10-4 M), que é um inibidor do óxido nitroso, pelo menos 20 min.
- Contrair os vasos novamente com uma única dose de 10 µ l de Phe (10-5 e 10-4 M para a artéria pulmonar e 10-4 M para a aorta abdominal e artéria ilíaca) por 1h, para induzir uma contração relativamente estável.
- Adicionar uma única dose de 40 µ l de ACh (10-4 M) até atingir um platô.
- Lavar os vasos novamente por 10 min, antes de adicionar 58,4 µ l de indometacina (10-5 M) e 184 µ l de NLA (10-4 M) por 20 min.
- Contrair os vasos com 10 µ l de Phe (10-5 e 10-4 M) por 1h.
- Adicione doses cumulativas (10-9 [58,4 µ l] a 10-4 M [40 µ l para todas as concentrações acima de 10-9 M]) da não doador Dietilamina (DEA) / não, em, a fim de avaliar o relaxamento do endotélio independente não-induzida.
- No final do experimento, armazene os vasos em nitrogênio líquido para análises futuras se necessário.
Resultados
A nosso conhecimento, o presente estudo é o primeiro a descrever um programa de treinamento de intensidade supramaximal em normoxia e em hipóxia para ratos. Neste protocolo, os ratos correram quatro conjuntos de sprints cinco 10 s com uma recuperação de s 20 entre cada sprint. Os conjuntos foram intercalados com 5 min de períodos de recuperação. Era desconhecido se os ratos seria capaz de sustentar tal um protocolo e completá-lo corretamente. No entanto, de acordo com a
Discussão
O primeiro objectivo deste estudo foi avaliar a viabilidade de hipóxica treinamento de alta intensidade em camundongos e para determinar as características adequadas do protocolo que iria ser bem tolerado pelos ratos. Propositadamente, já que não há dados utilizando treinamento de intensidade de supramaximal (ou seja, mais do que o Vmáx) em camundongos, tivemos que realizar julgamentos com base em protocolos anteriores desenvolvidos com atletas, que consistia de quatro ou cinco conjuntos de cinco sprints...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores gostaria de agradecer Danilo Gubian e Stephane Altaus da oficina mecânica Hospital Universitário de Lausanne (CHUV) para ajudar a criar a configuração hipóxica. Os autores também queria agradecer sua ajuda com os animais de treinamento Diane Macabrey e Melanie Sipion.
Materiais
| Name | Company | Catalog Number | Comments |
| Cotton swab | Q-tip | ||
| Gas mixer Sonimix 7100 | LSI Swissgas, Geneva, Switzerland | Gas-flow: 10 L/min and 1 L/min for O2 and CO2, respectively | |
| Hypoxic Box | Homemade | Made in Plexiglas | |
| Motorized rodents treadmill Panlab LE-8710 | Bioseb, France | ||
| Oximeter Greisinger GOX 100 | GREISINGER electronic Gmbh, Regenstauf, Germany | ||
| Sedacom software | Bioseb, France | ||
| Strain gauge | PowerLab/8SP; ADInstruments |
Referências
- Calbet, J. A., et al. Determinants of maximal oxygen uptake in severe acute hypoxia. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 284 (2), 291-303 (2003).
- Hanada, A., Sander, M., González-Alonso, J. Human skeletal muscle sympathetic nerve activity, heart rate and limb haemodynamics with reduced blood oxygenation and exercise. The Journal of Physiology. 551, 635-647 (2003).
- Casey, D. P., Joyner, M. J. Compensatory vasodilatation during hypoxic exercise: mechanisms responsible for matching oxygen supply to demand. The Journal of Physiology. 590 (24), 6321-6326 (2012).
- Casey, D. P., et al. Nitric oxide contributes to the augmented vasodilatation during hypoxic exercise. The Journal of Physiology. 588, 373-385 (2010).
- Girard, O., Brocherie, F., Millet, G. P. Effects of Altitude/Hypoxia on Single- and Multiple-Sprint Performance: A Comprehensive Review. Sports Medicine. 47 (10), 1931-1949 (2017).
- Faiss, R., Girard, O., Millet, G. P. Advancing hypoxic training in team sports: from intermittent hypoxic training to repeated sprint training in hypoxia. British Journal of Sports Medicine. 47, 45-50 (2013).
- Brocherie, F., Girard, O., Faiss, R., Millet, G. P. Effects of Repeated-Sprint Training in Hypoxia on Sea-Level Performance: A Meta-Analysis. Sports Medicine.(Auckland, N.Z). 47 (8), 1651-1660 (2017).
- Brocherie, F., et al. Repeated maximal-intensity hypoxic exercise superimposed to hypoxic residence boosts skeletal muscle transcriptional responses in elite team-sport athletes. Acta Physiologica. 222 (1), 12851 (2018).
- Pellegrin, M., et al. New insights into the vascular mechanisms underlying the beneficial effect of swimming training on the endothelial vasodilator function in apolipoprotein E-deficient mice. Atherosclerosis. 190 (1), 35-42 (2007).
- Picard, M., et al. Acute exercise remodels mitochondrial membrane interactions in mouse skeletal muscle. Journal of Applied Physiology. 115 (10), 1562-1571 (2013).
- Ayachi, M., Niel, R., Momken, I., Billat, V. L., Mille-Hamard, L. Validation of a Ramp Running Protocol for Determination of the True VO2max in Mice. Frontiers in Physiology. 7, (2016).
- Pellegrin, M., et al. Running Exercise and Angiotensin II Type I Receptor Blocker Telmisartan Are Equally Effective in Preventing Angiotensin II-Mediated Vulnerable Atherosclerotic Lesions. Journal of Cardiovascular Pharmacology and Therapeutics. 22 (2), (2016).
- Semin, I., Acikgöz, O., Gönenc, S. Antioxidant enzyme levels in intestinal and renal tissues after a 60-minute exercise in untrained mice. Acta Physiologica Hungarica. 88 (1), 55-62 (2001).
- Cho, J., et al. Treadmill Running Reverses Cognitive Declines due to Alzheimer Disease. Medicine & Science in Sports & Exercise. 47 (9), 1814-1824 (2015).
- Schill, K. E., et al. Muscle damage, metabolism, and oxidative stress in mdx mice: Impact of aerobic running. Muscle & Nerve. 54 (1), 110-117 (2016).
- Cho, J., Kim, S., Lee, S., Kang, H. Effect of Training Intensity on Nonalcoholic Fatty Liver Disease. Medicine & Science in Sports & Exercise. 47 (8), 1624-1634 (2015).
- Sabatier, M. J., Redmon, N., Schwartz, G., English, A. W. Treadmill training promotes axon regeneration in injured peripheral nerves. Experimental Neurology. 211 (2), 489-493 (2008).
- Rolim, N., et al. Aerobic interval training reduces inducible ventricular arrhythmias in diabetic mice after myocardial infarction. Basic Research in Cardiology. 110 (4), 44 (2015).
- Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database Available from: https://www.jove.com/science-education/10246/blood-withdrawal-i (2018)
- Peyter, A. -. C., et al. Muscarinic receptor M1 and phosphodiesterase 1 are key determinants in pulmonary vascular dysfunction following perinatal hypoxia in mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 295 (1), 201-213 (2008).
- Faiss, R., et al. Significant Molecular and Systemic Adaptations after Repeated Sprint Training in Hypoxia. PLOS ONE. 8 (2), (2013).
- Faiss, R., et al. Repeated Double-Poling Sprint Training in Hypoxia by Competitive Cross-country Skiers. Medicine & Science in Sports & Exercise. 47 (4), 809-817 (2015).
- Billat, V. L., Mouisel, E., Roblot, N., Melki, J. Inter- and intrastrain variation in mouse critical running speed. Journal of Applied Physiology. 98 (4), 1258-1263 (2005).
- Ferguson, S. K., et al. Effects of living at moderate altitude on pulmonary vascular function and exercise capacity in mice with sickle cell anemia. The Journal of Physiology. , (2018).
- Lightfoot, J. T., Turner, M. J., Debate, K. A., Kleeberger, S. R. Interstrain variation in murine aerobic capacity. Medicine & Science in Sports & Exercise. 33 (12), (2001).
- Wojewoda, M., et al. Running Performance at High Running Velocities Is Impaired but V'O2max and Peripheral Endothelial Function Are Preserved in IL-6-/- Mice. PLOS ONE. 9 (2), (2014).
- Muller, C. R., Américo, A. L. V., Fiorino, P., Evangelista, F. S. Aerobic exercise training prevents kidney lipid deposition in mice fed a cafeteria diet. Life Sciences. 211, 140-146 (2018).
- Petrosino, J. M., et al. Graded Maximal Exercise Testing to Assess Mouse Cardio-Metabolic Phenotypes. PLOS ONE. 11 (2), 0148010 (2016).
- Poole, D. C., Jones, A. M. Oxygen Uptake Kinetics. Comprehensive Physiology. , (2012).
- Copp, S. W., Hirai, D. M., Musch, T. I., Poole, D. C. Critical speed in the rat: implications for hindlimb muscle blood flow distribution and fibre recruitment. The Journal of Physiology. 588, 5077-5087 (2010).
- Kregel, K., et al. . Resource Book for the Design of Animal Exercise Protocols. , (2006).
- Lamy, S., et al. Air puffs as refinement of electric shocks for stimulation during treadmill exercise test. The FASEB Journal. 30, 1014 (2016).
- Koenen, K., et al. Sprint Interval Training Induces A Sexual Dimorphism but does not Improve Peak Bone Mass in Young and Healthy Mice. Scientific Reports. 7, (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados