A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل الخلايا الجذعية الوسيطة من أنسجة اللب والثقافة المشتركة مع الخلايا السرطانية لدراسة التفاعلات الخاصة بها
In This Article
Summary
نحن توفير بروتوكولات لتقييم الخلايا الجذعية الوسيطة المعزولة من لب الأسنان وتفاعلات خلايا سرطان البروستاتا استناداً إلى أساليب ثقافة المشاركة المباشرة وغير المباشرة. المتوسطة شرط وكذلك عبر الأغشية مناسبة لتحليل النشاط paracrine غير المباشرة. بذر الأثران الملون الخلايا معا نموذج مناسب للتفاعل المباشر خلية خلية.
Abstract
السرطان كعملية متعددة الخطوات ومرض معقد هو لا ينظم تكاثر الخلايا الفردية والنمو بل أيضا يسيطر عليها التفاعلات بين البيئة وخلية خلية الورم. قد يتيح التعرف على السرطان والتفاعلات بين الخلايا الجذعية، بما في ذلك التغيرات في البيئة خارج الخلية والتفاعلات المادية، والعوامل يفرزها، اكتشاف خيارات العلاج الجديدة. ونحن الجمع بين تقنيات الثقافة المشتركة المعروفة لإنشاء نظام نموذجي للخلايا الجذعية الوسيطة (MSCs) وسرطان الخلية التفاعلات. في الدراسة الحالية، وتم فحص الخلايا الجذعية لب الأسنان (دبسكس) والتفاعلات خلية سرطان البروستاتا PC-3 بتقنيات ثقافة المشاركة المباشرة وغير المباشرة. حالة متوسطة (سم) التي تم الحصول عليها من دبسكس واستخدمت 0.4 ميكرومتر المسامية الحجم جيدا عبر الأغشية لدراسة النشاط باراكريني. وأجرى ثقافة المشارك من أنواع مختلفة من الخلايا معا لدراسة التفاعل المباشر خلية خلية. كشفت النتائج أن سم زاد انتشار الخلايا والمبرمج في الثقافات خلايا سرطان البروستاتا. سم وكذلك عبر نظام زيادة قدرة الهجرة خلية من خلايا PC-3. كانت تبذر ملطخة بالأصباغ المختلفة غشاء الخلايا في الأوعية الثقافة نفسها، وشارك دبسكس في هيكل منظمة ذاتيا مع خلايا PC-3 تحت هذا الشرط ثقافة المشاركة المباشرة. وعموما، أشارت النتائج إلى أن تقنيات الثقافة المشتركة يمكن أن تفيد للسرطان والتفاعلات ماجستير كنظام نموذجي.
Introduction
الخلايا الجذعية الوسيطة (MSCs)، مع قدرة التمايز والمساهمة في تجديد الأنسجة الوسيطة مثل العظام والغضاريف والعضلات، والرباط، ووتر والدهنية، وقد تم عزل من تقريبا جميع الأنسجة في الجسم الكبار1 , 2-غير توفير التوازن الأنسجة بإنتاج خلايا المقيم في حالة التهاب مزمن أو إصابة، أنها تنتج السيتوكينات الحيوية وعوامل النمو تنسق الأوعية والجهاز المناعي وأنسجة يعيد البناء3. تفاعل MSCs مع أنسجة السرطان ليست مفهومة جيدا، ولكن الأدلة المتراكمة أن MSCs قد تشجع على بدء وتطور، وورم خبيث الورم4.
قدرة صاروخ موجه من MSCs إلى منطقة إصابة أو التهاب مزمن يجعل منها مرشح قيماً للعلاجات القائمة على الخلايا الجذعية. ومع ذلك، أنسجة السرطان، "ابدأ شفاء الجروح"، أيضا الإفراج عن السيتوكينات الالتهابية وجزيئات برو-الأوعية، وعوامل النمو الحيوي، الذي جذب MSCs إلى منطقة كانسيروجينوس5. بينما هناك قلة ذكرت التقارير التي تبين الآثار المثبطة ل MSCs على نمو السرطان6،7، تطور السرطان وورم خبيث تعزيز الآثار قد تم على نطاق واسع8. MSCs مباشرة أو غير مباشرة تؤثر التسرطن بطرق مختلفة بما في ذلك قمع الخلايا المناعية، إفراز عوامل النمو/السيتوكينات التي تدعم انتشار خلايا السرطان، والهجرة، وتعزيز نشاط الأوعية، وتنظم 9،الانتقالية الظهارية الوسيطة (EMT)10. ورم البيئة يتألف من عدة أنواع الخلايا المرتبطة بالسرطان الخلايا الليفية (اجواءه) و/أو ميوفيبروبلاستس وخلايا بطانية، adipocytes والخلايا المناعية11. من هؤلاء، هي اجواءه نوع الخلية الأكثر وفرة في مجال الأورام التي تفرز مختلف المستقطبات تعزيز النمو وورم خبيث سرطان8. فقد ثبت أن MSCs المشتقة من نخاع العظم يمكن أن تفرق في اجواءه في ستروما ورم12.
الخلايا الجذعية البالغة لب الأسنان (دبسكس)، تميزت ك MSCs المستمدة من أنسجة الأسنان الأولى جرونثوس et al. 13 في عام 2000 ثم على نطاق واسع التحقيق قبل الآخرين14،15، التعبير عن علامات بلوريبوتينسي مثل Oct4، Sox2، و نانج16 ويمكن التفريق في خلية مختلفة ليناجيس17. تحليل تعبير الجينات والبروتين أثبت أن دبسكس تنتج مستويات مماثلة من عوامل النمو/السيتوكينات مع MSCs الأخرى مثل عامل نمو الأوعية الدموية غشائي (VEGF)، أنجيوجينين، وعامل النمو تنتجها الخلايا الليفية 2 (FGF2)، 4-انترلوكين (إيل-4)، إيل-6، وايل-10، والخلايا الجذعية عامل (SCF)، فضلا عن fms مثل تيروزين كيناز-3 يجند (أنطوني-3 لتر) التي قد تعزز الأوعية وتعدل الخلايا المناعية، ودعم سرطان الخلية الانتشار والهجرة18،19،20 . في حين كانت تفاعلات MSCs مع البيئة سرطان موثقة توثيقاً جيدا في الأدب، لم يجر تقييم العلاقة بين دبسكس والخلايا السرطانية بعد. في هذه الدراسة، قمنا بإنشاء استراتيجيات علاجية متوسطة الثقافة المشتركة وشرط لخط خلية سرطان البروستاتا المنتشر جداً والكمبيوتر-3 دبسكس أن يقترح الإجراء المحتمل لآلية MSCs طب الأسنان في تطور السرطان وورم خبيث.
Protocol
تم الحصول على الموافقة الخطية للمرضى بعد الموافقة من "لجنة الأخلاقيات المؤسسية".
1-دبسك العزلة والثقافة
- نقل الحكمة الأسنان التي تم الحصول عليها من الشباب الذين تتراوح أعمارهم بين 17 و 20 إلى 15 مل الأنابيب التي تحتوي على تعديل النسر المتوسطة (دميم كامل دولبيكو) [انخفاض الجلوكوز دميم وسائط الإعلام، وتستكمل مع 10% مصل بقرى الجنين (FBS) والبنسلين 1%/ستربتوميسين/ الحل الامفوتريسين (PSA)]، ضمن ح 8 بعد الاستئصال. الحفاظ على نسيج المواد الباردة (4 درجة مئوية) أثناء نقل لتجنب احتمال موت الخلية.
- إزالة نسيج اللب بالملقط استخراج العقيمة من مركز الأسنان بعناية ووضع أنسجة اللب في المتوسط دميم كاملة الباردة في 10 سم أطباق زرع الأنسجة وتخطر لهم إلى قطع صغيرة (2-3 مم) بدون مشرط.
ملاحظة: جميع الإجراءات التجريبية ينبغي أن يتم تحت ظروف معقمة في هود الاندفاق الصفحي. وقد تم هذا الأسلوب غير الانزيمية المستخدمة سابقا21،،من2223. - تعامل لوحات 6-جيدا أنسجة اللب الصغيرة مكان داخل زراعة الأنسجة وإضافة 200 ميليلتر وسائط دميم كاملة لتغطية كل قطع أنسجة اللب الصغيرة.
- احتضان الآبار زراعة الأنسجة في 37 درجة مئوية في جو هواء هوميديفيد (80% رطوبة) مع 5% CO2 لح 2 لتوفير مرفق الأنسجة.
ملاحظة: هذه الخطوة يمكن أن تطول إلى 3-4 ح بمراقبة التبخر من وسائل الإعلام. - إضافة المجلد المناسب (2-2.5 مل) لإكمال دميم المتوسطة إلى الآبار واحتضان في 37 درجة مئوية في جو هواء هوميديفيد مع 5% CO2 للخلايا لتنتشر من الأنسجة.
ملاحظة: الخلايا تصبح مرئية بعد حوالي 4 أيام والتوصل إلى كونفلوينسي بعد 8-9 أيام. - عندما تصل الخلايا إلى 80% كونفلوينسي، قم بإزالة الوسائط من لوحات 6-جيدا وتغسل مع 2 مل من المحلول الملحي الفوسفات مخزنة (PBS)، وإضافة 2 مل التربسين. احتضانها ل 2 دقيقة في حاضنة في 37 درجة مئوية مع الأجواء الجوية هوميديفيد و شركاه 5%2. قم بإضافة 2 مل من إكمال المتوسطة دميم متبوعاً بحضانة 2 دقيقة تمنع التربسين. الطرد المركزي خلايا في 300 غرام x لمدة 5 دقائق بيليه الخلايا.
- مرور الخلايا في قوارير في كامل وسائل الإعلام دميم ومخزن لتجارب أخرى. إضافة 15 مل كاملة دميم وسائط قوارير T-75 ونقل الخلايا من بئرين للوحة 6-جيدا لأحد T-75 قوارير واحتضان في 37 درجة مئوية مع الهواء هوميديفيد الغلاف الجوي و شركة 5%2.
2-وصف دبسكس
- إجراء التحليلات المورفولوجية.
- خلايا البذور (الخطوة 1، 6) في زراعة الأنسجة المغلفة قوارير (أو لوحات 6-جيدا) في المتوسط دميم كاملة للممرات 8 على الأقل لمراقبة مورفولوجيا الخلايا.
- الخلايا عن طريق مجهر ضوء تصور وتحديد مورفولوجيا تنتجها الخلايا الليفية مثل الخلية. الخلايا يجب أن نعلق على أطباق الثقافة ومورفولوجيا الخلية مثل المغزل.
ملاحظة: بدلاً من ذلك، الخلايا يمكن أن تكون مثقف كخلايا مفردة لمدة تصل إلى 14 يوما في بئر-لوحات لمراقبة مستعمرة تشكيل القدرات التي سمة من سمات محددة من الخلايا الليفية و MSCs.
- إجراء تحليلات ماركر السطحية.
- تريبسينيزي الخلايا من الخطوة 1، 7. قم بإزالة الوسائط من قارورة زراعة الأنسجة T-75 وتغسل مع 2 مل من برنامج تلفزيوني، وإضافة 2 مل التربسين. احتضانها ل 2 دقيقة في حاضنة في 37 درجة مئوية مع الأجواء الجوية هوميديفيد و شركاه 5%2. قم بإضافة 2 مل من إكمال المتوسطة دميم متبوعاً بحضانة 2 دقيقة تمنع التربسين. الطرد المركزي خلايا في 300 غرام x لمدة 5 دقائق بيليه الخلايا.
- إصلاح الخلايا مع بارافورمالدهيد 4% لمدة 20 دقيقة في درجة حرارة الغرفة في أنابيب 1.5 مل وغسلها ثم مع 500 ميليلتر من برنامج تلفزيوني 3 مرات لإزالة بارافورمالدهيد.
- احتضان خلايا ثابتة مع الأجسام المضادة ضد CD29، CD34، CD14، CD45، CD90، CD105، CD166، و CD73 عن ح 1 في 4 درجات مئوية في 100 ميليلتر من برنامج تلفزيوني.
ملاحظة: يتم تركيز الأجسام المضادة المستخدمة 0.5 ميكروغرام/مل. CD34 و CD14 CD45 تستخدم كعلامات سلبية، في حين CD29، CD90، CD105، CD166، CD73، وتستخدم كعلامات إيجابية الخلايا السطحية ل MSCs. - يغسل خلايا 3 مرات مع برنامج تلفزيوني واستخدام كل منها الأجسام المضادة الثانوية مثل fluorescein isothiocyanate (فيتك)، فيكوريثرين (PE)، و ما إلى ذلك لوضع العلامات. احتضان الخلايا مع الأجسام المضادة الثانوية المخفف 1: 500 في 100 ميليلتر من برنامج تلفزيوني لمدة 30 دقيقة في 4 درجات مئوية ويغسل 3 مرات مع برنامج تلفزيوني.
- الاحتفاظ بعينات في الظلام للتدفق الخلوي التحليل والكشف عن تلطيخ الموجبة والسالبة بالتدفق الخلوي.
ملاحظة: استخدام خلايا المراقبة أونستينيد لترتيب مبعثر أمامية وجانبية. ترتيب النابضة للايجاب الملون السكان باستثناء الخلايا الميتة والحطام، والسكان غير الملون. استخدام 100 ميكرومتر فوهة مع الضغط غمد 45 رطل/بوصة مربعة وجمع الأحداث 10,000 لتحديد دبسكس الإيجابية عن طريق ترتيب القنوات.
- تنفيذ التفريق بين دبسكس.
- البذور 1 × 104 خلايا على لوحات 24-جيدا في إكمال الإعلام دميم واحتضانها ل 24 ساعة عند 37 درجة مئوية في جو هواء هوميديفيد مع شركة 5%2.
- وضع التمييز بين استخدام وسائل الإعلام تتنافس المتوسطة دميم كقاعدة الوسائط. تعد وسائل الإعلام أوستيوجينيك بخلط 100 الديكساميتازون شمال البحر الأبيض المتوسط، 10 مم β-جليسيروفوسفاتي، وحمض الأسكوربيك 0.2 مم. تعد وسائل الإعلام تشوندروجينيك بخلط 1 × الأنسولين-ترانسفيرين-السيلنيوم (ITS-ز) 100 نانومتر الديكساميتازون، 100 نانوغرام/مليلتر تحويل عامل النمو بيتا (TGF-β)، وحمض الأسكوربيك ميكروغرام/مل 14 والبومين المصل البقري 1 ملغ/مل (BSA). تعد وسائل الإعلام أديبوجينيك بخلط 100 نانومتر الديكساميتازون 5 ميكروغرام/مل الأنسولين، 0.5 مم 3-إيسوبوتيل-1-زانتين (إيبمكس) و 60 ميكرومتر الاندوميتاسين.
ملاحظة: يمكن الاحتفاظ الوسائط التمايز في 4 درجات مئوية لمدة أسبوع واحد على الأقل. - تغيير وسائط النمو osteo-أو شندرو-أو وسائط التمايز أديبو الجينية وتحديث وسائل الإعلام مرتين في أسبوع لمدة أسبوعين.
- تأكيد التمايز كوسي فون والسيان تلطيخ الأزرق ونشاط إنزيم (النشاط الفوسفاتيز القلوية)، إيمونوسيتوتشيميستري، والتحاليل بوليميريز الكمية سلسلة من ردود الفعل (قبكر) وفقا للبروتوكولات المذكورة سابقا21.
- أداء فون كوسي وستاينينجس السيان الأزرق في الخلايا التي يتم إصلاحها مع بارافورمالدهيد 4% في درجة حرارة الغرفة للغسيل 10 دقيقة الخلايا الثابتة مع برنامج تلفزيوني ووصمة عار لهم مع عدة فونكوسا وفقا لتوصيات الشركة المصنعة لمراقبة الودائع الكالسيوم .
- إعداد السيان الأزرق تلطيخ الحل بتذويب ز 1.00 من الصبغة السيان الأزرق في 100 مل حمض الخليك 3% (v/v) لتلطيخ كذلك. تغسل الخلايا الثابتة مع برنامج تلفزيوني ووصمة عار الخلايا لمدة 30 دقيقة مع الحل السيان الأزرق. تصور العينات ملطخة مجهر خفيفة.
3-إعداد حالة متوسطة (سم)
- استبدال وسائط الإعلام خلايا في الخطوة 1، 7 ح 24 دميم كاملة جديدة قبل جمع سم.
ملاحظة: ينصح مرور 2-4. - جمع شرط المتوسطة (سم) من دبسكس مثقف عندما تصل الخلايا إلى 80% كونفلوينسي. الطرد المركزي وسائل الإعلام التي تم جمعها في 300 غرام x لمدة 5 دقائق لإزالة الحطام الأنسجة النفايات المادية وخلية.
ملاحظة: بدلاً من ذلك، استخدام 0.2 ميكرون حقنه مرشحات لإزالة الحطام من المتوسطة شرط. - جمع المادة طافية وتخزينها في-20 درجة مئوية لإجراء مزيد من التجارب.
ملاحظة: الاحتفاظ المادة طافية في-80 درجة مئوية للتخزين على المدى الطويل.
4-معاملة الخلايا السرطانية مع سم
- إجراء تحليلات بقاء الخلية.
- البذور PC-3 خلايا (خلايا سرطان البروستاتا البشرية) على لوحات 96-جيدا في كثافة خلية3 5 × 10 خلايا/بئر في إكمال دميم واحتضان في دائرة هوميديفيد في 37 درجة مئوية و 5% CO2 ل 24 ساعة.
- علاج الخلايا التي تحتوي على 10، 20، 30 و 40 و 50 في المائة من سم (v/v) مختلطة مع دميم كاملة ح 24.
- قياس جدوى الخلية باستخدام 3-(4,5-dimethyl-thiazol-2-yl)-5-(3-carboxymethoxy-phenyl)-2-(4-sulfo-phenyl)-2H-tetrazolium (MTS)-الاعتداء كما هو موضح سابقا24.
- أداء محطة ديوكسينوكليوتيديل ترانسفيراز dUTP نك نهاية الوسم تحليلات (TUNEL).
- بذور PC-3 الخلايا على ثقافة الخلية جيدا 6 لوحات في كثافة خلية 2 × 105 خلايا/حسنا واحتضانها في دائرة هوميديفيد في 37 درجة مئوية و 5% CO2 بين عشية وضحاها.
- مزيج % 20 سم (v/v) مع إكمال المتوسطة دميم وتطبيقها على الخلايا ح 24.
- تريبسينيزي الخلايا وتعليق في 50 ميكروليتر TUNEL رد فعل خليط (وسم الحل + حل الإنزيم، زودت عدة) واحتضان في 37 درجة مئوية لمدة 60 دقيقة في جو2 هوميديفيد و 5 في المائة من أول أكسيد الكربون.
ملاحظة: تريبسينيزيشن، قم بإزالة الوسائط من لوحات ثقافة الخلية 6-جيدا وتغسل مع 1 مل من برنامج تلفزيوني، وإضافة 500 ميليلتر من التربسين. احتضانها ل 2 دقيقة في حاضنة في 37 درجة مئوية مع الأجواء الجوية هوميديفيد و شركاه 5%2. أضف 1 مل من إكمال المتوسطة دميم متبوعاً بحضانة 2 دقيقة تمنع التربسين. الطرد المركزي خلايا في 300 غرام x لمدة 5 دقائق بيليه الخلايا. - شطف مع برنامج تلفزيوني وتحليل الخلايا في برنامج تلفزيوني باستخدام التدفق الخلوي.
- إجراء تحليلات qPCR.
- بذور الخلايا PC-3 إلى 6-جيدا خلية ثقافة لوحات في كثافة خلية 2 × 105 خلايا/جيدا واحتضان في حاضنة هوميديفيد في 37 درجة مئوية و 5% CO2 بين عشية وضحاها.
- مزيج % 20 سم (v/v) مع إكمال المتوسطة دميم وتطبيقها على الخلايا ح 24.
- تريبسينيزي الخلايا وجمع بيليه خلية للتوليف والعزلة وكدنا الجيش الملكي النيبالي.
ملاحظة: قم بإزالة الوسائط من لوحات ثقافة الخلية 6-جيدا وتغسل مع 1 مل من برنامج تلفزيوني، وإضافة 500 ميليلتر من التربسين. احتضان 2 دقيقة في حاضنة في 37 درجة مئوية مع الأجواء الجوية هوميديفيد و شركاه 5%2. أضف 1 مل من إكمال المتوسطة دميم متبوعاً بحضانة 2 دقيقة تمنع التربسين. الطرد المركزي خلايا في 300 غرام x لمدة 5 دقائق بيليه الخلايا. - القيام بتجارب qPCR وفقا للبروتوكول هو موضح سابقا25.
- تؤدي الهجرة الخلية من الخلايا السرطانية.
- البذور 1 × 105 PC-3 الخلايا على لوحات 12-جيدا، واحتضان في حاضنة هوميديفيد بين عشية وضحاها في 37 درجة مئوية و 5% CO2.
- الصفر في الخلايا مع تلميح عقيمة 200 ميكروليتر وتغيير المتوسطة فورا مع المتوسطة الطازجة التي تحتوي على تركيزات مختلفة من سم [مثلاً، 10، 20، 30 و 40 و 50% من سم (v/v) مختلطة مع دميم كاملة].
- الخدوش تحت مجهر مقلوب مراقبة والتقاط صور في فترات زمنية مختلفة (0 و 24 ساعة).
- قياس إغلاق الصفر باستخدام البرمجيات "ي الصورة" باستخدام الصيغة:
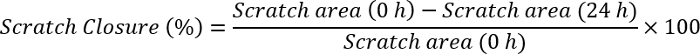
ملاحظة: فتح الصورة الصفر مع البرمجيات "ي الصورة". رسم خط بنفس حجم شريط نطاق موجود بالفعل في الصورة. انقر فوق تحليل وتعيين المقياس ومراعاة المسافة بالبكسل تكبير الخط مرسومة. كتابة حجم شريط مقياس للجزء المسافة المعروفة وترتيب الوحدة (بكسل، سم، إلخ)، وانقر فوق موافق. الانتقال إلى المقطع تحليل مرة أخرى وانقر على القياسات. وهذا سيعطي أولاً حجم شريط مقياس كوحدة مختارة. انقر فوق حافة واحدة من الصفر واسحب حتى الوصول إلى الجانب الآخر من نقطة الصفر. قم بتدوين القيمة لكل نقطة الوقت (ح 0 وح 24). قم بتوصيل هذه القيم في الصيغة المذكورة أعلاه وحساب إغلاق الصفر.
5-خلية الهجرة عن طريق الاتصال غير المباشر للخلايا السرطانية ودبسكس
- البذور 3 × 104 دبسكس على إدراج لوحة 24-جيدا مع 0.4 ميكرومتر المسامية واحتضان في حاضنة هوميديفيد بين عشية وضحاها في 37 درجة مئوية.
- لوحات في كثافة خلية من 5 × 104 البذور PC-3 الخلايا على 24-جيدا واحتضان في حاضنة هوميديفيد بين عشية وضحاها في 37 درجة مئوية و 5% CO2.
- الصفر PC-3 الخلايا مع تلميح عقيمة 200 ميكروليتر وتغيير المتوسطة مع المتوسط الطازجة ومكان إدراج تحمل دبسكس على الكمبيوتر-3 خلايا.
- الخلايا تحت مجهر مقلوب مراقبة والتقاط صور في فترات زمنية مختلفة (ح 0 و 24) لتحليل الهجرة الخلية.
6-اشترك في الثقافة المقايسة والتدفق الخلوي التحليل
- قم بتسمية الكمبيوتر-3 الخلايا ودبسكس باستخدام PKH67 (الأخضر) والأصباغ رابط خلية الفلورسنت (أحمر) PKH26، على التوالي26.
- تريبسينيزي الخلايا PC-3، ودبسكس، على التوالي. قم بإزالة الوسائط من قارورة زراعة الأنسجة T-75 وتغسل مع 2 مل من برنامج تلفزيوني، وإضافة 2 مل التربسين. احتضانها ل 2 دقيقة في حاضنة في 37 درجة مئوية مع الأجواء الجوية هوميديفيد و شركاه 5%2. إضافة 2 مل من إكمال المتوسطة دميم متبوعاً بحضانة 2 دقيقة تمنع التربسين.
- الطرد المركزي خلايا في 300 غرام x لمدة 5 دقائق وتجاهل المادة طافية ريسوسبيند الكريات الخلية في صبغ الحل أعد مخفف-ج المخزن المؤقت بالطقم (انظر الجدول للمواد).
- احتضان خلايا في الحل صبغ لمدة 10 دقائق وإنهاء رد فعل المصبوغة بإضافة 100 ميليلتر من FBS. الطرد المركزي خلايا في 300 غرام x لمدة 5 دقائق وتجاهل المادة طافية وغسل الخلايا مع متوسط النمو الكامل قبل استزراع المشترك.
- لوحة تسمية الخلايا (5 × 104/جيد) على لوحات 6-جيدا في نسبة 1:1 (دبسكس: PC3). الحفاظ على الخلايا المستزرعة شارك في دميم كاملة.
- جمع الخلايا بعد 24 ساعة أو 48 ساعة من فترات حضانة بالطرد المركزي خلايا في ز 300 x لمدة 5 دقائق والغسيل مع برنامج تلفزيوني.
- ريسوسبيند الخلايا في 300 ميليلتر من خلية تنشيط fluorescence الفرز المخزن المؤقت (نظام مراقبة الأصول الميدانية) في 5 مل جولة أسفل التدفق الخلوي أنابيب. دوامة لتفريق المجاميع خلية الحق قبل تحليل العينة.
- استخدام فوهة 100 ميكرومتر مع الضغط غمد 45 رطل/بوصة مربعة.
ملاحظة: قد يخفض معدل تدفق عالية للغاية حساسية الكشف عن الأسفار. - استخدام التحكم أونستينيد الخلايا والخلايا الملونة واحد لضبط مناسب للأمام والجانب مبعثر الجهد الليزر لأنواع الخلايا وتعويض كما ذكرنا سابقا27.
ملاحظة: استخدم النابضة للخلايا الحية لاستبعاد الحطام الخلية أو الخلايا الميتة، أو المجاميع. - جمع الأحداث 10,000 (100,000 الأفضل) لتحديد نسبة إيجابية دبسكس الخضراء والحمراء PC-3 الخلايا عن طريق ترتيب قنوات فلوريدا-2 (أحمر) وفلوريدا-1 (أخضر).
النتائج
ويصور الشكل 1 ماجستير الخصائص العامة دبسكس تحت ظروف الثقافة. دبسكس بذل مورفولوجيا تنتجها الخلايا الليفية مثل الخلية بعد الطلاء (الشكل 1B). ماجستير المستضدات السطحية (CD29، CD73، CD90، CD105، و CD166) شديدة يعبر عنها بينما علامات المكونة للدم (CD34 و CD45 و C...
Discussion
مساهمة MSCs للبيئة الورم ينظم التفاعلات عدة بما في ذلك الجيل الهجين خلية عن طريق اندماج الخلية، وأنشطة انتوسيس أو سيتوكين وتشيموكيني بين الخلايا الجذعية و خلايا السرطان28. الهيكل التنظيمي والتفاعلات خلية خلية ويفرز عوامل تحديد سلوك خلايا السرطان من حيث تعزيز الورم والتدر?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذه الدراسة جامعة يديتيب. وكانت جميع البيانات والأرقام المستخدمة في هذه المقالة المنشورة سابقا34.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11885084 | For cell culture |
| FBS | Invitrogen | 16000044 | For cell culture |
| PSA | Lonza | 17-745E | For cell culture |
| Trypsin | Invitrogen | 25200056 | For cell dissociation |
| PBS | Invitrogen | 10010023 | For washes |
| Dexamethasone | Sigma | D4902 | Component of differentiation media |
| β-Glycerophosphate | Sigma | G9422 | Component of osteogenic differentiation medium |
| Ascorbic acid | Sigma | A4544 | Component of osteo- and chondro-genic differentiation medium |
| Insulin-Transferrin-Selenium (ITS −G) | Invitrogen | 41400045 | Component of chondrogenic differentiation medium |
| TGF-β | Sigma | SRP3171 | Component of chondrogenic differentiation medium |
| Insulin | Sigma | I6634 | Component of adipogenic differentiation medium |
| Isobutyl-1-methylxanthine (IBMX) | Sigma | I7018 | Component of adipogenic differentiation medium |
| Indomethacin | Sigma | I7378 | Component of adipogenic differentiation medium |
| MTS Reagent | Promega | G3582 | Cell viability analyses |
| TUNEL Assay | Sigma | 11684795910 | Apoptotic analyses |
| 24-well plate inserts | Corning | 3396 | For trans-well migration assay |
| PKH67 | Sigma | PKH67GL | For co-culture cell staining |
| PKH26 | Sigma | PKH26GL | For co-culture cell staining |
| Paraformaldehyde | Sigma | P6148 | For cell fixation |
| von Kossa Kit | BioOptica | 04-170801.A | For cell staining (differentiation) |
| Alcian blue | Sigma | A2899 | For cell staining (differentiation) |
References
- Camberlain, G., Fox, J., Ashton, B., Middleton, J. Mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Demirci, S., Doğan, A., Şahin, F. . Dental Stem Cells. , 109-124 (2016).
- Fox, J. M., Chamberlain, G., Ashton, B. A., Middleton, J. Recent advances into the understanding of mesenchymal stem cell trafficking. British journal of haematology. 137 (6), 491-502 (2007).
- Chang, A. I., Schwertschkow, A. H., Nolta, J. A., Wu, J. Involvement of mesenchymal stem cells in cancer progression and metastases. Current cancer drug targets. 15 (2), 88-98 (2015).
- Dvorak, H. F. Tumors: wounds that do not heal. New England Journal of Medicine. 315 (26), 1650-1659 (1986).
- Lu, Y. -. r., et al. The growth inhibitory effect of mesenchymal stem cells on tumor cells in vitro and in vivo. Cancer biology & therapy. 7 (2), 245-251 (2008).
- Secchiero, P., et al. Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts. PloS one. 5 (6), e11140 (2010).
- Hong, I. -. S., Lee, H. -. Y., Kang, K. -. S. Mesenchymal stem cells and cancer: friends or enemies?. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 768, 98-106 (2014).
- Brennen, W. N., Chen, S., Denmeade, S. R., Isaacs, J. T. Quantification of Mesenchymal Stem Cells (MSCs) at sites of human prostate cancer. Oncotarget. 4 (1), 106 (2013).
- Klopp, A. H., Gupta, A., Spaeth, E., Andreeff, M., Marini, F. Concise review: dissecting a discrepancy in the literature: do mesenchymal stem cells support or suppress tumor growth. Stem cells. 29 (1), 11-19 (2011).
- Albini, A., Sporn, M. B. The tumour microenvironment as a target for chemoprevention. Nature Reviews Cancer. 7 (2), 139 (2007).
- Quante, M., et al. Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth. Cancer cell. 19 (2), 257-272 (2011).
- Gronthos, S., Mankani, M., Brahim, J., Robey, P. G., Shi, S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 97 (25), 13625-13630 (2000).
- Mori, G., et al. Dental pulp stem cells: osteogenic differentiation and gene expression. Annals of the new York Academy of Sciences. 1237 (1), 47-52 (2011).
- Mori, G., et al. Osteogenic properties of human dental pulp stem cells. Journal of biological regulators and homeostatic agents. 24 (2), 167-175 (2010).
- Kerkis, I., et al. Isolation and characterization of a population of immature dental pulp stem cells expressing OCT-4 and other embryonic stem cell markers. Cells Tissues Organs. 184 (3-4), 105-116 (2006).
- Potdar, P. D., Jethmalani, Y. D. Human dental pulp stem cells: applications in future regenerative medicine. World journal of stem cells. 7 (5), 839 (2015).
- Ahmed, N. E. -. M. B., Murakami, M., Hirose, Y., Nakashima, M. Therapeutic potential of dental pulp stem cell secretome for Alzheimer's disease treatment: an in vitro study. Stem cells international. 2016, (2016).
- Gorin, C., et al. Priming dental pulp stem cells with fibroblast growth factor-2 increases angiogenesis of implanted tissue-engineered constructs through hepatocyte growth factor and vascular endothelial growth factor secretion. Stem cells translational medicine. 5 (3), 392-404 (2016).
- Wakayama, H., et al. Factors secreted from dental pulp stem cells show multifaceted benefits for treating acute lung injury in mice. Cytotherapy. 17 (8), 1119-1129 (2015).
- Doğan, A., et al. Differentiation of human stem cells is promoted by amphiphilic pluronic block copolymers. International Journal of Nanomedicine. 7, 4849 (2012).
- Taşlı, P. N., Doğan, A., Demirci, S., Şahin, F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro. Biological trace element research. 153 (1-3), 419-427 (2013).
- Yalvac, M., et al. Isolation and characterization of stem cells derived from human third molar tooth germs of young adults: implications in neo-vascularization, osteo-, adipo-and neurogenesis. The pharmacogenomics journal. 10 (2), 105 (2010).
- Doğan, A., et al. Sodium pentaborate pentahydrate and pluronic containing hydrogel increases cutaneous wound healing in vitro and in vivo. Biological trace element research. 162 (1-3), 72-79 (2014).
- Doğan, A., Yalvaç, M. E., Yılmaz, A., Rizvanov, A., Şahin, F. Effect of F68 on cryopreservation of mesenchymal stem cells derived from human tooth germ. Applied biochemistry and biotechnology. 171 (7), 1819-1831 (2013).
- Rizvanov, A. A., et al. Interaction and self-organization of human mesenchymal stem cells and neuro-blastoma SH-SY5Y cells under co-culture conditions: A novel system for modeling cancer cell micro-environment. European Journal of Pharmaceutics and Biopharmaceutics. 76 (2), 253-259 (2010).
- Troiano, L., et al. Multiparametric analysis of cells with different mitochondrial membrane potential during apoptosis by polychromatic flow cytometry. Nature protocols. 2 (11), 2719 (2007).
- Melzer, C., von der Ohe, J., Lehnert, H., Ungefroren, H., Hass, R. Cancer stem cell niche models and contribution by mesenchymal stroma/stem cells. Molecular cancer. 16 (1), 28 (2017).
- Aguirre, A., Planell, J., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and biophysical research communications. 400 (2), 284-291 (2010).
- Bogdanowicz, D. R., Lu, H. H. . Biomimetics and Stem Cells. , 29-36 (2013).
- Plotnikov, E., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of cellular and molecular. 12 (5a), 1622-1631 (2008).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology journal. 8 (4), 395-396 (2013).
- Brunetti, G., et al. High expression of TRAIL by osteoblastic differentiated dental pulp stem cells affects myeloma cell viability. Oncology reports. 39 (4), 2031-2039 (2018).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Dental pulp stem cells (DPSCs) increase prostate cancer cell proliferation and migration under in vitro conditions. Tissue and Cell. 49 (6), 711-718 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved