Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mezenkimal kök hücre izolasyon hamuru doku ve kanser hücreleri ile ortak kültür ilişkileri incelemek için
Bu Makalede
Özet
Mezenkimal kök hücre diş hamurundan izole ve prostat kanseri hücre etkileşimi doğrudan ve dolaylı ortak kültür yöntemleri üzerinde temel değerlendirilmesi için iletişim kuralları sağlar. Koşul orta ve trans-şey membranlar dolaylı parakrin etkinliğini çözümlemeye uygundur. Differentially Tohum hücreleri birlikte lekeli doğrudan hücre-hücre etkileşim için uygun bir model olduğunu.
Özet
Kanser bir multistep süreç ve karmaşık hastalık olarak sadece tek tek hücre çoğalması ve büyüme tarafından yetkilendirilmekte ama aynı zamanda tümör çevre ve hücre-hücre etkileşimler tarafından kontrol. Kanser ve kök hücre etkileşimleri, hücre dışı ortam, fiziksel etkileşimleri ve salgılanan faktörler, değişiklikler de dahil olmak üzere yeni terapi seçenekleri bulmayı etkinleştirmek. Biz bilinen ortak kültürü teknikleri mezenkimal kök hücre (MSCs) ve kanser için bir model sistemi hücre etkileşimler oluşturmak için birleştirmek. Mevcut çalışmada, diş pulp kök hücreler (DPSCs) ve PC-3 prostat kanseri hücre etkileşimi doğrudan ve dolaylı ortak kültürü teknikleri tarafından incelenmiş. Koşul Orta (CM) DPSCs elde edilen ve 0.4 µm boyutlu gözenek trans-şey membranlar parakrin etkinlik eğitim için kullanılmıştır. Farklı hücre tiplerinin ortak kültür birlikte doğrudan hücre-hücre etkileşim çalışma gerçekleştirildi. Sonuçları CM hücre çoğalması arttı ve prostat kanseri hücre kültürlerinde apoptosis azalma saptandı. CM ve trans-şey sistem PC-3 hücre hücre göç kapasitesini arttırdı. Farklı membran boyalar ile lekeli hücreleri aynı kültür damarlarının tohumlari ve bu doğrudan ortak kültür koşul altında PC-3 hücreleri ile kendi kendine organize bir yapıda DPSCs katıldı. Genel olarak, sonuçlar ortak kültürü teknikleri bir modeli sistem olarak kanser ve MSC etkileşimleri için yararlı olabilir göstermiştir.
Giriş
Mezenkimal kök hücre (MKH), farklılaşma ve rejenerasyon ve yağ, kemik, kıkırdak, kas, ligament, tendon gibi mezenkimal dokuların katkısı yeteneklerini ile yetişkin vücut1 hemen hemen tüm dokularda yalıtılmış olmuştur , 2. kronik inflamasyon veya bir yaralanma durumunda ikamet hücreler üreterek doku homeostazı sağlamanın dışında onlar çok önemli sitokinler ve büyüme faktörleri anjiogenezi, bağışıklık sistemi ve3remodeling doku alacak üretmek. MSCs etkileşim kanser dokusu iyi anlaşılmış değil ama MSCs tümör başlatma, ilerleme ve metastaz4teşvik biriken kanıtlar gösteriyor.
MSCs homing yeteneği yaralı veya kronik iltihaplı alanına onları kök hücre tabanlı terapiler için değerli bir aday yapar. Ancak, kanser dokular, "asla yaralar şifa", ayrıca sürümü inflamatuar sitokinlerin, pro-anjiogenik molekülleri ve MSCs cancerogenous alan5' e çekmek önemli büyüme faktörleri. Sınırlı iken MSCs inhibitör etkileri kanser büyüme6üzerinde,7, kanser ilerlemesi ve etkileri teşvik metastaz kapsamlı olmuştur gösteren raporlar8bildirdi. MSCs doğrudan veya dolaylı olarak karsinojenezis bağışıklık hücreleri salgılayan destek kanser hücre çoğalması ve anjiogenik etkinliğini arttırmak ve düzenleyen göç, büyüme faktörleri/sitokinler, gizleme de dahil olmak üzere farklı şekillerde etkiler mezenkimal epitel geçiş (EMT)9,10. Tümör ortam kanser ilişkili fibroblastlar (restorantlar) ve/veya myofibroblasts, endotel hücreleri, adipositler ve bağışıklık hücreleri11de dahil olmak üzere çeşitli hücre türleri oluşur. O, restorantlar en bol hücre kanser büyüme ve metastaz8teşvik çeşitli kemokinler salgılar tümör alanında türüdür. Bu kemik iliği türevi MSCs tümör stroma12' restorantlar ayırabilirsiniz gösterilmiştir.
Diş pulp kök hücreler (DPSCs), ilk diş doku kaynaklı MSCs karakterize tarafından Gronthos vd. 13 2000 yılında yaygın olarak başkaları tarafından14,15araştırdık, hızlı pluripotency işaretleri Oct4, Sox2ve MicroRNAs16 gibi ve çeşitli hücre linages17ayırabilirsiniz. Gen ve protein ifade analizi ispat DPSCs büyüme faktörleri/sitokinler vasküler endotelyal büyüme faktörü (VEGF), angiogenin, fibroblast büyüme faktörü 2 (FGF2), interlökin-4 (IL-4), gibi diğer MSCs ile karşılaştırılabilir düzeyde üretmek Il-6, IL-10, ve kök hücre faktörü (SCF) yanı sıra angiogenez teşvik, bağışıklık hücreleri modüle ve kanser hücre çoğalması ve geçiş18,19,20 destek fms benzeri Tirozin kinaz-3 ligand (Flt - 3 L) . Ise MSCs etkileşimleri kanser çevre ile literatürde iyi belgelenmiş olabilirdi, DPSCs ve kanser hücrelerinin ilişkisi henüz değerlendirilmemiştir. Bu da çalışmanın, ortak kültür ve durumu orta tedavi stratejileri çok metastatik prostat kanseri hücre kültürünü, PC-3 ve olası eylem mekanizması kanser ilerlemesi ve metastaz diş MSCs evlenme DPSCs kurduk.
Protokol
Yazılı onam hastaların onayı alındıktan sonra kurumsal etik komiteden elde edildi.
1. DPSC yalıtım ve kültür
- Yirmi yaş dişleri tam Dulbecco'nın modifiye kartal Orta (DMEM) içeren 20-15 mL tüpler arasında 17 yaşındaki genç yetişkinler elde edilen aktarım [düşük glikoz DMEM medya, % 10 fetal Sığır serum (FBS) ve % 1 penisilin/streptomisin ile desteklenmiş / amfoterisin (PSA) çözüm], içinde 8 h rezeksiyonundan sonra. Doku malzeme soğuk (4 ° C) aktarımı sırasında potansiyel hücre ölümü önlemek için tutmak.
- Hamuru doku steril ayıklama forseps diş Merkezi tarafından dikkatli bir şekilde çıkarın, 10 cm doku kültürü yemekleri soğuk tam DMEM ortamda hamuru doku yerleştirin ve onları küçük parçalara (2-3 mm) tarafından neşteri kıyma.
Not: Tüm deneysel prosedürler laminar akış başlıklı steril koşullarda yapılmalıdır. Enzimatik olmayan bu tekniği daha önce kullanılan21,22,23olmuştur. - Yer küçük hamuru doku doku kültürü içinde 6-şey plakaları tedavi ve 200 µL her küçük hamuru doku parçaları kapsayacak şekilde tam DMEM medya ekleyin.
- Doku kültürü wells bir oksijen hava atmosferde (%80 nem) 37 ° C'de % 5 CO2 doku eki sağlamak 2 h için kuluçkaya.
Not: Medya buharlaşma kontrol ederek 3-4 h için bu adımı uzun. - Uygun birim (2-2.5 mL) tam DMEM orta kuyu için ekleyin ve % 5 CO2 dokudan yaymak hücrelerin oksijen hava atmosferde 37 ° C'de kuluçkaya.
Not: Hücreleri yaklaşık 4 gün sonra görünür hale gelir ve 8-9 gün sonra confluency ulaşır. - Hücrelerin % 80 confluency ulaştığınızda, media 6-şey plakalar kaldırmak, fosfat tamponlu tuz (PBS) 2 mL ile yıkayın ve tripsin 2 mL ekleyin. Bir kuluçka oksijen hava atmosferi ile 37 ° C'de 2 dk ve % 5 CO2için kuluçkaya. O zaman tam DMEM orta tripsin etkisizleştirmek için 2 dk kuluçka tarafından takip 2 mL ekleyin. Hücreler hücreleri cips 5 min için 300 x g, santrifüj kapasitesi.
- Tam DMEM medya ve mağaza daha fazla deneyler için şişeler için geçiş hücreleri. Komple DMEM medya 15 mL 6-şey plaka bir T-75 şişeler için iki kuyulardan T-75 şişeler ve transfer hücreleri ekleyin ve oksijen hava atmosferi ve % 5 CO237 ° C'de kuluçkaya.
2. DPSCs karakterizasyonu
- Morfolojik çözümlemesi.
- Tohum hücreleri (adım 1.6) doku kültürü şişeler (veya 6-şey tabak) hücre morfolojisi gözlemlemek en az 8 pasajlar için tam DMEM orta kaplı.
- Hücreleri tarafından ışık mikroskobu görselleştirmek ve fibroblast benzeri hücre morfolojisi tanımlayın. Hücre kültür yemekleri iliştirin ve Milli benzeri hücre morfolojisi var.
Not: Alternatif olarak, hücreleri tek hücre olarak 14 gün içinde fibroblastlar ve MSCs belirli bir karakteristik koloni oluşumu kapasite gözlemlemek için iyi-tabaklar için kültürlü.
- Yüzey marker çözümlemesi.
- Adım 1.7 hücrelerden trypsinize. Medya T-75 doku kültürü balonun kaldırmak, PBS 2 mL ile yıkayın ve tripsin 2 mL ekleyin. Bir kuluçka oksijen hava atmosferi ile 37 ° C'de 2 dk ve % 5 CO2için kuluçkaya. O zaman tam DMEM orta tripsin etkisizleştirmek için 2 dk kuluçka tarafından takip 2 mL ekleyin. Hücreler hücreleri cips 5 min için 300 x g, santrifüj kapasitesi.
- %4 paraformaldehyde 1,5 mL tüpler içinde oda sıcaklığında 20 dakika ile hücreleri tamir ve sonra paraformaldehyde kaldırmak için PBS 3 kez 500 µL ile yıkayın.
- CD29, CD34, CD14, CD45, CD90, CD105, CD166 ve CD73 karşı antikorlar için 1s PBS 100 µL 4 ° C'de sabit hücrelerle kuluçkaya.
Not: Kullanılan antikor 0,5 µg/mL bölgedir. CD29, CD90, CD105, CD166 ve CD73 için MSCs pozitif hücre yüzey işaretleyicileri kullanılırken CD34, CD14 ve CD45 negatif işaretleri kullanılır. - Hücreleri 3 kez PBS ile yıkama ve floresein isothiocyanate (FITC), phycoerythrin (PE), vb gibi ilgili ikincil antikorlar etiketleme için kullanın. PBS 100 µL 4 ° C'de 30 dk içinde seyreltilmiş 1:500 ikincil antikorlar içeren hücreleri ve yıkama 3 kez PBS ile kuluçkaya.
- Akış Sitometresi Analizi için örnekleri anlatmamanı ve akış sitometresi tarafından pozitif ve negatif boyama algılamak.
Not: günahı kontrol hücreleri ön ve yan dağılım düzenlemek için kullanın. Olumlu, perdeleme nüfus ölü hücreleri, enkaz ve un lekeli nüfus hariç tutarak lekeli düzenleyin. 100 µm meme 45 psi kılıf basınçla kullanın ve olumlu DPSCs kanalları düzenleyerek belirlemek için 10,000 olayları toplamak.
- DPSCs farklılaşma gerçekleştirin.
- Tohum 1 × 104 hücreleri 24-şey levha üzerine DMEM medya tamamlandı ve oksijen hava atmosferde % 5 CO237 ° C'de 24 h için kuluçkaya.
- Farklılaşma formüle kullanarak medya rekabet DMEM orta temel medya olarak. Osteojenik medya 100 nM deksametazon, 10 mM β-gliserofosfat ve 0.2 mM askorbik asit karışımı ile hazırlayın. Chondrogenic medya 1 × insülin-transferrin-selenyum (ITS-G), 100 nM deksametazon, 100 ng/mL dönüştürme büyüme faktörü beta (TGF-β), 14 μg/mL askorbik asit ve 1 mg/mL Sığır serum albumin (BSA) karıştırarak hazırlayın. Adipojenik medya 100 nM deksametazon, 5 μg/mL insülin, 0,5 mM 3-izobütil-1-methylxanthine (IBMX) ve 60 mikron indometazin karıştırarak hazırlayın.
Not: Farklılaşma medya en az bir hafta için 4 ° C'de tutulabilir. - Osteo, kondro veya adipo genetik farklılaşma medya büyüme medya ve yenileme medya iki hafta boyunca haftada iki kez değiştirin.
- Von Kossa ve Alcian mavi boyama, enzim aktivitesi (alkalen fosfataz aktivitesi), immunocytochemistry ve nicel polimeraz zincir reaksiyonu (qPCR) analizleri protokolleri yukarıda açıklanan21göre farklılaşma onaylayın.
- Von Kossa gerçekleştirmek ve Alcian mavi stainings, oda sıcaklığında 10 dakika süreyle %4 paraformaldehyde ile sabit hücrelerde PBS sabit hücrelerle yıkama ve onlara göre kalsiyum mevduat gözlemlemek için üreticinin önerilerini vonKossa kiti ile leke .
- Çözüm Alcian mavi boya daha fazla boyama için % 3 (v/v) asetik asitin 100 ml 1.00 g çözülerek boyama mavi Alcian hazırlayın. PBS sabit hücrelerle yıkama ve hücreler için 30 dk Alcian mavi çözüm ile leke. Lekeli örnekleri tarafından ışık mikroskop görselleştirin.
3. hazırlık durumu orta (CM)
- Medya hücre adım 1.7 taze tam DMEM 24 h CM koleksiyonu önce değiştirin.
Not: Geçiş 2-4 önerilir. - Hücrelerin % 80 confluency ulaştığınızda durumu orta (CM) kültürlü DPSCs toplamak. 300 x g atık doku malzeme ve hücre artıkları kaldırmak 5 min için toplanan medya santrifüj kapasitesi.
Not: Alternatif olarak, koşul ortamından enkaz kaldırmak için 0.2 µm şırınga filtreleri kullanın. - Süpernatant toplamak ve daha fazla deneyler için-20 ° C'de depolayın.
Not: uzun süreli depolama için-80 ° C'de süpernatant devam et.
4. tedavi CM ile kanser hücrelerinin
- Hücre canlılığı çözümlemesi.
- Tohum PC-3 hücre (insan prostat kanseri hücreleri) 5 × 103 hücreleri/iyi bir hücre yoğunluğuna, 96-şey plakalar üzerine DMEM tamamlamak ve 37 ° C ve % 5 CO2 24 h için oksijen odasında kuluçkaya.
- 10, 20, 30, 40 ve %50 cm (v/v) için 24 saat tam DMEM ile karışık hücrelerle tedavi.
- Ölçmek 3-(4,5-dimethyl-thiazol-2-yl)-5-(3-carboxymethoxy-phenyl)-2-(4-sulfo-phenyl)-2H-tetrazolium kullanarak hücre canlılığı (MTS)-tahlil24daha önce açıklandığı gibi.
- Terminal deoksinükleotidil transferaz dUTP nick uç (tünel) analizleri etiketleme gerçekleştirin.
- PC-3 hücreleri tabak 2 × 105 hücre yoğunluğu, hücreler/iyi ve oksijen odası 37 ° C ve %5 CO2 gecede kuluçkaya 6-şey hücre kültürü üzerine tohum.
- % 20 CM (v/v) ile DMEM orta tamamlamak ve 24 h için hücrelere uygulayın karıştırın.
- Hücreleri trypsinize ve tünel tepki karışımı (etiketleme çözüm + enzim çözüm, kiti ile birlikte) 50 μL askıya alma ve bir atmosferde oksijen ve % 5 CO2 60 dk 37 ° C'de kuluçkaya.
Not: Trypsinization için medya 6-şey hücre kültür plakalar kaldırın, PBS 1 mL ile yıkayın ve tripsin 500 µL ekleyin. Bir kuluçka oksijen hava atmosferi ile 37 ° C'de 2 dk ve % 5 CO2için kuluçkaya. Tripsin etkisizleştirmek için 2 dk kuluçka tarafından takip tam DMEM orta 1 mL ekleyin. Hücreler hücreleri cips 5 min için 300 x g, santrifüj kapasitesi. - PBS ile durulayın ve akış sitometresi PBS hücrelerde çözümleme.
- QPCR çözümlemesi.
- PC-3 hücreleri tabak 2 × 105 hücre yoğunluğu, hücreler/iyi ve 37 ° C ve %5 CO2 oksijen bir kuluçka gecede kuluçkaya 6-şey hücre kültürü üzerine tohum.
- % 20 CM (v/v) ile DMEM orta tamamlamak ve 24 h için hücrelere uygulayın karıştırın.
- Trypsinize hücreleri ve hücre Pelet RNA izolasyon ve cDNA sentezi için toplamak.
Not: medya 6-şey hücre kültür plakalar kaldırın, PBS 1 mL ile yıkayın ve tripsin 500 µL ekleyin. Bir kuluçka oksijen hava atmosferi ile 37 ° C'de 2 dk ve % 5 CO2kuluçkaya. Tripsin etkisizleştirmek için 2 dk kuluçka tarafından takip tam DMEM orta 1 mL ekleyin. Hücreler hücreleri cips 5 min için 300 x g, santrifüj kapasitesi. - QPCR deneyler yukarıda açıklanan protokol25göre gerçekleştirin.
- Kanser hücrelerinin hücre geçiş yapmanız.
- Tohum 1 × 105 PC-3 12-şey plakalar hücreleri ve 37 ° C ve % 5 CO2gece de oksijen bir kuluçka kuluçkaya.
- Steril 200 μL ipucu içeren hücreleri kazıyın ve hemen taze orta CM çeşitli konsantrasyonları içeren ile orta değiştirmek [Örneğin, 10, 20, 30, 40 ve %50 ile tam DMEM karışık cm (v/v)].
- Çizikler ters bir mikroskop altında gözlemlemek ve farklı zaman aralıklarıyla (0 ile 24 s) fotoğraf çekmek.
- Kazı-kazan kapatılması formülü kullanarak görüntü J yazılım kullanarak ölçün:
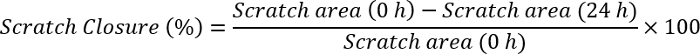
Not: görüntü J yazılımı ile sıfırdan görüntüyü açın. Görüntü zaten ölçek çubuğu olarak aynı büyüklükte olan bir çizgi çizin. Tıklatın analiz, ayarla ölçek ve uzaklığını piksel olarak çizilmiş çizgiyi büyütme gözlemlemek. Ölçek çubuğunun boyutunu bilinen mesafe bölümüne yazmak, birim (piksel, cm, vb) düzenleyin ve Tamam'ı tıklatın. Tekrar analiz bölümüne gidin ve ölçümler'i tıklatın. Bu ilk ölçek çubuğunun boyutunu seçilen birim olarak verecektir. Sıfırdan bir kenarını tıklatın ve öbür tarafında çizik erişene dek sürükleyin. Her zaman noktası (0 h ve 24 h) değerini not alın. Bu değerler formüle yukarıdaki takın ve sıfırdan kapatılması hesaplayın.
5. hücre göç dolaylı temas kanser hücreleri ve DPSCs
- Tohum 3 × 104 DPSCs 24-şey plaka ekler 0.4 mikron ile üzerine gözenek ve oksijen kuluçka gecede 37 ° C'de kuluçkaya
- Tohum PC-3 hücreleri 24-şey üzerine 5 × 104 hücre yoğunluğu tabaklar ve 37 ° C ve % 5 CO2gece de oksijen bir kuluçka kuluçkaya.
- Steril 200 μL bahşiş ile PC-3 hücreyi kazımak, orta taze orta ile değiştirin ve DPSCs PC-3 hücreleri taşıyan ekler yerleştirin.
- Hücreleri ters bir mikroskop altında gözlemlemek ve hücre göç analiz etmek için farklı zaman aralıklarıyla (0 ile 24 h) fotoğraf çekmek.
6. tahlil ortak kültür ve Akış Sitometresi Analizi
- PC-3 hücreleri ve DPSCs PKH67 (yeşil) ve PKH26 (kırmızı) Floresan hücre bağlayıcı boyalar, sırasıyla26kullanarak etiketleyin.
- PC-3 ve DPSCs hücreleri, anılan sıraya göre trypsinize. Medya T-75 doku kültürü balonun kaldırmak, PBS 2 mL ile yıkayın ve tripsin 2 mL ekleyin. Bir kuluçka oksijen hava atmosferi ile 37 ° C'de 2 dk ve % 5 CO2için kuluçkaya. Tripsin etkisizleştirmek için 2 dk kuluçka tarafından takip tam DMEM Orta 2 mL ekleyin.
- Santrifüj kapasitesi 300 x g 5 min için hücreleri, süpernatant atmak ve hücre topakları seyreltici-C arabelleği kiti ile birlikte hazırlanan boya solüsyona resuspend (bkz. Tablo malzeme).
- 10 dk için boya çözüm hücrelerde kuluçkaya ve boyama reaksiyonu FBS 100 µL ekleyerek bitirmek. 300 x g 5 min için hücreleri santrifüj kapasitesi, süpernatant atın ve tam büyüme orta hücrelerle birlikte kültür önce yıkayın.
- Hücreleri etiketli plaka (5 × 104/de) 1:1 oranında (DPSCs: PC3) 6-şey plakalar üzerine. Tam DMEM Co kültürlü hücreleri korumak.
- Hücreleri Santrifüjü 300 x g 5 min ve yıkama PBS ile de hücre tarafından 24 h veya 48 h kuluçka dönemi sonra toplamak.
- Floresans aktif hücrenin alt akış sitometresi tüpler yuvarlak 5 mL (FACS) arabellek sıralama 300 µL hücrelerde resuspend. Girdap hücre toplamları örnek analiz önce dağıtmak için.
- 100 µm meme 45 psi kılıf basınçla kullanın.
Not: Son derece yüksek debi floresans algılama hassasiyeti düşürebilir. - Günahı kontrol hücreleri ve tek renkli hücreler uygun ön ve yan dağılım lazer gerilim hücre tipleri ve27daha önce belirtildiği gibi tazminat için ayarlamak için kullanın.
Not: canlı hücreler için geçişi hücre artıkları, ölü hücreleri veya toplamları dışarıda bırakmak için kullanın. - FL-1 (yeşil) ve FL-2 (kırmızı) kanalları düzenleyerek yüzde pozitif yeşil DPSCs ve kırmızı PC-3 hücreleri belirlemek için 10,000 olayları (100.000 tercih) toplamak.
Sonuçlar
Şekil 1 DPSCs genel MSC özelliklerini kültür koşullar altında gösterilmektedir. DPSCs (Şekil 1B) kaplama sonra fibroblast benzeri hücre morfolojisi uygulamayın. MSC yüzey antijenleri (CD29, CD73, CD90, CD105 ve CD166) son derece hematopoetik işaretleri (CD34, CD45 ve CD14) sırasında ifade vardır negatif (Şekil 1 c). Değişiklikleri morfolojik ve moleküler düzeyde osteo-için ilgili...
Tartışmalar
MSCs, tümör çevre katkı hücre füzyon yoluyla melez hücre üretimi, kök hücre ve kanser hücreleri28arasında entosis veya sitokin ve kemokin faaliyetleri de dahil olmak üzere çeşitli etkileşimler tarafından düzenlenmiştir. Yapısal organizasyon, hücre-hücre etkileşimleri ve salgılanan faktörleri kanser hücre davranışı açısından tümör promosyon, ilerleme ve çevresindeki doku metastaz belirlenir. Yerleşik hücre popülasyonlarının etkileşimlerin arkasında...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu çalışmada Yeditepe Üniversitesi tarafından desteklenmiştir. Tüm veri ve bu makalede kullanılan rakamlar daha önce yayımlanmış34idi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11885084 | For cell culture |
| FBS | Invitrogen | 16000044 | For cell culture |
| PSA | Lonza | 17-745E | For cell culture |
| Trypsin | Invitrogen | 25200056 | For cell dissociation |
| PBS | Invitrogen | 10010023 | For washes |
| Dexamethasone | Sigma | D4902 | Component of differentiation media |
| β-Glycerophosphate | Sigma | G9422 | Component of osteogenic differentiation medium |
| Ascorbic acid | Sigma | A4544 | Component of osteo- and chondro-genic differentiation medium |
| Insulin-Transferrin-Selenium (ITS −G) | Invitrogen | 41400045 | Component of chondrogenic differentiation medium |
| TGF-β | Sigma | SRP3171 | Component of chondrogenic differentiation medium |
| Insulin | Sigma | I6634 | Component of adipogenic differentiation medium |
| Isobutyl-1-methylxanthine (IBMX) | Sigma | I7018 | Component of adipogenic differentiation medium |
| Indomethacin | Sigma | I7378 | Component of adipogenic differentiation medium |
| MTS Reagent | Promega | G3582 | Cell viability analyses |
| TUNEL Assay | Sigma | 11684795910 | Apoptotic analyses |
| 24-well plate inserts | Corning | 3396 | For trans-well migration assay |
| PKH67 | Sigma | PKH67GL | For co-culture cell staining |
| PKH26 | Sigma | PKH26GL | For co-culture cell staining |
| Paraformaldehyde | Sigma | P6148 | For cell fixation |
| von Kossa Kit | BioOptica | 04-170801.A | For cell staining (differentiation) |
| Alcian blue | Sigma | A2899 | For cell staining (differentiation) |
Referanslar
- Camberlain, G., Fox, J., Ashton, B., Middleton, J. Mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Demirci, S., Doğan, A., Şahin, F. . Dental Stem Cells. , 109-124 (2016).
- Fox, J. M., Chamberlain, G., Ashton, B. A., Middleton, J. Recent advances into the understanding of mesenchymal stem cell trafficking. British journal of haematology. 137 (6), 491-502 (2007).
- Chang, A. I., Schwertschkow, A. H., Nolta, J. A., Wu, J. Involvement of mesenchymal stem cells in cancer progression and metastases. Current cancer drug targets. 15 (2), 88-98 (2015).
- Dvorak, H. F. Tumors: wounds that do not heal. New England Journal of Medicine. 315 (26), 1650-1659 (1986).
- Lu, Y. -. r., et al. The growth inhibitory effect of mesenchymal stem cells on tumor cells in vitro and in vivo. Cancer biology & therapy. 7 (2), 245-251 (2008).
- Secchiero, P., et al. Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts. PloS one. 5 (6), e11140 (2010).
- Hong, I. -. S., Lee, H. -. Y., Kang, K. -. S. Mesenchymal stem cells and cancer: friends or enemies?. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 768, 98-106 (2014).
- Brennen, W. N., Chen, S., Denmeade, S. R., Isaacs, J. T. Quantification of Mesenchymal Stem Cells (MSCs) at sites of human prostate cancer. Oncotarget. 4 (1), 106 (2013).
- Klopp, A. H., Gupta, A., Spaeth, E., Andreeff, M., Marini, F. Concise review: dissecting a discrepancy in the literature: do mesenchymal stem cells support or suppress tumor growth. Stem cells. 29 (1), 11-19 (2011).
- Albini, A., Sporn, M. B. The tumour microenvironment as a target for chemoprevention. Nature Reviews Cancer. 7 (2), 139 (2007).
- Quante, M., et al. Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth. Cancer cell. 19 (2), 257-272 (2011).
- Gronthos, S., Mankani, M., Brahim, J., Robey, P. G., Shi, S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 97 (25), 13625-13630 (2000).
- Mori, G., et al. Dental pulp stem cells: osteogenic differentiation and gene expression. Annals of the new York Academy of Sciences. 1237 (1), 47-52 (2011).
- Mori, G., et al. Osteogenic properties of human dental pulp stem cells. Journal of biological regulators and homeostatic agents. 24 (2), 167-175 (2010).
- Kerkis, I., et al. Isolation and characterization of a population of immature dental pulp stem cells expressing OCT-4 and other embryonic stem cell markers. Cells Tissues Organs. 184 (3-4), 105-116 (2006).
- Potdar, P. D., Jethmalani, Y. D. Human dental pulp stem cells: applications in future regenerative medicine. World journal of stem cells. 7 (5), 839 (2015).
- Ahmed, N. E. -. M. B., Murakami, M., Hirose, Y., Nakashima, M. Therapeutic potential of dental pulp stem cell secretome for Alzheimer's disease treatment: an in vitro study. Stem cells international. 2016, (2016).
- Gorin, C., et al. Priming dental pulp stem cells with fibroblast growth factor-2 increases angiogenesis of implanted tissue-engineered constructs through hepatocyte growth factor and vascular endothelial growth factor secretion. Stem cells translational medicine. 5 (3), 392-404 (2016).
- Wakayama, H., et al. Factors secreted from dental pulp stem cells show multifaceted benefits for treating acute lung injury in mice. Cytotherapy. 17 (8), 1119-1129 (2015).
- Doğan, A., et al. Differentiation of human stem cells is promoted by amphiphilic pluronic block copolymers. International Journal of Nanomedicine. 7, 4849 (2012).
- Taşlı, P. N., Doğan, A., Demirci, S., Şahin, F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro. Biological trace element research. 153 (1-3), 419-427 (2013).
- Yalvac, M., et al. Isolation and characterization of stem cells derived from human third molar tooth germs of young adults: implications in neo-vascularization, osteo-, adipo-and neurogenesis. The pharmacogenomics journal. 10 (2), 105 (2010).
- Doğan, A., et al. Sodium pentaborate pentahydrate and pluronic containing hydrogel increases cutaneous wound healing in vitro and in vivo. Biological trace element research. 162 (1-3), 72-79 (2014).
- Doğan, A., Yalvaç, M. E., Yılmaz, A., Rizvanov, A., Şahin, F. Effect of F68 on cryopreservation of mesenchymal stem cells derived from human tooth germ. Applied biochemistry and biotechnology. 171 (7), 1819-1831 (2013).
- Rizvanov, A. A., et al. Interaction and self-organization of human mesenchymal stem cells and neuro-blastoma SH-SY5Y cells under co-culture conditions: A novel system for modeling cancer cell micro-environment. European Journal of Pharmaceutics and Biopharmaceutics. 76 (2), 253-259 (2010).
- Troiano, L., et al. Multiparametric analysis of cells with different mitochondrial membrane potential during apoptosis by polychromatic flow cytometry. Nature protocols. 2 (11), 2719 (2007).
- Melzer, C., von der Ohe, J., Lehnert, H., Ungefroren, H., Hass, R. Cancer stem cell niche models and contribution by mesenchymal stroma/stem cells. Molecular cancer. 16 (1), 28 (2017).
- Aguirre, A., Planell, J., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and biophysical research communications. 400 (2), 284-291 (2010).
- Bogdanowicz, D. R., Lu, H. H. . Biomimetics and Stem Cells. , 29-36 (2013).
- Plotnikov, E., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of cellular and molecular. 12 (5a), 1622-1631 (2008).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology journal. 8 (4), 395-396 (2013).
- Brunetti, G., et al. High expression of TRAIL by osteoblastic differentiated dental pulp stem cells affects myeloma cell viability. Oncology reports. 39 (4), 2031-2039 (2018).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Dental pulp stem cells (DPSCs) increase prostate cancer cell proliferation and migration under in vitro conditions. Tissue and Cell. 49 (6), 711-718 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır