Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement des cellules souches mésenchymateuses du tissu de pulpe et co-culture avec les cellules cancéreuses afin d’étudier leurs Interactions
Dans cet article
Résumé
Nous fournissons des protocoles d’évaluation des cellules souches mésenchymateuses isolées de la pulpe dentaire et interactions cellulaires de cancer de la prostate basées sur des méthodes directes et indirectes de co-culture. Moyenne de l’état et les membranes de trans-puits conviennent d’analyser l’activité paracrine indirecte. Ensemencement différemment colorées cellules ensemble est un modèle approprié pour l’interaction cellule-cellule direct.
Résumé
Cancer comme un processus multipas et compliquées de la maladie est non seulement régi par la croissance et la prolifération des cellules individuelles mais également contrôlé par des interactions entre environnement et cellules de tumeur. Identification du cancer et des interactions entre cellules souches, y compris les changements dans l’environnement extracellulaire, interactions physiques et facteurs sécrétés, pourrait permettre la découverte de nouvelles options thérapeutiques. Nous combinons des techniques de culture co connus pour créer un système modèle pour les cellules souches mésenchymateuses (CSM) et le cancer interactions cellulaires. Dans la présente étude, des cellules souches pulpe dentaire (DPSCs) et les interactions entre les cellules de cancer de la prostate dans la PC-3 ont été examinées par des techniques directes et indirectes de co-culture. Moyen de condition (CM) provenant de DPSCs et 0,4 µm taille de pore trans-puits membranes ont été utilisés pour étudier l’activité paracrine. Co-culture de différents types de cellules ensemble a été réalisée pour étudier les interactions cellule-cellule direct. Les résultats ont révélé que CM augmente la prolifération cellulaire et une diminution de l’apoptose dans les cultures de cellules de cancer de la prostate. Les CM et les trans-puits augmenté capacité de migration des cellules du PC-3 cellules. Cellules colorées avec des teintures différentes membranes ont été ensemencées dans les récipients de culture même, et DPSCs ont participé à une structure auto-organisée avec PC-3 cellules sous cette condition de co-culture direct. Dans l’ensemble, les résultats indiquent que les techniques de culture mixte pourraient être utiles contre le cancer et les interactions de MSC comme système modèle.
Introduction
Cellules souches mésenchymateuses (CSM), avec la capacité de différenciation et de contribution à la régénération des tissus mésenchymateux tels qu’OS, cartilage, muscle, ligament, tendon et adipeux, ont été isolés chez presque tous les tissus dans le corps adulte1 , 2. autre que fournir l’homéostasie tissulaire en produisant des cellules résidentes dans le cas d’une inflammation chronique ou d’une blessure, ils produisent vital cytokines et facteurs de croissance d’orchestrer l’angiogenèse, système immunitaire et tissu transformant3. L’interaction de MSCs avec tissus cancéreux n’est pas bien comprise, mais accumulant suggèrent que MSCs peuvent promouvoir d’initiation, progression et la métastase tumorale4.
La capacité de radioralliement de MSCs vers la zone lésée ou chroniquement enflammée rend un candidat valable pour des thérapies à base de cellules souches. Cependant, les tissus cancéreux, « jamais guérir des blessures », également libérer des cytokines inflammatoires, des molécules pro-angiogénique et vital des facteurs de croissance, qui attirent les MSCs aux cancérogènes zone5. Alors qu’il se limitent rapports montrant les effets inhibiteurs de MSCs sur cancer croissance6,7, leur progression du cancer et les métastases favorisant les effets ont été abondamment rapportés8. MSCs directement ou indirectement atteinte carcinogenèse de différentes façons, y compris la suppression des cellules immunitaires, qui sécrètent des facteurs de croissance/cytokines favorisant la prolifération des cellules cancéreuses et migration, d’améliorer l’activité angiogénique et réglementant transition épithéliale-mésenchymateuse (EMT)9,10. Environnement de la tumeur se compose de plusieurs types de cellules dont les fibroblastes associés au cancer (CAFs) et/ou myofibroblastes, cellules endothéliales, adipocytes et cellules immunitaires11. Parmi eux, CAFs ya type cellulaire le plus abondant dans la région de tumeur sécrétant divers chimiokines favorisant le cancer la croissance et la métastase8. Il a été démontré que MSCs dérivés de la moelle osseuse peuvent se différencier en CEFA dans le stroma de tumeur12.
Cellules souches pulpe dentaire (DPSCs), caractérisées comme les premières MSCs dérivés de tissus dentaires par Gronthos et al. 13 en 2000 puis largement étudié par d’autres14,15, expriment des marqueurs pluripotence par exemple Oct4, Sox2et Nanog16 et peuvent se différencier en divers cellule Chehalis17. Analyse de l’expression génique et protéique a prouvé que les DPSCs produisent des niveaux comparables de facteurs de croissance/cytokines avec autres MSCs comme facteur de croissance endothélial vasculaire (VEGF), angiogenin, facteur de croissance fibroblastique 2 (FGF2), interleukine-4 (IL-4), IL-6, IL-10, et stem cell factor (SCF), en plus de ligand de kinase-3 de fms-like tyrosine (Flt - 3L) qui pourrait promouvoir l’angiogenèse, moduler les cellules immunitaires et d’appuyer le cancer cell la prolifération et la migration18,19,20 . Alors que les interactions de MSCs avec environnement de cancer ont été bien étudiées dans la littérature, la relation entre DPSCs et les cellules cancéreuses n’a pas été évaluée encore. Dans la présente étude, nous avons établi la co-culture et condition des stratégies de traitement moyen pour une lignée cellulaire de cancer de la prostate métastatique hautement, PC-3 et DPSCs propose une action potentielle du mécanisme de MSCs dentaires dans la progression du cancer et des métastases.
Protocole
Consentement éclairé des patients a été obtenu après l’approbation de la Commission de déontologie institutionnelle.
1. culture et isolement et
- Transfert des dents de sagesse provenant de jeunes adultes âgés entre 17 et tubes de 20 à 15 mL contenant moyen d’Eagle modifié (DMEM de complet Dulbecco) [bas milieu DMEM glucose, avec 10 % sérum fœtal (SVF) et 1 % la pénicilline/streptomycine / solution de l’amphotéricine (PSA)], dans les 8 h après la résection. Garder le matériel tissulaire froid (4 ° C) pendant le transfert pour éviter la mort cellulaire potentiels.
- Retirer le tissu de pulpe par daviers stérile depuis le centre de la dent avec précaution, placez le tissu de pulpe dans le milieu DMEM complet froid plats de culture de tissu de 10 cm et les émincer en petits morceaux (2-3 mm) par scalpel.
Remarque : Toutes les procédures expérimentales doivent être effectués dans des conditions stériles sous hotte à flux laminaire. Cette technique non enzymatique a été utilisé précédemment21,22,23. - Place petite pâte tissus à l’intérieur de la culture de tissus traitement plaques 6 puits et ajouter 200 µL de médias DMEM complet pour couvrir chaque morceaux de tissu de petites pâtes.
- Incuber les puits de culture tissulaire à 37 ° C dans une atmosphère d’air humidifié (80 % d’humidité) avec 5 % de CO2 pendant 2 h fournir la fixation tissulaire.
Remarque : Cette étape pourrait se prolonger à 3-4 h en contrôlant l’évaporation des médias. - Ajouter le volume approprié (2 à 2,5 mL) de milieu DMEM complet dans les puits et incuber à 37 ° C dans une atmosphère d’air humidifié avec 5 % de CO2 pour les cellules à se répandre dans les tissus.
Remarque : Les cellules seront visibles qu’après environ 4 jours et atteignent la confluence après 8 à 9 jours. - Quand les cellules atteignent 80 % confluence, retirez le support de plaques 6 puits, laver avec 2 mL de solution saline tamponnée au phosphate (PBS) et ajouter 2 mL de trypsine. Incuber pendant 2 minutes dans un incubateur à 37 ° C avec atmosphère d’air humidifié et 5 % de CO2. Puis ajouter 2 mL de milieu DMEM complet suivi de 2 min d’incubation pour inhiber la trypsine. Centrifuger à 300 x g pendant 5 min granuler les cellules, les cellules.
- Cellules de passage pour les fioles en complet médias DMEM et magasin pour d’autres expériences. Ajouter 15 mL de médias DMEM complet aux flacons T-75 et cellules de transfert de deux puits de la plaque de 6 puits pour un flacons T-75 et incuber à 37 ° C avec atmosphère d’air humidifié et 5 % de CO2.
2. caractérisation des DPSCs
- Effectuer des analyses morphologiques.
- Cellules de semences (étape 1.6) en culture de tissus enduits fioles (ou plaques 6 puits) dans le milieu DMEM complet au moins 8 passages d’observer la morphologie cellulaire.
- Visualiser les cellules en microscopie photonique et définir la morphologie des cellules de fibroblaste-like. Les cellules devraient fixer sur les récipients de culture et ont la morphologie des cellules de tige-comme.
Remarque : En tant qu’alternativement, les cellules peuvent être cultivées comme des cellules individuelles jusqu'à 14 jours en plaques à puits d’observer la capacité de formation de colonie qui est une caractéristique spécifique des fibroblastes et MSCs.
- Effectuer des analyses de marqueurs de surface.
- Trypsinize les cellules de l’étape 1.7. Retirez le support du flacon de culture de tissus T-75, laver avec 2 mL de PBS et ajouter 2 mL de trypsine. Incuber pendant 2 minutes dans un incubateur à 37 ° C avec atmosphère d’air humidifié et 5 % de CO2. Puis ajouter 2 mL de milieu DMEM complet suivi de 2 min d’incubation pour inhiber la trypsine. Centrifuger à 300 x g pendant 5 min granuler les cellules, les cellules.
- Fixer les cellules avec du paraformaldéhyde 4 % pendant 20 min à température ambiante dans des tubes de 1,5 mL et puis lavez-les avec 500 µL de PBS 3 fois pour enlever le paraformaldéhyde.
- Incuber les cellules fixes avec les anticorps contre CD29, CD34, CD14, CD45, CD90, CD105, CD166 et CD73 pendant 1 h à 4 ° C dans 100 µL de PBS.
Remarque : La concentration d’anticorps utilisé est de 0,5 µg/mL. CD34, CD14 et CD45 sont utilisés comme marqueurs négatifs, tandis que CD29 CD90, CD105, CD166 et CD73 sont utilisés comme marqueurs de surface de cellules positives pour MSCs. - Laver les cellules 3 fois avec du PBS et utiliser des anticorps secondaires respectifs tels que l’isothiocyanate de fluorescéine (FITC), la phycoérythrine (PE), etc. pour l’étiquetage. Incuber les cellules avec des anticorps secondaires de 1/500 dilué dans 100 µL de PBS pendant 30 min à 4 ° C et les laver 3 fois avec du PBS.
- Conserver les échantillons dans l’obscurité pour analyse en cytométrie en flux et détecter les positifs et négatifs de coloration par cytométrie en flux.
Remarque : Utilisez cellules témoins non colorés pour organiser avant et latéraux en nuages de points XY. Organiser le blocage de positivement teinté des populations en excluant les cellules mortes, les débris et la population non tachée. Utiliser 100 µm buse avec pression de gaine de 45 lb/po2 et recueillir 10 000 événements afin de déterminer les DPSCs positifs en organisant des canaux.
- Effectuer la différenciation des DPSCs.
- Semences de 1 × 104 cellules sur des plaques 24 puits dans toutes les médias DMEM et incuber pendant 24 h à 37 ° C dans une atmosphère d’air humidifié avec 5 % de CO2.
- Formuler la différenciation des médias à l’aide de rivaliser milieu DMEM comme support de base. Préparer les milieux ostéogénique en mélangeant 100 nM dexaméthasone, β-glycérophosphate de 10 mM et 0. 2 mM d’acide ascorbique. Préparer les milieux chondrogéniques en mélangeant 1 × insuline-transferrine-sélénium (ITS-G), 100 dexaméthasone nM, 100 bêta de facteur de croissance transformant ng/mL (TGF-β), 14 μg/mL d’acide ascorbique et 1 mg/mL d’albumine sérique bovine (BSA). Préparer les milieux adipocytaire en mélangeant 100 dexaméthasone nM, 5 μg/mL d’insuline, 0,5 mM 3-isobutyl-1-méthylxanthine (IBMX) et 60 μM l’indométhacine.
NOTE : Les médias de différenciation peuvent être conservés à 4 ° C pendant au moins une semaine. - Modifier les médias croissance osteo-, chondro-ou médias de différenciation adipo-génique et actualisation deux fois par semaine pendant deux semaines.
- Confirmer la différenciation par von Kossa Alcian coloration bleue, l’activité enzymatique (activité de la phosphatase alcaline), immunocytochimie et analyses PCR (qPCR) polymérase quantitative selon les protocoles décrits antérieurement21.
- Effectuer de von Kossa et bleu Alcian salissures sur les cellules qui sont fixés avec 4 % de paraformaldéhyde à température ambiante pendant 10 min. laver les cellules fixes avec du PBS et leur tachent avec le kit de vonKossa selon les recommandations du fabricant pour l’observation des dépôts de calcium .
- Préparer la coloration solution en dissolvant 1,00 g de colorant bleu Alcian dans 100 mL d’acide acétique à 3 % (v/v) pour une coloration plus bleu Alcian. Laver les cellules fixes avec du PBS et tacher les cellules pendant 30 min avec une solution bleu Alcian. Visualiser les échantillons colorés par un microscope optique.
3. préparation de l’état moyen (CM)
- Remplacer le support des cellules de l’étape 1.7 avec frais complet DMEM 24 h avant le prélèvement de CM.
Remarque : Le Passage 2-4 est recommandé. - Recueillir moyen (CM) de la condition de culture DPSCs quand les cellules atteignent la confluence de 80 %. Centrifuger les médias collectés à 300 x g pendant 5 min enlever les débris de matériel et de la cellule des déchets des tissus.
NOTE : Également utiliser des filtres de seringue 0,2 µm pour enlever les débris provenant du milieu de l’état. - Recueillir le liquide surnageant et conserver à-20 ° C pour les autres expériences.
Remarque : Maintenez le surnageant à-80 ° C pour le stockage à long terme.
4. traitement des cellules cancéreuses avec CM
- Effectuer des analyses de viabilité cellulaire.
- Semences PC-3 cellules (cancer de la prostate humain) sur des plaques de 96 puits à une densité de 5 × 103 cellules/puits dans toutes les DMEM et incuber dans une chambre humidifiée à 37 ° C et 5 % de CO2 pendant 24 h.
- Traiter les cellules avec 10, 20, 30, 40 et 50 % des CM (v/v) en mélange avec DMEM complet pendant 24 h.
- Mesurer la viabilité des cellules à l’aide de 3-(4,5-dimethyl-thiazol-2-yl)-5-(3-carboxymethoxy-phenyl)-2-(4-sulfo-phenyl)-2H-tetrazolium (MTS)-dosage selon les indications déjà24.
- Effectuer terminale de deoxynucleotidyl transférase dUTP nick end labeling analyses (TUNEL).
- PC-3 cellules sur culture cellulaire 6 puits plaques à une densité cellulaire de 2 × 105 cellules/puitsent et incuber pendant la nuit dans une chambre humidifiée à 37 ° C et 5 % de CO2 de graines.
- Mélanger 20 % CM (v/v) avec toutes les milieu DMEM et appliquer aux cellules pendant 24 h.
- Trypsinize cellules et mettre en suspension dans 50 μL du mélange réactionnel de TUNEL (solution + solution d’enzyme, fourni avec le kit d’étiquetage) et incuber à 37 ° C pendant 60 min en CO2 atmosphère humidifiée et 5 %.
NOTE : Pour la trypsinisation, retirez le support de plaques de culture cellulaire 6 puits, laver avec 1 mL de PBS et ajouter 500 µL de la trypsine. Incuber pendant 2 minutes dans un incubateur à 37 ° C avec atmosphère d’air humidifié et 5 % de CO2. Ajouter 1 mL de milieu DMEM complet suivi de 2 min d’incubation pour inhiber la trypsine. Centrifuger à 300 x g pendant 5 min granuler les cellules, les cellules. - Rincer avec du PBS et d’analyser les cellules dans du PBS à l’aide de cytométrie en flux.
- Effectuer des analyses de qPCR.
- PC-3 cellules sur culture cellulaire 6 puits plaques à une densité cellulaire de 2 × 105 cellules/puitsent et incuber pendant la nuit dans un incubateur à 37 ° C et 5 % de CO2 à humidifié de graines.
- Mélanger 20 % CM (v/v) avec toutes les milieu DMEM et appliquer aux cellules pendant 24 h.
- Trypsinize cellules et recueillir le culot cellulaire pour la synthèse de l’ARN d’isolement et de cDNA.
Remarque : Retirez les supports de plaques de culture cellulaire 6 puits, laver avec 1 mL de PBS et ajouter 500 µL de la trypsine. Incuber 2 min dans un incubateur à 37 ° C avec atmosphère d’air humidifié et 5 % de CO2. Ajouter 1 mL de milieu DMEM complet suivi de 2 min d’incubation pour inhiber la trypsine. Centrifuger à 300 x g pendant 5 min granuler les cellules, les cellules. - Réaliser des expériences de qPCR selon le protocole décrit précédemment25.
- Effectuer la migration cellulaire des cellules cancéreuses.
- Semences de 1 × 105 PC-3 cellules sur des plaques de 12 puits et incuber dans un incubateur humidifié pendant une nuit à 37 ° C et 5 % de CO2.
- Rayer de cellules d’un embout stérile 200 μL et modifier le milieu immédiatement avec un milieu frais contenant différentes concentrations de CM [par exemple, 10, 20, 30, 40 et 50 % des CM (v/v) mélangé avec DMEM complet].
- Observer les rayures sous un microscope inversé et prendre des photos à intervalles de temps différents (0 et 24h).
- Mesure de la fermeture scratch en utilisant le logiciel Image J en utilisant la formule :
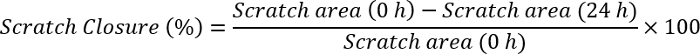
NOTE : Ouvrez l’image de gratter avec le logiciel Image J. Tracez une ligne qui a la même grandeur que la barre d’échelle qui existe déjà dans l’image. Cliquez sur analyser, définir l’échelle et observer la distance en pixels que le grossissement de la ligne tracée. Écrire la taille de la barre d’échelle dans la partie de distance connue, organiser l’unité (pixels, cm, etc.) et cliquez sur OK. Allez à la section analyse à nouveau et cliquez sur mesures. Cela donnera tout d’abord la taille de la barre d’échelle comme l’unité sélectionnée. Cliquez sur un bord du scratch et faites-le glisser jusqu'à l’autre extrémité de la rayure. Notez la valeur pour chaque point dans le temps (0 h et 24h). Branchez ces valeurs dans la formule ci-dessus et de calculer la fermeture scratch.
5. cellule Migration par contact Indirect avec des cellules cancéreuses et DPSCs
- Graines de 3 × 104 DPSCs sur plaque 24 puits inserts avec 0,4 μm pore et incuber dans un incubateur humidifié pendant une nuit à 37 ° C.
- Cellules de PC-3 graines sur 24 puits plaques à une densité de 5 × 10,4 et incuber dans un incubateur humidifié pendant une nuit à 37 ° C et 5 % de CO2.
- PC-3 cellules d’un embout stérile 200 μL de rayer, changer le milieu avec un milieu frais et placer les inserts transportant DPSCs sur PC-3 cellules.
- Observer des cellules au microscope inversé et prendre des photos à intervalles de temps différents (0 à 24 h) pour analyser la migration cellulaire.
6. test de co-culture et Flow Cytometry analyse
- Numéroter des cellules PC-3 et DPSCs en utilisant PKH67 (vert) et PKH26 (rouge) cellule fluorescente linker colorants, respectivement de26.
- Trypsinize cellules PC-3 et DPSCs, respectivement. Retirez le support de flacon de culture de tissu de T-75 laver avec 2 mL de PBS et ajouter 2 mL de trypsine. Incuber pendant 2 minutes dans un incubateur à 37 ° C avec atmosphère d’air humidifié et 5 % de CO2. Ajouter 2 mL de milieu DMEM complet suivi de 2 min d’incubation pour inhiber la trypsine.
- Centrifuger de cellules à 300 g pendant 5 min, jeter le surnageant et remettre en suspension les granules cellulaires dans la solution de colorant préparée dans du tampon diluant-C fourni par le kit (voir Table des matières).
- Incuber les cellules dans la solution de colorant pendant 10 min et mettre fin à la réaction de coloration en ajoutant 100 µL de FBS. Centrifuger de cellules à 300 g pendant 5 min, jeter le surnageant et laver les cellules avec milieu de culture complet avant de co-culture.
- Plaque marquée des cellules (5 × 10,4/bien) sur des plaques 6 puits au rapport 1:1 (DPSCs : PC3). Maintenir la collaboration des cellules en DMEM complet.
- Prélever des cellules après des périodes d’incubation 24h ou 48 h par centrifugation de cellules à 300 g pendant 5 min et laver avec du PBS.
- Remettre en suspension les cellules dans 300 µL de fluorescence-lancée de cellules tri tampon (FACS) dans 5 mL bas écoulement cytometry tubes ronds. Vortex pour disperser des agrégats cellulaires juste avant l’analyse de l’échantillon.
- Utiliser une buse de 100 µm avec pression de gaine de 45 lb/po2.
NOTE : Très haut débit pourrait diminuer la sensibilité de la détection par fluorescence. - Utiliser cellules témoins non colorés et des cellules colorées uniques pour ajuster approprié avant et tension de laser de scatter côté de types de cellules et d’indemnisation tel que mentionné précédemment27.
Remarque : Utilisez le déclenchement pour des cellules vivantes d’exclure les débris cellulaires, les cellules mortes ou agrégats. - Collecter des événements 10 000 (100 000 est préférable) pour déterminer le pourcentage positifs DPSCs verts et rouge PC-3 cellules en arrangeant FL-2 (rouge) et FL-1 (vert).
Résultats
La figure 1 illustre les caractéristiques générales de MSC de DPSCs dans des conditions de culture. DPSCs exercer une morphologie de cellules fibroblastes après ensemencement (Figure 1 b). Antigènes de surface de MSC (CD29 CD73, CD90, CD105 et CD166) sont fortement exprimés lors des marqueurs hématopoïétiques (CD34, CD45 et CD14) sont négatifs (Figure 1). Changements au niveau morphologique...
Discussion
Contribution de MSCs au milieu de la tumeur est régie par plusieurs interactions dont hybride cellulaire génération via cellulaire fusions, entosis ou de cytokines et de chimiokines activités entre les cellules souches et de cellules de cancer du28. Structure de l’organisation, les interactions cellule-cellule et facteurs sécrétés déterminent le comportement de cellule du cancer en termes de promotion tumorale, la progression et la métastase aux tissus avoisinants. Bon ex v...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée par l’Université Yeditepe. Toutes les données et les chiffres utilisés dans cet article ont été publiées antérieurement34.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11885084 | For cell culture |
| FBS | Invitrogen | 16000044 | For cell culture |
| PSA | Lonza | 17-745E | For cell culture |
| Trypsin | Invitrogen | 25200056 | For cell dissociation |
| PBS | Invitrogen | 10010023 | For washes |
| Dexamethasone | Sigma | D4902 | Component of differentiation media |
| β-Glycerophosphate | Sigma | G9422 | Component of osteogenic differentiation medium |
| Ascorbic acid | Sigma | A4544 | Component of osteo- and chondro-genic differentiation medium |
| Insulin-Transferrin-Selenium (ITS −G) | Invitrogen | 41400045 | Component of chondrogenic differentiation medium |
| TGF-β | Sigma | SRP3171 | Component of chondrogenic differentiation medium |
| Insulin | Sigma | I6634 | Component of adipogenic differentiation medium |
| Isobutyl-1-methylxanthine (IBMX) | Sigma | I7018 | Component of adipogenic differentiation medium |
| Indomethacin | Sigma | I7378 | Component of adipogenic differentiation medium |
| MTS Reagent | Promega | G3582 | Cell viability analyses |
| TUNEL Assay | Sigma | 11684795910 | Apoptotic analyses |
| 24-well plate inserts | Corning | 3396 | For trans-well migration assay |
| PKH67 | Sigma | PKH67GL | For co-culture cell staining |
| PKH26 | Sigma | PKH26GL | For co-culture cell staining |
| Paraformaldehyde | Sigma | P6148 | For cell fixation |
| von Kossa Kit | BioOptica | 04-170801.A | For cell staining (differentiation) |
| Alcian blue | Sigma | A2899 | For cell staining (differentiation) |
Références
- Camberlain, G., Fox, J., Ashton, B., Middleton, J. Mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Demirci, S., Doğan, A., Şahin, F. . Dental Stem Cells. , 109-124 (2016).
- Fox, J. M., Chamberlain, G., Ashton, B. A., Middleton, J. Recent advances into the understanding of mesenchymal stem cell trafficking. British journal of haematology. 137 (6), 491-502 (2007).
- Chang, A. I., Schwertschkow, A. H., Nolta, J. A., Wu, J. Involvement of mesenchymal stem cells in cancer progression and metastases. Current cancer drug targets. 15 (2), 88-98 (2015).
- Dvorak, H. F. Tumors: wounds that do not heal. New England Journal of Medicine. 315 (26), 1650-1659 (1986).
- Lu, Y. -. r., et al. The growth inhibitory effect of mesenchymal stem cells on tumor cells in vitro and in vivo. Cancer biology & therapy. 7 (2), 245-251 (2008).
- Secchiero, P., et al. Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts. PloS one. 5 (6), e11140 (2010).
- Hong, I. -. S., Lee, H. -. Y., Kang, K. -. S. Mesenchymal stem cells and cancer: friends or enemies?. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 768, 98-106 (2014).
- Brennen, W. N., Chen, S., Denmeade, S. R., Isaacs, J. T. Quantification of Mesenchymal Stem Cells (MSCs) at sites of human prostate cancer. Oncotarget. 4 (1), 106 (2013).
- Klopp, A. H., Gupta, A., Spaeth, E., Andreeff, M., Marini, F. Concise review: dissecting a discrepancy in the literature: do mesenchymal stem cells support or suppress tumor growth. Stem cells. 29 (1), 11-19 (2011).
- Albini, A., Sporn, M. B. The tumour microenvironment as a target for chemoprevention. Nature Reviews Cancer. 7 (2), 139 (2007).
- Quante, M., et al. Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth. Cancer cell. 19 (2), 257-272 (2011).
- Gronthos, S., Mankani, M., Brahim, J., Robey, P. G., Shi, S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 97 (25), 13625-13630 (2000).
- Mori, G., et al. Dental pulp stem cells: osteogenic differentiation and gene expression. Annals of the new York Academy of Sciences. 1237 (1), 47-52 (2011).
- Mori, G., et al. Osteogenic properties of human dental pulp stem cells. Journal of biological regulators and homeostatic agents. 24 (2), 167-175 (2010).
- Kerkis, I., et al. Isolation and characterization of a population of immature dental pulp stem cells expressing OCT-4 and other embryonic stem cell markers. Cells Tissues Organs. 184 (3-4), 105-116 (2006).
- Potdar, P. D., Jethmalani, Y. D. Human dental pulp stem cells: applications in future regenerative medicine. World journal of stem cells. 7 (5), 839 (2015).
- Ahmed, N. E. -. M. B., Murakami, M., Hirose, Y., Nakashima, M. Therapeutic potential of dental pulp stem cell secretome for Alzheimer's disease treatment: an in vitro study. Stem cells international. 2016, (2016).
- Gorin, C., et al. Priming dental pulp stem cells with fibroblast growth factor-2 increases angiogenesis of implanted tissue-engineered constructs through hepatocyte growth factor and vascular endothelial growth factor secretion. Stem cells translational medicine. 5 (3), 392-404 (2016).
- Wakayama, H., et al. Factors secreted from dental pulp stem cells show multifaceted benefits for treating acute lung injury in mice. Cytotherapy. 17 (8), 1119-1129 (2015).
- Doğan, A., et al. Differentiation of human stem cells is promoted by amphiphilic pluronic block copolymers. International Journal of Nanomedicine. 7, 4849 (2012).
- Taşlı, P. N., Doğan, A., Demirci, S., Şahin, F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro. Biological trace element research. 153 (1-3), 419-427 (2013).
- Yalvac, M., et al. Isolation and characterization of stem cells derived from human third molar tooth germs of young adults: implications in neo-vascularization, osteo-, adipo-and neurogenesis. The pharmacogenomics journal. 10 (2), 105 (2010).
- Doğan, A., et al. Sodium pentaborate pentahydrate and pluronic containing hydrogel increases cutaneous wound healing in vitro and in vivo. Biological trace element research. 162 (1-3), 72-79 (2014).
- Doğan, A., Yalvaç, M. E., Yılmaz, A., Rizvanov, A., Şahin, F. Effect of F68 on cryopreservation of mesenchymal stem cells derived from human tooth germ. Applied biochemistry and biotechnology. 171 (7), 1819-1831 (2013).
- Rizvanov, A. A., et al. Interaction and self-organization of human mesenchymal stem cells and neuro-blastoma SH-SY5Y cells under co-culture conditions: A novel system for modeling cancer cell micro-environment. European Journal of Pharmaceutics and Biopharmaceutics. 76 (2), 253-259 (2010).
- Troiano, L., et al. Multiparametric analysis of cells with different mitochondrial membrane potential during apoptosis by polychromatic flow cytometry. Nature protocols. 2 (11), 2719 (2007).
- Melzer, C., von der Ohe, J., Lehnert, H., Ungefroren, H., Hass, R. Cancer stem cell niche models and contribution by mesenchymal stroma/stem cells. Molecular cancer. 16 (1), 28 (2017).
- Aguirre, A., Planell, J., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and biophysical research communications. 400 (2), 284-291 (2010).
- Bogdanowicz, D. R., Lu, H. H. . Biomimetics and Stem Cells. , 29-36 (2013).
- Plotnikov, E., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of cellular and molecular. 12 (5a), 1622-1631 (2008).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology journal. 8 (4), 395-396 (2013).
- Brunetti, G., et al. High expression of TRAIL by osteoblastic differentiated dental pulp stem cells affects myeloma cell viability. Oncology reports. 39 (4), 2031-2039 (2018).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Dental pulp stem cells (DPSCs) increase prostate cancer cell proliferation and migration under in vitro conditions. Tissue and Cell. 49 (6), 711-718 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon