A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד תאי גזע mesenchymal זולה רקמות, תרבות משותפת עם תאים סרטניים ללמוד אינטראקציות שלהם
In This Article
Summary
אנו מספקים פרוטוקולים להערכה של גזע mesenchymal מבודד מן עיסת שיניים ואינטראקציות התא סרטן הערמונית המבוסס על שיטות תרבות שיתוף ישיר ועקיף. מצב בינוני וממברנות הטרנס-ובכן מתאימים לניתוח פעילות paracrine עקיף. זריעה באופן שונה מוכתמת. בתאים ביחד הוא מודל המתאים לאינטראקציה תא ישירה-cell.
Abstract
סרטן כמו תהליך רב-שלבי המחלה מורכב לא רק מוסדר על ידי התפשטות תאים בודדים וצמיחה אלא גם נשלט על ידי אינטראקציות וסביבה תא-תא הגידול. זיהוי של סרטן ואינטראקציות תאי גזע, לרבות שינויים בסביבה חוץ-תאית, האינטראקציות פיזי וגורמים מופרשים, עשוי לאפשר הגילוי של אפשרויות טיפול חדשות. אנו משלבים תרבות משותפת מוכרת טכניקות ליצירת מערכת מודל עבור גזע mesenchymal (MSCs) וסרטן תא אינטראקציות. במחקר הנוכחי, תאי גזע זולה שיניים (DPSCs) ואינטראקציות התא סרטן הערמונית PC-3 נבדקו על-ידי טכניקות תרבות שיתוף ישיר ועקיף. מצב בינוני (ס מ) המתקבל DPSCs, 0.4 מיקרומטר נקבוביות בגודל הטרנס-ובכן ממברנות שימשו כדי ללמוד paracrine פעילות. תרבות משותפת של סוגי התאים יחד בוצעה ללמוד אינטראקציה ישירה תאים תאים. התוצאות חשף כי ס מ גדל התפשטות תאים, ירד אפופטוזיס תרביות תאים סרטן הערמונית. ס מ ומערכת הטרנס-ובכן גדל תא קיבולת העברה של PC-3 תאים. תאים צבעונית עם צבעי ממברנה שונים היו נזרע לתוך תרבות אותם כלי-דם, והשתתף DPSCs מבנה מאורגן עצמית עם PC-3 תאים תחת תנאי זה תרבות שיתוף ישיר. בסך הכל, התוצאות הראו, כי שיטות חקלאות משותף יכול להיות שימושי עבור סרטן ואינטראקציות MSC כמערכת מודל.
Introduction
גזע mesenchymal (MSCs), עם היכולת של בידול ותרומה רגנרציה של רקמות mesenchymal כגון עצמות, סחוס, שריר, רצועה, גיד שומן, היה מבודד כמעט לכל רקמות הגוף למבוגרים1 , 2. מלבד מתן הומאוסטזיס רקמות על ידי ייצור תאים תושב במקרה של דלקת כרונית או פציעה, הם לייצר ציטוקינים חיוני, גורמי גדילה שננהל אנגיוגנזה, המערכת החיסונית, רקמות שיפוץ3. האינטראקציה של MSCs עם סרטן רקמות לא מובנות, אך ראיות המצטבר מרמז כי MSCs עשוי לקדם את החניכה, התקדמות, גרורות הגידול4.
יכולת ביות של MSCs האזור הפצוע או דלקתי כרוני גורם להם מועמד בעל ערך עבור טיפולים מבוססי תאי גזע. עם זאת, סרטן רקמות, "מעולם לא ריפוי הפצעים", שחרר גם ציטוקינים דלקתיים מולקולות פרו-אנגיוגנזה, גורמי גדילה חיוני, אשר מושכים MSCs אזור cancerogenous5. יש אמנם מוגבל דוחות מציג מעכבות ההשפעות של MSCs על סרטן הצמיחה6,7, שלהם התקדמות סרטן, גרורות קידום אפקטים כבר נרחב דיווח8. MSCs במישרין או בעקיפין להשפיע carcinogenesis בדרכים שונות, כולל דיכוי תאים חיסוניים, מפריש גורמי גדילה/ציטוקינים התומכים התפשטות תאים סרטן של הגירה, שיפור פעילות האנגיוגנזה, וויסות 9,mesenchymal-אפיתל המעבר (החובשים)10. סביבת הגידול מורכב של מספר סוגי תאים כולל סרטן הקשורים fibroblasts (CAFs) ו/או myofibroblasts, תאי אנדותל, adipocytes של תאים חיסוניים11. מאלה, CAFs הם סוג התא הנפוץ ביותר באזור הגידול להפריש נוגדנים שונים לקידום וצמיחה של גרורות סרטן8. הוכח כי MSCs הנגזרות מח עצם יכולים להתמיין CAFs משתית הגידול12.
תאי גזע זולה שיניים (DPSCs), המאופיינת כמו MSCs הראשון נגזר רקמות שיניים. Gronthos et al. 13 בשנת 2000 ואז נרחב נחקר על-ידי אחרים14,15, אקספרס סמנים pluripotency כגון Oct4, Sox2ו- Nanog16 , יכולים להתמיין תא שונים linages17. ניתוח ביטוי גנים וחלבונים הוכיח כי DPSCs לייצר רמות דומות של גורמי גדילה/ציטוקינים עם אחרים MSCs כלי הדם צמיחה אנדותל (VEGF), angiogenin, פיברובלסט גורם גידול 2 (FGF2), אינטרלויקין-4 (IL-4), IL-6, IL-10, תא גזע פקטור (SCF), כמו גם fms דמוי טירוזין קינאז-3 ליגנד (Flt - 3L) זה עשוי לקדם אנגיוגנזה, לווסת את תאי המערכת החיסונית ולתמוך סרטן התא התפשטות והעברה18,19,20 . בעוד האינטראקציות של MSCs לסביבת סרטן כבר מתועד בספרות, היחס בין DPSCs, תאים סרטניים לא הוערך עדיין. במחקר הנוכחי, הקמנו תרבות משותפת, מצב בינוני טיפול אסטרטגיות עבור קו תא סרטן הערמונית גרורתי מאוד, PC-3 ו- DPSCs להציע פוטנציאל הפעולה של המנגנון של MSCs שיניים התקדמות סרטן, גרורות.
Protocol
בכתב הסכמה מדעת של המטופלים היה המתקבלים לאחר האישור ועדת אתיקה מוסדית.
1. DPSC בידוד ותרבות
- להעביר את שיני הבינה המתקבל צעירים בגילאי 17 עד 20-15 מ"ל צינורות המכיל של Dulbecco מלאה ששינה נשר בינוני (DMEM) [נמוך הגלוקוז DMEM מדיה, בתוספת 10% סרום שור עוברית (FBS) ו- 1% פניצילין/סטרפטומיצין / פתרון שהוא גוסס (PSA)], בתוך 8 שעות לאחר כריתה. לשמור על החומר רקמות קר (4 ° C) במהלך ההעברה כדי למנוע מוות תאי פוטנציאליים.
- להסיר את הרקמה זולה על ידי מיצוי סטרילי מלקחיים מהמרכז של השן בקפידה, למקם את הרקמה זולה המדיום DMEM מלאה קר במנות תרביות רקמה 10 ס מ, מינצ אותם לחתיכות קטנות (2-3 מ מ) על ידי ומהדקים.
הערה: כל ההליכים ניסיוני צריכה להתבצע בתנאים סטריליים ב למינארי. טכניקה זו הלא-אנזימטי כבר השתמשו בעבר21,22,23. - המקום רקמות זולה קטן בתוך התרבות רקמות טיפול טוב 6 צלחות ולהוסיף 200 µL של התקשורת DMEM מלאה כדי לכסות את כל חתיכות רקמה זולה קטן.
- דגירה הבארות תרביות רקמה ב 37 מעלות צלזיוס באווירה humidified אוויר (80% לחות) עם 5% CO2 עבור 2 h לספק מצורף רקמות.
הערה: שלב זה יכול להיות ממושך עד 3-4 h על-ידי שליטה האידוי של מדיה. - להוסיף אמצעי האחסון המתאים (2-2.5 מ ל) של מדיום DMEM מלאה הבארות, דגירה ב 37 מעלות צלזיוס באווירה humidified אוויר עם 5% CO2 עבור תאים להתפשט מכל הרקמה.
הערה: התאים הופכים גלויים לאחר כ 4 ימים ולהגיע confluency אחרי 8-9 ימים. - כאשר תאים מגיעים 80% confluency, להסיר מדיה לוחות 6-ובכן, לשטוף עם 2 מ ל תמיסת פוספט buffered (PBS) ולהוסיף 2 מ של טריפסין. תקופת דגירה של 2 דקות בתוך אינקובטור ב 37 ° C עם אווירה אוויר humidified ו- 5% CO2. לאחר מכן להוסיף 2 מ"ל של מדיום DMEM מלאה ולאחריו הדגירה 2 דקות כדי לעכב טריפסין. צנטריפוגה תאים על 300 גרם x עבור 5 דקות כדי הצניפה תאים.
- מעבר לתאים המבחנות מלאה DMEM מדיה, החנות לניסויים נוספים. להוסיף 15 מ"ל של מדיה DMEM מלאה T-75 מבחנות, העברת תאים שתי בארות של צלחת 6-ובכן אל אחד T-75 מבחנות, דגירה ב 37 ° C עם אווירה אוויר humidified ו- 5% CO2.
2. אפיון DPSCs
- לבצע המורפולוגיים.
- תאי זרע (שלב 1.6) בתרבות רקמה מצופה מבחנות (או טוב 6 צלחות) במדיום DMEM מלאה לפחות 8 קטעים להתבונן מורפולוגיה תאים.
- דמיינו תאים על ידי מיקרוסקופ אור ולהגדיר פיברובלסט דמוי תא מורפולוגיה. התאים צריך לצרף הכלים תרבות, יש מורפולוגיה תאים דמויי כישור.
הערה: לחלופין, תאים יכולים להיות מחונן כמו תאים בודדים עד 14 ימים בובכן-פלטות להתבונן קיבולת היווצרות המושבה היא מאפיין ספציפי של fibroblasts ו- MSCs
- לבצע ניתוח סמן משטח.
- Trypsinize התאים מהשלב 1.7. להסיר מדיה מן הבקבוק תרביות רקמה T-75, לשטוף עם 2 מ של PBS ולהוסיף 2 מ של טריפסין. תקופת דגירה של 2 דקות בתוך אינקובטור ב 37 ° C עם אווירה אוויר humidified ו- 5% CO2. לאחר מכן להוסיף 2 מ"ל של מדיום DMEM מלאה ולאחריו הדגירה 2 דקות כדי לעכב טריפסין. צנטריפוגה תאים על 300 גרם x עבור 5 דקות כדי הצניפה תאים.
- לתקן את התאים עם 4% paraformaldehyde למשך 20 דקות בטמפרטורת החדר צינורות 1.5 mL ולאחר מכן לשטוף אותם עם 500 µL PBS 3 פעמים כדי להסיר את paraformaldehyde.
- דגירה תאים קבוע עם הנוגדנים נגד CD29, CD34, CD14, CD45, CD90, CD105, CD166 ו CD73 עבור h 1-4 מעלות צלזיוס ב 100 µL ל- PBS.
הערה: ריכוז נוגדן בשימוש היא 0.5 µg/mL. CD34, CD14 ו- CD45 משמשים כסמני שליליים, בעוד CD29 ', ' CD90 ', ' CD105 ', CD166, CD73 משמשים כסמני פני שטח התא חיובי עבור MSCs. - לשטוף תאים 3 פעמים עם PBS ולהשתמש בהתאמה נוגדנים משניים כגון fluorescein isothiocyanate (FITC), phycoerythrin (PE), וכו ' עבור תוויות. דגירה תאים עם נוגדנים משניים שבערך מדולל ב µL 100 ל- PBS למשך 30 דקות ב 4 ° C ושטוף 3 פעמים עם PBS.
- לשמור דגימות בחושך לניתוח cytometry זרימה, לזהות חיוביים ושליליים מכתים מאת cytometry זרימה.
הערה: השתמש תאים שליטה וללא רבב כדי לארגן את קדימה ואת הצד פיזור. לארגן gating של חיובי מוכתמת. למעט תאים מתים, פסולת, והאוכלוסייה בלתי מוכתם אוכלוסיות. השתמש 100 מיקרומטר זרבובית בלחץ נדן 45 psi ולאסוף אירועים 10,000 כדי לקבוע DPSCs חיובי על-ידי סידור ערוצים.
- לבצע הבידול של DPSCs.
- זרע 1 × 10 תאים4 על הצלחות 24-ובכן להשלים DMEM מדיה, תקופת דגירה של 24 שעות ביממה ב 37 מעלות צלזיוס באווירה humidified אוויר עם 5% CO2.
- לגבש בידול מדיה באמצעות להתחרות DMEM בינוני כמו בסיס מדיה. הכן osteogenic מדיה על ידי ערבוב 100 ננומטר דקסמטסון 10 מ מ β-glycerophosphate, חומצה אסקורבית 0.2 מ מ. הכן chondrogenic מדיה על ידי ערבוב × 1 אינסולין-transferrin-סלניום (ITS-G) 100 דקסמתזון nM, 100 ננוגרם למ"ל להפוך לגורם בטא הצמיחה (TGF-β), חומצה אסקורבית μg/mL 14, 1 מ"ג/מ"ל אלבומין שור (BSA). הכן adipogenic מדיה על ידי ערבוב 100 ננומטר דקסאמתאזון, 5 μg/mL אינסולין, 0.5 מ מ 3-איזובוטיל-1-methylxanthine (IBMX) ו- 60 μM indomethacin.
הערה: המדיה בידול ניתן לשמור ב 4 מעלות צלזיוס למשך לפחות שבוע. - לשנות מדיה צמיחה osteo - chondro-מדיה, או בידול adipo-genic ומדיה רענון פעמיים בשבוע במשך שבועיים.
- לאשר בידול על ידי פון Kossa, Alcian כתמים כחולים, פעילות אנזים (פעילות פוספטאז אלקליין), immunocytochemistry, וניתוחים פולימראז כמותיים תגובת שרשרת (qPCR) לפי הפרוטוקולים שתואר קודם לכן21.
- לבצע פון Kossa, stainings Alcian כחול על תאים שתוקנו עם 4% paraformaldehyde בטמפרטורת החדר במשך 10 דקות לשטוף את התאים קבוע עם PBS תכתים אותם עם ערכת vonKossa על פי המלצות היצרן להתבונן מצבורי סידן .
- הכינו את Alcian כחול מכתים פתרון על ידי המסת 1.00 גר' Alcian כחול צבע ב- 100 מ של 3% (v/v) חומצה אצטית עבור נוסף מכתים. רוחצים את התאים קבוע עם PBS את כתם תאים למשך 30 דקות עם פתרון Alcian כחול. דמיינו את הדגימות מוכתם על ידי מיקרוסקופ אור.
3. הכנת במצב בינוני (ס מ)
- החלף מדיה של תאים מהשלב 1.7 טריים-שלמה DMEM 24 h לפני אוסף ס מ.
הערה: מומלץ מעבר 2-4. - לאסוף מצב בינוני (ס מ) DPSCs בתרבית תאים מגיעות 80% confluency. צנטריפוגה מדיה שנאספו ב g x 300 במשך 5 דקות כדי להסיר רקמות פסולת תא וחומרי פסולת.
הערה: לחלופין, להשתמש 0.2 µm סביבונים להסיר את הלכלוך של המדיום תנאי. - לאסוף את תגובת שיקוע ולאחסן ב-20 ° C לניסויים נוספים.
הערה: לשמור את תגובת שיקוע ב-80 מעלות צלזיוס לאחסון לטווח ארוך.
4. טיפול של תאים סרטניים עם ס מ
- לבצע ניתוח הכדאיות התא.
- תאים PC-3 הזרע (האדם סרטן הערמונית תאים) על גבי לוחות 96-ובכן-צפיפות התאים של 5 × 103 תאים/באר להשלים DMEM, דגירה בתוך תא humidified-37 מעלות צלזיוס ו-5% CO2 במשך 24 שעות ביממה.
- יטפל בתאים עם 10, 20, 30, 40 ו- 50% של ס מ (v/v) מעורבב עם DMEM מלאה במשך 24 שעות ביממה.
- למדוד את הכדאיות תא על-ידי שימוש 3-(4,5-dimethyl-thiazol-2-yl)-5-(3-carboxymethoxy-phenyl)-2-(4-sulfo-phenyl)-2H-tetrazolium (MTS)-assay כפי שתואר לעיל24.
- לבצע מסוף deoxynucleotidyl טרנספראז dUTP ניק סוף תיוג ניתוחים (TUNEL).
- תאים PC-3 זרעים על תרבית תאים 6-ובכן צלחות-צפיפות התאים של 2 × 105 תאים/טוב, דגירה בתוך תא humidified-37 ° C ו- 5% CO2 בן לילה.
- מערבבים % 20 ס מ (v/v) עם להשלים DMEM בינוני ולהחיל התאים עבור 24 שעות.
- Trypsinize תאים להשעות ב- 50 μL תערובת התגובה TUNEL (תיוג פתרון + פתרון אנזים, מסופק עם הקיט), דגירה ב 37 מעלות צלזיוס למשך 60 דקות באווירה2 CO humidified ו- 5%.
הערה: עבור trypsinization, להסיר מדיה מ- 6-ובכן תא תרבות צלחות, לשטוף עם 1 מ"ל של PBS ולהוסיף 500 µL של טריפסין. תקופת דגירה של 2 דקות בתוך אינקובטור ב 37 ° C עם אווירה אוויר humidified ו- 5% CO2. להוסיף 1 מ"ל של מדיום DMEM מלאה ולאחריו הדגירה 2 דקות כדי לעכב טריפסין. צנטריפוגה תאים על 300 גרם x עבור 5 דקות כדי הצניפה תאים. - לשטוף עם PBS ולנתח התאים ב- PBS באמצעות cytometry זרימה.
- לבצע ניתוח qPCR.
- תאים PC-3 זרעים על תרבית תאים 6-ובכן צלחות-צפיפות התאים של 2 × 105 תאים/טוב, דגירה ב חממה humidified 37 ° C ו 5% CO2 בן לילה.
- מערבבים % 20 ס מ (v/v) עם להשלים DMEM בינוני ולהחיל התאים עבור 24 שעות.
- Trypsinize התאים ולאסוף תא צניפה סינתזה RNA בידוד ו- cDNA.
הערה: להסיר מדיה צלחות התרבות תאים 6-ובכן, לשטוף עם 1 מ"ל ל- PBS, וכן להוסיף 500 µL של טריפסין. דגירה 2 דקות בתוך אינקובטור ב 37 ° C עם אווירה אוויר humidified ו- 5% CO2. להוסיף 1 מ"ל של מדיום DMEM מלאה ולאחריו הדגירה 2 דקות כדי לעכב טריפסין. צנטריפוגה תאים על 300 גרם x עבור 5 דקות כדי הצניפה תאים. - ביצוע ניסויים qPCR לפי פרוטוקול שתואר לעיל25.
- לבצע נדידת תאים סרטניים.
- זרע 1 × 10-5 PC-3 תאים על גבי לוחות 12-ובכן, דגירה ב חממה humidified בין לילה-CO של 37 ° C ו- 5%-2.
- לגרד תאים עם טיפ μL 200 סטרילי ולשנות בינוני מיד עם בינוני טריים המכילים ריכוזים שונים של ס מ [למשל, 10, 20, 30, 40 ו- 50% של ס מ (v/v) מעורבב עם מלא DMEM].
- להתבונן שריטות תחת מיקרוסקופ הפוכה, לצלם תמונות במרווחי זמן שונים (0 ו- 24 שעות).
- למדוד את הסגר מאפס באמצעות תוכנה J התמונה באמצעות הנוסחה:
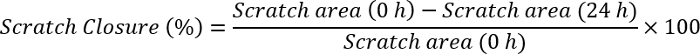
הערה: פתחו את התמונה מאפס עם התמונה J תוכנה. צייר קו בעל גודל זהה כמו סרגל קנה מידה שכבר קיים בתמונה. לחץ על נתח, להגדיר, ולבחון מרחק בפיקסלים כמו ההגדלה של קו שצויר. לכתוב את הגודל של סרגל קנה מידה החלק מרחק ידוע לארגן יחידה (פיקסלים, ס מ, וכו '), לחץ על אישור. עבור לסעיף נתח שוב ולחץ על המידות. זה ייתן לראשונה את הגודל של סרגל קנה מידה כיחידה הנבחרת. לחץ על קצה אחד של שריטה וגרור עד שהגיע את הקצה השני של השריטה. הערה הערך עבור כל נקודת זמן (0 h ו- 24 שעות). ערכים אלה מתחברים לנוסחה שלעיל ולחשב את הסגר מאפס.
5. נדידת תאים על-ידי מגע ישיר של תאים סרטניים, DPSCs
- הזרע 3 × 104 DPSCs על גבי צלחת 24-ובכן מוסיף עם 0.4 μm הנקבוביות ו דגירה ב חממה humidified בין לילה ב 37 º C.
- זרע התאים PC-3 אל. ובכן 24 צלחות-צפיפות התאים של × 10 54 , דגירה ב חממה humidified בין לילה-CO של 37 ° C ו- 5%-2.
- לגרד PC-3 תאים עם טיפ μL 200 סטרילי, לשנות בינונית בינונית טרייה, ולמקם מוסיף נושא DPSCs על גבי המחשב האישי-3 תאים.
- להתבונן התאים תחת מיקרוסקופ הפוכה, לצלם תמונות במרווחי זמן שונים (0 ו- 24 h) כדי לנתח נדידת תאים.
6. תרבות משותפת Assay, לזרום Cytometry ניתוח
- תווית PC-3 תאים, DPSCs באמצעות PKH67 (ירוק) ו- PKH26 צבע מקשר תא פלורסנט (אדום), בהתאמה26.
- Trypsinize תאים PC-3 ו- DPSCs, בהתאמה. להסיר מדיה מן הבקבוק תרביות רקמה T-75, לשטוף עם 2 מ של PBS ולהוסיף 2 מ של טריפסין. תקופת דגירה של 2 דקות בתוך אינקובטור ב 37 ° C עם אווירה אוויר humidified ו- 5% CO2. להוסיף 2 מ"ל של מדיום DMEM מלאה ולאחריו הדגירה 2 דקות כדי לעכב טריפסין.
- צנטריפוגה תאים על 300 גרם x עבור 5 דקות לבטל את תגובת שיקוע, resuspend תא כדורי בפתרון לצבוע מוכנים במאגר diluent-C שסופק על-ידי הערכה (ראה טבלה של חומרים).
- דגירה בתאים הפתרון צבע עבור 10 דקות ולסיים את התגובה צביעת על-ידי הוספת µL 100 של FBS. צנטריפוגה תאים ב g x 300 במשך 5 דקות, למחוק את תגובת שיקוע, רחץ את התאים עם מדיום הגידול מלאה לפני שיתוף culturing.
- צלחת עם התווית תאים (5 × 104/טוב) על גבי לוחות 6-טוב ביחס 1:1 (DPSCs: PC3). לשמור על שיתוף בתרבית תאים DMEM מלאה.
- איסוף תאים לאחר תקופות דגירה 24 שעות או 48 שעות על ידי צנטריפוגה של תאים ב g 300 x במשך 5 דקות, כביסה עם PBS.
- Resuspend תאים µL 300 של תא לפעיל על-ידי קרינה פלואורסצנטית מיון (FACS) מאגר ב 5 מ ל סביב צינורות cytometry זרימה התחתון. מערבולת לפיזור תא אגרגטים ממש לפני הניתוח הדגימה.
- השתמש זרבובית מיקרומטר 100 45 psi נדן לחץ.
הערה: קצב הזרימה גבוהה מאוד עלול להקטין את הרגישות של זיהוי קרינה פלואורסצנטית. - השתמש בקרה וללא רבב תאים ותאים בצבע יחיד כדי להתאים המתאימה לפנים ומתח לצד פיזור לייזר עבור סוגי תאים ופיצויים כאמור27.
הערה: השתמש gating עבור תאים חיים כדי לא לכלול שאריות תאים, תאים מתים או אגרגטים. - לאסוף אירועים 10,000 (100,000 עדיפה) כדי לקבוע אחוז חיובי DPSCs ירוק אדום PC-3 תאים על-ידי סידור FL-1 (ירוק) ו- FL-2 (אדום) ערוצים.
תוצאות
איור 1 מציג MSC מאפייניה של DPSCs בתנאים תרבות. DPSCs מפעילים תאי פיברובלסט דמוי מורפולוגיה לאחר ציפוי (איור 1B). MSC אנטיגנים פני השטח (CD29, CD73, CD90, CD105 ו CD166) מבוטאים מאוד בזמן סמנים hematopoietic (CD34, CD45 ו CD14) הם שליליים (איור 1C). שינויים ברמה המ...
Discussion
התרומה של MSCs לסביבת הגידול מוסדר על ידי אינטראקציות מספר כולל היברידית תא דור דרך התא fusions, entosis או ציטוקינים ופעילויות כימוקין בין תאי גזע תאים סרטן28. מבנה הארגון, תא-תא אינטראקציות וגורמים המופרש לקבוע בהתנהגות התא סרטן מבחינת קידום הגידול, התקדמות, גרורות לרקמות. נאות
Disclosures
המחברים אין לחשוף.
Acknowledgements
מחקר זה נתמך על ידי אוניברסיטת Yeditepe. כל הנתונים ודמויות להשתמש במאמר זה היו שפורסמו בעבר34.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11885084 | For cell culture |
| FBS | Invitrogen | 16000044 | For cell culture |
| PSA | Lonza | 17-745E | For cell culture |
| Trypsin | Invitrogen | 25200056 | For cell dissociation |
| PBS | Invitrogen | 10010023 | For washes |
| Dexamethasone | Sigma | D4902 | Component of differentiation media |
| β-Glycerophosphate | Sigma | G9422 | Component of osteogenic differentiation medium |
| Ascorbic acid | Sigma | A4544 | Component of osteo- and chondro-genic differentiation medium |
| Insulin-Transferrin-Selenium (ITS −G) | Invitrogen | 41400045 | Component of chondrogenic differentiation medium |
| TGF-β | Sigma | SRP3171 | Component of chondrogenic differentiation medium |
| Insulin | Sigma | I6634 | Component of adipogenic differentiation medium |
| Isobutyl-1-methylxanthine (IBMX) | Sigma | I7018 | Component of adipogenic differentiation medium |
| Indomethacin | Sigma | I7378 | Component of adipogenic differentiation medium |
| MTS Reagent | Promega | G3582 | Cell viability analyses |
| TUNEL Assay | Sigma | 11684795910 | Apoptotic analyses |
| 24-well plate inserts | Corning | 3396 | For trans-well migration assay |
| PKH67 | Sigma | PKH67GL | For co-culture cell staining |
| PKH26 | Sigma | PKH26GL | For co-culture cell staining |
| Paraformaldehyde | Sigma | P6148 | For cell fixation |
| von Kossa Kit | BioOptica | 04-170801.A | For cell staining (differentiation) |
| Alcian blue | Sigma | A2899 | For cell staining (differentiation) |
References
- Camberlain, G., Fox, J., Ashton, B., Middleton, J. Mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Demirci, S., Doğan, A., Şahin, F. . Dental Stem Cells. , 109-124 (2016).
- Fox, J. M., Chamberlain, G., Ashton, B. A., Middleton, J. Recent advances into the understanding of mesenchymal stem cell trafficking. British journal of haematology. 137 (6), 491-502 (2007).
- Chang, A. I., Schwertschkow, A. H., Nolta, J. A., Wu, J. Involvement of mesenchymal stem cells in cancer progression and metastases. Current cancer drug targets. 15 (2), 88-98 (2015).
- Dvorak, H. F. Tumors: wounds that do not heal. New England Journal of Medicine. 315 (26), 1650-1659 (1986).
- Lu, Y. -. r., et al. The growth inhibitory effect of mesenchymal stem cells on tumor cells in vitro and in vivo. Cancer biology & therapy. 7 (2), 245-251 (2008).
- Secchiero, P., et al. Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts. PloS one. 5 (6), e11140 (2010).
- Hong, I. -. S., Lee, H. -. Y., Kang, K. -. S. Mesenchymal stem cells and cancer: friends or enemies?. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 768, 98-106 (2014).
- Brennen, W. N., Chen, S., Denmeade, S. R., Isaacs, J. T. Quantification of Mesenchymal Stem Cells (MSCs) at sites of human prostate cancer. Oncotarget. 4 (1), 106 (2013).
- Klopp, A. H., Gupta, A., Spaeth, E., Andreeff, M., Marini, F. Concise review: dissecting a discrepancy in the literature: do mesenchymal stem cells support or suppress tumor growth. Stem cells. 29 (1), 11-19 (2011).
- Albini, A., Sporn, M. B. The tumour microenvironment as a target for chemoprevention. Nature Reviews Cancer. 7 (2), 139 (2007).
- Quante, M., et al. Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth. Cancer cell. 19 (2), 257-272 (2011).
- Gronthos, S., Mankani, M., Brahim, J., Robey, P. G., Shi, S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 97 (25), 13625-13630 (2000).
- Mori, G., et al. Dental pulp stem cells: osteogenic differentiation and gene expression. Annals of the new York Academy of Sciences. 1237 (1), 47-52 (2011).
- Mori, G., et al. Osteogenic properties of human dental pulp stem cells. Journal of biological regulators and homeostatic agents. 24 (2), 167-175 (2010).
- Kerkis, I., et al. Isolation and characterization of a population of immature dental pulp stem cells expressing OCT-4 and other embryonic stem cell markers. Cells Tissues Organs. 184 (3-4), 105-116 (2006).
- Potdar, P. D., Jethmalani, Y. D. Human dental pulp stem cells: applications in future regenerative medicine. World journal of stem cells. 7 (5), 839 (2015).
- Ahmed, N. E. -. M. B., Murakami, M., Hirose, Y., Nakashima, M. Therapeutic potential of dental pulp stem cell secretome for Alzheimer's disease treatment: an in vitro study. Stem cells international. 2016, (2016).
- Gorin, C., et al. Priming dental pulp stem cells with fibroblast growth factor-2 increases angiogenesis of implanted tissue-engineered constructs through hepatocyte growth factor and vascular endothelial growth factor secretion. Stem cells translational medicine. 5 (3), 392-404 (2016).
- Wakayama, H., et al. Factors secreted from dental pulp stem cells show multifaceted benefits for treating acute lung injury in mice. Cytotherapy. 17 (8), 1119-1129 (2015).
- Doğan, A., et al. Differentiation of human stem cells is promoted by amphiphilic pluronic block copolymers. International Journal of Nanomedicine. 7, 4849 (2012).
- Taşlı, P. N., Doğan, A., Demirci, S., Şahin, F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro. Biological trace element research. 153 (1-3), 419-427 (2013).
- Yalvac, M., et al. Isolation and characterization of stem cells derived from human third molar tooth germs of young adults: implications in neo-vascularization, osteo-, adipo-and neurogenesis. The pharmacogenomics journal. 10 (2), 105 (2010).
- Doğan, A., et al. Sodium pentaborate pentahydrate and pluronic containing hydrogel increases cutaneous wound healing in vitro and in vivo. Biological trace element research. 162 (1-3), 72-79 (2014).
- Doğan, A., Yalvaç, M. E., Yılmaz, A., Rizvanov, A., Şahin, F. Effect of F68 on cryopreservation of mesenchymal stem cells derived from human tooth germ. Applied biochemistry and biotechnology. 171 (7), 1819-1831 (2013).
- Rizvanov, A. A., et al. Interaction and self-organization of human mesenchymal stem cells and neuro-blastoma SH-SY5Y cells under co-culture conditions: A novel system for modeling cancer cell micro-environment. European Journal of Pharmaceutics and Biopharmaceutics. 76 (2), 253-259 (2010).
- Troiano, L., et al. Multiparametric analysis of cells with different mitochondrial membrane potential during apoptosis by polychromatic flow cytometry. Nature protocols. 2 (11), 2719 (2007).
- Melzer, C., von der Ohe, J., Lehnert, H., Ungefroren, H., Hass, R. Cancer stem cell niche models and contribution by mesenchymal stroma/stem cells. Molecular cancer. 16 (1), 28 (2017).
- Aguirre, A., Planell, J., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and biophysical research communications. 400 (2), 284-291 (2010).
- Bogdanowicz, D. R., Lu, H. H. . Biomimetics and Stem Cells. , 29-36 (2013).
- Plotnikov, E., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of cellular and molecular. 12 (5a), 1622-1631 (2008).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology journal. 8 (4), 395-396 (2013).
- Brunetti, G., et al. High expression of TRAIL by osteoblastic differentiated dental pulp stem cells affects myeloma cell viability. Oncology reports. 39 (4), 2031-2039 (2018).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Dental pulp stem cells (DPSCs) increase prostate cancer cell proliferation and migration under in vitro conditions. Tissue and Cell. 49 (6), 711-718 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved