JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
펄프 조직 문화와 공동 암 세포와 그들의 상호 작용을 공부 하에서 중간 엽 줄기 세포 분리
요약
우리 치과 펄프에서 격리 된 중간 엽 줄기 세포와 공동 문화를 직접 및 간접 방법에 따라 전립선 암 세포 상호 작용의 평가 대 한 프로토콜을 제공 합니다. 조건 매체 및 트랜스-잘 막 간접 paracrine 활동 분석에 적당 하다. 차동 시드 직접 셀 상호 작용에 대 한 적절 한 모델입니다 함께 셀 스테인드.
초록
다단계 프로세스와 복잡 한 질병으로 암은 개별 세포 증식 및 성장 뿐만 아니라 또한 종양 환경과 세포 세포 상호 작용에 의해 제어. 암 및 줄기 세포 상호 작용, 세포 외 환경, 물리적 상호 작용 및 분 비 요소에 변화를 포함 하 여 새로운 치료 옵션의 발견을 사용 수 있습니다. 우리는 시스템을 만들 모델 중간 엽 줄기 세포 (MSCs)와 암 세포 상호 작용 알려진된 공동 문화 기술을 결합 한다. 현재 연구에서 치과 펄프의 줄기 세포 (DPSCs) 및 PC 3 전립선 암 세포 상호 작용은 직접 및 간접 공동 문화 기술에 의해 시험 되었다. 조건 매체 (CM) DPSCs에서 얻은 고 0.4 µ m 기 공 크기의 트랜스-잘 막 paracrine 활동을 연구 하는 데 사용 했다. 다른 세포 유형의 공동 문화 함께 직접 셀 상호 작용을 연구 수행 되었다. 결과 공개 CM 세포 증식을 증가 하 고 전립선 암 세포 배양에 있는 apoptosis를 감소. CM 및 트랜스-잘 시스템 PC-3 셀의 셀 마이그레이션 용량을 증가 했다. 다른 막 염료와 스테인드 셀 같은 문화 혈관으로 시드 했다 고 DPSCs PC-3 셀이 직접 공동 문화 조건 자체 조직된 구조에 참가 했다. 전반적으로, 결과 표시 공동 문화 기술 모델 시스템으로 암 및 MSC 상호 작용에 대 한 도움이 될 수 있습니다.
서문
차별화와 같은 뼈, 연골, 근육, 인 대, 힘 줄, 그리고 지방, 간 엽 조직의 재생에 기여의 능력을 가진 중간 엽 줄기 세포 (MSCs),1 성인 신체에서 거의 모든 조직에서 분리 되어 , 2. 조직의 항상성 만성 염증 또는 상해 거주 셀을 생산 하 여 제공 하는, 다른 그들은 중요 한 cytokines 및 통합 하는 신생, 면역 체계, 그리고 조직3개장을 성장 요인 생산. 암 조직으로 MSCs의 상호 작용은 잘 이해 하지만 축적 증거 나왔다 MSCs가 종양 개시, 진행, 전이4를 홍보 수 있습니다.
부상 또는 만성 염증이 지역 MSCs의 귀환 능력은 그들이 줄기 세포 기반 요법에 대 한 귀중 한 후보. 그러나, 암 조직, "상처를 치유 하지", 또한 염증 성 cytokines, 프로-신생 분자, 그리고 cancerogenous 지역5MSCs를 유치 하는 중요 한 성장 요인 풀어. 그러나 거기에 제한7, 그들의 암 진행과 전이 홍보 효과 광범위 하 게 되어 암 성장6,에 MSCs의 억제 효과 보여주는 보고서 보고8. MSCs 직접 또는 간접적으로 영향을 미칠 발암 억제 면역 세포, 암 세포 증식 및 마이그레이션, 신생 활동을 강화 하 고 규제를 지 원하는 성장 인자/cytokines를 은닉 하는 등 다른 방법으로 상피 엽 전환 (응급)9,10. 암 관련 된 섬유 아 세포 (CAFs) 또는 myofibroblasts, 내 피 세포, adipocytes, 그리고 면역 세포11을 포함 한 여러 세포 유형 종양 환경에 의하여 이루어져 있다. 그 중, CAFs는 암 성장과 전이8을 홍보 하는 다양 한 발산을 분 비 하는 종양 영역에서 가장 풍부한 셀 유형입니다. 그것은 종양 기질12골 파생 MSCs CAFs로 분화 할 수 표시 되었습니다.
치과 펄프의 줄기 세포는 (DPSCs), Gronthos 그 외 여러분 에 의해 첫 번째 치과 조직 파생 MSCs로 특징 2000 년에 13 널리14,15다른 사람에 의해 조사, Oct4, Sox2및 Nanog16 등 pluripotency 마커를 표현 하 고 다양 한 셀 linages17으로 분화 할 수 있다. 유전자와 단백질 표정 분석 입증 DPSCs 성장 인자/cytokines 혈관 내 피 성장 인자 (VEGF), angiogenin, 섬유 아 세포 성장 인자 2 (FGF2), 인터 루 킨-4 (IL-4), 다른 MSCs와 대 등 한 수준의 생산 일리노이-6, 일리노이-10, 그리고 줄기 세포 요소 (SCF), 뿐만 아니라 신생을 촉진, 면역 세포를 조절 하 고 암 세포 확산 및 마이그레이션18,19,20 지원 수 fms 같은 티로신 키 니 아 제 3 ligand (Flt-3 L) . 동안 암 환경 상호작용 MSCs의 문학에서 문서화, DPSCs와 암 세포 사이 관계 아직 평가 하지는. 현재 연구에서 우리는 높은 전이성 전립선 암 세포 선, PC-3, 및 암 진행과 전이에 치과 MSCs의 메커니즘의 잠재적인 행동을 제안 하는 DPSCs에 대 한 공동 문화 및 상태 중간 치료 전략을 설립.
프로토콜
환자 서 면된 동의 기관 윤리 위원회에서 승인 후 얻은 것입니다.
1. DPSC 격리와 문화
- 17 ~ 20 15 mL 튜브 포함 하는 완전 한 Dulbecco의 수정이 글 중간 (DMEM) 세 젊은 성인에서 얻은 사랑니 전송 [낮은 포도 당 DMEM 미디어, 10% 태아 둔감 한 혈 청 (FBS)와 1% 페니실린/스 보충 / 암포 (PSA) 솔루션], 절제 후 8 시간 이내. 잠재적인 세포 죽음을 방지 하는 전송 하는 동안 조직 자료 감기 (4 ° C)를 보관.
- 신중 하 게 치아의 중심에서 무 균 추출 겸 자 펄프 조직 제거, 펄프 조직 10cm 조직 문화 요리, 감기 완전 한 DMEM 매체에 놓고 메스로 작은 조각 (2-3 m m)으로 그들을 말하다.
참고: 모든 실험 절차 수행 되어야 합니다 밖으로 층 류 후드에서 무 균 조건 하에서. 이 비 효소 기술 이전에 사용한21,,2223되었습니다. - 내부 조직 문화 장소 작은 펄프 조직 6 잘 플레이트 취급 하 고 커버 각 작은 펄프 조직 조각에 완전 한 DMEM 미디어의 200 µ L를 추가 합니다.
- 2 h 조직 첨부 파일을 제공 하기 위한 5% CO2 와 37 ° c 습도 공기 분위기 (80% 습도)에서 조직 문화 웰 스를 품 어.
참고:이 단계 수 수 연장에 3-4 미디어의 증발을 조절 하 여. - 우물에 완전 한 DMEM 매체의 적절 한 볼륨 (2-2.5 mL)를 추가 하 고 조직에서 확산 하는 셀에 대 한 5% CO2 습도 공기 분위기에서 37 ° C에서 품 어.
참고: 셀 약 4 일 후에 표시 되 고 8-9 일 후에 confluency를 도달. - 셀 80 %confluency 도달, 6 잘 플레이트에서 미디어를 제거 하 고 인산 염 버퍼 식 염 수 (PBS)의 2 개 mL로 씻어 trypsin의 2 개 mL를 추가. 37 ° C 습도 공기 분위기에서 인큐베이터에 2 분 및 5% CO2품 어. 트립 신 억제 하기 위해 부 화 2 분 뒤 완전 한 DMEM 매체의 2 개 mL를 추가 합니다. 셀 작은 셀을 5 분에 대 한 300 x g에서 원심
- 완전 한 DMEM 미디어와 추가 실험에 대 한 저장소에 플라스 크를 통로 셀. 6 잘 플레이트 한 T-75 플라스 크에의 2 개의 우물에서 T-75 플라스 크 및 전송 셀 완전 한 DMEM 미디어의 15 mL를 추가 하 고 37 ° C 습도 공기 분위기와 5% CO2에서 품 어.
2입니다. DPSCs의 특성
- 형태소 분석을 수행 합니다.
- 씨 셀 (단계 1.6) 조직 문화에 플라스 크 (또는 6 잘 플레이트) 셀 형태를 관찰 하기 위해 적어도 8 구절에 대 한 완전 한 DMEM 매체에 코팅.
- 가벼운 현미경으로 세포를 시각화 하 고 구와 같은 셀 형태를 정의 합니다. 셀 문화 요리를 연결 하 고 스핀 들 모양의 세포 형태를가지고 해야 합니다.
참고: 또는, 셀 수 수 경작 단일 셀으로 섬유 아 세포와 MSCs의 특정 특성은 식민지 형성 능력을 관찰을 잘 플레이트에 최대 14 일 동안.
- 표면 마커 분석을 수행 합니다.
- 1.7 단계에서 셀 trypsinize T-75 조직 배양 플라스 크에서 미디어를 제거 하 고 PBS의 2 개 mL로 씻어 trypsin의 2 개 mL를 추가. 37 ° C 습도 공기 분위기에서 인큐베이터에 2 분 및 5% CO2품 어. 트립 신 억제 하기 위해 부 화 2 분 뒤 완전 한 DMEM 매체의 2 개 mL를 추가 합니다. 셀 작은 셀을 5 분에 대 한 300 x g에서 원심
- 1.5 mL 튜브에 실 온에서 20 분 동안 4 %paraformaldehyde 셀을 수정 하 고 paraformaldehyde 제거 하려면 PBS 3 번 500 µ L로 그들을 씻어.
- PBS의 100 µ L에 4 ° C에서 1 시간을 위한 CD29, CD34, CD14, CD45, CD90, CD105, CD166, 및 CD73에 대 한 항 체와 고정된 셀을 품 어.
참고: 사용 하는 항 체의 농도 0.5 µ g/mL. CD34, CD14, CD45 CD29, CD90, CD105, CD166, 및 CD73 MSCs에 대 한 긍정적인 세포 표면 표식으로 사용 하는 동안 부정적인 표식으로 사용 됩니다. - 셀 3 회 PBS로 세척 하 고 fluorescein isothiocyanate (FITC), phycoerythrin (PE), 등 각각 2 차 항 체를 사용 하 여 라벨에 대 한. 4 ° C에서 30 분 PBS의 100 µ L에 희석 1: 500 2 차 항 체와 세포와 PBS로 3 회 세척을 품 어.
- 샘플 흐름 cytometry 분석을 위해 어둠 속에서 유지 하 고 긍정적이 고 부정적인 얼룩 cytometry에 의해 감지.
참고: 앞으로 및 측면 분산형을 흠 없는 제어 셀을 사용 합니다. 죽은 세포, 파편, 및 유엔 스테인드 인구를 제외 하 여 인구 스테인드 게이팅의 긍정적으로 정렬 합니다. 45 psi 칼 집 압력 100 µ m 노즐을 사용 하 여 고 10000 이벤트 채널을 정렬 하 여 긍정적인 DPSCs 결정를 수집 합니다.
- DPSCs의 차별화를 수행 합니다.
- 씨앗 1 × 10에 24-잘 접시에4 셀 DMEM 미디어를 완료 하 고 5% CO2습도 공기 분위기에서 37 ° C에서 24 h에 대 한 품 어.
- 차별화를 공식화 미디어를 사용 하 여 기본 미디어 DMEM 매체 경쟁. 100 nM dexamethasone, 10 m m β-glycerophosphate, 및 0.2 m m 의약품을 혼합 하 여 osteogenic 미디어를 준비 합니다. 혼합 하 여 1 × 인슐린-처리가-셀레늄 (ITS-G), 100 nM dexamethasone, 100 ng/mL 변형 시키는 성장 인자 beta (TGF-β), 의약품 14 μ g/mL, 1 mg/mL 소 혈 청 알 부 민 (BSA) chondrogenic 미디어를 준비 합니다. 100 nM dexamethasone, 5 μ g/mL 인슐린, 0.5 m m 3-isobutyl-1-methylxanthine (IBMX), 그리고 60 μ M indomethacin을 혼합 하 여 adipogenic 미디어를 준비 합니다.
참고: 차별화 미디어 보관할 수 있습니다 4 ° C에 적어도 1 주일에 대 한. - 2 주 동안 일주일에 두 번 osteo, chondro 또는 adipo genic 차별화 미디어 성장 매체 및 새로 고침 미디어를 변경 합니다.
- Von Kossa Alcian 블루 얼룩, 효소 활동 (알칼리 성 인산 가수분해 효소 활동), immunocytochemistry, 및 프로토콜 앞에서 설명한21에 따라 정량적 중 합 효소 연쇄 반응 (정량) 분석 하 여 차별화를 확인 합니다.
- Von Kossa 수행 하 고 Alcian 블루 stainings 10 분에 대 한 실 온에서 4 %paraformaldehyde 고정 된 셀에 PBS 가진 고정된 셀을 세척 하 고 칼슘 예금 관찰 하는 제조 업체의 권장 사항에 따라 vonKossa 키트와 함께 얼룩 .
- Alcian 블루 추가 얼룩에 대 한 3% (v/v) 초 산 100ml에 파란 Alcian 염료의 1.00 g을 용 해 하 여 솔루션 얼룩을 준비 합니다. PBS 가진 고정된 셀을 세척 하 고 30 분 Alcian 블루 솔루션에 대 한 셀을 얼룩. 가벼운 현미경에 의해 스테인드 샘플을 시각화.
3. 조건 매체 (CM)의 준비
- CM 컬렉션 전에 신선한 완전 한 DMEM 24 h 단계 1.7에서에서 셀의 미디어를 바꿉니다.
참고: 통로 2-4는 것이 좋습니다. - 셀 도달 80 %confluency 교양된 DPSCs에서 조건 매체 (CM)를 수집 합니다. 폐 조직 재료와 세포 파편을 제거 하 5 분에 대 한 300 x g에서 수집 된 미디어 원심
참고: 또는, 조건 매체에서 파편을 제거 하려면 0.2 µ m 주사기 필터를 사용 합니다. - 상쾌한 수집 하 고 추가 실험-20 ° C에서 저장.
참고: 장기 저장을 위한-80 ° C에는 상쾌한을 유지.
4입니다. CM와 암 세포의 치료
- 세포 생존 능력 분석을 수행 합니다.
- 씨앗 PC-3 셀 (인간의 전립선 암 세포)의 5 × 103 셀/에 셀 밀도에서 96 잘 접시에 DMEM 고 24 h에 대 한 37 ° C, 5% CO2 습도 챔버에 품 어.
- 24 h에 대 한 완전 한 DMEM 혼합 10, 20, 30, 40, 및 CM (v/v)의 50%에 포함 된 셀을 취급 합니다.
- (MTS) 3-(4,5-dimethyl-thiazol-2-yl)-5-(3-carboxymethoxy-phenyl)-2-(4-sulfo-phenyl)-2H-tetrazolium를 사용 하 여 세포 생존 측정-24이전에 설명 된 대로 시험.
- 터미널 deoxynucleotidyl 전이 효소 dUTP 닉 끝 라벨 (TUNEL) 분석을 수행 합니다.
- 6 잘 세포 배양 접시 2 × 105 셀 밀도에 셀/잘와 하룻밤에 37 ° C, 5% CO2 습도 챔버에 품 어에 씨 PC-3 셀.
- 혼합 20%와 CM (v/v) DMEM 매체를 완료 하 고 24 시간에 대 한 셀에 적용 합니다.
- 셀 trypsinize TUNEL 반응 혼합물 (솔루션 + 효소 솔루션, 키트와 함께 제공 된 라벨)의 50 μ에 중단 하 고 습도 하 고 5% CO2 분위기에서 60 분 동안 37 ° C에서 품 어.
참고: trypsinization에 대 한 6-잘 세포 배양 배지에서 미디어를 제거, 1 mL의 PBS로 세척 및 추가 500 µ L의 트립 신. 37 ° C 습도 공기 분위기에서 인큐베이터에 2 분 및 5% CO2품 어. 트립 신 억제 하기 위해 부 화 2 분 뒤 완전 한 DMEM 매체의 1 mL를 추가 합니다. 셀 작은 셀을 5 분에 대 한 300 x g에서 원심 - PBS와 린스를 cytometry 사용 하 여 PBS에 세포를 분석 합니다.
- 정량 분석을 수행 합니다.
- 6 잘 세포 배양 접시 2 × 105 셀 밀도에 셀/잘와 하룻밤에 37 ° C, 5% CO2 습도 인큐베이터에서 품 어에 씨 PC-3 셀.
- 혼합 20%와 CM (v/v) DMEM 매체를 완료 하 고 24 시간에 대 한 셀에 적용 합니다.
- Trypsinize 셀을 RNA 격리 및 cDNA 합성 펠 렛 셀을 수집 합니다.
참고: 6 잘 세포 배양 배지에서 미디어를 제거 하 고 PBS의 1 mL로 씻어 trypsin의 500 µ L을 추가. 37 ° C 습도 공기 분위기에서 인큐베이터에 2 분, 5% CO2를 품 어. 트립 신 억제 하기 위해 부 화 2 분 뒤 완전 한 DMEM 매체의 1 mL를 추가 합니다. 셀 작은 셀을 5 분에 대 한 300 x g에서 원심 - 앞에서 설명한 프로토콜25에 따라 정량 실험 수행 합니다.
- 암 세포의 세포 마이그레이션을 수행 합니다.
- 씨앗 1 × 105 PC-3 12-잘 접시에 셀 하 고 37 ° C, 5% CO2에서 하룻밤 습도 인큐베이터에서 품 어.
- 살 균 200 μ 팁 셀 긁 고 즉시 CM의 다양 한 농도 포함 하는 신선한 매체와 매체 변경 [예를 들어, 10, 20, 30, 40, 및 완전 한 DMEM 섞인 CM (v/v)의 50%].
- 거꾸로 현미경 흠집을 관찰 하 고 다른 시간 간격 (0, 24 h)에서 사진을 찍을.
- 수식을 사용 하 여 이미지 J 소프트웨어를 사용 하 여 스크래치 폐쇄를 측정:
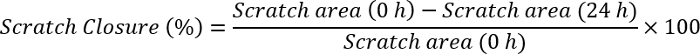
참고: 이미지 J 소프트웨어와 함께 스크래치 이미지를 엽니다. 눈금 막대는 이미지에 이미 있는 동일한 크기를 가진 선을 그립니다. 클릭 분석, 규모, 설정 하 고 그려진 선의 확대 픽셀에서 거리를 관찰. 알려진된 거리 부분에 눈금 막대의 크기를 작성, 단위 (픽셀, cm, 등), 배열 하 고 확인을 클릭 합니다. 분석 섹션에 다시가 고 측정 클릭. 이 먼저 선택한 단위로 눈금 막대의 크기를 줄 것 이다. 처음의 한 가장자리에 클릭 하 고 처음의 다른 쪽 끝을 도달할 때까지 끕니다. (오와 24 h) 각 시간 점의 값 note 위의 공식에 이러한 값을 연결 하 고 스크래치 폐쇄를 계산.
5. 암 세포와 DPSCs의 간접적인 접촉에 의해 셀 마이그레이션
- 시드 3 × 104 DPSCs 0.4 μ m와 24-잘 플레이트 삽입에 기 공 하 고 37 ° c.에 하룻밤 습도 인큐베이터에서 품 어
- 씨 PC-3 셀에 24-잘 5 × 104 의 세포 조밀도에 플레이트 고 37 ° C, 5% CO2에서 하룻밤 습도 인큐베이터에서 품 어.
- 살 균 200 μ 팁 PC-3 셀 스크래치, 신선한 매체와 매체를 변경 하 고 삽입 PC-3 셀에 DPSCs를 들고 장소.
- 거꾸로 현미경 세포를 관찰 하 고 셀 마이그레이션 분석을 다른 시간 간격 (0, 24 h)에서 사진을 찍을.
6. 공동 문화 분석 결과 및 Flow Cytometry 분석
- PC-3 셀 및 DPSCs PKH67 (녹색) 및 PKH26 (적색) 형광 셀 링커 염료, 각각26사용 하 여 레이블을 지정 합니다.
- Trypsinize PC-3와 DPSCs 세포, 각각. T-75 조직 배양 플라스 크에서 미디어를 제거 하 고 PBS의 2 개 mL로 씻어 trypsin의 2 개 mL를 추가. 37 ° C 습도 공기 분위기에서 인큐베이터에 2 분 및 5% CO2품 어. 트립 신 억제 하기 위해 부 화 2 분 뒤 완전 한 DMEM 매체의 2 개 mL를 추가 합니다.
- 5 분 x 300g에 세포를 원심, 상쾌한, 삭제 및 셀 펠 릿 키트에서 제공 하는 희석제 C 버퍼에 염료 해결책에서 resuspend ( 재료의 표참조).
- 10 분 동안 염료 용액에 세포를 품 어와 FBS의 100 µ L을 추가 하 여 착 색 반응 종료. 5 분 x 300g에 세포를 원심, 상쾌한, 삭제 하 고 공동 경작 하기 전에 완전 한 성장 매체를 가진 세포를 씻어.
- 셀 표시 판 (5 × 104/잘) 1:1 비율로 (DPSCs: PC3) 6-잘 접시에. 완전 한 DMEM에 공동 경작된 한 세포를 유지 합니다.
- 24 시간 또는 48 h 인큐베이션 기간 후 5 분 및 PBS로 세척에 대 한 300 x g에서 셀의 원심 분리에 의해 세포를 수집 합니다.
- 300 µ L 하단 흐름 cytometry 튜브 라운드 5 ml에서 (FACS) 버퍼를 정렬 하는 형광 활성화 셀의 셀 resuspend 샘플 분석 전에 오른쪽 셀 집계를 분산 소용돌이.
- 45 psi 칼 집 압력 100 µ m 노즐을 사용 합니다.
참고: 매우 높은 유량 형광 검출의 감도 줄일 수 있습니다. - 흠 없는 컨트롤 셀과 단일 색된 셀 사용 하 여 적절 한 앞으로 세포 유형 및 보상 듯이27사이드 분산형 레이저 전압 조정.
참고: 사용 하 여 라이브 셀 게이팅 세포 파편, 죽은 세포, 또는 집계 제외 하. - FL-1 (녹색) 및 플로리다-2 (레드) 채널을 정렬 하 여 % 긍정적인 녹색 DPSCs 및 빨간 PC-3 셀 결정 10000 이벤트 (100000 바람직합니다) 수집.
결과
그림 1 문화 조건 하에서 DPSCs의 일반적인 MSC 특성 묘사. DPSCs (그림 1B) 도금 후 구와 같은 세포 형태학을 발휘 한다. MSC 표면 항 원 (CD29, CD73, CD90, CD105, 및 CD166)은 매우 조 혈 마커 (CD34, CD45, 및 CD14) 동안 표시는 부정적인 (그림 1C). 형태학 및 분자 수준에서 변경 내용을 관련 osteo-chondro-, 그리고 adipo genic 차별?...
토론
종양 환경 MSCs의 기여는 하이브리드 세포 생성을 통해 세포 융해, 줄기 세포와 암 세포28사이 entosis 또는 cytokine 및 chemokine 활동을 포함 한 여러 가지 상호 작용에 의해 통제 된다. 구조 조직, 세포 세포 상호 작용 및 분 비 종양 승진, 진행, 및 주위 조직 전이 암 셀 동작을 결정 합니다. 적절 한 비보 전 모델 시스템 상주 세포 인구의 상호 작용의 뒤에 기계 장치를 조사...
공개
저자는 공개 없다.
감사의 말
이 연구는 Yeditepe 대학에 의해 지원 되었다. 모든 데이터 및이 문서에서 사용 되는 그림34이전에 게시 했다.
자료
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11885084 | For cell culture |
| FBS | Invitrogen | 16000044 | For cell culture |
| PSA | Lonza | 17-745E | For cell culture |
| Trypsin | Invitrogen | 25200056 | For cell dissociation |
| PBS | Invitrogen | 10010023 | For washes |
| Dexamethasone | Sigma | D4902 | Component of differentiation media |
| β-Glycerophosphate | Sigma | G9422 | Component of osteogenic differentiation medium |
| Ascorbic acid | Sigma | A4544 | Component of osteo- and chondro-genic differentiation medium |
| Insulin-Transferrin-Selenium (ITS −G) | Invitrogen | 41400045 | Component of chondrogenic differentiation medium |
| TGF-β | Sigma | SRP3171 | Component of chondrogenic differentiation medium |
| Insulin | Sigma | I6634 | Component of adipogenic differentiation medium |
| Isobutyl-1-methylxanthine (IBMX) | Sigma | I7018 | Component of adipogenic differentiation medium |
| Indomethacin | Sigma | I7378 | Component of adipogenic differentiation medium |
| MTS Reagent | Promega | G3582 | Cell viability analyses |
| TUNEL Assay | Sigma | 11684795910 | Apoptotic analyses |
| 24-well plate inserts | Corning | 3396 | For trans-well migration assay |
| PKH67 | Sigma | PKH67GL | For co-culture cell staining |
| PKH26 | Sigma | PKH26GL | For co-culture cell staining |
| Paraformaldehyde | Sigma | P6148 | For cell fixation |
| von Kossa Kit | BioOptica | 04-170801.A | For cell staining (differentiation) |
| Alcian blue | Sigma | A2899 | For cell staining (differentiation) |
참고문헌
- Camberlain, G., Fox, J., Ashton, B., Middleton, J. Mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Demirci, S., Doğan, A., Şahin, F. . Dental Stem Cells. , 109-124 (2016).
- Fox, J. M., Chamberlain, G., Ashton, B. A., Middleton, J. Recent advances into the understanding of mesenchymal stem cell trafficking. British journal of haematology. 137 (6), 491-502 (2007).
- Chang, A. I., Schwertschkow, A. H., Nolta, J. A., Wu, J. Involvement of mesenchymal stem cells in cancer progression and metastases. Current cancer drug targets. 15 (2), 88-98 (2015).
- Dvorak, H. F. Tumors: wounds that do not heal. New England Journal of Medicine. 315 (26), 1650-1659 (1986).
- Lu, Y. -. r., et al. The growth inhibitory effect of mesenchymal stem cells on tumor cells in vitro and in vivo. Cancer biology & therapy. 7 (2), 245-251 (2008).
- Secchiero, P., et al. Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts. PloS one. 5 (6), e11140 (2010).
- Hong, I. -. S., Lee, H. -. Y., Kang, K. -. S. Mesenchymal stem cells and cancer: friends or enemies?. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 768, 98-106 (2014).
- Brennen, W. N., Chen, S., Denmeade, S. R., Isaacs, J. T. Quantification of Mesenchymal Stem Cells (MSCs) at sites of human prostate cancer. Oncotarget. 4 (1), 106 (2013).
- Klopp, A. H., Gupta, A., Spaeth, E., Andreeff, M., Marini, F. Concise review: dissecting a discrepancy in the literature: do mesenchymal stem cells support or suppress tumor growth. Stem cells. 29 (1), 11-19 (2011).
- Albini, A., Sporn, M. B. The tumour microenvironment as a target for chemoprevention. Nature Reviews Cancer. 7 (2), 139 (2007).
- Quante, M., et al. Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth. Cancer cell. 19 (2), 257-272 (2011).
- Gronthos, S., Mankani, M., Brahim, J., Robey, P. G., Shi, S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 97 (25), 13625-13630 (2000).
- Mori, G., et al. Dental pulp stem cells: osteogenic differentiation and gene expression. Annals of the new York Academy of Sciences. 1237 (1), 47-52 (2011).
- Mori, G., et al. Osteogenic properties of human dental pulp stem cells. Journal of biological regulators and homeostatic agents. 24 (2), 167-175 (2010).
- Kerkis, I., et al. Isolation and characterization of a population of immature dental pulp stem cells expressing OCT-4 and other embryonic stem cell markers. Cells Tissues Organs. 184 (3-4), 105-116 (2006).
- Potdar, P. D., Jethmalani, Y. D. Human dental pulp stem cells: applications in future regenerative medicine. World journal of stem cells. 7 (5), 839 (2015).
- Ahmed, N. E. -. M. B., Murakami, M., Hirose, Y., Nakashima, M. Therapeutic potential of dental pulp stem cell secretome for Alzheimer's disease treatment: an in vitro study. Stem cells international. 2016, (2016).
- Gorin, C., et al. Priming dental pulp stem cells with fibroblast growth factor-2 increases angiogenesis of implanted tissue-engineered constructs through hepatocyte growth factor and vascular endothelial growth factor secretion. Stem cells translational medicine. 5 (3), 392-404 (2016).
- Wakayama, H., et al. Factors secreted from dental pulp stem cells show multifaceted benefits for treating acute lung injury in mice. Cytotherapy. 17 (8), 1119-1129 (2015).
- Doğan, A., et al. Differentiation of human stem cells is promoted by amphiphilic pluronic block copolymers. International Journal of Nanomedicine. 7, 4849 (2012).
- Taşlı, P. N., Doğan, A., Demirci, S., Şahin, F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro. Biological trace element research. 153 (1-3), 419-427 (2013).
- Yalvac, M., et al. Isolation and characterization of stem cells derived from human third molar tooth germs of young adults: implications in neo-vascularization, osteo-, adipo-and neurogenesis. The pharmacogenomics journal. 10 (2), 105 (2010).
- Doğan, A., et al. Sodium pentaborate pentahydrate and pluronic containing hydrogel increases cutaneous wound healing in vitro and in vivo. Biological trace element research. 162 (1-3), 72-79 (2014).
- Doğan, A., Yalvaç, M. E., Yılmaz, A., Rizvanov, A., Şahin, F. Effect of F68 on cryopreservation of mesenchymal stem cells derived from human tooth germ. Applied biochemistry and biotechnology. 171 (7), 1819-1831 (2013).
- Rizvanov, A. A., et al. Interaction and self-organization of human mesenchymal stem cells and neuro-blastoma SH-SY5Y cells under co-culture conditions: A novel system for modeling cancer cell micro-environment. European Journal of Pharmaceutics and Biopharmaceutics. 76 (2), 253-259 (2010).
- Troiano, L., et al. Multiparametric analysis of cells with different mitochondrial membrane potential during apoptosis by polychromatic flow cytometry. Nature protocols. 2 (11), 2719 (2007).
- Melzer, C., von der Ohe, J., Lehnert, H., Ungefroren, H., Hass, R. Cancer stem cell niche models and contribution by mesenchymal stroma/stem cells. Molecular cancer. 16 (1), 28 (2017).
- Aguirre, A., Planell, J., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and biophysical research communications. 400 (2), 284-291 (2010).
- Bogdanowicz, D. R., Lu, H. H. . Biomimetics and Stem Cells. , 29-36 (2013).
- Plotnikov, E., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of cellular and molecular. 12 (5a), 1622-1631 (2008).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology journal. 8 (4), 395-396 (2013).
- Brunetti, G., et al. High expression of TRAIL by osteoblastic differentiated dental pulp stem cells affects myeloma cell viability. Oncology reports. 39 (4), 2031-2039 (2018).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Dental pulp stem cells (DPSCs) increase prostate cancer cell proliferation and migration under in vitro conditions. Tissue and Cell. 49 (6), 711-718 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유