A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
لوسيفر الأصفر - علامة نفاذية شبه خلوية قوية في نموذج خلية من حاجز الدم في الدماغ البشري
In This Article
Summary
نقدم اختبار الفلورة لإثبات أن لوسيفر الأصفر (LY) هو علامة قوية لتحديد نفاذية شبه الخلايا الظاهرة من الخلايا أحادية hCMEC /D3، وهو نموذج في المختبر من حاجز الدم والدماغ البشري. استخدمنا هذا الفحص لتحديد حركية تشكيل أحادي الطبقات في خلايا hCMEC/D3 المستزرعة.
Abstract
يتكون حاجز الدم في الدماغ BBB من الخلايا البطانية التي تشكل حاجزا بين الدورة الدموية الجهازية والدماغ لمنع تبادل الأيونات غير الضرورية والمواد السامة. تقاطعات ضيقة (TJ) ختم فعال الفضاء شبه الخلوية في الطبقات الأحادية مما أدى إلى حاجز سليمة. تصف هذه الدراسة فحص الفلورة القائم على LY التي يمكن استخدامها لتحديدمعامل نفاذية واضحة (P التطبيق) وبدورها يمكن استخدامها لتحديد حركية تشكيل الطبقات الأحادية المطابقة وتقاطع ضيق الناتجة سلامة الحاجز في الطبقات الأحادية hCMEC/D3. كما نبرهن على فائدة إضافية من هذا الاختبار لتحديد السلامة الوظيفية TJ في الخلايا المنقولة. بياناتنا من LY Pالتطبيق فحص يظهر أن الخلايا hCMEC / D3 البذر في إعداد transwell تحد بشكل فعال LY النقل شبه الخلوي 7 أيام بعد الثقافة. كفائدة إضافية من فحص المقدمة، ونحن نثبت أيضا أن نقل الجسيمات النانوية الحمض النووي لا يغير LY النقل شبه الخلوي في الطبقات الأحادية hCMEC/D3.
Introduction
حاجز الدم في الدماغ (BBB) هو الحاجز الوقائي الذي يحد من تدفق مكونات البلازما إلى أنسجة الدماغ ويتكون من خلايا بطانة الدماغ جنبا إلى جنب مع الخلايا الداعمة مثل pericytes. الدور الرئيسي لBBB هو أن تكون بمثابة الحاجز الذي يختم المسافة بين الدم المحيطي والجهاز العصبي المركزي (CNS) للحفاظ على الهيموسات من البيئة الدقيقة العصبية1،2. الخلايا البطانية الشعرية في الدماغ ختم المسار شبه الخلوي بشكل فعال عن طريق تشكيل تقاطعات ضيقة بين الخلايا (TJs)1. هذا الحاجز الواقي يسمح الجلوكوز والمواد الغذائية المختارة لدخول الدماغ في حين أنه يمنع غالبية الأيونات والمواد السامة والأدوية من المرور من خلال هذا الحاجز الضيق. وإلى جانب الدور الوقائي الذي يضطلع به المكتب، فإن وظيفة الحاجز الطبيعي لـ BBB تشكل تحديا ً شديداً في تطوير نظم إيصال المخدرات التي تستهدف الجهاز العصبي المركزي.
في المختبر نماذج زراعة الخلايا من BBB هي أدوات مفيدة لدراسة البيولوجيا وفهم آثار العلاج من المخدرات على سلامة حاجز TJ. استخدمنا خط الخلايا البطانية الأوعية الدموية المجهرية الدماغية البشرية (hCMEC/D3) كنموذج في المختبر لأنه نموذج مقبول من بطانة الدماغ البشري3 ويلخص العديد من وظائف BBB البشرية. hCMEC /D3is واحدة من خطوط الخلايا الأكثر استخداما لنمذجة BBB في المختبر4،5،6،7،8،9. على الرغم من قيمها المنخفضة نسبيا من المقاومة الكهربائية عبر الانعندوات (TEER)، وهو مقياس لضيق الحاجز، يحتفظ هذا الخط الخلوي بمعظم الخصائص المورفولوجية والوظيفية للخلايا البطانية الدماغية، حتى كثقافة أحادية في غياب الخلايا الغليفية المشتركة الثقافة6،7. خط الخلية hCMEC /D3 يعبر عن علامات BBB متعددة بما في ذلك الناقلين النشطين والمستقبلات حتى مرور ما يقرب من 35 دون الخضوع للتمييز إلى الأنماط الظاهرية غير المستقرة6و7و9 ،10،11. السمة الأكثر لفتا للانتباه من خط الخلية hCMEC / D3 كنموذج BBB في المختبر هو قدرته على تشكيل TJs5،9،11،12. وتجدر الإشارة إلى أنه على الرغم من أن نماذج BBB المشتقة من الخلايا الجذعية أظهرت نفاذية أعلى في العديد من الدراسات مقارنة مع خط الخلية hCMEC/D3 وأنها لا تعبر عن بعض علامات BBB، فإنها لم تتطور بعد كنموذج الخلية BBB الأكثر شيوعا13. الأهم من ذلك، لا تزال نماذج BBB المشتقة من الخلايا الجذعية تتميز فيما يتعلق بأرقام المرور القصوى التي تسمح للخلايا للحفاظ على الأنماط الظاهرية BBB مستقرة14.
وتستخدم عادة ثلاث طرق أولية لتحديد سلامة حاجز TJ، بما في ذلك قياس TEER،وقياس معامل نفاذية واضح (P التطبيق) من جزيئات التتبع المائية الصغيرة مثل السكروز، الإينولين، لوسيفر الأصفر، الخ والمناعة من علامات الجزيئية المعروفة من TJs مثل claudin-5، ZO-1، occludin، الخ5. TEER هو طريقة بسيطة نسبيا وكمية أن يقيس المقاومة الكهربائية عبر أحاديةالخلية المستزرعة على الركيزة غشاء مسامية 5. ومع ذلك، يمكن أن تتأثر قيم TEER بالمتغيرات التجريبية مثل تكوين وسط الثقافة ونوع أداة القياس. مزيج محتمل من هذه العوامل يؤدي إلى توزيع واسع من قيم TEER تتراوح بين 2 إلى 1150 Ω سم2 في خط الخلية hCMEC /D3 المستزرعة لمدة 2-21 يوما13. تلطيخ المناعة هو طريقة بصرية لتحديد وجود بروتينات TJ عن طريق وضع العلامات على البروتين المستهدف باستخدام الأجسام المضادة. ومع ذلك، ينطوي التلطيخ المناعي على سلسلة من الخطوات التجريبية، بما في ذلك الحاجة إلى إصلاح/نفاذية الخلايا التي قد تؤدي إلى قطع أثرية تجريبية وإشارات الفلورسنت قد تتلاشى مع مرور الوقت. قد تؤدي العوامل المذكورة أعلاه إلى أخطاء ذاتية تؤثر على جودة البيانات.
التركيز الرئيسي لهذا العمل هو تقديم فحص نفاذية واضحة تستند إلى LY تحديد حركية تشكيل أحادي الطبقات المنافي في الخلايا المستزرعة hCMEC/D3. على الرغم من أن أنظمة BBB المتقدمة الأخرى في المختبر، مثل أنظمة الثقافة المشتركة، وأنظمة السوائل الدقيقة، هي من الناحية الفسيولوجية أكثر أهمية يحاكي مع وظيفة حاجز تحسنت بشكل كبير15،16،17،hCMEC /D3 transwell الإعداد هو نموذج بسيط وموثوق بها لتقدير حركية تشكيل TJ وفرز بسرعة تأثير تركيبات المخدرات المختلفة على وظيفة الحاجز. بشكل عام، قيمالتطبيق P متسقة لمختلف solutes المائية في الطبقات الأحادية hCMEC/D3. على سبيل المثال، قيمالتطبيق P المبلغ عنها لمختلف solutes الكتلة الجزيئية المنخفضة المختلفة (مثل السكروز، مانيتول، LY، الخ) في مختلف نماذج BBB في المختبر هي في ترتيب 10-4 سم / دقيقة5،18،19 , 20.في الإعداد التجريبي لدينا، يتم بذر الخلايا البطانية الدماغ على غشاء ميكرومبوروس المغلفة بالكولاجين لتعلق الخلية وتشكيل أحادية الطبقة لتقليد الحاجز في الجسم الحي. وأضاف LY في الجانب apical ومن المتوقع أن اجتياز التقاطعات الضيقة بين الخلايا وتتراكم في الجانب الباضلي. وتشير تركيزات أكبر من LY في الجانب الباضيلي إلى وجود حاجز غير ناضج وغير عملي بالكامل، في حين تعكس التركيزات المنخفضة النقل المقيد بسبب وجود TJs وظيفية مما يؤدي إلى حاجز ناضج.
LY هو صبغة مائية مع قمم الإثارة / الانبعاثات متميزة ويتجنب الحاجة إلى جزيئات تتبع العلامة الراديوية مثل السكروز، مانيتول أو الإينولين. وهكذا، يمكن استخدام قيم الفلورة من LY لحساب نفاذية شبه الخلوية مباشرة عبر الطبقات الأحادية BBB. أيضا، بالمقارنة مع العديد من الأصباغ المتاحة تجاريا المستخدمة في المجالات الطبية الحيوية التي تعاني من التحولات ستوكس الصغيرة مثل الفلورسين21،تحول ستوكس من LY حوالي 108 نانومتر مع فصل الطيفية كافية، مما يسمح LY البيانات الفلورية باعتبارها قراءة قوية لتحديد نفاذية شبه الخلوية. استخدمنا النشاف الغربي كتقنية متعامدة لإظهار التغيرات في التعبير عن البروتين علامة تقاطع ضيق، ZO-1، على مدى وقت الثقافة. يتم استخدام التعبير ZO-1 الكشف عن طريق النشاف الغربية لتكملة بياناتالتطبيق LY P وجنبا إلى جنب، وتشير هذه البيانات إلى أن التغييرات التي لوحظت في قيمالتطبيق LY P يعكس تشكيل طبقة أحادية مع زيادة تدريجية في التعبير عن علامة تقاطع ضيق، ZO-1.
وكما أشير في وقت سابق، فإن التركيز الرئيسي لهذا العمل هو إظهار اختبار LY كتقنية بسيطة لرصد تشكيل طبقة أحادية المنافية مع تقاطعات ضيقة وظيفية. ومع ذلك، لإظهار فائدة إضافية من اختبار المتقدمة، قمنا بقياسالتطبيق LY P في الحمض النووي نانوجسيم transfecd hCMEC / D3 أحادية الطبقات. يمكن تكثيف الأحماض النووية في جسيمات نانوية متعددة الكهرباء بقطر 100-200 نانومتر عن طريق التفاعل الكهروستاتيكي بين مجموعات البوليمرات المشحونة بشكل إيجابي ومجموعات الفوسفات المشحونة سلبا من الأحماض النووية22، 23.نشير إلى هذه المجمعات كجسيمات نانوية الحمض النووي (DNA NPs) في عملنا. في حين أن نيتنا هي نقل الخلايا والتعبير عن البروتين المطلوب، يجب علينا أن نضمن عدم المساس بخصائص الحاجز من الطبقات الأحادية hCMEC/D3. تشير بياناتنا إلى أن نظام الانف الجيني القياسي 4 h luciferase لا يغير بشكل ملموس نفاذية LY مما يدل على فائدة اختبارالتطبيق LY P لتحديد التغييرات في سلامة حاجز TJ.
Protocol
1.General hCMEC /D3 ثقافة الخلية
- إنعاش الخلايا المجمدة
ملاحظة: تم إجراء جميع صيانة ثقافة الخلايا والتجارب داخل غطاء أمان حيوي معقم. تم شراء وسائل الإعلام الثقافية والمكملات الغذائية والكواشف كمنتجات معقمة أو تعقيمها عن طريق الترشيح باستخدام فلتر غشاء 0.22 م لمنع التلوث الميكروبي.- إضافة 8.5 مل من محلول الكولاجين (0.15mg /mL) في قارورة زراعة الأنسجة (75 سم2 منطقة النمو؛ يشار إليها من الآن فصاعدا باسم T75) ووضعها في حاضنة (37 درجة مئوية، 5٪ CO2)لمدة 1 ساعة.
- إزالة محلول الكولاجين وغسل بلطف قارورة مع معقم الفوسفات المخزنة المالحة (PBS). أضف 15 مل من وسط النمو الكامل إلى القارورة واتركها في حاضنة CO2 لمدة 15 دقيقة.
ملاحظة: الوسط الكامل (التركيز النهائي) يحتوي على بطانة الخلية النمو القاعدية المتوسطة-2 (500 مل) تستكمل مع مصل البقر الجنين (5٪)، البنسلين-ستربيتوبيسين (1٪)، هيدروكورتيزون (1.4 درجة مئوية)، حمض الاسكوربيك (5 ميكروغرام / مل)، الدهون المعرفة كيميائيا التركيز (1/100)، HEPES (10 MM) وعامل نمو الخلايا الليفية الأساسية (1 نانوغرام/مل). - نقل الفيع السريع من خلايا hCMEC/D3 المجمدة من خزان النيتروجين السائل وذوبان القارورة بسرعة في حمام مائي 37 درجة مئوية (< 1 دقيقة).
- مرة واحدة فقط رقاقة صغيرة من الجليد مرئية، يستنشق بسرعة ونقل الخلايا إلى قارورة تحتوي على وسط قبل تسخينها. يهز بلطف قارورة للسماح خلط الخلايا مع وسط النمو.
- وضع قارورة في الحاضنة (37 درجةمئوية، 5٪ CO 2) ومراقبة الخلايا تحت المجهر الخفيف بعد 2 ساعة للتأكد من أن يتم إرفاق الخلايا.
- مرة واحدة الخلايا تعلق على الجزء السفلي من قارورة، وإزالة متوسط النمو القديم وإضافة 10 مل من المتوسطة النمو الطازجة قبل تسخينها لتحل محل ثنائي ميثيل سولفوكسيد في وسط النمو القديم24.
- بعد 24 ساعة، تحقق تحت المجهر الخفيف لمراقبة الخلايا على شكل المغزل واستبدال وسط النمو القديم مع متوسط النمو الطازجة قبل تسخينها.
- صيانة ثقافة الخلايا
- تجديد وسط النمو كل يومين حتى التقاء 100٪. تحقق من الخلايا تحت المجهر قبل إزالة متوسط النمو القديم وأيضا بعد إضافة وسط نمو جديد. إخراج قارورة من الحاضنة وفحص خلايا hCMEC / D3 تحت مجهر التباين المرحلة لضمان أنها تبدو صحية.
ملاحظة: يجب أن تعلق غالبية الخلايا إلى الجزء السفلي من قارورة، لديها مورفولوجيا على شكل المغزل وفي كثير من الأحيان، وينظر أيضا الانكسار الضوء حول أغشيةها. يجب أن تكون متوسطة النمو شفافة (غير غائمة) والوردي البرتقالي في اللون. - إزالة متوسط النمو القديم من قارورة ونقل 10 مل من المتوسطة الطازجة قبل تسخينها في قارورة.
ملاحظة: يجب إضافة الوسيط إلى الجانب العلوي من القارورة وليس مباشرة على سطح الخلايا لتجنب التأثير على مرفق الخلية. - تحويل قارورة مرة أخرى إلى موقف أفقي وصخرة بلطف عدة مرات والتحقق من خلايا hCMEC / D3 تحت المجهر قبلإعادة قارورة إلى الحاضنة (37 درجة مئوية، 5٪ CO 2).
- مراقبة الخلايا تحت المجهر الضوئي المقلوب في كل مرة قبل وبعد التعامل مع الخلايا، سواء أثناء العمل الثقافي العادي وخلال التجارب. تسجيل أي تغييرات ملحوظة في رقم الخلية أو مورفولوجيا في دفتر المختبر.
- تجديد وسط النمو كل يومين حتى التقاء 100٪. تحقق من الخلايا تحت المجهر قبل إزالة متوسط النمو القديم وأيضا بعد إضافة وسط نمو جديد. إخراج قارورة من الحاضنة وفحص خلايا hCMEC / D3 تحت مجهر التباين المرحلة لضمان أنها تبدو صحية.
- خلية تمرير
- احتضان قارورة T75 جديدة مع 8.5 مل من محلول الكولاجين لمدة 1 ساعة فيالحاضنة (37 درجة مئوية، 5٪ CO 2).
- إزالة محلول الكولاجين وغسل بلطف قارورة مع PBS معقمة. إضافة 10 مل من hCMEC / D3 قبل تسخينها المتوسطة إلى قارورة جديدة ووضع قارورة فيالحاضنة (37 درجة مئوية، 5٪ CO 2).
- إخراج قارورة من الحاضنة وفحص خلايا hCMEC / D3 تحت مجهر التباين المرحلة للتحقق مما إذا كانت الخلايا هي 100٪ مترافق.
- إزالة hCMEC / D3 متوسط الخلية من قارورة تحتوي على خلايا وغسل خلايا hCMEC / D3 مع 10 مل من PBS.
ملاحظة: FBS المضافة إلى متوسط النمو يحتوي على مثبطات البروتياز مثل α1-أنتيتريبسين وα2-ماكروغلوبولين. هذه تمنع عملية التربسيني. وبالتالي، فمن الضروري لغسل الخلايا مع PBS لإزالة آثار FBS لمنع تثبيط عملية التغريب. - إضافة 1 مل من 0.25٪ التربسين الحل الذي يحتوي على 0.02٪ EDTA وtrypsinize لمدة2-5 دقيقة في الحاضنة (37 درجة مئوية، 5٪ CO 2) (اضغط على قارورة بلطف على الجانبين للمساعدة في مفرزة).
ملاحظة: لا تترك الخلايا على التربسين/EDTA لأكثر من 6 دقائق. - إضافة 10 مل من hCMEC/D3 قبل تسخينها المتوسطة لوقف عملية التربسينية وإعادة تعليق خلية hCMEC/D3 عن طريق الأنابيب صعودا وهبوطا عدة مرات. ثم قم بإزالة تعليق الخلية بالكامل من القارورة إلى أنبوب 15 مل.
- نقل 1 مل من تعليق الخلية من أنبوب 15 مل إلى قارورة جديدة مع متوسط الطازجة قبل تسخينها (تقسيم الخلايا 1:10) والعودة قارورة جديدة مرة أخرى إلى الحاضنة.
ملاحظة: قبل نقل إلى قارورة جديدة، ماصة تعليق الخلية صعودا وهبوطا عدة مرات لتقليل التدرجات تركيز الخلية.
2. خلية الطلاء
- مكان إدراج ثقافة الأنسجة مع الأغشية المسامية (حجم المسام: 0.4 م، المواد: البولي ايثيلين تيريفثالات (PET)) في لوحة ثقافة 24 جيدا.
- إضافة 400 درجة مئوية من الكولاجين من النوع الأول (0.15 ملغ / مل) في كل إدراج ثقافة الأنسجة وحضانة لمدة 1 ساعة في حاضنة CO2 (37 درجة مئوية، 5٪ CO2). هز لوحة 24 جيدا بلطف للسماح حتى انتشار محلول الكولاجين على الغشاء المسامي في إدراج ثقافة الأنسجة.
- إزالة محلول الكولاجين وغسل بلطف غشاء microporous مع 0.4 مل من 1X PBS العازلة.
- خلايا hCMEC/D3 ذات الكثافة 50,000 خلية/سم2 في الخلية إدراج (15,000 خلية في 500 ميكرولتر من المتوسط).
ملاحظة: لتقليل الاختلافات في رقم الخلية في كل إدراج زراعة الأنسجة، تم إعادة تعليق تعليق الخلية مع ماصة 10 مل قبل إضافة الخلايا إلى إدراج. - ضع اللوحة ذات الـ 24 بئرًا مع إعداد زراعة الأنسجة في حاضنة (37 درجة مئوية، 5% ثاني أكسيدالكربون)للسماح بإرفاق الخلايا وانتشارها.
- احتضان لوحة لمدة 7 أيام للسماح للخلايا للوصول إلى 100٪ الملاءمة. إزالة متوسط النمو كل يوم ونقل 0.5 مل من وسائل الإعلام الطازجة قبل تسخينها في إدراج ثقافة الأنسجة.
- كرر إجراء الطلاء (الخطوات 2.2-2.6) على لوحة 12 جيدا، لوحة 48 جيدا ولوحة 96 جيدا. استخدم لوحة 12 بئرًا للنشاف الغربي لتحديد التغييرات في تعبير ZO-1. استخدام لوحة 48 جيدا لDNA NP التغوط. استخدم لوحة 96-well للحصول على اختبار ATP لتحديد صلاحية الخلايا في الخلايا المنكرة.
3. حركية نمو الخلايا.
- بذور الخلايا في كثافة 50،000 خلية / سم2 في الكولاجين المغلفة 24 جيدا لوحة ثقافة الأنسجة.
- في كل يوم من التجربة، قم بإزالة متوسط النمو وغسل الخلايا بلطف مرتين مع 500 درجة مئوية من 1x PBS. ثم، إضافة 30 درجة مئوية من 0.25٪ التربسين الحل الذي يحتوي على 0.02٪ EDTA وترك لوحة لحوالي2-5 دقيقة في حاضنة (37 درجة مئوية، 5٪ CO 2).
ملاحظة: قد يؤثر التشكيل التدريجي للطبقة الأحادية المنافية على مدى انفصال الخلايا، ومن الضروري زيادة كميات التربسين/EDTA على النحو المبين هنا: 30 ميكرولتر لمدة 1-5 أيام بعد البذر، و60 ميكرولتر لمدة 6-7 أيام بعد البذر، و100 يورو لتر لمدة 8-10 أيام بعد البذر . - إضافة إما 470 μL، 440 درجة مئوية أو 400 درجة مئوية من متوسط النمو على أساس حجم التربسين / EDTA الحل المضافة في الخطوة 3.2 لإعداد 500 درجة مئوية من تعليق الخلية في كل بئر.
- تعليق الخلايا عن طريق الأنابيب صعودا وهبوطا في كل بئر عدة مرات ومراقبة الخلايا تحت المجهر للتأكد من تعليق جميع الخلايا في وسط النمو. إذا كانت بعض الخلايا لا تزال تعلق على أسفل لوحة بعد الأنابيب عدة مرات، كشط بلطف الخلايا باستخدام مكشطة الخلية البلاستيكية لتسهيل انفصال الخلية.
- إزالة 0.1 مل من تعليق الخلية من تعليق الخلية 500 درجة مئوية في الخطوة 3.3 وإضافة إلى أنبوب 1.5 مل. ثم، إضافة 0.1 مل من 0.4٪ تريبان الحل الأزرق إلى تعليق الخلية ومزيج جيدا.
- تنظيف مقياس الهيماسيمع الكحول isopropyl 70٪. إضافة 20 درجة مئوية من الخليط من الخطوة 3.5 على كل جانب في الأخدود الخامس وتحديد موقع المربعات 16 تحت المجهر. وتعتبر المربعات الـ 16 شبكة واحدة. حدد موقع شبكتين عشوائيتين على كل جانب من مقياس الهوة وعد جميع الخلايا الحية غير الزرقاء.
ملاحظة: الخلايا التي ظهرت باللون الأزرق من المستبعدة من العد، <1% من الخلايا الملطخة باللون الأزرق في جميع نقاط الوقت. - حساب كثافة الخلية (الخلايا/سم2)استناداً إلى الصيغ التالية.
متوسط عدد الخلايا/الشبكة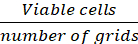 = (Eq.1)
= (Eq.1)
عامل التخفيف =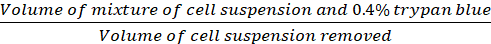 (Eq.2)
(Eq.2)
كثافة الخلايا (الخلاياالقابلة للحياة /سم 2) =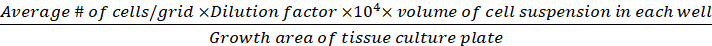
(مق.ق.ع-3)
المعادلات 1-3 الخلايا القابلة للحياة هي عدد الخلايا التي يتم عدها في كل شبكة، وعدد الشبكات تتوافق مع عدد الشبكات الموجودة تحت المجهر، وحجم خليط من تعليق الخلية و 0.4٪ تريبان الأزرق هو حجم أعدت في الخطوة 3.5، وحجم تعليق الخلية إزالة هو حجم إزالتها من تعليق الخلية 500 درجة مئوية في الخطوة 3.5، وحجم تعليق الخلية في كل بئر هو تعليق الخلية 500 درجة مئوية من الخطوة 3.3، منطقة النمو من لوحة زراعة الأنسجة هو منطقة النمو من بئر واحد في لوحة 24 جيدا.
4. لوسيفر الصفراء نفاذية واضحة (LY P التطبيق) تقييم
- لتحديدالتطبيق LY P على كل يوم بعد البذر، اتبع الخطوات التي تبدأ 4.3. لتحديدالتطبيق P في خلايا hCMEC/D3 المنقولة، إضافة 8.3 ميكرولتر من تركيبة التغوط (الشكل1)مختلطة مع 50 ميكرولتر من متوسط النمو الكامل والحضانة لمدة 4 ح. ويرد وصف تركيبات الانفسيون في القسم 5.
- بعد 4 ساعات من التغوط، اغسل بلطف الجانب apical مرتين باستخدام معقمة 1X PBS العازلة لإزالة أي خليط التغوط المتبقية. يمكن أن تؤثر وحدات التخزين المتفاوتة للحاجز PBS الذي ترك بعد الإزالة على تركيز LY في الجانب apical. الحرص على التأكد من إزالة المخزن المؤقت PBS المتبقية في إدراج زراعة الأنسجة تماما. يستنشق بعناية الكواشف المتبقية والمتوسطة للحد من انفصال الخلية.
ملاحظة: يتم تخطي هذه الخطوة عند قياس نفاذيةواضحة كل يوم (P التطبيق) من خلايا hCMEC/D3. - إزالة متوسط النمو وإضافة 1.5 مل من قبل الاحماء (37 درجة مئوية) النقل العازلة (25 M HEPES، 145 ملشمال شعبة الكلر، 3 مل ككل، 1 مليون متر كل+سي 2، 0.5 مليون متر من كل+سي 2، 1 مليون مترشمالبو4،5 مل الجلوكوز، درجة الحموضة 7.4) إلى الجانب البسول.
ملاحظة: ينبغي أن يكون حجم المخزن المؤقت للنقل في جميع المقصورات الجانبية متساوياً لضمان دقة حساب معامل النفاذية. - إضافة 58.3 درجة مئوية من 20 μM LY الحل إلى الجانب apical من كل إدراج transwell. وفر 50 ميكرولتر من محلول LY 20 درجة مئوية لقياسات الفلورة. بعد إزالة المخزن المؤقت PBS المتبقية من الجانب apical تماما، إضافة LY الحل في أسرع وقت ممكن لتجنب تجفيف خلايا hCMEC /D3. ضمان وحدات تخزين دقيقة من حل LY في الجانب apical.
ملاحظة: لتقليل اضمحلال شدة الفلورة LY، يجب أن يكون التعرض للضوء محدوداً. بمجرد إعادة تشكيل مسحوق LY، يجب تخزين الحل عند درجة حرارة 4 درجة مئوية، محمية من الضوء. - حضانة في شاكر لوحة دوارة (37 درجة مئوية، 100 دورة في الدقيقة) لمدة 60 دقيقة. ثم، قم بإزالة 30 ميكرولتر من عينة LY من كل مقصورة apical. ثم نقل الحل LY 20 μM وعينات الجانب apical إلى أنابيب وصفت مسبقا والتخفيف من عينة 10 أضعاف باستخدام المخزن المؤقت النقل.
ملاحظة: مطلوب لتخفيف محلول المخزون LY 20 μM والعينات الجانبية apical لأن كثافة الفلورة العالية من هذه العينات قد يحتمل أن الزائد وتلف كاشف الفلورة من قارئ الفلورة. - إزالة 500 درجة مئوية من كل مقصورة basolateral ونقل العينة إلى أنابيب وصفت مسبقا.
ملاحظة: تتم إزالة العينات من transwell منفصلة في نقاط الوقت المشار إليها. النقاط الزمنية هي كل يوم بعد البذر بدءا من اليوم 1 حتى اليوم 10. - إعداد سلسلة من معايير LY للمنحنى القياسي (39.00 nM, 78.13 nM, 156.25 nM, 312 nM, 625 nM, 1250 nM, 2500 nM).
- إضافة 100 درجة مئوية من كل معيار (في تكرار)، عينة apical وbasolateralإلى كل بئر في لوحة سوداء 96 جيدا (الشكل 1).
ملاحظة: لوحات سوداء تمتص الضوء والحد من الخلفية وكروس الفلورية بين الآبار. - استخدام قارئ لوحة ميكروتورسين (مجموعة النقاط: الإثارة 428 نانومتر، الانبعاثات 536 نانومتر) لقياس كثافة الفلورة LY لحسابالتطبيقP . يتم استخدام قارئ لوحة الفلورة لهذه الدراسة.
- حسابقيم استرداد التطبيق P و %LY كما هو موضح في نص المخطوطة.
المعادلة الرابعة صيغ لحساب قيمالتطبيق P.
حساب معامل النفاذية الظاهرة (Pالتطبيق)واسترداد %LY باستخدام المعادلات التالية. وتجدر الإشارة إلى أن قيمالتطبيق P يمكن حسابها إما على أساس كتلة25 أو تركيز LY.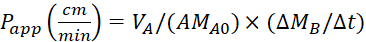 او
او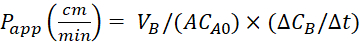
VA - حجم في مقصورة apical
VB - حجم في المقصورة الباضية
أ - المساحة السطحية لغشاء إدراج transwell(0.3 سم 2)
MA0 - الكتلة الأولية في المقصورة apical
ΔMB/Δt - تغيير الكتلة مع مرور الوقت في المقصورة الباضية
CA0 - التركيز الأولي في المقصورة apical
ΔCB/Δt - التغير في التركيز مع مرور الوقت في المقصورة الباضية.
المعادلة الخامسة صيغ لحساب ٪ LY الانتعاش.
الاسترداد (٪) =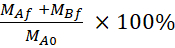
MAf هو الكتلة في مقصورة apical في نهاية نقطة زمنية, MBf هو كتلة في مقصورة basolateral في نقطة نهاية الوقت, MA0 هو الكتلة الأولية في مقصورة apical. 26 ملاحظة: يتم حساب الكتلة الأولية استناداً إلى حجم حل LY 20 μM في الخطوة 4.5. وقد أجريت هذه التجربة دائما باستخدام الخلايا تحت الممر رقم 35 وأجريت أربع مرات مستقلة.
5- استنفاد الكالسيوم
- إزالة متوسط النمو من إدراج transwell و12 جيدا لوحة وغسل بلطف الجانب apical و12 جيدا لوحة باستخدام ما قبل تسخينها الكالسيوم خالية من المتوسطة (الحد الأدنى الأساسية المتوسطة النسر سبينر (S-MEM) المتوسطة) لإزالة أيونات الكالسيوم من إدراج transwell و12 جيدا لوحة.
- إضافة 500 درجة مئوية أو 2 مل من S-MEM قبل تسخينها 1xmedium إلى إدراج أو 12 جيدا لوحة وحضانة لمدة 24 ساعة في الحاضنة (37 درجة مئوية، 5٪ CO2). بعد الحضانة، قم بإزالة متوسط S-MEM 1x واغسل الخلايا مرة واحدة باستخدام المخزن المؤقت PBS 1x الذي تم تسخينه مسبقًا.
- اتبع الخطوات 4.4-4.10 الموضحة في القسم 4 لعلاج LY والخطوات اللاحقة. اتبع الخطوات 8.1.2-8.2.4 الموضحة في القسم 8 للنشاف الغربي والخطوات اللاحقة.
6. التغوط
- إعداد الجسيمات النانوية للحمض النووي (DNA NPs).
- تخفيف محلول المخزون من gWIZ-Luc plasmid في 10 mM خلات الصوديوم (NaAc) العازلة (درجة الحموضة 5.0) والسماح للحل الحمض النووي للوقوف لمدة 10 دقيقة في درجة حرارة الغرفة (RT).
ملاحظة: يمكن إعداد الحمض النووي الوطني الذي يحتوي على جزيئات الحمض النووي المفردة في الغالب بتركيزات الحمض النووي 20-40 ميكروغرام/مل23. وبالتالي، فإن محلول الأسهم gWIZ-Luc بلازميد يحتاج إلى تخفيف. يجب إذابة مخزون gWIZ-Luc بلازميد المجمد ة تمامًا على الجليد لتقليل إجهاد درجة الحرارة. دوامة بلطف حل مخزون الحمض النووي المخفف لمدة 30 s على دوامة مقاعد البدلاء القياسية المنصوص عليها في موقف مقبض الباب 3-5. - حساب نسب N/P المطلوبة، المستخدمة هنا كمعلمة رقمية لتعكس تكوين NP.

المعادلة السادسة N / P حساب نسبة: نسبة الشامات من مجموعات أمين البوليمرات الموجبة إلى تلك المجموعات الفوسفات من الحمض النووي. كتلة البوليمرات الموجبة يعني مجموع كمية وزنه من البوليمر الموجبة. (كتلة / تهمة) البوليمرات الموجبة يشير إلى الوزن الجزيئي للبوليمر الموجبة (بولي (إيثيلينغليكول) 5K-كتلة-بولياسبارامميد مع 48 سلاسل جانبية ثنائي إيثيلينتريامين (PEG-DET)) تطبيع إلى عدد من الأمينات الأولية المشحونة (48) لكل بوليمر الموجبة ( مول / مول)، وهذه القيمة للبوليمر لدينا هو 306 دا. كتلة الحمض النووي تعني الكمية الإجمالية للحمض النووي المستخدم في التركيبة التي تم الحصول عليها عن طريق مضاعفة الحجم والتركيز في مغ/مل؛ (كتلة / تهمة) الحمض النووي يشير إلى الوزن الجزيئي للحمض النووي تطبيع إلى عدد من مجموعة الفوسفات لكل الحمض النووي المزدوج الذين تقطعت بهم السبل (325 دا لكل نيوكليوباسي).
ملاحظة: يحتوي جدول إعدادالحمض النووي (الجدول 1) على وصفة صياغة للعينات المختلفة التي تم اختبارها في تجاربنا. تم إعداد الحمض النووي NP باستخدام تقنية المعايرة السريعة. تمت إضافة حل البوليمر PEG-DET على طول جدران الأنبوب أثناء عقد الأنبوب في وضع أفقي. ثم تم تحويل الأنبوب إلى موقف عمودي، تليها دوامة بسرعة في السرعة القصوى لمدة 10S. سمح للحمض النووي الوطني للوقوف لمدة 30 دقيقة في RT قبل الاستخدام. قاعدة الإبهام لالدوز الحمض النووي NP هو 0.5 ميكروغرام الحمض النووي لمنطقة النمو 1 سم 2. لذلك، لكل transwell إدراج / كل بئر في لوحة 48 جيدا / كل بئر في لوحة 96 جيدا، وإعداد الحمض النووي NP في N / P 10 التي تحتوي على 0.157/0.5/0.195 ميكروغرام / بئر من الحمض النووي gWIZ لوك. - بالنسبة للعينات التي تحتوي على تركيز مشار إليه من Poloxamer P84 (P84)، أضف P84 إلى الحمض النووي NP والدوامة لمدة 5 ق. التركيز النهائي للP84 في كل عينة هو إما 0.01٪ أو 0.03٪ الوزن.
- تخفيف محلول المخزون من gWIZ-Luc plasmid في 10 mM خلات الصوديوم (NaAc) العازلة (درجة الحموضة 5.0) والسماح للحل الحمض النووي للوقوف لمدة 10 دقيقة في درجة حرارة الغرفة (RT).
- الحمض النووي NP التغوط في إعداد لوحة 48 جيدا
- بذور الخلايا مع كثافة 50،000 خلية / سم2 في لوحة 48 جيدا وتنمو حتى التقاء في الحاضنة (37 درجة مئوية، 5٪ CO2).
- لكل مجموعة علاج، مزيج 25 درجة مئوية من العينة المشار إليها (تركيبة التغوط عبر) و 150 ميكرولتر من متوسط النمو الكامل و 175 ميكرولتر من هذا الخليط إلى كل بئر.
- مراقبة خلايا hCMEC /D3 تحت المجهر لضمان أن الخلايا تبدو صحية و100٪ مترافقة في وقت التجربة.
- إزالة متوسط النمو من الآبار و175 درجة مئوية خليط التغوط إلى كل بئر. ثم، حضانة لوحة لمدة 4 ساعة في الحاضنة (37درجة مئوية، 5٪ CO 2).
- بعد 4 ساعة، قم بإزالة خليط الانعطاف واغسل خلايا hCMEC/D3 بمخزن بسعة 1x PBS معقم مسبقًا.
ملاحظة: لتقليل انفصال عرضي من خلايا hCMEC/D3 من سطح اللوحة/الإدراج أثناء خطوات الغسيل، ماصة بعناية بما فيه الكفاية PBS معقمة على طول جدران الآبار وإزالة أي جسيمات نانوية في وسائل الإعلام الثقافة المتبقية. - هز ّ اللوحة برفق عدة مرات واستنشق بعناية وتجاهل غسل PBS وأضف 500 لتر من hCMEC/D3 وسط الثقافة الدافئة مسبقاً.
- فحص مجهري الخلايا وتسجيل الملاحظات على مورفولوجيا الخلية وأي آثار محتملة للتغوط.
- حضانة لمدة 24 ساعة في حاضنة ثقافة الخلية 37 درجة مئوية للسماح إنتاج لوسيفيراز. بعد 24 ساعة، إزالة متوسط النمو تماما وغسل الخلايا مرة واحدة مع ما قبل تسخين ها 1X PBS.
- Lyse الخلايا المنقولة عن طريق إضافة 100 درجة مئوية من الجليد البارد luciferase خلية ثقافة lysis 1X الكاشف لكل بئر.
- لقياس محتوى البروتين لوسيفيراز، إضافة 20 ميكرولتر من lysate الخلية و 100 ميكرولتر من لوسيفيراز اختبار العازلة (20 مل غليسيليكلغليسين (درجة الحموضة 8)، 1 مل مغكل2،0.1 mM EDTA، 3.5 mM DTT، 0.5 mM ATP، 0.27 mM الإنزيم المساعد A) في أنبوب 1.5 مل.
- قراءة الإنارة من العينة الموصوفة في الخطوة 6.2.10 على مقياس الإنارة مع واحد لصناعة السيارات في الحقن.
ملاحظة: يجب أن تكون متكاملة الإنارة أكثر من 10 s قبل القراءة. - قياس الكمية الإجمالية من البروتين الخلوي في lysate باستخدام اختبار حمض bicinchoninic (اختبار BCA) عدة باتباع بروتوكول الشركة المصنعة.
- حساب والتعبير عن التعبير الجيني لوسيفيراز كوحدات الضوء النسبي (RLU) لكل بروتين خلوي إجمالي.
7. الإنارة ATP التبيّاق
- بذور الخلايا مع كثافة 50،000 خلية / سم2 في لوحة بئر 96 وتنمو حتى التقاء في الحاضنة (37 درجة مئوية، 5٪ CO2).
- [ترنسفيكت] الخلايا مع 9.7 [فل] من ال [ترّفكأيشن] صياغة (تحضير تفاصيل في قسم 6) و58.4 [فل] من كاملة حالة نموّ وسط ل 4 [ه].
- إزالة خليط التغوط وغسل بلطف الخلايا مع PRE-الدافئة PBS 1X العازلة مرتين لإزالة الكواشف العلاج تماما.
ملاحظة: وحدات تخزين مختلفة من المخزن المؤقت المتبقية يمكن أن تضعف الكواشف فحص ATP إلى نطاق مختلف ويمكن أن تؤثر على البيانات. - امزج 75 ميكرو لتر من الكاشف الطازج المتوسط المُدفأ مسبقاً وكاشف فحص ATP في تخفيف 1:1 باستخدام ماصة متعددة القنوات. تأكد من أن مستوى السائل في جميع نصائح ماصة متعددة القنوات هو نفسه.
- ضع اللوحة على شاكر الصالل لمدة 15 دقيقة في درجة حرارة الغرفة. بعد 15 دقيقة من إضافة الكواشف، نقل 60 درجة مئوية من كل عينة في لوحة بيضاء 96 جيدا.
ملاحظة: لوحات بيضاء هي أفضل لتعكس ضوء الإخراج من لوحات واضحة أو سوداء. - البوب أي فقاعات الهواء باستخدام إبرة قبل قراءة لوحة. قراءة لوحة على مقياس الإنارة مع 1 s وقت التكامل. قراءة لوحة في غضون 20 دقيقة بعد إضافة الكواشف AS التوقيت أمر بالغ الأهمية للمقارنة عبر لوحات مختلفة، لأن إشارة الإنارة عابرة مع معدل الاضمحلال السريع.
- حساب النسبة المئوية (٪) صلاحية الخلية باستخدام هذه الصيغة: (الإنارة من الخلايا المنقولة / الإنارة من السيطرة، والخلايا غير المعالجة) × 100.
8. النشاف الغربية لقياس البروتين تقاطع ضيق ZO-1
-
تحليل الخلايا واستخراج البروتين
ملاحظة: يجب تنفيذ جميع الخطوات لاستخراج البروتين من الخلايا في 2-8 درجة مئوية.- بذور الخلايا في كثافة 50،000 خلية / سم2 في الكولاجين المغلفة 12 جيدا لوحة ثقافة الأنسجة.
- في اليوم 3، اليوم 5، اليوم 7، اليوم 10 ما بعد البذر وفي اليوم 7 (الخلايا pre-cubated مع وسط خال من الكالسيوم)، وإزالة متوسط النمو وغسل الخلايا بلطف مرتين مع 2 مل من الجليد البارد 1X PBS. ثم، إضافة 300 درجة مئوية خليط من الجليد البارد 1X RIPA lysis العازلة التي تحتوي على 3 ميكروغرام / مل aprotinin في كل بئر.
ملاحظة: يجب أن يتم الخليط الطازج والاحتفاظ بها على الجليد. يستخدم Aprotinin لمنع البروتياز الموجودة في lysates من تدهور البروتين من الفائدة. - بعد دورتين تجميد ذوبان (-80 درجة مئوية)، كشط الخلايا باستخدام مكشطة خلية بلاستيكية باردة. جمع lysates الخلية في أنابيب microfuge. ثم، الطرد المركزي الأنابيب في 200 × ز لمدة 30 دقيقة في 4 درجة مئوية.
- جمع supernatant في أنابيب نظيفة ووضعها على الجليد. قياس الكمية الإجمالية للبروتين الخلوي في lysates باستخدام مجموعة اختبار BCA باتباع بروتوكول الشركة المصنعة.
-
النشاف الغربية للكشف عن البروتين تقاطع ضيق ZO-1
- التحلل aliquots من مجموع المتجانسات التي تحتوي على 40 ميكروغرام من البروتين الكلي مع 1X Lemmli العازلة في 95 درجة مئوية، 5 دقيقة وتخضع للكتروفوريس في خفض 6-7.5٪ الصوديوم دوديسيل كبريتات بوليأكريلاميد هلام (SDS-PAGE) (90 V، 10 دقيقة من خلال هلام التراص، 120 V من خلال حل المواد الهلامية).
ملاحظة: عند تحميل العينات أو المعايير تذكر تحميل ببطء وبعناية في كل حارة، مع الحرص على عدم كسر البئر في العملية. - نقل البروتينات المنفصلة على غشاء النيتروسيلولوز مع احتياطي نقل درجة الحموضة 8.5 الذي يحتوي على 192 مل غليسين، 25 mM قاعدة تريس، 10٪ الميثانول و 0.1٪ SDS (75 V، 110 دقيقة في درجة حرارة الغرفة).
ملاحظة: لا تلمس الغشاء. استخدام 70٪ isopropanol غسلها ملقط البلاستيك للتعامل مع الغشاء. من أجل نقل بنجاح البروتين ZO-1 (MW 200 kDa) إلى الغشاء، ينبغي أن يكون درجة الحموضة حوالي 8.3-8.5. إذا كان المخزن المؤقت نقل أكثر حمضية من ذلك، لن يحدث النقل. إذا كانت نطاقات سلم مرئية لا تزال على هلام، سيكون من المفيد زيادة وقت النقل وتركيز SDS. - بعد غسل الغشاء باستخدام الخيوط المخزنة مؤقتا المالحة التي تحتوي على 0.1٪ توين 20 (T-TBS)، استخدم محلول حظر (1:1 LiCOR-أوديسي كتلة: 1X تريس المخزنة المالحة المخزنة) لمنع الأغشية لمدة 60 دقيقة.
- قطع الغشاء بعناية إلى شريطين. حضانة مع اثنين من الأجسام المضادة الأولية (ZO-1 الأجسام المضادة أحادية النسيلة، تخفيف، 1: 900، وغليسيرالدهايد 3 فوسفات dehydrogenase (GAPDH) الأجسام المضادة، تخفيف، 1: 10،000) بين عشية وضحاها في 4 درجة مئوية. ثم، احتضان الأغشية ZO-1 وGAPDH مع حمار المضادة للماوس IgG (تخفيف، 1:50،000). بعد غسل الأغشية باستخدام T-TBS، صورة الأغشية في قناة 700 على صورة 16 بت.
- التحلل aliquots من مجموع المتجانسات التي تحتوي على 40 ميكروغرام من البروتين الكلي مع 1X Lemmli العازلة في 95 درجة مئوية، 5 دقيقة وتخضع للكتروفوريس في خفض 6-7.5٪ الصوديوم دوديسيل كبريتات بوليأكريلاميد هلام (SDS-PAGE) (90 V، 10 دقيقة من خلال هلام التراص، 120 V من خلال حل المواد الهلامية).
النتائج
أولا، حددنا تأثير وقت الزراعة على نفاذية LY لتحديد الحركية الظاهرة لتشكيل TJ. يتم عرض قيمالتطبيق LY P المتوسط من اليوم 1 إلى 10 آخر البذر في الشكل 2a. في اليوم 1، كانمتوسط P التطبيق 4.25 × 10-4 سم / دقيقة وانخفض قليلا إلى 3.32 × 10-4 سم / دقيقة في اليو...
Discussion
دور رئيسي لBBB هو منع تبادل الأيونات غير الضرورية والمواد السامة بين الدورة الدموية الجهازية والدماغ للحفاظ على انحلال البيئة الدقيقة العصبية. واحدة من السمات المميزة لBBB هو قدرة الخلايا البطانية الشعرية لتشكيل تقاطعات ضيقة (TJs) التي ختم على نحو فعال الطريق شبه الخلوي للنقل. أظهرنا فحصال...
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويشكر المؤلفون على الدعم المالي المقدم من جائزة المحقق الجديد لعام 2017 من الرابطة الأمريكية للصيدلية، وجائزة هوكلمني للأمراض المخيفة من جامعة دوكين، وأموال بدء كلية الصيدلة لمختبر مانيكام. نود أن نشكر مختبر تسرب (جامعة Duquesne) للمساعدة الغربية النشاف والسماح باستخدام الصور أوديسي 16 بت. ونود أيضا أن ندرج مذكرة تقدير خاصة لكاندارب ديف (مختبر مانيكام) للمساعدة في النشاف الغربية.
Materials
| Name | Company | Catalog Number | Comments |
| hCMEC/D3 cell line | Cedarlane Laboratories | 102114.3C-P25 | human cerebral microvascular endothelial cell line |
| gWizLuc | Aldevron | 5000-5001 | Plasmid DNA encoding luciferase gene |
| lucifer yellow CH dilithium salt | Invitrogen | 155267 | |
| Transwell inserts with polyethylene terephthalate (PET) track-etched membranes | Falcon | 353095 | |
| Tissue culture flask | Olympus Plastics | 25-207 | |
| 24-well Flat Bottom | Olympus Plastics | 25-107 | |
| Black 96-Well Immuno Plates | Thermo Scientific | 437111 | |
| S-MEM 1X | Gibco | 1951695 | Spinner-minimum essential medium (S-MEM) |
| EBM-2 | Clonetics | CC-3156 | Endothelial cell basal medium-2(EBM-2) |
| phosphate-buffered saline 1X | HyClone | SH3025601 | |
| Collagen Type I | Discovery Labware, Inc. | 354236 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | |
| Cell Culture Lysis 5X Reagent | Promega | E1531 | |
| Beetle Luciferin, Potassium Salt | Promega | E1601 | |
| SpectraMax i3 | Molecular Devices | Fluorescence Plate Reader | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| ZO-1 Polyclonal Antibody | ThermoFisher | 61-7300 | |
| anti-GAPDH antibody | abcam | ab8245 | |
| Alexa Fluor680-conjugated AffiniPure Donkey Anti-Mouse LgG(H+L) | Jackson ImmunoResearch Inc | 128817 | |
| 12-well, Flat Bottom | Olympus Plastics | 25-106 | |
| RIPA buffer (5X) | Alfa Aesar | J62524 | |
| Aprotinin | Fisher BioReagents | BP2503-10 | |
| Odyssey CLx imager | LI-COR Biosciences | for scanning western blot membranes |
References
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology Of Disease. 37 (1), 13-25 (2010).
- Griep, L. M., et al. BBB on chip: microfluidic platform to mechanically and biochemically modulate blood-brain barrier function. Biomedical Microdevices. 15 (1), 145-150 (2013).
- Camos, S., Mallolas, J. Experimental models for assaying microvascular endothelial cell pathophysiology in stroke. Molecules. 15 (12), 9104-9134 (2010).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow & Metabolism. 28 (2), 312-328 (2008).
- Wolff, A., Antfolk, M., Brodin, B., Tenje, M. In vitro Blood-Brain Barrier Models-An Overview of Established Models and New Microfluidic Approaches. Journal of Pharmaceutical Sciences. 104 (9), 2727-2746 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmaceutics. 10 (1), 289-296 (2013).
- Tornabene, E., Brodin, B. Stroke and Drug Delivery--In vitro Models of the Ischemic Blood-Brain Barrier. Journal of Pharmaceutical Sciences. 105 (2), 398-405 (2016).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Llombart, V., et al. Characterization of secretomes from a human blood brain barrier endothelial cells in-vitro model after ischemia by stable isotope labeling with aminoacids in cell culture (SILAC). Journal of Proteomics. 133, 100-112 (2016).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- Avdeef, A. How well can in vitro brain microcapillary endothelial cell models predict rodent in vivo blood-brain barrier permeability?. European Journal of Pharmaceutical Sciences. 43 (3), 109-124 (2011).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Shao, X., et al. Development of a blood-brain barrier model in a membrane-based microchip for characterization of drug permeability and cytotoxicity for drug screening. Analytica Chimica Acta. 934, 186-193 (2016).
- Walter, F. R., et al. A versatile lab-on-a-chip tool for modeling biological barriers. Sensors and Actuators B: Chemical. 222, 1209-1219 (2016).
- Cecchelli, R., et al. In vitro model for evaluating drug transport across the blood–brain barrier. Advanced Drug Delivery Reviews. 36, (1999).
- Cecchelli, R., et al. Modelling of the blood–brain barrier in drug discovery and development. Nature reviews Drug discovery. 6 (8), 650 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. . The Blood-Brain Barrier. , 307-324 (2003).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability Studies on In vitro Blood–Brain Barrier Models: Physiology, Pathology, and Pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Ren, T. B., et al. A General Method To Increase Stokes Shift by Introducing Alternating Vibronic Structures. Journal of the American Chemical Society. 140 (24), 7716-7722 (2018).
- Pack, D. W., Hoffman, A. S., Pun, S., Stayton, P. S. Design and development of polymers for gene delivery. Nature Reviews Drug Discovery. 4 (7), 581-593 (2005).
- Oupický, D., Konák, C., Ulbrich, K., Wolfert, M. A., Seymour, L. W. DNA delivery systems based on complexes of DNA with synthetic polycations and their copolymers. Journal of Controlled Release. 65, (2000).
- Couraud, P. O. . The hCMEC/D3 CELL LINE: IMMORTALIZED HUMAN CEREBRAL MICROVASCULAR ENDOTHELIAL CELLS As a model of human Blood-Brain Barrier. , (2012).
- Youdim, K. u. r. e. s. h. A., A, A. A. a. N. J. In vitro trans-monolayer permeability calculations: often forgotten assumptions. research focus reviews. 8, (2003).
- Eigenmann, D. E., Xue, G., Kim, K. S., Moses, A. V., Hamburger, M., Oufir, M. Comparative study of four immortalized human brain capillary endothelial cell lines, hCMEC/D3, hBMEC, TY10, and BB19, and optimization of culture conditions, for an in vitro blood-brain barrier model for drug permeability studies. Fluid and Barriers of the CNS. 10 (33), (2013).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Balda, M. S., Anderson, J. M. Two classes of tight junctions are revealed by ZO-1 isoforms. The American Physiological Society. , (1992).
- Brown, R. C., Davis, T. P. Calcium Modulation of Adherens and Tight Junction Function: A Potential Mechanism for Blood-Brain Barrier Disruption After Stroke. Stroke. 33 (6), 1706-1711 (2002).
- Gorodeski, G., Jin, W., Hopfer, U. Extracellular Ca2+ directly regulates tight junctional permeability in the human cervical cell line CaSki. American Journal of Physiology-Cell Physiology. 272 (2), C511-C524 (1997).
- Stuart, R. O., Sun, A., Panichas, M., Hebert, S. C., Brenner, B. M., Nigam, S. K. Critical Role for lntracellular Calcium in Tight Junction Biogenesis. Journal of Cellular Physiology. 159, (1994).
- Tobey, N. A. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. , (2004).
- Tobey, N. A., Argote, C. M., Hosseini, S. S., Orlando, R. C. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. 286, (2004).
- Posimo, J. M., et al. Viability assays for cells in culture. Journal of visualized experiments : JoVE. (83), e50645 (2014).
- Cipolla, M. J., Crete, R., Vitullo, L., Rix, R. D. Transcellular transport as a mechanism of blood-brain barrier disruption during stroke. Frontiers in Bioscience. 9 (3), 777-785 (2004).
- Kreuter, J. Influence of the surface properties on nanoparticle-mediated transport of drugs to the brain. Journal of nanoscience and nanotechnology. 4 (5), 484-488 (2004).
- Markoutsa, E., et al. Uptake and permeability studies of BBB-targeting immunoliposomes using the hCMEC/D3 cell line. European Journal of Pharmaceutics and Biopharmaceutics. 77 (2), 265-274 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved