需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
路西法黄 - 人类血脑屏障细胞模型中一个健壮的细胞渗透标记
摘要
我们提出了荧光测定,以证明Lucifer黄色(LY)是一个强大的标记,以确定hCMEC/D3细胞单层的明显准细胞渗透性,人类血脑屏障的体外模型。我们使用这种测定来确定培养的hCMEC/D3细胞中汇体单层形成的动力学。
摘要
血脑屏障BBB由内皮细胞组成,在全身循环和大脑之间形成屏障,防止非必需离子和有毒物质的交换。紧密的结(TJ)有效地密封了单层中的准细胞空间,从而产生了完整的屏障。本研究描述了一种基于LY的荧光测定,可用于确定其表观渗透系数(P应用),进而可用于确定连接单层形成的动力学和由此产生的紧密结hCMEC/D3 单层的屏障完整性。我们进一步演示了此测定的另一个效用,以确定转染细胞中的TJ功能完整性。我们从LY P应用测定数据显示,在跨井设置中播种的hCMEC/D3细胞有效地限制了LY准细胞传输7天后培养。作为所呈现的测定的另一个效用,我们还证明了DNA纳米粒子转染不会改变hCMEC/D3单层中的LY准细胞传输。
引言
血脑屏障(BBB)是限制血浆成分流入脑组织的保护屏障,由脑内皮细胞和围细胞等辅助细胞组成。BBB的主要作用是作为屏障,密封外周血和中枢神经系统(CNS)之间的空间,以保持神经微环境1,2的血缘。脑毛细管内皮细胞通过形成细胞间紧密结(TJs)1有效密封准细胞通路。这种保护屏障允许葡萄糖和选定的营养物质进入大脑,同时防止大多数离子、有毒物质和药物通过这个紧密的屏障。除了保护作用外,BBB的天然屏障功能对开发针对CNS的药物输送系统提出了严峻的挑战。
BBB的体外细胞培养模型是研究其生物学和了解药物治疗对TJ屏障完整性影响的有用工具。我们使用人脑微血管内皮细胞系(hCMEC/D3)作为体外模型,因为它是人脑内皮3的公认模型,并重述了人类BBB的许多功能。hCMEC/D3是最常见的细胞系之一,用于在体外4、5、6、7、8、9对BBB进行建模。尽管这种细胞系的跨端电阻值相对较低,是阻隔性紧度的一个指标,但该细胞系保留了大脑内皮细胞的大部分形态和功能特性,即使在没有共培养的胶质细胞6,7。hCMEC/D3细胞系表示多个BBB标记,包括活性转运体和受体,直到大约通过35,而不经过分化到不稳定的表型6,7,9 ,10,11.hCMEC/D3细胞系作为体外BBB模型最显著的特征是能够形成TJs5,9,11,12。应该指出的是,虽然干细胞衍生的BBB模型在许多研究中表现出更高的渗透性,与hCMEC/D3细胞系相比,他们确实表达了一些BBB标记,但它们尚未演变为最常见的BBB细胞模型13。重要的是,干细胞衍生的BBB模型仍然具有最大通道数的特征,使细胞能够保持稳定的BBB表型14。
三种主要方法通常用于确定TJ阻隔完整性,包括TEER的测量,测量小亲水性示踪分子(P应用)的表观渗透系数(P应用),如蔗糖、黄素、路西法黄、等和免疫染色的已知分子标记的TJ,如克劳丁-5,ZO-1,卡他丁等5。TEER是一种相对简单和定量的方法,用于测量在多孔膜基板上培养的细胞单层的电阻。但是,TEER 值可能受实验变量(如培养介质的组成和测量仪器的类型)的影响。这些因素的可能组合导致在 hCMEC/D3 细胞系中广泛分布 TEER 值,范围从2 到 1150 Ω cm 2,培养2-21天13。免疫染色是一种视觉方法,通过使用抗体标记靶向蛋白来确定TJ蛋白的存在。然而,免疫染色涉及一系列实验步骤,包括需要修复/渗透可能导致实验伪影的细胞,荧光信号可能会随着时间的推移而消退。上述因素可能导致主观错误影响数据质量。
这项工作的主要重点是提出基于LY的表观渗透性测定,以确定培养的hCMEC/D3细胞中汇体单层形成的动力学。虽然其他先进的体外BBB系统,如共培养系统,微流体系统,是生理上更相关的模拟与显著改善屏障功能15,16,17,hCMEC/D3横井设置是一个简单可靠的模型,用于估计TJ形成的动力学,并快速筛选不同药物制剂对阻隔功能的影响。通常,P应用值对于 hCMEC/D3 单层中的各种亲水溶性溶质是一致的。例如,报告不同体外BBB模型中各种低分子质量溶质(如蔗糖、曼尼醇、LY等)的P应用值在10-4厘米/分钟5,18,19 ,在我们的实验设置中,大脑内皮细胞被播种在胶原蛋白涂层的微孔膜上,用于细胞附着和单层形成,以模仿体内屏障。在圆锥侧添加的LY预计将穿过细胞间紧密结,并在巴索侧累积。巴利侧LY浓度越大,表明存在不成熟、功能不全的屏障,而较低的浓度则反映了由于功能性TJs的存在导致成熟的屏障而导致运输受限。
LY 是一种亲水染料,具有明显的激发/发射峰值,无需放射性标签示踪分子,如蔗糖、曼尼醇或乌林。因此,LY的荧光值可用于直接计算其在BBB单层上的准细胞渗透性。此外,与许多用于生物医学领域的商业染料,遭受小斯托克斯变化,如荧光21,斯托克斯转移LY是约108nm有足够的光谱分离,从而允许LY荧光数据作为强健的读出,以确定副细胞渗透性。我们使用西方印迹作为正交技术来演示紧密结标记蛋白 ZO-1 在培养时间中表达的变化。通过西方印迹检测到的ZO-1表达式用于补充LY P应用数据,并结合这些数据表明,在LY P应用值中观察到的变化反映了单层的形成,并逐渐增加紧密交汇点标记 ZO-1 的表达式。
如前所述,这项工作的中心重点是演示LY测定作为一种简单的技术,以监测具有功能紧密结的交汇单层的形成。然而,为了证明所开发检测的另一个效用,我们测量了DNA纳米粒子转染hCMEC/D3单层中的LY P应用。核酸可以通过带正电荷的聚合物组与核酸的负电荷磷酸盐组之间的静电相互作用,浓缩成直径为100-200nm的聚电解质纳米颗粒。23.在我们的工作中,我们将这些复合物称为DNA纳米粒子(DNA NPs)。虽然我们的目的是转染细胞和表达所需的蛋白质,但我们必须确保 hCMEC/D3 单层的屏障特性不会受到损害。我们的数据表明,标准的4 h荧光酶基因转染机制不能显著改变LY渗透性,证明LY P应用测定的效用,以确定TJ屏障完整性的变化。
研究方案
1.一般 hCMEC/D3 细胞培养
- 冷冻细胞的复苏
注:所有细胞培养维护和实验均在无菌生物安全罩内进行。培养培养剂、补充剂和试剂要么作为无菌产品购买,要么通过过滤使用0.22 μm膜过滤器进行灭菌,以防止微生物污染。- 在组织培养瓶中加入8.5 mL的胶原蛋白溶液(0.15mg/mL)(75cm2生长面积;以后称为T75),并将其放入培养箱(37°C,5%CO2)1小时。
- 取出胶原蛋白溶液,用消毒的磷酸盐缓冲盐水(PBS)轻轻清洗烧瓶。将15 mL的完整生长介质加入烧瓶,并在CO2培养箱中等待15分钟。
注:完整的介质(最终浓度)含有内皮细胞生长基底-2(500 mL),辅以胎儿牛血清(5%)、青霉素-链霉素(1%)、氢皮质酮(1.4μM)、酸抗坏血(5微克/mL)、化学定义的脂质浓缩物(1/100)、HEPES(10 mM)和基本成纤维细胞生长因子(1纳克/mL)。 - 从液氮罐中移动冷冻 hCMEC/D3 细胞的冷冻液,在 37°C 水浴中快速解冻小瓶(< 1 分钟)。
- 一旦只有一小片冰可见,迅速吸出并转移细胞到含有预加热介质的烧瓶。轻轻摇动烧瓶,使细胞与生长培养基混合。
- 将烧瓶放入培养箱(37°C,5%CO2),并在2小时后在光学显微镜下观察细胞,以确保细胞附着。
- 一旦细胞附着在烧瓶底部,去除旧的生长介质,并加入10 mL的新鲜预热生长介质,以取代二甲基硫酸盐在旧的生长培养基24。
- 24小时后,在光学显微镜下检查,观察主轴状细胞,用预热的新鲜生长介质替换旧的生长介质。
- 细胞培养维护
- 每隔一天补充生长介质,直到100%汇合。在去除旧的生长介质之前,在添加新的生长培养基后,检查显微镜下的细胞。从培养箱中拿出烧瓶,在相对比显微镜下检查hCMEC/D3细胞,以确保它们看起来健康。
注:大多数细胞应附着在烧瓶底部,具有主轴形状的形态,而且经常可以看到其膜周围的光线折射。生长介质应透明(非云)和粉红色橙色。 - 从烧瓶中取出旧的生长介质,并将 10 mL 的预加热新鲜介质转移到烧瓶中。
注:介质应添加到烧瓶的顶部,而不是直接添加到细胞表面,以避免影响细胞附着。 - 将烧瓶重新调回水平位置,轻轻摇动几次,并在显微镜下检查 hCMEC/D3 细胞,然后再将烧瓶返回到培养箱(37°C,5% CO2)。
- 每次在常规培养工作和实验期间,在操作细胞之前和之后,在倒置光显微镜下观察细胞。在实验室笔记本中记录细胞数或形态的任何明显变化。
- 每隔一天补充生长介质,直到100%汇合。在去除旧的生长介质之前,在添加新的生长培养基后,检查显微镜下的细胞。从培养箱中拿出烧瓶,在相对比显微镜下检查hCMEC/D3细胞,以确保它们看起来健康。
- 细胞传递
- 在培养箱中孵育一种含有8.5 mL胶原蛋白溶液的新T75烧瓶,1小时(37°C,5%CO2)。
- 取出胶原蛋白溶液,用消毒的PBS轻轻清洗烧瓶。将预加热的 hCMEC/D3 介质加入 10 mL 到新烧瓶中,并将烧瓶放入培养箱(37 °C,5% CO2)。
- 从培养箱中拿出烧瓶,在相对比显微镜下检查hCMEC/D3细胞,检查细胞是否100%汇入。
- 从含有细胞的烧瓶中取出hCMEC/D3细胞培养基,用10 mL的PBS清洗hCMEC/D3细胞。
注:添加到生长培养基的FBS含有蛋白酶抑制剂,如β1-抗胰蛋白酶和β2-宏球蛋白。这些抑制胰蛋白酶化过程。因此,必须用PBS清洗细胞,以去除FBS的痕迹,以防止胰蛋白酶化过程的抑制。 - 加入含有0.02%EDTA的0.25%胰蛋白酶溶液的1 mL,在培养箱中加入2-5分钟(37°C,5%CO2)(轻轻敲打两侧的烧瓶以帮助分离)。
注意:切勿将细胞留在胰蛋白酶/EDTA 上超过 6 分钟。 - 加入10 mL的预加热hCMEC/D3介质,以阻止胰蛋白酶化过程,并通过上下液液多次重新悬浮hCMEC/D3细胞。然后,将整个细胞悬浮液从烧瓶中取出至15 mL管中。
- 将1 mL的细胞悬浮液从15 mL管转移到新的烧瓶与预加热的新鲜介质(分裂细胞1:10),并将新的烧瓶返回到孵化器。
注:在转移到新烧瓶之前,移液器细胞悬浮液上下几次,以尽量减少细胞浓度梯度。
2. 电池电镀
- 将组织培养物插入带微孔膜(孔径:0.4 μm,材料:聚乙烯对苯二甲酸酯(PET)))放入24孔培养板中。
- 在每个组织培养物插入中加入400 μL的胶原蛋白I型(0.15mg/mL),并在CO2培养箱中孵育1小时(37°C,CO25%)。轻轻摇动 24 孔板,使胶原蛋白溶液均匀地扩散到组织培养插件中的微孔膜上。
- 取出胶原蛋白溶液,用0.4 mL的1x PBS缓冲液轻轻清洗微孔膜。
- 在细胞插入件中具有50,000个细胞/cm2的板hCMEC/D3细胞(500μL介质中15,000个细胞)。
注:为了尽量减少每个组织培养插件中细胞数的差异,在将细胞添加到插入件之前,用10 mL移液器重新悬浮细胞悬浮液。 - 将装有组织培养装置的24孔板放入培养箱(37°C,5%CO2),允许细胞附着和增殖。
- 孵育板7天,使细胞达到100%的汇合。每隔一天取出生长介质,并将 0.5 mL 的预加热新鲜介质转移到组织培养插件中。
- 在 12 孔板、48 孔板和 96 孔板上重复电镀步骤(步骤 2.2-2.6)。使用 12 孔板进行西方印迹以确定 ZO-1 表达式的变化。使用 48 孔板进行 DNA NP 转染。使用ATP测定的96孔板来确定转染细胞中的细胞活力。
3. 细胞生长动力学。
- 在胶原蛋白涂层的24孔组织培养板中,以50,000个细胞/cm2的密度将细胞播种。
- 在实验的每一天,去除生长培养基,用500μL的1xPBS轻轻洗涤细胞两次。然后,加入含有0.02%EDTA的0.02%胰蛋白酶溶液的30μL,在培养箱(37°C,5%CO 2)中保持2-5分钟。
注:逐渐形成汇体单层可能会影响细胞分离的程度,有必要增加胰蛋白酶/EDTA的体积,如此处所示:播种后1-5天30μL,播种后6-7天60μL,播种后8-10天100μL. - 根据步骤 3.2 中添加的胰蛋白酶/EDTA 溶液的体积,添加 470 μL、440 μL 或 400 μL 的生长介质,以制备每个孔中的 500 μL 细胞悬浮液。
- 在每个井中上下移液几次,悬浮细胞,并在显微镜下观察细胞,以确保所有细胞都悬浮在生长培养基中。如果一些细胞在移液几次后仍附着在板底部,请使用塑料细胞刮刀轻轻刮擦细胞,以促进细胞分离。
- 在步骤 3.3 中从 500 μL 细胞悬浮液中去除 0.1 mL 的细胞悬浮液,并添加到 1.5 mL 管中。然后,在细胞悬浮液中加入0.1 mL的0.4%的试青溶液,并混合均匀。
- 用70%的等丙醇清洁测气仪。在 V 槽的每侧加入步骤 3.5 中的 20 μL 混合物,并在显微镜下定位 16 个方块。16 个正方形被视为一个网格。在血球测量仪的每一侧找到两个随机网格,并计算所有活的、非蓝色的细胞。
注: 以蓝色显示蓝色的单元格从计数中排除,<1% 的单元格在所有时间点都染成蓝色。 - 根据以下公式计算细胞密度(细胞/cm2)。
单元格/网格的平均 =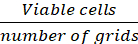 (Eq.1)
(Eq.1)
稀释因子*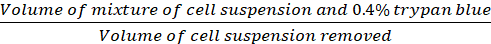 (Eq.2)
(Eq.2)
细胞密度 (活细胞/厘米2) |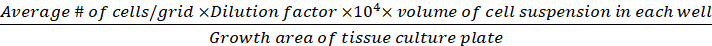
(Eq.3)
方程 1-3。活细胞是每个网格中计数的细胞数,网格数对应于显微镜下的网格数,细胞悬浮液的混合物量和 0.4% Trypan 蓝色是步骤 3.5 中制备的体积,去除的细胞悬浮量是步骤3.5中从500μL细胞悬浮液中去除的体积,每孔细胞悬浮量为步骤3.3的500μL细胞悬浮量,组织培养板的生长面积为24孔板单孔的生长面积。
4. 路西法黄色表观渗透性 (LY P应用) 测定
- 要确定在播种后的每一天使用LY P 应用,请按照从 4.3 开始的步骤操作。为了确定转染hCMEC/D3细胞中的P应用,添加8.3μL的转染配方(图1)与50μL的完整生长培养基混合,孵育4小时。
- 转染4小时后,使用无菌1x PBS缓冲液轻轻清洗片侧两次,以去除任何残留转染混合物。去除后留下的不同体积的PBS缓冲液会影响LY在尖侧中的浓度。注意确保完全去除组织培养插件中的残留 PBS 缓冲液。小心吸出残留试剂和介质,以尽量减少细胞分离。
注:在测量 hCMEC/D3 细胞的每天表观渗透性 (P 应用) 时,将跳过此步骤。 - 取出生长介质,在巴索侧加入1.5 mL的预加热(37°C)输送缓冲液(25 mM HEPES,145 mM NaCl,3 mM KCl,1 mM CaCl2,0.5 mM MgCl 2,1 mM NaH2PO4,5 mM 葡萄糖,pH 7.4)。
注:所有巴索侧隔间中的传输缓冲器体积应相等,以确保渗透系数计算的准确性。 - 将 58.3 μL 的 20 μM LY 溶液添加到每个跨井插入件的锥侧。节省 20 μM LY 溶液的 50 μL,用于荧光测量。完全从片侧取出残留的PBS缓冲液后,尽可能快地加入LY溶液,以避免hCMEC/D3细胞干燥。确保在 apical 侧准确量的 LY 溶液。
注:为了尽量减少LY荧光强度的衰减,应限制光暴露。一旦LY粉末重组,溶液应储存在4°C,防止光线照射。 - 在旋转板摇床(37°C,100 rpm)中孵育60分钟。然后,从每个锥形隔间中取出 30 μL 的 LY 样品。然后,将20μM LY溶液和尖侧样品转移到预标记的管中,并使用输送缓冲液将样品稀释10倍。
注:需要稀释20μM LY库存溶液和片面样品,因为这些样品的高荧光强度可能会超载,并损坏荧光微板读卡器的荧光检测器。 - 从每个双侧隔间中取出 500 μL,并将样品转移到预标记的管中。
注:在指定时间点从单独的跨井中移除样品。时间点是每天播种后从第 1 天到第 10 天。 - 为标准曲线准备一系列 LY 标准(39.00 nM、78.13 nM、156.25 nM、312 nM、625 nM、1250 nM、2500 nM)。
- 将每个标准(重复的)、尖底和双侧样品的100 μL添加到黑色96孔板中的每口孔中(图1)。
注:黑板吸收光线,减少井间的背景和荧光交叉。 - 使用荧光微孔板读取器(设定点:激励 428 nm,发射 536 nm)测量 LY 荧光强度以计算 P应用。本研究使用荧光板读取器。
- 计算手稿文本中所述的 P应用和 %LY 恢复值。
公式 4.用于计算 P应用值的公式。
使用以下方程计算表观渗透率 (P应用) 系数和 %LY 恢复。需要注意的是,P应用值可以基于质量25或 LY 浓度计算。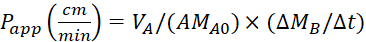 或
或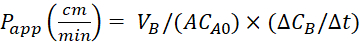
VA - 锥形隔间中的体积
VB - 双侧隔间中的体积
A - 跨井插入膜的表面面积 (0.3 厘米2)
MA0 - 锥形隔间中的初始质量
[MB/μt - 在双侧隔间中随时间变化
CA0 - 锥形腔室中的初始浓度
[CB/μt - 在双侧隔间中随时间的变化。
公式 5.用于计算 % LY 恢复的公式。
恢复 (%) |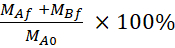
MAf是端点处的锥形隔间的质量,MBf是端点处的巴索边隔间的质量,MA0是圆锥形隔间中的初始质量。 26注意:初始质量基于步骤 4.5 中 20 μM LY 溶液的体积计算。这个实验总是使用通道35下的细胞进行,并进行了四次独立时间。
5. 钙耗竭
- 从跨井刀片和 12 孔板中取出生长介质,并使用预加热的无钙介质(最小基本中鹰微调器 (S-MEM) 介质轻轻清洗锥面和 12 孔板,以去除跨孔插入件中的钙离子和12孔板。
- 将500μL或2 mL的预加热S-MEM 1x-meM 1x-mem 1x-mem加入插入器或12孔板,在孵化器中孵育24小时(37°C,5%CO 2)。孵育后,取出S-MEM 1x培养基,并使用预加热的1xPBS缓冲液清洗细胞。
- 按照第 4 节中所述的步骤 4.4-4.10 进行 LY 治疗和后续步骤。按照第 8 节中所述的步骤 8.1.2-8.2.4 进行西印和后续步骤。
6. 转染
- DNA纳米粒子(DNA NPs)的制备。
- 在10mM醋酸钠(NaAc)缓冲液(pH 5.0)中稀释gWIZ-Luc质粒的库存溶液,使DNA溶液在室温(RT)下站立10分钟。
注:含有主要单DNA分子的DNANP可在DNA浓度为20-40微克/mL23时制备。因此,gWIZ-Luc质粒溶液需要稀释。冷冻的gWIZ-Luc质粒需要在冰上完全解冻,以尽量减少温度应力。在位于旋钮位置 3-5 的标准台式涡旋器上轻轻涡旋稀释的 DNA 库存溶液 30 s。 - 计算所需的 N/P 比率,此处用作数字参数以反映 NP 组成。

公式 6.N/P比计算:阳离子聚合物胺组摩尔与脱氧核糖核酸磷基的摩尔比。阳离子聚合物的质量是指阳离子聚合物的总称量;(质量/电荷)阳离子聚合物是指阳离子聚合物(聚(乙二醇)5k-块聚氨酰胺的分子量,含有48个二甲胺侧链(PEG-DET)),归化为每个阳离子聚合物的带电原胺(48)数(摩尔/摩尔),此值为我们的聚合物是 306 Da;DNA质量是指通过将量和浓度以mg/mL相乘获得配方中使用的DNA总量;(质量/电荷)脱氧核糖核酸(DNA)是指每双链DNA(每核碱325 Da)的磷酸盐组数的DNA的分子量。
注:DNA NP制备表(表1)包含实验中测试的不同样品的配方。DNA NP是使用快速滴定技术制备的。PEG-DET 聚合物溶液沿管壁添加,同时将管固定在水平位置。然后,管子被切换到垂直位置,然后以最大速度快速涡旋10s。DNA NP 在使用前允许在 RT 上站立 30 分钟。DNA NP 给给法的拇指法则为 0.5 μg DNA,用于约 1 cm2生长区。因此,对于在 96 孔板中的 48 孔板/每口孔中的每口跨孔插入/每口孔,在 N/P 10 处制备 DNA NP,其中包含 0.157/0.5/0.195 μg/孔 gWIZ-Luc DNA。 - 对于含有指示浓度的Poloxamer P84(P84)的样品,将P84加入DNANP和涡旋5s。每个样品中P84的最终浓度为0.01%或0.03%。
- 在10mM醋酸钠(NaAc)缓冲液(pH 5.0)中稀释gWIZ-Luc质粒的库存溶液,使DNA溶液在室温(RT)下站立10分钟。
- 48孔板设置中的DNA NP 转染
- 在48孔板中播种密度为50,000细胞/cm2的细胞,并生长至孵化器中汇合(37°C,CO25%)。
- 对于每个治疗组,将指示样品的25μL(转染配方)和150μL的完整生长培养基和175μL的这种混合物混合到每个井中。
- 在显微镜下观察hCMEC/D3细胞,以确保细胞看起来健康,并在实验时100%的汇入。
- 将生长介质从井中取出,将175 μL转染混合物取出至每个井。然后,在培养箱中孵育4小时(37°C,5%CO 2)。
- 4小时后,取出转染混合物,用预加热无菌1x PBS缓冲液清洗hCMEC/D3细胞。
注:为了在洗涤步骤中尽量减少 hCMEC/D3 细胞从板/插入表面意外脱落,请小心地沿井壁移移足够的无菌 PBS,并清除残留培养培养层中的任何纳米颗粒。 - 轻轻摇动板几次,小心吸气,丢弃PBS洗涤,并加入500μL的hCMEC/D3预加热培养基。
- 微观检查细胞,并记录细胞形态的观察和转染的任何可能的影响。
- 在37°C细胞培养箱中孵育24小时,允许荧光素酶生产。24小时后,完全去除生长培养基,用预加热的1x PBS清洗细胞一次。
- 通过加入100 μL的冰冷荧光素酶细胞培养赖斯1x试剂每孔来使转染细胞赖斯。
- 为了测量荧光酶蛋白含量,将20μL的细胞裂解物和100μL的荧光素酶测定缓冲液(20 mM甘油(pH 8),1 mM MgCl2,0.1 mM EDTA,3.5 mM DTT,0.5m M ATP,0.27 mM辅酶A)加入1.5 mL管。
- 阅读步骤 6.2.10 中描述的样品在带有单个自动喷油器的灯具上的发光。
注:发光应在阅读前集成超过 10 s。 - 按照制造商的协议,使用双辛辛酸测定试剂盒测量莱沙溶液中细胞蛋白的总量。
- 计算并表达荧光酶基因表达为相对光单位(RLU)每个总细胞蛋白。
7. 发光ATP测定
- 在96孔板中播种密度为50,000细胞/cm2的细胞,并生长至孵化器中汇合(37°C,CO25%)。
- 用9.7 μL转染制剂(制备细节见第6节)和58.4μL的完整生长培养基转染4小时。
- 取出转染混合物,用预加热的PBS 1x缓冲液轻轻清洗细胞两次,以完全去除治疗试剂。
注:不同体积的残留缓冲液会不同程度地稀释ATP测定试剂,并可能影响数据。 - 使用多通道移液器将 75 μL 的新鲜预热介质和 ATP 测定试剂混合在 1:1 稀释中。确保所有多通道移液器吸头中的液位相同。
- 在室温下,将盘子放在螺母摇床上 15 分钟。加入试剂15分钟后,将每个样品的60μL转移到白色96孔板中。
注:白色板比透明或黑色板更好地反射输出光。 - 在读取盘子之前,使用针头弹出任何气泡。以 1 s 积分时间读取灯具上的板。加入ATP测定试剂后20分钟内读取板。时序对于不同板的比较至关重要,因为发光信号具有快速衰减率的瞬态性。
- 计算百分比 (%)使用此公式的细胞活力:(转染细胞的发光/控制发光、未经处理的细胞)x 100。
8. 用于测量紧密结蛋白 ZO-1 的西方印迹
-
细胞莱沙和蛋白质提取
注:从细胞中提取蛋白质的所有步骤必须在2-8°C下进行。- 在胶原蛋白涂层的12孔组织培养板中,以50,000个细胞/cm2的密度将细胞播种。
- 在第3天,第5天,第7天,播种后的第10天和第7天(细胞预育与无钙培养基),去除生长培养基,并轻轻洗涤细胞两次与2 mL的冰冷1x PBS。然后,在每个孔中加入含有3μg/mL丙丙丁的冰冷1xRIPA裂变缓冲液的300μL混合物。
注:混合物应新鲜制成,并保存在冰上。丙丙宁用于抑制酶中的蛋白酶降解感兴趣的蛋白质。 - 经过两个冷冻解冻周期(-80°C),使用冷塑料细胞刮刀刮取细胞。在微熔管中收集细胞液化液。然后,在4°C下以200 x g将管离心30分钟。
- 将上清液收集到干净的管子中,并把它们放在冰上。按照制造商的协议,使用 BCA 测定试剂盒测量莱沙中细胞蛋白的总量。
-
用于检测紧密结蛋白 ZO-1 的西方印迹
- 在95°C下,用1xLaemmli缓冲液对含有40μg总蛋白质的总均质物进行变性等分,在减少6-7.5%硫酸二甲酰聚丙烯酰胺凝胶(SDS-PAGE)(90 V,10分钟通过堆叠凝胶,120 V通过120V)中接受电泳解决凝胶)。
注:装载样品或标准时,请记住缓慢而小心地装载到每个通道中,小心不要在过程中打井。 - 将分离的蛋白质转移到含有192 mM甘氨酸、25 mM Tris碱、10%甲醇和0.1%SDS(75 V,110分钟室温下)的硝化纤维素膜上。
注:请勿触摸膜。使用 70% 异丙醇洗涤塑料钳处理膜。为了成功地将ZO-1蛋白(MW 200 kDa)转移到膜上,pHH应在8.3-8.5左右。如果转移缓冲液的酸性比这一点大,则不会发生转移。如果凝胶上仍然可以看到梯形带,则增加传输时间和 SDS 浓度会很有帮助。 - 使用含有 0.1%T-TBS (T-TBS) 的 Tris 缓冲盐水洗涤膜后,使用阻滞溶液(1:1 LiCOR-奥德赛块:1x Tris 缓冲盐水)将膜阻塞 60 分钟。
- 小心地将膜切成两条。用两种原抗体(ZO-1单克隆抗体,稀释,1:900)和甘油醛3-磷酸脱氢酶(GAPDH)抗体孵育,稀释,1:10,000)在4°C过夜。然后,用驴抗小鼠IgG孵育ZO-1和GAPDH膜(稀释,1:50,000)。使用 T-TBS 清洗膜后,在 16 位成像器上对 700 通道中的膜进行成像。
- 在95°C下,用1xLaemmli缓冲液对含有40μg总蛋白质的总均质物进行变性等分,在减少6-7.5%硫酸二甲酰聚丙烯酰胺凝胶(SDS-PAGE)(90 V,10分钟通过堆叠凝胶,120 V通过120V)中接受电泳解决凝胶)。
结果
首先,我们确定了培养时间对LY渗透性的影响,以确定TJ形成的表观动力学。从第 1 天到 10 天后种子的均值 LY P应用值如图2a所示。在第 1 天,平均 P应用为 4.25 x 10-4厘米/分钟,第 2 天略降至 3.32 x 10-4厘米/分钟。平均 P应用值在第 3 天略微增加到 3.93 x 10-4厘米/分钟,直到第 6 天才出现显著变化。与第 1 ...
讨论
BBB的一个关键作用是防止非必需离子和有毒物质在系统循环和大脑之间交换,以保持神经微环境的四分法。BBB 的一个特征是毛细管内皮细胞能够形成紧密的结(TJs),从而有效密封半细胞运输路线。我们演示了一种LY P应用测定作为定量方法,以确定培养hCMEC/D3单层中TJ阻隔形成表动力学。通过西方印迹正交检测的 ZO-1 表达式验证了 LY P应用研究中的数据,详于下一段所述。作为已?...
披露声明
作者没有什么可透露的。
致谢
作者感谢美国药学协会2017年新调查员奖、杜克斯内大学亨克勒恐惧病奖和Manickam实验室药学院启动基金的财政支持。我们要感谢泄漏实验室(杜克斯纳大学)的西方印迹援助,并允许使用他们的奥德赛16位成像仪。我们还要特别感谢坎达普·戴夫(Manickam实验室)对西方印迹的帮助。
材料
| Name | Company | Catalog Number | Comments |
| hCMEC/D3 cell line | Cedarlane Laboratories | 102114.3C-P25 | human cerebral microvascular endothelial cell line |
| gWizLuc | Aldevron | 5000-5001 | Plasmid DNA encoding luciferase gene |
| lucifer yellow CH dilithium salt | Invitrogen | 155267 | |
| Transwell inserts with polyethylene terephthalate (PET) track-etched membranes | Falcon | 353095 | |
| Tissue culture flask | Olympus Plastics | 25-207 | |
| 24-well Flat Bottom | Olympus Plastics | 25-107 | |
| Black 96-Well Immuno Plates | Thermo Scientific | 437111 | |
| S-MEM 1X | Gibco | 1951695 | Spinner-minimum essential medium (S-MEM) |
| EBM-2 | Clonetics | CC-3156 | Endothelial cell basal medium-2(EBM-2) |
| phosphate-buffered saline 1X | HyClone | SH3025601 | |
| Collagen Type I | Discovery Labware, Inc. | 354236 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | |
| Cell Culture Lysis 5X Reagent | Promega | E1531 | |
| Beetle Luciferin, Potassium Salt | Promega | E1601 | |
| SpectraMax i3 | Molecular Devices | Fluorescence Plate Reader | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| ZO-1 Polyclonal Antibody | ThermoFisher | 61-7300 | |
| anti-GAPDH antibody | abcam | ab8245 | |
| Alexa Fluor680-conjugated AffiniPure Donkey Anti-Mouse LgG(H+L) | Jackson ImmunoResearch Inc | 128817 | |
| 12-well, Flat Bottom | Olympus Plastics | 25-106 | |
| RIPA buffer (5X) | Alfa Aesar | J62524 | |
| Aprotinin | Fisher BioReagents | BP2503-10 | |
| Odyssey CLx imager | LI-COR Biosciences | for scanning western blot membranes |
参考文献
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology Of Disease. 37 (1), 13-25 (2010).
- Griep, L. M., et al. BBB on chip: microfluidic platform to mechanically and biochemically modulate blood-brain barrier function. Biomedical Microdevices. 15 (1), 145-150 (2013).
- Camos, S., Mallolas, J. Experimental models for assaying microvascular endothelial cell pathophysiology in stroke. Molecules. 15 (12), 9104-9134 (2010).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow & Metabolism. 28 (2), 312-328 (2008).
- Wolff, A., Antfolk, M., Brodin, B., Tenje, M. In vitro Blood-Brain Barrier Models-An Overview of Established Models and New Microfluidic Approaches. Journal of Pharmaceutical Sciences. 104 (9), 2727-2746 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmaceutics. 10 (1), 289-296 (2013).
- Tornabene, E., Brodin, B. Stroke and Drug Delivery--In vitro Models of the Ischemic Blood-Brain Barrier. Journal of Pharmaceutical Sciences. 105 (2), 398-405 (2016).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Llombart, V., et al. Characterization of secretomes from a human blood brain barrier endothelial cells in-vitro model after ischemia by stable isotope labeling with aminoacids in cell culture (SILAC). Journal of Proteomics. 133, 100-112 (2016).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- Avdeef, A. How well can in vitro brain microcapillary endothelial cell models predict rodent in vivo blood-brain barrier permeability?. European Journal of Pharmaceutical Sciences. 43 (3), 109-124 (2011).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Shao, X., et al. Development of a blood-brain barrier model in a membrane-based microchip for characterization of drug permeability and cytotoxicity for drug screening. Analytica Chimica Acta. 934, 186-193 (2016).
- Walter, F. R., et al. A versatile lab-on-a-chip tool for modeling biological barriers. Sensors and Actuators B: Chemical. 222, 1209-1219 (2016).
- Cecchelli, R., et al. In vitro model for evaluating drug transport across the blood–brain barrier. Advanced Drug Delivery Reviews. 36, (1999).
- Cecchelli, R., et al. Modelling of the blood–brain barrier in drug discovery and development. Nature reviews Drug discovery. 6 (8), 650 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. . The Blood-Brain Barrier. , 307-324 (2003).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability Studies on In vitro Blood–Brain Barrier Models: Physiology, Pathology, and Pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Ren, T. B., et al. A General Method To Increase Stokes Shift by Introducing Alternating Vibronic Structures. Journal of the American Chemical Society. 140 (24), 7716-7722 (2018).
- Pack, D. W., Hoffman, A. S., Pun, S., Stayton, P. S. Design and development of polymers for gene delivery. Nature Reviews Drug Discovery. 4 (7), 581-593 (2005).
- Oupický, D., Konák, C., Ulbrich, K., Wolfert, M. A., Seymour, L. W. DNA delivery systems based on complexes of DNA with synthetic polycations and their copolymers. Journal of Controlled Release. 65, (2000).
- Couraud, P. O. . The hCMEC/D3 CELL LINE: IMMORTALIZED HUMAN CEREBRAL MICROVASCULAR ENDOTHELIAL CELLS As a model of human Blood-Brain Barrier. , (2012).
- Youdim, K. u. r. e. s. h. A., A, A. A. a. N. J. In vitro trans-monolayer permeability calculations: often forgotten assumptions. research focus reviews. 8, (2003).
- Eigenmann, D. E., Xue, G., Kim, K. S., Moses, A. V., Hamburger, M., Oufir, M. Comparative study of four immortalized human brain capillary endothelial cell lines, hCMEC/D3, hBMEC, TY10, and BB19, and optimization of culture conditions, for an in vitro blood-brain barrier model for drug permeability studies. Fluid and Barriers of the CNS. 10 (33), (2013).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Balda, M. S., Anderson, J. M. Two classes of tight junctions are revealed by ZO-1 isoforms. The American Physiological Society. , (1992).
- Brown, R. C., Davis, T. P. Calcium Modulation of Adherens and Tight Junction Function: A Potential Mechanism for Blood-Brain Barrier Disruption After Stroke. Stroke. 33 (6), 1706-1711 (2002).
- Gorodeski, G., Jin, W., Hopfer, U. Extracellular Ca2+ directly regulates tight junctional permeability in the human cervical cell line CaSki. American Journal of Physiology-Cell Physiology. 272 (2), C511-C524 (1997).
- Stuart, R. O., Sun, A., Panichas, M., Hebert, S. C., Brenner, B. M., Nigam, S. K. Critical Role for lntracellular Calcium in Tight Junction Biogenesis. Journal of Cellular Physiology. 159, (1994).
- Tobey, N. A. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. , (2004).
- Tobey, N. A., Argote, C. M., Hosseini, S. S., Orlando, R. C. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. 286, (2004).
- Posimo, J. M., et al. Viability assays for cells in culture. Journal of visualized experiments : JoVE. (83), e50645 (2014).
- Cipolla, M. J., Crete, R., Vitullo, L., Rix, R. D. Transcellular transport as a mechanism of blood-brain barrier disruption during stroke. Frontiers in Bioscience. 9 (3), 777-785 (2004).
- Kreuter, J. Influence of the surface properties on nanoparticle-mediated transport of drugs to the brain. Journal of nanoscience and nanotechnology. 4 (5), 484-488 (2004).
- Markoutsa, E., et al. Uptake and permeability studies of BBB-targeting immunoliposomes using the hCMEC/D3 cell line. European Journal of Pharmaceutics and Biopharmaceutics. 77 (2), 265-274 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。