Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lucifer Sarı - İnsan Kan-beyin Bariyerbir Hücre Modeli sağlam bir Parasellüler Geçirgenlik Marker
Bu Makalede
Özet
Biz Lucifer Sarı (LY) hCMEC / D3 hücre monolayers, insan kan-beyin bariyerinin bir in vitro modeli görünür parasellüler geçirgenlik belirlemek için sağlam bir belirteç olduğunu göstermek için bir floresan tahlili salıyoruz. Bu analizi, kültürlü hCMEC/D3 hücrelerinde etkili bir monolayer oluşumunun kinetiklerini belirlemek için kullandık.
Özet
Kan-beyin bariyeri BBB, gerekli olmayan iyonlar ve toksik maddelerin değişimini önlemek için sistemik dolaşım ve beyin arasında bir bariyer oluşturan endotel hücrelerinden oluşur. Sıkı kavşaklar (TJ) etkili bir bozulmamış bariyer sonuçlanan monolayers parasellüler alanı mühür. Bu çalışmada, görünür geçirgenlik katsayısını (P uygulaması) belirlemek için kullanılabilen LYtabanlı floresan titreci açıklanır ve buna karşılık konjenital monolayers oluşumunun kinetik ve ortaya çıkan sıkı kavşak hCMEC/D3 monokatmanlarında bariyer bütünlüğü. Transfected hücrelerde TJ fonksiyonel bütünlüğünü belirlemek için bu tispatın ek bir yararını da gösteriyoruz. LY Puygulama analizinden elde edilen veriler, transwell kurulumunda tohumlanan hCMEC/D3 hücrelerinin LY parasellüler taşımayı 7 gün sonra kültürünü etkili bir şekilde sınırladığını göstermektedir. Sunulan çıktının ek bir faydası olarak, DNA nanopartikül transfeksiyonunun hCMEC/D3 monokatmanlarında LY parasellüler aktarımını değiştirmediğini de gösteriyoruz.
Giriş
Kan-beyin bariyeri (BBB) beyin dokusuna plazma bileşenlerinin akını sınırlayan koruyucu bariyer ve perisitler gibi destekleyici hücreler ile birlikte beyin endotel hücrelerinden oluşur. BBB'nin ana rolü, nöral mikroçevrenin hemostazını korumak için periferik kan ve merkezi sinir sistemi (CNS) arasındaki boşluğu kapatan bir bariyer görevigörmektir. Beyin kapiller endotel hücreleri etkili hücreler arası sıkı kavşakoluşumu yoluyla parasellüler yolu mühür (TJs)1. Bu koruyucu bariyer, glikoz ve seçilmiş besinlerin beyne girmesini sağlarken, iyonların, toksik maddelerin ve ilaçların çoğunun bu sıkı bariyerden geçmesini engeller. Koruyucu rolünün yanı sıra, BBB'nin doğal bariyer işlevi CNS'yi hedef alan ilaç dağıtım sistemlerinin geliştirilmesinde ciddi bir sorun teşkil etmektedir.
BBB in vitro hücre kültürü modelleri biyolojisini incelemek ve ilaç tedavisinin TJ bariyer bütünlüğü üzerindeki etkilerini anlamak için yararlı araçlardır. İnsan beyin endotel 3'ün kabul edilen bir modeli olduğu ve bbb'nin birçok fonksiyonlarını özetlediğinden, insan serebral mikrovasküler endotel hücre hattını (hCMEC/D3) in vitro model olarak kullandık. hCMEC/D3is bbb in vitro modelleme için en sık kullanılan hücre hatlarından biridir4,5,6,7,8,9. Bariyer sıkılığının bir ölçüsü olan transendotel elektrikdirencinin (TEER) nispeten düşük değerlerine rağmen, bu hücre hattı beyin endotel hücrelerinin morfolojik ve fonksiyonel özelliklerinin çoğunu korur. cokültürd glial hücreler6,7. hCMEC/D3 hücre hattı, kararsız fenotiplere defarklılaşma geçirmeden yaklaşık 35 geçişine kadar aktif taşıyıcılar ve reseptörler de dahil olmak üzere birden fazla BBB belirteçlerini ifade eder6,7,9 ,10,11. Bir in vitro BBB modeli olarak hCMEC/D3 hücre hattının en çarpıcıözelliği TJs 5,9,11,12oluşturmak için yeteneğidir. Kök hücre kaynaklı BBB modellerinin hCMEC/D3 hücre hattı ile karşılaştırıldığında birçok çalışmada daha yüksek geçirgenlik gösterdiği ve bazı BBB belirteçlerini ifade ettikleri unutulmamalıdır, ancak en yaygın BBB hücre modeli13olarak gelişmemiştir. Daha da önemlisi, kök hücre türetilmiş BBB modelleri hücrelerin kararlı BBB fenotipleri korumakiçin izin maksimum geçiş sayıları ile ilgili olarak karakterize olmaya devam 14 .
Teer ölçümü, sakaroz, inulin, Lucifer Sarı gibi küçük hidrofilik tracermoleküllerinin görünür geçirgenlik katsayısının (P uygulaması) ölçümü de dahil olmak üzere TJ bariyer bütünlüğünü belirlemek için üç ana yöntem yaygın olarak kullanılmaktadır. vb. ve claudin-5, ZO-1, oklüdin, vb5gibi TJs bilinen moleküler belirteçleri immunostaining . TEER, gözenekli membran substrat5üzerinde kültürlenmiş hücre monolayers arasındaki elektrikdirencini ölçen nispeten basit ve nicel bir yöntemdir. Ancak TEER değerleri, kültür ortamının bileşimi ve ölçüm aletinin türü gibi deneysel değişkenlerden etkilenebilir. Bu faktörlerin olası bir kombinasyonu, hCMEC/D3 hücre hattında 2-21 gün 13'te 2 ila 1150 Ωcm2 arasında değişen TEER değerlerinin geniş bir dağılımına yol açar. İmmünoboyama, hedeflenen proteini antikorlar kullanarak etiketleyerek TJ proteinlerinin varlığını belirlemek için kullanılan görsel bir yöntemdir. Ancak, immünboyama deneysel eserler ve floresan sinyalleri zaman içinde kaybolabilir neden olabilir hücreleri düzeltmek / permeabilize ihtiyacı da dahil olmak üzere deneysel adımlar, bir dizi içerir. Yukarıdaki etkenler veri kalitesini etkileyen öznel hatalara yol açabilir.
Bu çalışmanın temel odak noktası, kültürlü hCMEC/D3 hücrelerinde enfluent monolayer oluşumunun kinetiklerini belirleyen LY tabanlı belirgin geçirgenlik testini sunmaktır. Co-kültür sistemleri, mikroakışkan sistemler gibi diğer gelişmiş in vitro BBB sistemleri, fizyolojik olarak daha uygun mimikler önemli ölçüde geliştirilmiş bariyer fonksiyonu15,16,17, hCMEC/D3 ile transwell kurulumu, TJ oluşumunun kinetiklerini tahmin etmek ve farklı ilaç formülasyonlarının bariyer fonksiyonu üzerindeki etkisini hızla taramak için basit ve güvenilir bir modeldir. Genel olarak, Puygulama değerleri hCMEC/D3 monokatmanlarında çeşitli hidrofilik soluteler için tutarlıdır. Örneğin, farklı in vitro BBB modellerinde çeşitli düşük moleküler kütleli soluteler (sakaroz, mannitol, LY, vb. gibi) için bildirilen Puygulama değerleri 10-4 cm/dk5,18,19 , 20- Deneysel kurulumumuzda beyin endotel hücreleri in vivo bariyerini taklit etmek için hücre eki ve monolayer oluşumu için kollajen kaplı mikrogözenekli membran üzerine seri olarak eklenir. Apikal tarafa eklenen LY'nin hücreler arası sıkı kavşaklardan geçmesi ve basolateral tarafta birikmesi beklenmektedir. Basolateral tarafta ki LY konsantrasyonlarının daha fazla olması olgunlaşmamış, tam olarak işlevsel olmayan bir bariyeri gösterirken, daha düşük konsantrasyonlar olgun bir bariyerle sonuçlanan fonksiyonel TJ'lerin varlığı nedeniyle sınırlı taşımayı yansıtır.
LY farklı uyarma / emisyon zirveleri ile bir hidrofilik boya ve sakaroz, mannitol veya inulin gibi radyolabel tracer molekülleri ihtiyacını önler. Böylece LY'nin floresan değerleri, BBB monokatmanları arasında parasellüler geçirgenliğini doğrudan hesaplamak için kullanılabilir. Ayrıca, floresan21gibi küçük Stokes vardiya muzdarip biyomedikal alanlarda kullanılan birçok ticari boyaile karşılaştırıldığında, LY Stokes kayması yeterli spektral ayırma ile yaklaşık 108 nm, böylece LY floresan veri olarak izin parasellüler geçirgenliği belirlemek için sağlam okuma. Biz sıkı kavşak marker protein, ZO-1, kültür zaman içinde ifade değişiklikleri göstermek için bir ortogonal teknik olarak Batı lekeleme kullanılır. Batı lekeleme yoluyla saptanan ZO-1 ekspresyonu LY Puygulama verilerini tamamlamak için kullanılır ve bu veriler LY Puygulama değerlerinde gözlenen değişikliklerin kademeli olarak sıkı kavşak işareti, ZO-1 ifadesi.
Daha önce de belirtildiği gibi, bu çalışmanın odak noktası, fonksiyonel sıkı kavşaklara sahip bir tek tabakanın oluşumunu izlemek için basit bir teknik olarak LY tözünü göstermektir. Ancak, geliştirilen testin ek bir faydasını göstermek için, LY Puygulamasını DNA nanopartikül enine hCMEC/D3 monolayers cinsinden ölçtük. Nükleik asitler polimerlerin pozitif yüklü grupları ve nükleik asitlerin negatif yüklü fosfat grupları arasında elektrostatik etkileşim yoluyla 100-200 nm çapında polielektrolit nano tanecikleri içine yoğunlaşmış olabilir22, 23. Bu kompleksleri çalışmamızda DNA nano tanecikleri (DNA NPs) olarak adlandırıyoruz. Amacımız hücreleri transfect ve istenilen proteinifade etmek iken, biz hCMEC / D3 monolayers bariyer özellikleri ödün olmadığından emin olmalısınız. Verilerimiz, standart 4 saat luciferase gen transfeksiyon rejiminin, LY P uygulamasının yararını gösteren LY geçirgenliğini, TJ bariyer bütünlüğündeki değişiklikleri belirlemek için ölçülebilir bir şekilde değiştirmediğini göstermektedir.
Protokol
1.Genel hCMEC/D3 hücre kültürü
- Dondurulmuş hücrelerin resüsitasyonu
NOT: Tüm hücre kültürü bakım ve deneyleri steril bir biyogüvenlik başlığı içinde yapılmıştır. Kültür ortamı, takviyeleri ve reaktifleri ya steril ürünler olarak satın alındı ya da mikrobiyal kontaminasyonu önlemek için 0.22 μm membran filtre kullanılarak filtrasyon yoluyla sterilize edildi.- Bir doku kültürü şişesine 8,5 mL kollajen çözeltisi (0,15mg/mL) ekleyin (75 cm2 büyüme alanı; bundan böyle T75 olarak anılacaktır) ve 1 saat boyunca bir kuvöze (37 °C, %5 CO2)yerleştirin.
- Kollajen çözeltisini çıkarın ve şişeyi sterilize fosfat tamponlu salin (PBS) ile hafifçe yıkayın. Şişeye 15 mL tam büyüme ortamı ekleyin ve CO2 kuluçka makinesinde 15 dakika bekletin.
NOT: Tam orta (son konsantrasyon) fetal sığır serumu (%5), penisilin-streptomisin (%1), hidrokortizon (1,4 μM), asit askorbik (5 μg/mL), kimyasal olarak tanımlanmış lipid ile desteklenmiş Endotel Hücre Büyümesi Bazal Orta-2 (500 mL) içeriyordu. konsantre (1/100), HEPES (10 mM) ve temel fibroblast büyüme faktörü (1 ng/mL). - Sıvı nitrojen tankından dondurulmuş hCMEC/D3 hücrelerinden oluşan bir cryovial'ı hareket ettirin ve şişeyi 37 °C'lik su banyosunda (< 1 dk) hızla eritin.
- Bir kez buz sadece küçük bir pul görünür, hızlı bir şekilde aspire ve önceden ısıtılmış orta içeren şişe hücreleri aktarın. Yavaşça büyüme ortamı ile hücrelerin karıştırılması için şişe sallamak.
- Şişeyi kuvöze yerleştirin (37 °C, %5 CO2)ve hücrelerin bağlı olduğundan emin olmak için 2 saat sonra hücreleri ışık mikroskobu altında gözlemleyin.
- Hücreler şişenin dibine bağlandıktan sonra, eski büyüme ortamını kaldırın ve eski büyüme ortamı24'te dimetilsülfoksityerine 10 mL taze önceden ısıtılmış büyüme ortamı ekleyin.
- 24 saat sonra, mil şeklindeki hücreleri gözlemlemek için hafif bir mikroskop altında kontrol edin ve eski büyüme ortamını önceden ısıtılmış taze büyüme ortamıyla değiştirin.
- Hücre kültürü bakımı
- % 100 birleştiği kadar her gün büyüme ortamı doldurmak. Eski büyüme ortamını çıkarmadan önce ve taze büyüme ortamı ekledikten sonra mikroskop altındaki hücreleri kontrol edin. Kuvözden şişeyi alın ve sağlıklı görünmelerini sağlamak için hCMEC/D3 hücrelerini faz kontrast mikroskobu altında inceleyin.
NOT: Hücrelerin çoğunluğu şişenin altına ilolmalı, iğ şeklinde morfolojisi olmalı ve çoğu zaman membranlarının etrafında ışık kırılması da görülür. Büyüme orta şeffaf olmalıdır (olmayan bulutlu) ve pembemsi-turuncu renkli. - Eski büyüme ortamını şişeden çıkarın ve önceden ısıtılmış 10 mL'lik taze ortamı şişeye aktarın.
NOT: Hücre eki etkilememesi için ortam doğrudan hücre yüzeyine değil, şişenin üst tarafına eklenmelidir. - Şişeyi yatay konuma geri döndürün ve birkaç kez hafifçe sallayın ve şişeyi kuvöze (37 °C, %5 CO2)geri vermeden önce mikroskop altında hCMEC/D3 hücrelerini kontrol edin.
- Hücreleri normal kültür çalışmaları sırasında ve deneyler sırasında, hücreleri kullanmadan önce ve sonra her seferinde ters ışık mikroskobu altında gözlemleyin. Laboratuvar defterine hücre numarası veya morfolojisindeki gözle görülür değişiklikleri kaydedin.
- % 100 birleştiği kadar her gün büyüme ortamı doldurmak. Eski büyüme ortamını çıkarmadan önce ve taze büyüme ortamı ekledikten sonra mikroskop altındaki hücreleri kontrol edin. Kuvözden şişeyi alın ve sağlıklı görünmelerini sağlamak için hCMEC/D3 hücrelerini faz kontrast mikroskobu altında inceleyin.
- Hücre geçişi
- Kuvözde 1 saat (37 °C, %5 CO 2) 8,5 mL kollajen çözeltisiiçeren yeni bir T75 şişesi inkübatın.
- Kollajen çözeltisini çıkarın ve şişeyi sterilize PBS ile hafifçe yıkayın. Yeni şişeye önceden ısıtılmış hCMEC/D3 ortamının 10 mL'sini ekleyin ve şişeyi kuvöze yerleştirin(37 °C, %5 CO 2).
- Kuvözden şişeyi alın ve hücrelerin %100 konfluent olup olmadığını kontrol etmek için hCMEC/D3 hücrelerini faz kontrastmikroskobu altında inceleyin.
- HCMEC/D3 hücre ortamını hücre içeren şişeden çıkarın ve hCMEC/D3 hücrelerini 10 mL PBS ile yıkayın.
NOT: Büyüme ortamına eklenen FBS α1-antitripsin ve α2-makroglobulin gibi proteaz inhibitörleri içerir. Bunlar tripsinizasyon işlemini engeller. Bu nedenle, tripsinizasyon sürecinin inhibisyonunu önlemek için FBS izlerini kaldırmak için PBS ile hücreleri yıkamak esastır. - %0,02 EDTA içeren %0,25 tripsin çözeltisi ve kuvözde 2-5 dakika (37 °C, %5CO 2) için trypsinize ekleyin (ayrışmaya yardımcı olmak için yanlara yavaşça şişeye dokunun).
NOT: Hücreleri asla tripsin/EDTA'da 6 dakikadan fazla bırakmayın. - Trypsinization işlemini durdurmak ve hCMEC/D3 hücresini birkaç kez yukarı ve aşağı borulandırarak yeniden askıya almak için önceden ısıtılmış hCMEC/D3 ortamının 10 mL'sini ekleyin. Daha sonra, 15 mL tüp içine şişeden tüm hücre süspansiyon kaldırın.
- Hücre süspansiyonunun 1 mL'sini 15 mL'lik tüpten önceden ısıtılmış taze ortamla yeni şişeye aktarın (hücreleri 1:10'da bölün) ve yeni şişeyi kuvöze geri döndürün.
NOT: Yeni şişeye aktarmadan önce, pipet hücre konsantrasyongradientlerini en aza indirmek için hücre süspansiyonunu birkaç kez yukarı ve aşağı yaslayın.
2. Hücre kaplaması
- Mikro gözenekli membranlar (gözenek boyutu: 0.4 μm, malzeme: polietilen tereftalat (PET)) ile doku kültürü ekler yerleştirin 24-iyi kültür plakası içine.
- Her doku kültürü eklemek kollajen tip I (0.15 mg /mL) 400 μL ekleyin ve CO2 inkübatör (37 °C, 5% CO2)1 saat için inkübat. Doku kültürü ekler mikro gözenekli membran üzerinde kollajen çözeltisi bile yayılmasını sağlamak için 24-iyi plaka yavaşça rock.
- Kollajen çözeltisini çıkarın ve mikro gözenekli membranı 0,4 mL 1x PBS tamponile hafifçe yıkayın.
- Hücre uçlarında 50.000 hücre/cm2 yoğunluğuna sahip hCMEC/D3 hücreleri (500 μL ortadaki 15.000 hücre).
NOT: Her doku kültürü insertindeki hücre sayısı farklılıklarını en aza indirmek için, hücre süspansiyonu kesici uçlara hücre eklemeden önce 10 mL'lik pipetle yeniden askıya alınmıştır. - Hücre bağlanmasına ve çoğalmasına izin vermek için 24 kuyulu plakayı dokukültürü kurulumu ile bir kuvöze (37 °C, %5 CO 2) yerleştirin.
- Hücrelerin %100 biraraya gelmesi için 7 gün boyunca plakayı kuluçkaya yatırın. Büyüme ortamını her gün çıkarın ve önceden ısıtılmış taze ortamın 0,5 mL'sini doku kültürü kesici uçlarına aktarın.
- 12 kuyulu plaka, 48 kuyulu plaka ve 96 kuyulu plaka üzerine kaplama işlemini (adım 2.2-2.6) tekrarlayın. ZO-1 ifadesindeki değişiklikleri belirlemek için Batı lekeleme için 12 kuyulu plakayı kullanın. DNA NP transfeksiyonu için 48 kuyulu plakayı kullanın. Transfected hücrelerde hücre canlılığını belirlemek için ATP tsay için 96-iyi plaka kullanın.
3. Hücre büyümesinin kinetik.
- Kollajen kaplı 24 kuyulu doku kültür plakasında hücreleri 50.000 hücre/cm2 yoğunlukta tohumlayın.
- Deneyin her gününde, büyüme ortamını çıkarın ve hücreleri 500 μL 1x PBS ile iki kez hafifçe yıkayın. Daha sonra % 0,02 EDTA içeren %0,25 tripsin çözeltisinin 30 μL'sini ekleyin ve plakayı bir kuluçka makinesinde yaklaşık2-5 dakika (37 °C, %5 CO 2) bırakın.
NOT: Konsepsiyon monolayer'ın kademeli oluşumu hücre kopma derecesini etkileyebilir ve burada belirtildiği gibi tripsin/EDTA hacimlerini artırmak gereklidir: tohumlama sonrası 1-5 gün için 30 μL, tohumlama sonrası 60 0L ve tohumlama sonrası 8-10 gün boyunca 100 μL . - Her kuyuda 500 μL hücre süspansiyonu hazırlamak için adım 3.2'ye eklenen trypsin/EDTA çözeltisinin hacmine göre 470 μL, 440 μL veya 400 μL büyüme ortamı ekleyin.
- Her bir kuyuda birkaç kez yukarı ve aşağı boru lar oluşturarak hücreleri askıya alın ve tüm hücrelerin büyüme ortamında askıya olduğundan emin olmak için mikroskop altında hücreleri gözlemleyin. Bazı hücreler birkaç kez pipetleme sonra hala plaka alt bağlı ise, yavaşça hücre ayrılmasını kolaylaştırmak için plastik bir hücre kazıyıcı kullanarak hücreleri kazıyın.
- Adım 3.3'te 500 μL hücre süspansiyonundan 0,1 mL hücre süspansiyonu çıkarın ve 1,5 mL'lik bir tüp ekleyin. Daha sonra hücre süspansiyonuna 0,1 mL %0,4 Trypan mavisi çözelti ekleyin ve iyice karıştırın.
- %70 isopropil alkol ile bir hemacytometre temizleyin. V-oluğunda her iki tarafa 3,5 adımdan 20 μL karışım ekleyin ve mikroskop altında 16 kareleri bulun. 16 kare tek bir ızgara olarak kabul edilir. Hemacytometer her iki tarafında iki rasgele ızgaraları bulmak ve tüm canlı, mavi olmayan hücreleri saymak.
NOT: Mavi renkte görünen hücreler sayma dışında, <1% hücrelerin her zaman noktalarında mavi lekeli. - Aşağıdaki formüllere göre hücreyoğunluğunu (hücre/cm 2) hesaplayın.
Hücrelerin/ızgaranın ortalama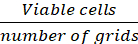 #u = (Eq.1)
#u = (Eq.1)
Seyreltme Faktörü=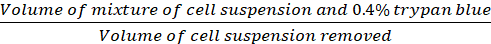 (Eq.2)
(Eq.2)
Hücre yoğunluğu (canlı hücreler/cm2) =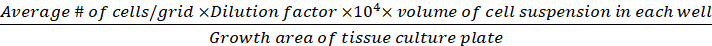
(Eq.3)
Denklemler 1-3. Canlı hücreler her ızgarada sayılan hücre sayısıdır, ızgara sayısı mikroskop altında bulunan ızgara sayısına karşılık gelir, hücre süspansiyonu karışımının hacmi ve %0,4 Trypan mavisi 3.5 adımda hazırlanan hacimdir, çıkarılan hücre süspansiyonunun hacmi adım 3.5 5 000 μL hücre süspansiyon kaldırıldı hacmi, her kuyuda hücre süspansiyon hacmi adım 3.3 gelen 500 μL hücre süspansiyon, doku kültür plaka büyüme alanı 24-iyi plaka tek kuyunun büyüme alanıdır.
4. Lucifer sarı görünür geçirgenlik (LY P uygulaması) teşp
- Tohumlama sonrası her gün LY Puygulamasını belirlemek için 4.3'ten başlayan adımları izleyin. Transfected hCMEC/D3 hücrelerinde P uygulamasının belirlenmesi için, transfeksiyon formülasyonunun 8.3 μL'sini (Şekil1)ekleyin ve 4 h. Transfeksiyon formülasyonları için 50 μL tam büyüme ortamı ile karıştırıldı.
- 4 saat transfeksiyondan sonra, herhangi bir transfeksiyon karışımını çıkarmak için steril 1x PBS tamponu kullanarak apikal tarafı iki kez hafifçe yıkayın. Çıkarıldıktan sonra geride kalan çeşitli hacimlerde PBS tamponu apikal taraftaki LY konsantrasyonuna neden olabilir. Doku kültürü uçlarında artık PBS tampon tamamen kaldırılır emin olmak için dikkat edin. Hücre ayrışmasını en aza indirmek için artık reaktifleri ve orta yı dikkatlice aspire edin.
NOT: HCMEC/D3 hücrelerinin her gün görünürgeçirgenliği (P uygulaması) ölçülürken bu adım atlanır. - Büyüme ortamını çıkarın ve 1,5 mL önceden ısıtılmış (37 °C) taşıma tamponunu (25 mM HEPES, 145 mM NaCl, 3 mM KCl, 1 mM CaCl2, 0,5 mM MgCl2, 1 mM NaH2PO4, 5 mM glikoz, pH 7,4) basolateral tarafına ekleyin.
NOT: Geçirgenlik katsayısı hesaplamasının doğruluğunu sağlamak için tüm bazoyan bölmelerde taşıma tamponhacmi eşit olmalıdır. - Her transwell kesici ucunun apikal tarafına 58,3 μL 20 μM LY çözelti ekleyin. Floresan ölçümleri için 20 μM LY çözeltisinin 50 μL'sini kaydedin. Artık PBS tamponu apikal taraftan tamamen çıkardıktan sonra, hCMEC/D3 hücrelerinin kurumasını önlemek için mümkün olduğunca çabuk LY çözeltisi ekleyin. Apical tarafında LY çözeltisinin doğru hacimlerini sağlayın.
NOT: LY floresan yoğunluğunun çürümesini en aza indirmek için ışığa maruz kalma sınırlandırılmalıdır. LY tozu yeniden oluşturulduktan sonra çözelti 4 °C'de saklanmalıdır ve ışıktan korunmalıdır. - 60 dk için bir döner plaka shaker (37 °C, 100 rpm) incubate. Daha sonra, her apikal bölmeden LY örneğinin 30 μL'sini çıkarın. Daha sonra 20 μM LY çözeltisini ve apikal yan numuneleri önceden etiketlenmiş tüplere aktarın ve taşıma tamponu kullanarak numuneyi 10 kat seyreltin.
NOT: Bu numunelerin yüksek floresan yoğunluğu potansiyel olarak aşırı yüklenebileceği ve floresan mikroplaka okuyucunun floresan dedektörüne zarar verebileceğinden, 20 μM LY stok çözeltisinin ve apikal yan numunelerin seyreltilmesi gerekmektedir. - Her bazolateral bölmeden 500 μL çıkarın ve numuneyi önceden etiketlenmiş tüplere aktarın.
NOT: Örnekler belirtilen zaman noktalarında ayrı transwell'den çıkarılır. Zaman noktaları her gün tohumlama sonrası 1 gün 10 güne kadar başlayarak vardır. - Standart eğri için bir dizi LY standardı hazırlayın (39.00 nM, 78.13 nM, 156.25 nM, 312 nM, 625 nM, 1250 nM, 2500 nM).
- Her bir standart (yinelenen), apikal ve bazolateral örnek her kuyuya siyah 96-kuyu plaka (Şekil1)100 μL ekleyin.
NOT: Siyah plakalar ışığı emer ve kuyular arasında arka plan ve floresan geçişini azaltır. - Puygulamasınıhesaplamak için LY floresan yoğunluğunu ölçmek için floresan mikroplaka okuyucu (ayar noktaları: uyarma 428 nm, emisyon 536 nm) kullanın. Bu çalışma için floresan levha okuyucu kullanılır.
- Makale metninde açıklandığı gibi Puygulamasını ve %LY kurtarma değerlerini hesaplayın.
Denklem 4. Puygulama değerlerini hesaplamak için formüller.
Aşağıdaki denklemleri kullanarak görünürgeçirgenlik (P uygulaması) katsayısını ve %LY kurtarmasını hesaplayın. Puygulama değerlerinin kütle 25'e veya LY konsantrasyonuna göre hesaplanabileceği unutulmamalıdır.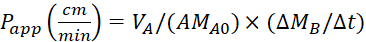 Veya
Veya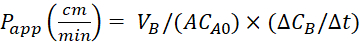
VA - apikal bölmedeki hacim
VB - bazolateral bölmede hacim
A - transwell ekleme membranının yüzey alanı (0,3 cm2)
MA0 - apikal bölmedeki ilk kütle
ΔMB/Δt - bazolateral bölmede zaman içinde kütle değişimi
CA0 - apikal bölmedeki başlangıç konsantrasyonu
ΔCB/Δt - bazolateral bölmede zaman içinde konsantrasyon daki değişim.
Denklem 5. % LY kurtarma hesaplamak için formüller.
Kurtarma (%) =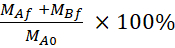
MAf son zaman noktasında apikal bölmede kütle, MBf son zaman noktasında basolateral bölmesi kitle, MA0 apikal bölmede ilk kütle . 26 Not: İlk kütle, adım 4.5'teki 20 μM LY çözeltisinin hacmine göre hesaplanır. Bu deney her zaman 35 numaralı geçit altındaki hücreler kullanılarak yapıldı ve dört kez bağımsız olarak yapıldı.
5. Kalsiyum tükenmesi
- Transwell kesici uçlardan ve 12 kuyulu plakadan büyüme ortamını çıkarın ve transwell uçlarından kalsiyum iyonlarını çıkarmak için önceden ısıtılmış kalsiyumsuz ortam (Minimum Essential Medium Medium Eagle Spinner (S-MEM) ortamı nı kullanarak apikal kenarı ve 12 kuyulu plakayı nazikçe yıkayın ve 12-iyi plaka.
- Kesici uçlara 500°L veya 2 mL önceden ısıtılmış S-MEM 1xmedium ekleyin ve kuvözde 24 saat kuluçka (37 °C,%5 CO 2) için kuluçka ya da kuluçka makinesi ekleyin. Kuluçkadan sonra, S-MEM 1x ortamını çıkarın ve önceden ısıtılmış 1x PBS tamponunu kullanarak hücreleri yıkayın.
- LY tedavisi için 4.4-4.10 numaralı bölümleri ve sonraki adımları takip edin. Batı lekeleme ve sonraki adımlar için bölüm 8 açıklanan adımları izleyin.
6. Transfeksiyon
- DNA nano taneciklerinin (DNA NPs) hazırlanması.
- 10 mM sodyum asetat (NaAc) tampon (pH 5.0) gWIZ-Luc plazmid stok çözeltisi seyreltmek ve DNA çözeltisi oda sıcaklığında 10 dakika (RT) durmak için izin.
NOT: Ağırlıklı olarak tek DNA molekülleri içeren DNA NP' si 20-40 μg/mL23. Bu nedenle, gWIZ-Luc plazmid stok çözeltisi seyreltilmelidir. Dondurulmuş gWIZ-Luc plazmid stoksıcaklık stresini en aza indirmek için buz tamamen çözülmüş olması gerekir. Hafifçe 3-5 pozisyonda ayarlanmış standart bir tezgah üstü girdap üzerinde 30 s için seyreltilmiş DNA stok çözeltisi girdap. - NP kompozisyonu yansıtmak için burada sayısal parametre olarak kullanılan istenilen N/P oranlarını hesaplayın.

Denklem 6. N/P oranı hesaplaması: Katyonik polimerlerin amin gruplarının benlerinin DNA fosfat gruplarına oranı. Katyonik polimerlerin kütlesi toplam tartılmış katyonik polimer miktarı anlamına gelir; (Kütle/Şarj) katyonik polimerler katyonik polimer (poli (etilenglikol)5k-blok-poliasesemi ile 48 kanton-poliaspartamide (PEG-DET)) yüklü primer amin (48) sayısına normale anlamına gelir ( mol/mol), polimerimiz için bu değer 306 Da;; DNA'nın kütlesi, mg/mL'deki hacim ve konsantrasyonun çarpılmasıyla elde edilen formülasyonda kullanılan toplam DNA miktarı anlamına gelir; (Kütle/Şarj) DNA, çift iplikli DNA başına fosfat grubu sayısına normalleştirilmiş DNA'nın molekül ağırlığını ifade eder (nükleobaz başına 325 Da).
NOT: DNA NP hazırlamatablosu (Tablo 1) deneylerimizde test edilen farklı numunelerin formülasyon tarifini içermektedir. DNA NP hızlı titrasyon tekniği kullanılarak hazırlanmıştır. PEG-DET polimer çözeltisi tüpü yatay bir pozisyonda tutarken tüpün duvarları boyunca eklenmiştir. Daha sonra tüp dikey konuma geçti, ardından 10'lu maksimum hızda hızla girdap lar geldi. DNA NP'nin kullanımdan önce RT'de 30 dakika dayanmasına izin verildi. DNA NP dosing için başparmak kuralı 0.5 μg DNA'dır. Bu nedenle, 96 kuyulu bir plakadaki 48 kuyulu plaka/her kuyudaki her transwell kesici uç için, 0.157/0.5/0.195 μg-Luc DNA içeren N/P 10'da DNA NP'si hazırlayın. - Poloxamer P84 (P84) konsantrasyonu içeren örnekler için, 5 s için DNA NP ve girdap P84 ekleyin. Her numunede P84'ün son konsantrasyonu %0.01 veya %0.03 wt'dir.
- 10 mM sodyum asetat (NaAc) tampon (pH 5.0) gWIZ-Luc plazmid stok çözeltisi seyreltmek ve DNA çözeltisi oda sıcaklığında 10 dakika (RT) durmak için izin.
- 48 kuyulu plaka kurulumunda DNA NP transfeksiyonu
- 48 kuyu plakasında 50.000 hücre/cm2 yoğunluğuna sahip hücreleri tohumlayın ve kuvözde biraraya gelene kadar büyüyün (37 °C, %5 CO2).
- Her tedavi grubu için, belirtilen numunenin 25°L'sini (transfeksiyon formülasyonu) ve 150 μL'lik tam büyüme ortamını ve bu karışımın 175°L'sini her kuyuya karıştırın.
- HCMEC/D3 hücrelerini mikroskop altında gözlemleyin ve hücrelerin sağlıklı görünmesini sağlayın ve deney sırasında %100 konca dır.
- Büyüme ortamını kuyulardan ve 175°L transfeksiyon karışımından her kuyuya çıkarın. Daha sonra, kuvözde 4 saat (37 °C, %5CO 2) plakayı kuluçkaya yatırın.
- 4 saat sonra transfeksiyon karışımını çıkarın ve hCMEC/D3 hücrelerini önceden ısıtılmış steril 1x PBS tamponuyla yıkayın.
NOT: Yıkama adımları sırasında hCMEC/D3 hücrelerinin plaka/insert yüzeyinden kazara ayrılmasını en aza indirmek için, kuyuduvarları boyunca yeterince steril PBS pipetleme ve artık kültür medyasındaki nano partikülleri çıkarın. - Plakayı birkaç kez hafifçe sallayın ve pbs yıkamayı dikkatlice aspire edin ve 500 μL hCMEC/D3 önceden ısıtılmış kültür ortamı ekleyin.
- Hücreleri mikroskopik olarak inceleyin ve hücre morfolojisi ve transfeksiyonun olası etkileri üzerine gözlemleri kaydedin.
- 37 °C hücre kültüründe 24 saat boyunca inkübatör lüle üretimine izin vermek için. 24 saat sonra, büyüme ortamını tamamen çıkarın ve önceden ısıtılmış 1x PBS ile hücreleri bir kez yıkayın.
- 100 μL buz gibi luciferase hücre kültürü lysis 1x reaktif ilerleyerek transfected hücreleri lyse iyi başına.
- Luciferase protein içeriğinin ölçümü için, 20 μL hücre lisat ve 100 μL luciferase istin arabelleği (20 mM glislikin (pH 8), 1 mM MgCl2, 0,1 mM EDTA, 3,5 mM DTT, 0,5 mM ATP, 0,27 mM koenzim A) 1,5 mL tüp içine ekleyin.
- Tek bir Otomatik enjektörlü bir Luminometre'de 6.2.10 adımda açıklanan numunenin Parlaklığını okuyun.
NOT: Parlaklık okumadan önce 10 s üzerinde entegre edilmelidir. - Üreticinin protokolünü izleyerek bilarchoninik asit test (BCA test) kiti kullanarak lysatdaki toplam hücresel protein miktarını ölçün.
- Toplam hücresel protein başına Göreli Işık Birimleri (RLU) olarak luciferase gen ekspresyonunu hesaplayın ve ifade edin.
7. Parlak ATP tsası
- 96 kuyu plakasında 50.000 hücre/cm2 yoğunluğuna sahip hücreleri tohumlayın ve kuvözde biraraya gelene kadar büyüyün (37 °C, %5 CO2).
- Transfeksiyon formülasyonunun 9.7 μL'lik hücreleri transfect (hazırlık detayları bölüm 6'dadır) ve 58.4 μL tam büyüme ortamı4 saat.
- Transfeksiyon karışımını çıkarın ve tedavi reaktiflerini tamamen çıkarmak için hücreleri önceden ısıtılmış PBS 1x tamponuyla iki kez hafifçe yıkayın.
NOT: Farklı hacimlerde kalan arabellek ATP tsay reaktiflerini farklı ölçüde seyreltebilir ve verileri etkileyebilir. - Çok kanallı pipet kullanarak 1:1 seyreltmede 75 μL taze önceden ısıtılmış orta ve ATP istresiyonaracını karıştırın. Tüm çok kanallı pipet uçlarında sıvı seviyesinin aynı olduğundan emin olun.
- Oda sıcaklığında 15 dakika boyunca bir besleyici shaker üzerine plaka yerleştirin. Reaktifleri 15 dk ekledikten sonra, her numunenin 60 μL'sini beyaz 96 kuyulu bir tabağa aktarın.
NOT: Beyaz plakalar net veya siyah plakalar daha çıkış ışığı yansıtmak için daha iyidir. - Plaka okumadan önce bir iğne kullanarak herhangi bir hava kabarcıkları pop. 1 s entegrasyon süresi ile bir luminometre üzerinde plaka okuyun. ATP tsay reaktifleri ekledikten sonra 20 dakika içinde plakaokuyun. Parlaklık sinyali hızlı çürüme hızıile geçici olduğundan, zamanlama farklı plakalar arasında karşılaştırma için önemlidir.
- Yüzdeyi hesaplama (%) bu formülü kullanarak hücre canlılığı: (transfected hücrelerin lüminesans / kontrol lüminesans, işlenmemiş hücreler) x 100.
8. Sıkı kavşak proteini ZO-1 ölçümü için batı lekeleme
-
Hücre lisisi ve protein ekstraksiyonu
NOT: Hücrelerden protein çıkarma için gerekli tüm adımlar 2-8 °C'de yapılmalıdır.- Kollajen kaplı 12 kuyulu doku kültür plakasında hücreleri 50.000 hücre/cm2 yoğunlukta tohumlayın.
- Gün 3, gün 5, gün 7, gün 10 post-tohumlama ve gün 7 (hücreler önceden kalsiyum içermeyen orta ile kuluçka), büyüme ortamı kaldırmak ve yavaşça buz gibi 2 mL ile hücreleri iki kez yıkayın 1x PBS. Daha sonra, her kuyuda 3 μg/mL aprotinin içeren buz gibi 1x RIPA lysis tamponunun 300 μL karışımını ekleyin.
NOT: Karışım taze olarak yapılmalı ve buzüzerinde tutulmalıdır. Aprotinin ilgi proteini aşağılayıcı lysates mevcut proteazlar inhibe etmek için kullanılır. - İki donma-çözülme döngüsünden (-80 °C) sonra, hücreleri soğuk plastik bir hücre kazıyıcı kullanarak kazıyın. Mikrofuge tüplerde hücre lysates toplamak. Daha sonra tüpleri 200 x g'de 30 dk 4 °C'de santrifüj edin.
- Temiz tüpler içine supernatant toplamak ve buz üzerine yerleştirin. BcA test kitini kullanarak lysates'teki toplam hücresel protein miktarını üreticinin protokolünü izleyerek ölçün.
-
Sıkı bağlantı proteini ZO-1'in saptanabilirliği için batıda blotlama
- 95 °C'de 1x Laemmli tampon ile toplam protein 40 μg içeren toplam homojenatların denatüre aliquots, 5 dk ve bir azaltıcı elektroforezi tabi 6-7.5% sodyum dodecyl sülfat poliakrilamid jel (SDS-PAGE) (90 V, istifleme jeli ile 10 dakika, 120 V jelleri çözme).
NOT: Numuneleri veya standartları yüklerken, her şeride yavaş ve dikkatli bir şekilde yüklemeyi unutmayın, bu süreçte kuyuyu kırmamaya dikkat edin. - Ayrılmış proteinleri 192 mM Glisin, 25 mM Tris Base, %10 metanol ve %0,1 SDS (75 V, oda sıcaklığında 110 dk) içeren pH 8.5 transfer tamponlu bir nitroselüloz membrana aktarın.
NOT: Membrana dokunmayın. Membranı işlemek için %70 izopropanol yıkanmış plastik çömlek ler kullanın. ZO-1 proteininin (MW 200 kDa) membrana başarılı bir şekilde aktarılabilmesi için pH 8.3-8.5 civarında olmalıdır. Transfer tamponu bundan daha asidik sayılsaydı, aktarım gerçekleşmez. Merdiven bantları jel üzerinde hala görünür ise, transfer süresini ve SDS konsantrasyonu artırmak için yararlı olacaktır. - %0,1 Arat20 (T-TBS) içeren Tris-tamponlu salin kullanarak membranı yıkadıktan sonra, membranları 60 dakika boyunca engellemek için bloklama çözeltisi (1:1 LiCOR-Odyssey Block: 1x Tris tamponlu salin) kullanın.
- Membranı dikkatlice iki şerit halinde kesin. İki ana antikor (ZO-1 monoklonal antikor, seyreltme, 1: 900 ve gliserindehit 3-fosfat dehidrogenaz (GAPDH) antikor, seyreltme, 1: 10.000) 4 °C gecede kuluçka. Sonra, eşek anti-fare IgG (seyreltme, 1:50.000) ile ZO-1 ve GAPDH membranlar kuluçka. Membranları T-TBS kullanarak yıkadıktan sonra, 700 kanaldaki membranları 16 bit görüntüleyicide görüntüleyin.
- 95 °C'de 1x Laemmli tampon ile toplam protein 40 μg içeren toplam homojenatların denatüre aliquots, 5 dk ve bir azaltıcı elektroforezi tabi 6-7.5% sodyum dodecyl sülfat poliakrilamid jel (SDS-PAGE) (90 V, istifleme jeli ile 10 dakika, 120 V jelleri çözme).
Sonuçlar
İlk olarak, TJ oluşumunun görünür kinetiklerini belirlemek için zaman diliminin LY geçirgenliği üzerindeki etkisini belirledik. 1. günden 10'a kadar olan ortalama LY Puygulama değerleri Şekil 2a'dagösterilmiştir. 1. günde, ortalama Puygulaması 4.25 x 10-4 cm/dk idi ve 2. Ortalama Puygulama değeri 3. Puygulama değerleri, 7. Puygulama değerle...
Tartışmalar
BBB'nin önemli bir rolü, sinirsel mikroortamın hemostazını korumak için sistemik dolaşım ve beyin arasında gerekli olmayan iyonların ve toksik maddelerin değişimini önlemektir. BBB'nin karakteristik özelliklerinden biri, kapiller endotel hücrelerinin parasellüler taşıma rotasını etkili bir şekilde kapatan sıkı kavşaklar (TJs) oluşturabilme yeteneğidir. Kültürlü hCMEC/D3 monolayers TJ bariyer oluşumunun görünür kinetik belirlemek için nicel bir yöntem olarak bir LY Puygulaması
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, Amerikan Eczacılık Derneği'nin 2017 Yeni Araştırmacı Ödülü, Duquesne Üniversitesi'nden Hunkele Dreaded Disease ödülü ve Manickam laboratuvarı için Eczacılık Fakültesi'nin başlangıç fonlarından gelen mali destek için müteşekkirler. Biz sızıntı laboratuvarı (Duquesne Üniversitesi) batı bloting yardım ve onların Odyssey 16-bit görüntüleyici kullanımına izin için teşekkür etmek istiyorum. Biz de Batı blotting ile ilgili yardım için Kandarp Dave (Manickam laboratuvarı) için takdir özel bir not eklemek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| hCMEC/D3 cell line | Cedarlane Laboratories | 102114.3C-P25 | human cerebral microvascular endothelial cell line |
| gWizLuc | Aldevron | 5000-5001 | Plasmid DNA encoding luciferase gene |
| lucifer yellow CH dilithium salt | Invitrogen | 155267 | |
| Transwell inserts with polyethylene terephthalate (PET) track-etched membranes | Falcon | 353095 | |
| Tissue culture flask | Olympus Plastics | 25-207 | |
| 24-well Flat Bottom | Olympus Plastics | 25-107 | |
| Black 96-Well Immuno Plates | Thermo Scientific | 437111 | |
| S-MEM 1X | Gibco | 1951695 | Spinner-minimum essential medium (S-MEM) |
| EBM-2 | Clonetics | CC-3156 | Endothelial cell basal medium-2(EBM-2) |
| phosphate-buffered saline 1X | HyClone | SH3025601 | |
| Collagen Type I | Discovery Labware, Inc. | 354236 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | |
| Cell Culture Lysis 5X Reagent | Promega | E1531 | |
| Beetle Luciferin, Potassium Salt | Promega | E1601 | |
| SpectraMax i3 | Molecular Devices | Fluorescence Plate Reader | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| ZO-1 Polyclonal Antibody | ThermoFisher | 61-7300 | |
| anti-GAPDH antibody | abcam | ab8245 | |
| Alexa Fluor680-conjugated AffiniPure Donkey Anti-Mouse LgG(H+L) | Jackson ImmunoResearch Inc | 128817 | |
| 12-well, Flat Bottom | Olympus Plastics | 25-106 | |
| RIPA buffer (5X) | Alfa Aesar | J62524 | |
| Aprotinin | Fisher BioReagents | BP2503-10 | |
| Odyssey CLx imager | LI-COR Biosciences | for scanning western blot membranes |
Referanslar
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology Of Disease. 37 (1), 13-25 (2010).
- Griep, L. M., et al. BBB on chip: microfluidic platform to mechanically and biochemically modulate blood-brain barrier function. Biomedical Microdevices. 15 (1), 145-150 (2013).
- Camos, S., Mallolas, J. Experimental models for assaying microvascular endothelial cell pathophysiology in stroke. Molecules. 15 (12), 9104-9134 (2010).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow & Metabolism. 28 (2), 312-328 (2008).
- Wolff, A., Antfolk, M., Brodin, B., Tenje, M. In vitro Blood-Brain Barrier Models-An Overview of Established Models and New Microfluidic Approaches. Journal of Pharmaceutical Sciences. 104 (9), 2727-2746 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmaceutics. 10 (1), 289-296 (2013).
- Tornabene, E., Brodin, B. Stroke and Drug Delivery--In vitro Models of the Ischemic Blood-Brain Barrier. Journal of Pharmaceutical Sciences. 105 (2), 398-405 (2016).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Llombart, V., et al. Characterization of secretomes from a human blood brain barrier endothelial cells in-vitro model after ischemia by stable isotope labeling with aminoacids in cell culture (SILAC). Journal of Proteomics. 133, 100-112 (2016).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- Avdeef, A. How well can in vitro brain microcapillary endothelial cell models predict rodent in vivo blood-brain barrier permeability?. European Journal of Pharmaceutical Sciences. 43 (3), 109-124 (2011).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Shao, X., et al. Development of a blood-brain barrier model in a membrane-based microchip for characterization of drug permeability and cytotoxicity for drug screening. Analytica Chimica Acta. 934, 186-193 (2016).
- Walter, F. R., et al. A versatile lab-on-a-chip tool for modeling biological barriers. Sensors and Actuators B: Chemical. 222, 1209-1219 (2016).
- Cecchelli, R., et al. In vitro model for evaluating drug transport across the blood–brain barrier. Advanced Drug Delivery Reviews. 36, (1999).
- Cecchelli, R., et al. Modelling of the blood–brain barrier in drug discovery and development. Nature reviews Drug discovery. 6 (8), 650 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. . The Blood-Brain Barrier. , 307-324 (2003).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability Studies on In vitro Blood–Brain Barrier Models: Physiology, Pathology, and Pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Ren, T. B., et al. A General Method To Increase Stokes Shift by Introducing Alternating Vibronic Structures. Journal of the American Chemical Society. 140 (24), 7716-7722 (2018).
- Pack, D. W., Hoffman, A. S., Pun, S., Stayton, P. S. Design and development of polymers for gene delivery. Nature Reviews Drug Discovery. 4 (7), 581-593 (2005).
- Oupický, D., Konák, C., Ulbrich, K., Wolfert, M. A., Seymour, L. W. DNA delivery systems based on complexes of DNA with synthetic polycations and their copolymers. Journal of Controlled Release. 65, (2000).
- Couraud, P. O. . The hCMEC/D3 CELL LINE: IMMORTALIZED HUMAN CEREBRAL MICROVASCULAR ENDOTHELIAL CELLS As a model of human Blood-Brain Barrier. , (2012).
- Youdim, K. u. r. e. s. h. A., A, A. A. a. N. J. In vitro trans-monolayer permeability calculations: often forgotten assumptions. research focus reviews. 8, (2003).
- Eigenmann, D. E., Xue, G., Kim, K. S., Moses, A. V., Hamburger, M., Oufir, M. Comparative study of four immortalized human brain capillary endothelial cell lines, hCMEC/D3, hBMEC, TY10, and BB19, and optimization of culture conditions, for an in vitro blood-brain barrier model for drug permeability studies. Fluid and Barriers of the CNS. 10 (33), (2013).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Balda, M. S., Anderson, J. M. Two classes of tight junctions are revealed by ZO-1 isoforms. The American Physiological Society. , (1992).
- Brown, R. C., Davis, T. P. Calcium Modulation of Adherens and Tight Junction Function: A Potential Mechanism for Blood-Brain Barrier Disruption After Stroke. Stroke. 33 (6), 1706-1711 (2002).
- Gorodeski, G., Jin, W., Hopfer, U. Extracellular Ca2+ directly regulates tight junctional permeability in the human cervical cell line CaSki. American Journal of Physiology-Cell Physiology. 272 (2), C511-C524 (1997).
- Stuart, R. O., Sun, A., Panichas, M., Hebert, S. C., Brenner, B. M., Nigam, S. K. Critical Role for lntracellular Calcium in Tight Junction Biogenesis. Journal of Cellular Physiology. 159, (1994).
- Tobey, N. A. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. , (2004).
- Tobey, N. A., Argote, C. M., Hosseini, S. S., Orlando, R. C. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. 286, (2004).
- Posimo, J. M., et al. Viability assays for cells in culture. Journal of visualized experiments : JoVE. (83), e50645 (2014).
- Cipolla, M. J., Crete, R., Vitullo, L., Rix, R. D. Transcellular transport as a mechanism of blood-brain barrier disruption during stroke. Frontiers in Bioscience. 9 (3), 777-785 (2004).
- Kreuter, J. Influence of the surface properties on nanoparticle-mediated transport of drugs to the brain. Journal of nanoscience and nanotechnology. 4 (5), 484-488 (2004).
- Markoutsa, E., et al. Uptake and permeability studies of BBB-targeting immunoliposomes using the hCMEC/D3 cell line. European Journal of Pharmaceutics and Biopharmaceutics. 77 (2), 265-274 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır