Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Lucifer Yellow - Un marcador de permeabilidad paracelular robusto en un modelo celular de la barrera hematoencefálica humana
En este artículo
Resumen
Presentamos un ensayo de fluorescencia para demostrar que Lucifer Yellow (LY) es un marcador robusto para determinar la aparente permeabilidad paracelular de las monocapas celulares hCMEC/D3, un modelo in vitro de la barrera hematoencefálica humana. Usamos este ensayo para determinar la cinética de una formación monocapa confluente en células hCMEC/D3 cultivadas.
Resumen
La barrera hematoencefálica BBB consiste en células endoteliales que forman una barrera entre la circulación sistémica y el cerebro para evitar el intercambio de iones no esenciales y sustancias tóxicas. Las uniones estrechas (TJ) sellan eficazmente el espacio paracelular en las monocapas, lo que resulta en una barrera intacta. Este estudio describe un ensayo de fluorescencia basado en LY que sepuede utilizar para determinar su coeficiente de permeabilidad aparente (aplicación P) y a su vez se puede utilizar para determinar la cinética de la formación de monocapas confluentes y la unión estrecha resultante integridad de barrera en las monocapas hCMEC/D3. Demostramos además una utilidad adicional de este ensayo para determinar la integridad funcional de TJ en células transinfectadas. Nuestros datos del ensayo de laaplicación LY P muestran que las células hCMEC/D3 sembradas en una configuración transwell limitan efectivamente el transporte paracelular LY 7 días de cultivo. Como utilidad adicional del ensayo presentado, también demostramos que la transfección de nanopartículas de ADN no altera el transporte paracelular LY en monocapas hCMEC/D3.
Introducción
La barrera hematoencefálica (BBB) es la barrera protectora que limita la afluencia de componentes plasmáticos en el tejido cerebral y consiste en células endoteliales cerebrales junto con células de apoyo como los pericitas. El papel principal de BBB es servir como barrera que sella el espacio entre la sangre periférica y elsistema nervioso central (SNC) para mantener la hemostasis del microambiente neural 1,2. Las células endoteliales capilares cerebrales sellan eficazmente la vía paracelular a través de la formación de uniones estrechas intercelulares (TJ)1. Esta barrera protectora permite que la glucosa y los nutrientes seleccionados entren en el cerebro mientras evita que la mayoría de los iones, sustancias tóxicas y drogas pasen a través de esta barrera apretada. Aparte de su función protectora, la función de barrera natural del BBB plantea un grave desafío en el desarrollo de sistemas de administración de medicamentos dirigidos al SNC.
Los modelos de cultivo celular in vitro del BBB son herramientas útiles para estudiar su biología y comprender los efectos del tratamiento farmacológico en la integridad de la barrera TJ. Utilizamos la línea celular endotelial microvascular humana (hCMEC/D3) como modelo in vitro ya que es un modelo aceptado de endotelio cerebral humano3 y recapitula muchas funciones de la BBB humana. hCMEC/D3 es una de las líneas celulares más utilizadas para modelar el BBB in vitro4,5,6,7,8,9. A pesar de sus valores comparativamente bajos de resistencia eléctrica transendotelial (TEER), una medida de la estanqueidad de las barreras, esta línea celular conserva la mayoría de las propiedades morfológicas y funcionales de las células endoteliales cerebrales, incluso como monocultivo en ausencia de células gliales cocultivadas6,7. La línea celular hCMEC/D3 expresa múltiples marcadores BBB incluyendo transportadores y receptores activos hasta aproximadamente el paso 35 sin someterse a desdiferencia a fenotipos inestables6,7,9 ,10,11. La característica más llamativa de la línea celular hCMEC/D3 como modeloBBB in vitro es su capacidad para formar TJs 5,9,11,12. Cabe señalar que aunque los modelos BBB derivados de células madre mostraron una mayor permeabilidad en muchos estudios en comparación con la línea celular hCMEC/D3 y expresan algunos marcadores BBB, todavía no han evolucionado como el modelo de células BBB más común13. Es importante destacar que los modelos BBB derivados de células madre siguen siendo caracterizados con respecto a los números máximos de pasaje que permiten a las células mantener fenotipos BBB estables14.
Tres métodos primarios se utilizan comúnmente para determinar la integridad de la barrera TJ, incluyendo la medición del TEER, la medición del coeficiente de permeabilidad aparente(aplicaciónP) de pequeñas moléculas de trazador hidrófilo como sacarosa, inulina, Lucifer Yellow, etc. e inmunomanchación de marcadores moleculares conocidos de TJs como claudin-5, ZO-1, occludin, etc.5. TEER es un método relativamente simple y cuantitativo que mide la resistenciaeléctrica a través de las monocapas celulares cultivadas en un sustrato de membrana porosa 5. Sin embargo, los valores TEER pueden verse influenciados por variables experimentales como la composición del medio de cultivo y el tipo de instrumento de medición. Una combinación probable de estos factores conduce a una amplia distribución de los valores TEER que van de 2 a 1150 cm2 en la línea celular hCMEC/D3 cultivada durante 2-21 días13. La inmunomancha es un método visual para determinar la presencia de proteínas TJ mediante el etiquetado de la proteína objetivo utilizando anticuerpos. Sin embargo, la inmunomancha implica una serie de pasos experimentales, incluyendo la necesidad de fijar/permeabilizar las células que pueden resultar en artefactos experimentales y las señales fluorescentes pueden desvanecerse con el tiempo. Los factores anteriores pueden dar lugar a errores subjetivos que afectan a la calidad de los datos.
El enfoque principal de este trabajo es presentar un ensayo de permeabilidad aparente basado en LY determinar la cinética de una formación monocapa confluente en células hCMEC/D3 cultivadas. Aunque otros sistemas avanzados de BBB in vitro, como los sistemas de cocultivo, los sistemas microfluídicos, son imitaciones fisiológicamente más relevantes con una función de barrera significativamente mejorada15,16,17, el hCMEC/D3 configuración de transwell es un modelo simple y confiable para estimar la cinética de la formación de TJ y examinar rápidamente el efecto de diferentes formulaciones de fármacos en la función de barrera. En general, los valores de laaplicación P son consistentes para varios solutos hidrófilos en monócapas hCMEC/D3. Por ejemplo, los valores deaplicación P reportados para varios solutos de baja masa molecular (como sacarosa, manitol, LY, etc.) en diferentes modelos BBB in vitro están en el orden de 10-4 cm/min 5,18,19 , 20. En nuestra configuración experimental, las células endoteliales cerebrales se sembran en una membrana microporosa recubierta de colágeno para la unión celular y la formación de monocapa para imitar la barrera in vivo. Se espera que el LY añadido en el lado apical atraviese las uniones estrechas intercelulares y se acumule en el lado basolateral. Las mayores concentraciones de LY en el lado basolateral indican una barrera inmadura, no completamente funcional, mientras que las concentraciones más bajas reflejan el transporte restringido debido a la presencia de TJs funcionales que resultan en una barrera madura.
LY es un tinte hidrófilo con picos de excitación/emisión distintos y evita la necesidad de radioetiquetar moléculas trazadoras como sacarosa, manitol o inulina. Por lo tanto, los valores de fluorescencia de LY se pueden utilizar para calcular directamente su permeabilidad paracelular a través de las monocapas BBB. Además, en comparación con muchos tintes disponibles comercialmente utilizados en campos biomédicos que sufren de pequeños cambios Stokes como fluoresceína21, el desplazamiento Stokes de LY es de aproximadamente 108 nm con suficiente separación espectral, permitiendo así datos de fluorescencia LY como lectura robusta para determinar la permeabilidad paracelular. Usamos la hincha occidental como una técnica ortogonal para demostrar los cambios en la expresión de la proteína marcador de unión apretada, ZO-1, durante el tiempo de cultivo. La expresión ZO-1 detectada a través de la hincha occidental se utiliza para complementar los datos de laaplicación LY P y, en combinación, estos datos sugieren que los cambios observados en los valores de laaplicación LY P reflejan la formación de una monocapa con aumento gradual en expresión del marcador de unión estrecha, ZO-1.
Como se señaló anteriormente, el enfoque central de este trabajo es demostrar un ensayo LY como una técnica simple para monitorear la formación de una monocapa confluente con uniones estrechas funcionales. Sin embargo, para demostrar una utilidad adicional del ensayo desarrollado, medimos laaplicación LY P en monócapas hCMEC/D3 transfectó nanopartículas de ADN. Los ácidos nucleicos se pueden condensar en nanopartículas de polielectrolitos con un diámetro de 100-200 nm mediante interacción electrostática entre los grupos de polímeros cargados positivamente y los grupos fosfatos cargados negativamente de ácidos nucleicos22, 23. Nos referimos a estos complejos como nanopartículas de ADN (NPs de ADN) en nuestro trabajo. Si bien nuestra intención es transfectar las células y expresar la proteína deseada, debemos asegurarnos de que las propiedades de barrera de las monocapas hCMEC/D3 no se vean comprometidas. Nuestros datos sugieren que un régimen estándar de transfección del gen luciferasa de 4 h no cambia mediblemente la permeabilidad LY que demuestra la utilidad del ensayo de laaplicación LY P para determinar los cambios en la integridad de la barrera TJ.
Protocolo
1.Cultivo celular general hCMEC/D3
- Reanimación de células congeladas
NOTA: Todos los experimentos y mantenimiento del cultivo celular se realizaron dentro de una campana de bioseguridad estéril. Los medios de cultivo, los suplementos y los reactivos se compraron como productos estériles o se esterilizaron mediante filtración utilizando un filtro de membrana de 0,22 m para evitar la contaminación microbiana.- Añadir 8,5 ml de solución de colágeno (0,15mg/ml) en un matraz de cultivo tisular (75 cm2 de área de crecimiento; referida a partir de ahora como T75) y colocarla en una incubadora (37 oC, 5% CO2)durante 1 h.
- Retire la solución de colágeno y lave suavemente el matraz con solución salina esterilizada con fosfato (PBS). Añadir 15 ml de medio de crecimiento completo al matraz y dejar en la incubadora de CO2 durante 15 min.
NOTA: El medio completo (concentración final) contenía Crecimiento celular endotelial Basal Medium-2 (500 mL) complementado con suero bovino fetal (5%), penicilina-estreptomicina (1%), hidrocortisona (1,4 m), ascórbico ácido (5 g/ml), lípidos definidos químicamente (1/100), HEPES (10 mM) y factor básico de crecimiento de fibroblastos (1 ng/ml). - Mover un criovial de células hCMEC/D3 congeladas del tanque de nitrógeno líquido y descongelar rápidamente el vial en un baño de agua de 37 oC (< 1 min).
- Una vez que sólo una pequeña escama de hielo es visible, aspirar rápidamente y transferir las células al matraz que contiene medio precalentado. Agitar suavemente el matraz para permitir la mezcla de las células con el medio de crecimiento.
- Coloque el matraz en la incubadora (37oC, 5% CO 2) y observe las células bajo un microscopio de luz después de 2 h para asegurarse de que las células están unidas.
- Una vez que las células se adhieren a la parte inferior del matraz, retire el antiguo medio de crecimiento y agregue 10 ml de medio de crecimiento precalentado fresco para reemplazar el dimetilsulfóxido en el antiguo medio de crecimiento24.
- Después de 24 h, compruebe bajo un microscopio ligero para observar las células en forma de husillo y reemplace el antiguo medio de crecimiento por un medio de crecimiento fresco precalentado.
- Mantenimiento del cultivo celular
- Reponer el medio de crecimiento cada dos días hasta el 100% de confluencia. Compruebe las células bajo el microscopio antes de extraer el medio de crecimiento antiguo y también después de agregar un nuevo medio de crecimiento. Saque el matraz de la incubadora y examine las células hCMEC/D3 bajo el microscopio de contraste de fase para asegurarse de que parezcan saludables.
NOTA: La mayoría de las células deben estar unidas a la parte inferior del matraz, tienen una morfología en forma de husillo y, a menudo, también se observa refracción ligera alrededor de sus membranas. El medio de crecimiento debe ser transparente (sin nublado) y de color rosado-naranja. - Retire el medio de crecimiento viejo del matraz y transfiera 10 ml de medio fresco precalentado al matraz.
NOTA: El medio debe añadirse a la parte superior del matraz y no directamente en la superficie de las células para evitar afectar la unión celular. - Vuelva a colocar el matraz en posición horizontal y encozó suavemente varias veces y compruebe las células hCMEC/D3bajo el microscopio antes de devolver el matraz a la incubadora (37 oC, 5% CO 2).
- Observe las células bajo un microscopio de luz invertida cada vez antes y después de manipular las células, tanto durante el trabajo de cultivo regular como durante los experimentos. Registre cualquier cambio notable en el número celular o morfología en el cuaderno de laboratorio.
- Reponer el medio de crecimiento cada dos días hasta el 100% de confluencia. Compruebe las células bajo el microscopio antes de extraer el medio de crecimiento antiguo y también después de agregar un nuevo medio de crecimiento. Saque el matraz de la incubadora y examine las células hCMEC/D3 bajo el microscopio de contraste de fase para asegurarse de que parezcan saludables.
- Paso celular
- Incubar un nuevo matraz T75 con 8,5 ml de solución de colágeno durante 1 hen la incubadora (37oC, 5% CO 2).
- Retire la solución de colágeno y lave suavemente el matraz con PBS esterilizado. Añadir 10 ml de medio hCMEC/D3 precalentado al matraz nuevo y colocar el matraz en laincubadora (37oC, 5% CO 2).
- Saque el matraz de la incubadora y examine las células hCMEC/D3 bajo un microscopio de contraste de fase para comprobar si las células son 100% confluentes.
- Retire el medio celular hCMEC/D3 del matraz que contiene células y lave las células hCMEC/D3 con 10 ml de PBS.
NOTA: El FBS añadido al medio de crecimiento contiene inhibidores de la proteasa, como la antitripsina n.o 1 y la macroglobulina n.o 2. Estos inhiben el proceso de tripinización. Por lo tanto, es esencial lavar las células con PBS para eliminar los rastros de FBS para prevenir la inhibición del proceso de tripinización. - Añadir 1 mL de 0,25% de solución de trippsina que contenga 0,02% EDTA y trippsinizar durante 2-5 min en la incubadora (37 oC, 5% CO2) (toque suavemente el matraz en los lados para ayudar a desprendimiento).
NOTA: Nunca deje las células en trippsina/EDTA durante más de 6 min. - Agregue 10 ml de medio hCMEC/D3 precalentado para detener el proceso de trippsinización y resuspender la célula hCMEC/D3 pipeteando hacia arriba y hacia abajo varias veces. A continuación, retire toda la suspensión celular del matraz en un tubo de 15 ml.
- Transfiera 1 ml de la suspensión celular del tubo de 15 ml al nuevo matraz con medio fresco precalentado (células de división 1:10) y devuelva el nuevo matraz a la incubadora.
NOTA: Antes de transferir al nuevo matraz, pipetee la suspensión celular hacia arriba y hacia abajo varias veces para minimizar los gradientes de concentración celular.
2. Revestimiento de celdas
- Colocar las inserciones de cultivo de tejido con membranas microporosas (tamaño de los poros: 0,4 m, material: tereftalato de polietileno (PET)) en una placa de cultivo de 24 pocillos.
- Añadir 400 l de colágeno tipo I (0,15 mg/ml) en cada inserto de cultivo tisular e incubar durante 1 h en la incubadora de CO2 (37 oC, 5% CO2). Mece suavemente la placa de 24 pocillos para permitir la propagación uniforme de la solución de colágeno sobre la membrana microporosa en las inserciones del cultivo tisular.
- Retire la solución de colágeno y lave suavemente la membrana microporosa con 0,4 ml de 1 pampón PBS 1x.
- Placa hCMEC/D3 células con la densidad de 50.000 celdas/cm2 en las inserciones de celdas (15.000 celdas en 500 l de medio).
NOTA: Para minimizar las diferencias en el número de células en cada inserción de cultivo de tejido, la suspensión celular se resuspendió con una pipeta de 10 ml antes de agregar células a las plaquitas. - Coloque la placa de 24 pocillos con configuración de cultivo de tejidoen una incubadora (37 oC, 5% CO 2) para permitir la unión celular y la proliferación.
- Incubar la placa durante 7 días para permitir que las células alcancen el 100% de confluencia. Retire el medio de crecimiento cada dos días y transfiera 0,5 ml de medios frescos precalentados a inserciones de cultivo de tejidos.
- Repita el procedimiento de chapado (pasos 2.2-2.6) en una placa de 12 pocillos, una placa de 48 pocillos y una placa de 96 pocillos. Utilice la placa de 12 pocillos para la hincha occidental para determinar los cambios en la expresión ZO-1. Utilice la placa de 48 pocillos para la transfección de ADN NP. Utilice la placa de 96 pocillos para el ensayo ATP para determinar la viabilidad celular en las células transinfectadas.
3. Cinética del crecimiento celular.
- Sembrar las células a una densidad de 50.000 células/cm2 en una placa de cultivo de tejido de 24 pocillos recubierta de colágeno.
- En cada día del experimento, retire el medio de crecimiento y lave suavemente las células dos veces con 500 ml de 1x PBS. A continuación, añadir 30 sL de solución de trippsina al 0,25% que contenga 0,02% EDTA y dejarla placa durante unos 2-5 minutos en una incubadora (37 oC, 5% CO 2).
NOTA: La formación gradual de monocapa de confluente puede afectar la extensión del desprendimiento celular y es necesario aumentar los volúmenes de tripsina/EDTA como se indica aquí: 30 l durante 1-5 días después de la sembrada, 60 l para 6-7 días después de la sembrada y 100 l para 8-10 días después de la sembrada . - Añadir 470 sL, 440 o 400 l de medio de crecimiento en función del volumen de solución de trippsina/EDTA añadido en el paso 3.2 para preparar 500 ml de suspensión celular en cada poca.
- Suspenda las células pipetando hacia arriba y hacia abajo en cada pozo varias veces y observe las células bajo un microscopio para asegurarse de que todas las células estén suspendidas en el medio de crecimiento. Si algunas células todavía están unidas a la parte inferior de la placa después de pipetear varias veces, raspe suavemente las células usando un rascador de celda de plástico para facilitar el desprendimiento de celdas.
- Retire 0,1 ml de suspensión celular de la suspensión celular de 500 ml en el paso 3.3 y agréguela a un tubo de 1,5 ml. A continuación, agregue 0,1 ml de solución azul Trypan al 0,4% de solución azul Trypan a la suspensión celular y mezcle bien.
- Limpie un hemachisómetro con un 70% de alcohol isopropílico. Añadir 20 l de mezcla a partir del paso 3.5 a cada lado en la ranura en V y localizar los 16 cuadrados bajo el microscopio. Los 16 cuadrados se consideran como una cuadrícula. Localice dos cuadrículas aleatorias a cada lado del hemacitómetro y cuente todas las celdas vivas y no azules.
NOTA: Las celdas que aparecían de color azul de las excluidas del recuento, <1% de las celdas teñidas de azul en todos los puntos de tiempo. - Calcule la densidad celular (células/cm2) basándose en las siguientes fórmulas.
Promedio de la red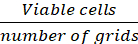 de celdas (Eq.1)
de celdas (Eq.1)
Factor de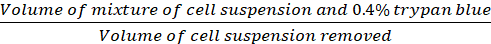 Dilución (Eq.2)
Dilución (Eq.2)
Densidad celular (células viables/cm2)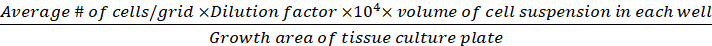
(Eq.3)
Ecuaciones 1-3. Las celdas viables son el número de celdas contadas en cada cuadrícula, el número de cuadrículas corresponde al número de cuadrículas ubicadas bajo el microscopio, Volumen de mezcla de suspensión celular y 0.4% Trypan azul es el volumen preparado en el paso 3.5, el volumen de la suspensión celular eliminada es el volumen eliminado de la suspensión celular de 500 l en el paso 3.5, el volumen de suspensión celular en cada pozo es la suspensión celular de 500 l del paso 3.3, el área de crecimiento de la placa de cultivo tisular es el área de crecimiento de un solo pozo en placa de 24 pocillos.
4. Lucifer amarillo permeabilidad aparente (aplicación LY P ) ensayo
- Para determinar laaplicación LY P en cada día después de la sesión, siga los pasos a partir de 4.3. Para determinar laaplicación P en células transfectóticas de hCMEC/D3, agregue 8,3 l de la formulación de transfección (Figura1) mezclada con 50 ml de medio de crecimiento completo e incubar durante 4 h. Las formulaciones de transfección se describen en la sección 5.
- Después de la transfección de 4 h, lave suavemente el lado apical dos veces usando un tampón estéril de 1x PBS para eliminar cualquier mezcla de transfección residual. Variar los volúmenes de búfer de PBS dejado después de la eliminación puede afectar a la concentración de LY en el lado apical. Tenga cuidado de asegurarse de que el tampón PBS residual en las plaquitas de cultivo de tejido se elimina por completo. Aspirar cuidadosamente reactivos residuales y medios para minimizar el desprendimiento celular.
NOTA: Este paso se omite al medir la permeabilidad aparente diaria(aplicaciónP) de las células hCMEC/D3. - Retirar el medio de crecimiento y añadir 1,5 ml de tampón de transporte precalentado (37 oC) (25 mM HEPES, 145 mM NaCl, 3 mM KCl, 1 mM De CaCl2, 0,5 mM MgCl2, 1 mM NaH2PO4, 5 mM de glucosa, pH 7,4) al lado basolateral.
NOTA: El volumen del búfer de transporte en todos los compartimentos basolaterales debe ser igual para garantizar la precisión del cálculo del coeficiente de permeabilidad. - Añadir 58,3 l de solución LY de 20 m al lado apical de cada plaquita transwell. Ahorre 50 ml de la solución LY de 20 m para mediciones de fluorescencia. Después de eliminar completamente el búfer residual de PBS del lado apical, agregue la solución LY lo más rápido posible para evitar el secado de células hCMEC/D3. Asegurar volúmenes precisos de la solución LY en el lado apical.
NOTA: Para minimizar la descomposición de la intensidad de la fluorescencia LY, la exposición a la luz debe ser limitada. Una vez reconstituido el polvo LY, la solución debe conservarse a 4oC, protegida de la luz. - Incubar en una coctelera rotativa (37oC, 100 rpm) durante 60 min. A continuación, retire 30 s l de la muestra LY de cada compartimiento apical. A continuación, transfiera la solución LY de 20 m y las muestras laterales apicales a tubos preetiquetados y diluya la muestra 10 veces utilizando el búfer de transporte.
NOTA: Es necesario diluir la solución de stock de 20 M LY y las muestras laterales apicales, ya que la alta intensidad de fluorescencia de estas muestras puede sobrecargar y dañar potencialmente el detector de fluorescencia del lector de microplacas de fluorescencia. - Retire 500 ml de cada compartimiento basolateral y transfiera la muestra a tubos preetiquetados.
NOTA: Las muestras se eliminan de transwell separados en los puntos de tiempo indicados. Los puntos de tiempo son cada día después de la sembración desde el día 1 hasta el día 10. - Preparar una serie de estándares LY para la curva estándar (39,00 nM, 78,13 nM, 156,25 nM, 312 nM, 625 nM, 1250 nM, 2500 nM).
- Añadir 100 l de cada muestra estándar (en duplicado), apical y basolateral a cada pocal en una placa negra de 96 pocillos (Figura1).
NOTA: Las placas negras absorben la luz y reducen el fondo y el cruce de fluorescencia entre los pozos. - Utilice un lector de microplacas de fluorescencia (puntos de ajuste: excitación 428 nm, emisión 536 nm) para medir la intensidad de la fluorescencia LY para calcular laaplicaciónP . Para este estudio se utiliza un lector de placas de fluorescencia.
- Calcule los valores de recuperación de laaplicación P y %LY como se describe en el texto del manuscrito.
Ecuación 4. Fórmulas para calcular los valoresde la aplicación P .
Calcule el coeficiente depermeabilidad aparente (aplicación P) y la recuperación %LY utilizando las siguientes ecuaciones. Cabe señalar que los valores de laaplicación P se pueden calcular ya sea sobre la base de la masa25 o la concentración de LY.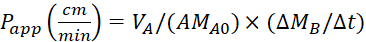 O
O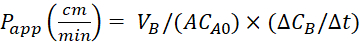
VA - volumen en el compartimiento apical
VB - volumen en el compartimiento basolateral
A - la superficie de la membrana de inserción transwell (0,3 cm2)
MA0 - la masa inicial en el compartimiento apical
•MB/'t - el cambio de masa a lo largo del tiempo en el compartimiento basolateral
CA0 - la concentración inicial en el compartimiento apical
-el cambio de concentración a lo largo del tiempo en el compartimiento basolateral.
Ecuación 5. Fórmulas para calcular la recuperación de % LY.
Recuperación (%) ?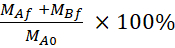
MAf es la masa en el compartimiento apical en el punto de tiempo final, MBf es la masa en el compartimiento basolateral en el punto de tiempo final, MA0 es la masa inicial en el compartimiento apical. 26 Nota: La masa inicial se calcula sobre la base del volumen de la solución LY de 20 M en el paso 4.5. Este experimento siempre se realizó utilizando celdas bajo el pasaje número 35 y se llevó a cabo cuatro veces independientes.
5. Agotamiento del calcio
- Retire el medio de crecimiento de las plaquitas transwell y la placa de 12 pocillos y lave suavemente el lado apical y la placa de 12 pocillos utilizando un medio precalentado libre de calcio (medio Mínimo Esencial Deáguila (S-MEM) para eliminar los iones de calcio de las inserciones transwell y placa de 12 pocillos.
- Añadir 500 o 2 ml de S-MEM 1xmedium precalentado a las plaquitas o placa de 12 pocillos e incubar durante24 h en la incubadora (37oC, 5% CO 2). Después de la incubación, retire el medio S-MEM 1x y lave las células una vez usando 1o tampón PBS precalentado.
- Siga los pasos 4.4-4.10 descritos en la sección 4 para el tratamiento CON LY y los pasos subsiguientes. Siga los pasos 8.1.2-8.2.4 descritos en la sección 8 para la hincha occidental y los pasos subsiguientes.
6. Transfección
- Preparación de nanopartículas de ADN (NPs de ADN).
- Diluir la solución en stock de plásmido gWIZ-Luc en tampón de acetato de sodio de 10 mM (NaAc) (pH 5.0) y permitir que la solución de ADN se pare 10 minutos a temperatura ambiente (RT).
NOTA: El ADN NP que contiene predominantemente moléculas de ADN únicas se puede preparar a concentraciones de ADN 20-40 g/mL23. Por lo tanto, la solución de material de plásmido gWIZ-Luc necesita ser diluida. El material de plásmido gWIZ-Luc congelado debe descongelarse completamente sobre hielo para minimizar el estrés de temperatura. Vórtice suavemente la solución de stock de ADN diluido durante 30 s en un vórtice de sobremesa estándar en la posición de la perilla 3-5. - Calcule las relaciones N/P deseadas, utilizadas aquí como parámetro numérico para reflejar la composición NP.

Ecuación 6. Cálculo de la relación N/P: la proporción de lunares de los grupos de aminas de polímeros catiónicos con los de los grupos fosfatos de ADN. Masa de polímeros catiónicos significa cantidad total pesada de polímero catiónico; (Masa/Carga) Los polímeros catiónicos se refieren al peso molecular del polímero catiónico (poli (etilenglicol)5k-bloque-poliaspartamida con 48 cadenas laterales de dietileniamina (PEG-DET)) normalizadas al número de aminas primarias cargadas (48) por polímero catiónico ( mol/mol), este valor para nuestro polímero es 306 Da; Masa de ADN significa la cantidad total de ADN utilizado en la formulación obtenida multiplicando el volumen y la concentración en mg/ml; (Masa/Carga) El ADN se refiere al peso molecular del ADN normalizado al número de grupos de fosfato por ADN de doble cadena (325 Da por nucleobase).
NOTA: La tabla de preparación DNA NP (Tabla1) contiene la receta de formulación para las diferentes muestras analizadas en nuestros experimentos. DNA NP se prepararon utilizando una técnica de valoración rápida. La solución de polímero PEG-DET se añadió a lo largo de las paredes del tubo mientras sujetaba el tubo en posición horizontal. A continuación, el tubo se cambió a una posición vertical, seguido de vórtice rápidamente a la velocidad máxima durante 10s. A los ADN NP se les permitió permanecer de pie durante 30 minutos a RT antes de su uso. La regla general para la dosificación de ADN NP es de 0,5 g de ADN para un área de crecimiento de aprox. 1 cm 2. Por lo tanto, para cada inserto transwell/cada pozo en una placa de 48 pocillos/cada pocal en una placa de 96 pocillos, prepare DNA NP en N/P 10 que contenga 0.157/0.5/0.195 g/pozo de ADN gWIZ-Luc. - Para muestras que contengan la concentración indicada de Poloxámero P84 (P84), agregue P84 al ADN NP y al vórtice durante 5 s. La concentración final de P84 en cada muestra es 0,01% o 0,03% en el wt.
- Diluir la solución en stock de plásmido gWIZ-Luc en tampón de acetato de sodio de 10 mM (NaAc) (pH 5.0) y permitir que la solución de ADN se pare 10 minutos a temperatura ambiente (RT).
- Transfección de ADN NP en una configuración de placa de 48 pocillos
- Sembrar las células con una densidad de 50.000 células/cm2 en una placa de 48 pocillos y crecer hasta la confluencia en la incubadora (37oC, 5% CO2).
- Para cada grupo de tratamiento, mezcle 25 ml de la muestra indicada (formulación de transfección) y 150 ml de medio de crecimiento completo y 175 ml de esta mezcla a cada pocato.
- Observe las células hCMEC/D3 bajo un microscopio para asegurarse de que las células aparecen sanas y son 100% confluentes en el momento del experimento.
- Retire el medio de crecimiento de los pocillos y la mezcla de transfección de 175 ml a cada poca. A continuación, incubar la placa durante 4 h en la incubadora (37 oC, 5% CO2).
- Después de 4 h, retire la mezcla de transfección y lave las células hCMEC/D3 con un búfer de PBS estéril 1x precalentado.
NOTA: Para minimizar el desprendimiento accidental de células hCMEC/D3 de la superficie de la placa/inserción durante los pasos de lavado, pipetee cuidadosamente suficiente PBS estéril a lo largo de las paredes de los pocillos y retire cualquier nanopartícula en los medios de cultivo residuales. - Mezcle suavemente la placa unas cuantas veces y aspire cuidadosamente y deseche el lavado PBS y agregue 500 ml de medio de cultivo precalentado hCMEC/D3.
- Examinar microscópicamente las células y registrar observaciones sobre la morfología celular y los posibles efectos de la transfección.
- Incubar durante 24 h en la incubadora de cultivo celular de 37oC para permitir la producción de luciferasa. Después de 24 h, retire el medio de crecimiento por completo y lave las células una vez con 1x PBS precalentado.
- Lijar las células transinfectadas mediante la adición de 100 l de hielo-frío luciferasa cultivo celular lisis 1x reactivo por pozo.
- Para la medición del contenido de proteína luciferasa, añadir 20 ml de lisato celular y 100 l de tampón de ensayo de luciferasa (20 mM de glicilglicina (pH 8), 1 mM MgCl2, 0,1 mM EDTA, 3,5 mM de TDT, 0,5 mM de ATP, 0,27 mM de coenzima A) en un tubo de 1,5 mM.
- Lea la luminiscencia de la muestra descrita en el paso 6.2.10 de un luminómetro con un solo autoinyector.
NOTA: La luminiscencia debe integrarse durante 10 s antes de leer. - Mida la cantidad total de proteína celular en el lisado utilizando un kit de ensayo de ácido bicincino (ensayo BCA) siguiendo el protocolo del fabricante.
- Calcular y expresar la expresión génica luciferasa como Unidades de Luz Relativa (RLU) por proteína celular total.
7. Ensayo luminiscente de ATP
- Sembrar las células con una densidad de 50.000 células/cm2 en una placa de 96 pocillos y crecer hasta la confluencia en la incubadora (37oC, 5% CO2).
- Transfectar las células con 9,7 ml de la formulación de transfección (los detalles de preparación están en la sección 6) y 58,4 l de medio de crecimiento completo durante 4 h.
- Retire la mezcla de transfección y lave suavemente las células con un tampón PBS 1x precalentado dos veces para eliminar los reactivos de tratamiento por completo.
NOTA: Diferentes volúmenes de búfer residual podrían diluir los reactivos de ensayo ATP en diferente medida y pueden afectar potencialmente a los datos. - Mezclar 75 ml de medio precalentado fresco y reactivo de ensayo ATP en una dilución 1:1 utilizando una pipeta multicanal. Asegúrese de que el nivel de líquido en todas las puntas de pipeta multicanal es el mismo.
- Coloque el plato en una coctelera nutating durante 15 minutos a temperatura ambiente. Después de 15 minutos de adición de los reactivos, transfiera 60 ml de cada muestra a una placa blanca de 96 pocillos.
NOTA: Las placas blancas son mejores para reflejar la luz de salida que las placas claras o negras. - Haga estallar cualquier burbuja de aire usando una aguja antes de leer la placa. Lea la placa en un luminómetro con un tiempo de integración de 1 s. Lea la placa dentro de 20 minutos después de añadir los reactivos de ensayo ATP. El tiempo es crítico para la comparación entre diferentes placas, porque la señal de luminiscencia es transitoria con una tasa de decaimiento rápida.
- Calcular el porcentaje (%) viabilidad celular utilizando esta fórmula: (luminiscencia de células transfectól/luminiscencia de control, células no tratadas) x 100.
8. Hincha occidental para la medición de la proteína de unión apretada ZO-1
-
Lisis celular y extracción de proteínas
NOTA: Todos los pasos para la extracción de proteínas de las células deben llevarse a cabo a 2-8 oC.- Sembrar las células a una densidad de 50.000 células/cm2 en una placa de cultivo de tejido de 12 pocillos recubierta de colágeno.
- El día 3, día 5, día 7, día 10 después de la sembración y el día 7 (células preincubadas con medio libre de calcio), retire el medio de crecimiento y lave suavemente las células dos veces con 2 ml de hielo-frío 1x PBS. A continuación, añadir una mezcla de 300 ol de tampón de lisis RIPA 1o frío en hielo que contenga 3 g/ml de aprotintina en cada pocil.
NOTA: La mezcla debe estar recién hecha y mantenida sobre hielo. La aprotinina se utiliza para inhibir las proteasas presentes en los lysatos de degradar la proteína de interés. - Después de dos ciclos de congelación y descongelación (-80 oC), raspar las células con un rascador de células de plástico frío. Recoger los lysates celulares en tubos de microfúcya. A continuación, centrifugar los tubos a 200 x g durante 30 min a 4 oC.
- Recoger el sobrenadante en tubos limpios y colocarlos en hielo. Mida la cantidad total de proteína celular en los lysates utilizando el kit de ensayo BCA siguiendo el protocolo del fabricante.
-
Hincha occidental para la detección de proteína de unión estrecha ZO-1
- Alícuotas de desnaturalidad de homogeneizados totales que contienen 40 g de proteína total con 1 tampón Laemmli a 95oC, 5 min y sujeto a electroforesis en un gel de dodecilo sulfato sódico reductor de 6-7.5% que contienen 1xtam (SDS-PAGE) (90 V, 10 min a través de gel de apilado, 120 V a través de gel de apilamiento, 120 V a través de geles de resolución).
NOTA: Al cargar las muestras o estándares, recuerde cargar lentamente y cuidadosamente en cada carril, teniendo cuidado de no romper el pozo en el proceso. - Transfiera las proteínas separadas a una membrana de nitrocelulosa con tampón de transferencia pH 8,5 que contiene 192 mM de glicina, 25 mM Tris Base, 10% de metanol y 0,1% de SDS (75 V, 110 min a temperatura ambiente).
NOTA: No toque la membrana. Utilice 70% fórceps de plástico lavados con isopropanol para manejar la membrana. Con el fin de transferir con éxito la proteína ZO-1 (MW 200 kDa) a la membrana, el pH debe ser alrededor de 8.3-8.5. Si el búfer de transferencia es más ácido que eso, la transferencia no ocurriría. Si las bandas de la escalera son visibles todavía en el gel, sería útil aumentar el tiempo de transferencia y la concentración de SDS. - Después de lavar la membrana utilizando solución salina tamponada De Tris que contiene 0.1%Tween 20 (T-TBS), utilice la solución de bloqueo (1:1 LiCOR-Odyssey Block: 1x Tris salina tamponada) para bloquear las membranas durante 60 min.
- Corte cuidadosamente la membrana en dos tiras. Incubar con dos anticuerpos primarios (anticuerpo monoclonal ZO-1, dilución, 1: 900 y anticuerpo silceraldehído 3-fosfato deshidrogenasa (GAPDH), dilución, 1: 10.000) durante la noche a 4oC. A continuación, incubar las membranas ZO-1 y GAPDH con burro anti-ratón IgG (dilución, 1:50,000). Después de lavar las membranas usando T-TBS, imagine las membranas en el canal 700 en un imager de 16 bits.
- Alícuotas de desnaturalidad de homogeneizados totales que contienen 40 g de proteína total con 1 tampón Laemmli a 95oC, 5 min y sujeto a electroforesis en un gel de dodecilo sulfato sódico reductor de 6-7.5% que contienen 1xtam (SDS-PAGE) (90 V, 10 min a través de gel de apilado, 120 V a través de gel de apilamiento, 120 V a través de geles de resolución).
Resultados
En primer lugar, determinamos el efecto del tiempo de cultivo en la permeabilidad LY para determinar la cinética aparente de la formación de TJ. Los valores medios de laaplicación LY P del día 1 a 10 post de la sesión se muestran en la Figura 2a. En el día 1, laaplicación P media era de 4,25 x 10-4 cm/min y cayó ligeramente a 3,32 x 10-4 cm/min el día 2. El valor medio de laaplicación P aumentó...
Discusión
Un papel clave del BBB es prevenir el intercambio de iones no esenciales y sustancias tóxicas entre la circulación sistémica y el cerebro para mantener la hemostasis del microambiente neural. Una de las características características del BBB es la capacidad de las células endoteliales capilares para formar uniones estrechas (TJ) que sellan eficazmente la ruta paracelular de transporte. Demostramos un ensayo deaplicación LY P como un método cuantitativo para determinar la cinética aparente de la forma...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores están agradecidos por el apoyo financiero del Premio Nuevo Investigador 2017 de la Asociación Americana de Farmacia, un premio Hunkele Dreaded Disease de la Universidad Duquesne y la Escuela de Fondos de Inicio de Farmacia para el laboratorio Manickam. Nos gustaría agradecer al laboratorio Leak (Universidad de Duquesne) por la asistencia de la hincha occidental y la autorización del uso de su imagen de 16 bits de Odyssey. También nos gustaría incluir una nota especial de agradecimiento para Kandarp Dave (laboratorio Manickam) para obtener ayuda con la hincha occidental.
Materiales
| Name | Company | Catalog Number | Comments |
| hCMEC/D3 cell line | Cedarlane Laboratories | 102114.3C-P25 | human cerebral microvascular endothelial cell line |
| gWizLuc | Aldevron | 5000-5001 | Plasmid DNA encoding luciferase gene |
| lucifer yellow CH dilithium salt | Invitrogen | 155267 | |
| Transwell inserts with polyethylene terephthalate (PET) track-etched membranes | Falcon | 353095 | |
| Tissue culture flask | Olympus Plastics | 25-207 | |
| 24-well Flat Bottom | Olympus Plastics | 25-107 | |
| Black 96-Well Immuno Plates | Thermo Scientific | 437111 | |
| S-MEM 1X | Gibco | 1951695 | Spinner-minimum essential medium (S-MEM) |
| EBM-2 | Clonetics | CC-3156 | Endothelial cell basal medium-2(EBM-2) |
| phosphate-buffered saline 1X | HyClone | SH3025601 | |
| Collagen Type I | Discovery Labware, Inc. | 354236 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | |
| Cell Culture Lysis 5X Reagent | Promega | E1531 | |
| Beetle Luciferin, Potassium Salt | Promega | E1601 | |
| SpectraMax i3 | Molecular Devices | Fluorescence Plate Reader | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| ZO-1 Polyclonal Antibody | ThermoFisher | 61-7300 | |
| anti-GAPDH antibody | abcam | ab8245 | |
| Alexa Fluor680-conjugated AffiniPure Donkey Anti-Mouse LgG(H+L) | Jackson ImmunoResearch Inc | 128817 | |
| 12-well, Flat Bottom | Olympus Plastics | 25-106 | |
| RIPA buffer (5X) | Alfa Aesar | J62524 | |
| Aprotinin | Fisher BioReagents | BP2503-10 | |
| Odyssey CLx imager | LI-COR Biosciences | for scanning western blot membranes |
Referencias
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology Of Disease. 37 (1), 13-25 (2010).
- Griep, L. M., et al. BBB on chip: microfluidic platform to mechanically and biochemically modulate blood-brain barrier function. Biomedical Microdevices. 15 (1), 145-150 (2013).
- Camos, S., Mallolas, J. Experimental models for assaying microvascular endothelial cell pathophysiology in stroke. Molecules. 15 (12), 9104-9134 (2010).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow & Metabolism. 28 (2), 312-328 (2008).
- Wolff, A., Antfolk, M., Brodin, B., Tenje, M. In vitro Blood-Brain Barrier Models-An Overview of Established Models and New Microfluidic Approaches. Journal of Pharmaceutical Sciences. 104 (9), 2727-2746 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmaceutics. 10 (1), 289-296 (2013).
- Tornabene, E., Brodin, B. Stroke and Drug Delivery--In vitro Models of the Ischemic Blood-Brain Barrier. Journal of Pharmaceutical Sciences. 105 (2), 398-405 (2016).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Llombart, V., et al. Characterization of secretomes from a human blood brain barrier endothelial cells in-vitro model after ischemia by stable isotope labeling with aminoacids in cell culture (SILAC). Journal of Proteomics. 133, 100-112 (2016).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- Avdeef, A. How well can in vitro brain microcapillary endothelial cell models predict rodent in vivo blood-brain barrier permeability?. European Journal of Pharmaceutical Sciences. 43 (3), 109-124 (2011).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Shao, X., et al. Development of a blood-brain barrier model in a membrane-based microchip for characterization of drug permeability and cytotoxicity for drug screening. Analytica Chimica Acta. 934, 186-193 (2016).
- Walter, F. R., et al. A versatile lab-on-a-chip tool for modeling biological barriers. Sensors and Actuators B: Chemical. 222, 1209-1219 (2016).
- Cecchelli, R., et al. In vitro model for evaluating drug transport across the blood–brain barrier. Advanced Drug Delivery Reviews. 36, (1999).
- Cecchelli, R., et al. Modelling of the blood–brain barrier in drug discovery and development. Nature reviews Drug discovery. 6 (8), 650 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. . The Blood-Brain Barrier. , 307-324 (2003).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability Studies on In vitro Blood–Brain Barrier Models: Physiology, Pathology, and Pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Ren, T. B., et al. A General Method To Increase Stokes Shift by Introducing Alternating Vibronic Structures. Journal of the American Chemical Society. 140 (24), 7716-7722 (2018).
- Pack, D. W., Hoffman, A. S., Pun, S., Stayton, P. S. Design and development of polymers for gene delivery. Nature Reviews Drug Discovery. 4 (7), 581-593 (2005).
- Oupický, D., Konák, C., Ulbrich, K., Wolfert, M. A., Seymour, L. W. DNA delivery systems based on complexes of DNA with synthetic polycations and their copolymers. Journal of Controlled Release. 65, (2000).
- Couraud, P. O. . The hCMEC/D3 CELL LINE: IMMORTALIZED HUMAN CEREBRAL MICROVASCULAR ENDOTHELIAL CELLS As a model of human Blood-Brain Barrier. , (2012).
- Youdim, K. u. r. e. s. h. A., A, A. A. a. N. J. In vitro trans-monolayer permeability calculations: often forgotten assumptions. research focus reviews. 8, (2003).
- Eigenmann, D. E., Xue, G., Kim, K. S., Moses, A. V., Hamburger, M., Oufir, M. Comparative study of four immortalized human brain capillary endothelial cell lines, hCMEC/D3, hBMEC, TY10, and BB19, and optimization of culture conditions, for an in vitro blood-brain barrier model for drug permeability studies. Fluid and Barriers of the CNS. 10 (33), (2013).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Balda, M. S., Anderson, J. M. Two classes of tight junctions are revealed by ZO-1 isoforms. The American Physiological Society. , (1992).
- Brown, R. C., Davis, T. P. Calcium Modulation of Adherens and Tight Junction Function: A Potential Mechanism for Blood-Brain Barrier Disruption After Stroke. Stroke. 33 (6), 1706-1711 (2002).
- Gorodeski, G., Jin, W., Hopfer, U. Extracellular Ca2+ directly regulates tight junctional permeability in the human cervical cell line CaSki. American Journal of Physiology-Cell Physiology. 272 (2), C511-C524 (1997).
- Stuart, R. O., Sun, A., Panichas, M., Hebert, S. C., Brenner, B. M., Nigam, S. K. Critical Role for lntracellular Calcium in Tight Junction Biogenesis. Journal of Cellular Physiology. 159, (1994).
- Tobey, N. A. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. , (2004).
- Tobey, N. A., Argote, C. M., Hosseini, S. S., Orlando, R. C. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. 286, (2004).
- Posimo, J. M., et al. Viability assays for cells in culture. Journal of visualized experiments : JoVE. (83), e50645 (2014).
- Cipolla, M. J., Crete, R., Vitullo, L., Rix, R. D. Transcellular transport as a mechanism of blood-brain barrier disruption during stroke. Frontiers in Bioscience. 9 (3), 777-785 (2004).
- Kreuter, J. Influence of the surface properties on nanoparticle-mediated transport of drugs to the brain. Journal of nanoscience and nanotechnology. 4 (5), 484-488 (2004).
- Markoutsa, E., et al. Uptake and permeability studies of BBB-targeting immunoliposomes using the hCMEC/D3 cell line. European Journal of Pharmaceutics and Biopharmaceutics. 77 (2), 265-274 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados