Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Люцифер желтый - Надежный параклеточной проницаемости маркер а в клеточной модели человеческого кровяного мозга барьер
В этой статье
Резюме
Мы представляем флуоресценции анализ, чтобы продемонстрировать, что Люцифер желтый (LY) является надежным маркером для определения очевидной параклеточной проницаемости hCMEC /D3 клеточных монослоев, в пробирке модель человеческого гематоэнцефалического барьера. Мы использовали этот ацензию для определения кинетики сольственного монослойного образования в культурных клетках hCMEC/D3.
Аннотация
Гематоэнцефалический барьер BBB состоит из эндотелиальных клеток, которые образуют барьер между системной циркуляции и мозга, чтобы предотвратить обмен несущественных ионов и токсичных веществ. Плотные соединения (TJ) эффективно уплотнять параклеточное пространство в монослойных в результате чего нетронутыми барьер. Это исследование описывает LY основе флуоресценции ассс, который может быть использован для определения его очевидного коэффициента проницаемости (Pприложение) и, в свою очередь, может быть использован для определения кинетики формирования слияния монослойных и в результате жесткой связи барьерцелостноста в монослойах hCMEC/D3. Мы также демонстрируем дополнительную полезность этого исследования для определения функциональной целостности TJ в трансинфицированных клетках. Наши данные из LY Pприложение анализа показывает, что hCMEC /D3 клетки, посеянные в трансвелл установки эффективно ограничить LY параклеточного транспорта 7 дней после культуры. В качестве дополнительной полезности представленного анализа мы также демонстрируем, что трансфекция наночастиц ДНК не изменяет пароклеточный перенос LY в монослойах hCMEC/D3.
Введение
Барьер крови-мозг (BBB) защитный барьер ограничивая приток компонентов плазмы в ткань мозга и состоит из эндотелиальных клеток мозга наряду с поддерживающими клетками, такими как перициты. Основная роль BBB заключается в том, чтобы служить в качестве барьера, который уплотняет пространство между периферической крови и центральной нервной системы (ЦНС) для поддержания гемостаза нервной микросреды1,2. Капиллярные эндотелиальные клетки мозга эффективно уплотняют параклеточный путь через образование межклеточных узких узлов (TJs)1. Этот защитный барьер позволяет глюкозе и выбранным питательным веществам проникать в мозг, в то время как он предотвращает прохождение через этот жесткий барьер большинство ионов, токсичных веществ и лекарств. Помимо своей защитной роли, функция естественного барьера BBB представляет собой серьезную проблему в разработке систем доставки лекарств, ориентированных на ЦНС.
Модели культуры клеток In vitro BBB являются полезными инструментами для изучения его биологии и понимания влияния лечения наркотиками на целостность Барьера TJ. Мы использовали микрососудистую эндотелиальную линию мозга человека (hCMEC/D3) в качестве модели in vitro, так как она является общепринятой моделью эндотелия мозга человека3 и резюмирует многие функции человеческого BBB. hCMEC/D3is один из наиболее часто используемых клеточныхлиний для моделирования BBB in vitro 4,5,6,7,8. Несмотря на свои сравнительно низкие значения трансэндотелиального электрического сопротивления (TEER), мера герметичности барьера, эта линия клетки сохраняет большую часть морфологических и функциональных свойств эндотелиальных клеток мозга, даже как монокультура при отсутствии cocultured глиальных клеток6,7. Линия клеток hCMEC/D3 выражает несколько маркеров BBB, включая активные транспортеры и рецепторы до приблизительно прохождения 35 без прохождения дедифференцирования к нестабильным фенотипам6,7,9 ,10,11. Наиболее поразительной характеристикой линии клеток hCMEC/D3 в качестве моделиin vitro BBB является ее способность формировать TJs 5,9,11,12. Следует отметить, что, хотя стволовые клетки полученных bBB модели показали более высокую проницаемость во многих исследованиях по сравнению с hCMEC / D3 клеточной линии, и они выражают некоторые маркеры BBB, они еще не развиваться как наиболее распространенные модели BBB ячейки13. Важно отметить, что стволовые клетки, полученные bBB модели по-прежнему характеризуются по отношению к максимальным числам прохода, которые позволяют клеткам поддерживать стабильные фенотипы BBB14.
Три основных метода обычно используются для определения целостности барьера TJ, включая измерение TEER, измерение коэффициента проницаемости (Papp) малых гидрофильных молекул трассировщика, таких как сахароза, инулин, Люцифер желтый, и т.д. и иммуно-пятно известных молекулярных маркеров TJs, таких как claudin-5, ЗО-1, окклудин и т.д.5. TEER является относительно простым и количественным методом, который измеряет электрическое сопротивление черезмонослои клеток, культивированные на пористых мембранных субстратах 5. Однако значения TEER могут зависеть от экспериментальных переменных, таких как состав культуры и тип измерительного прибора. Вероятное сочетание этих факторов приводит к широкому распределению значений TEER в диапазоне от 2 до 1150 см2 в линии клеток hCMEC/D3, культивируется в течение 2-21 дней13. Immunostaining является визуальным методом, чтобы определить наличие TJ белков путем маркировки целевого белка с использованием антител. Тем не менее, иммуностоирование включает в себя ряд экспериментальных шагов, в том числе необходимость исправить / пермяки клеток, которые могут привести к экспериментальным артефактов и флуоресцентные сигналы могут исчезать с течением времени. Вышеуказанные факторы могут привести к субъективным ошибкам, влияющим на качество данных.
Основное внимание в этой работе заключается в представлении LY основе очевидной проницаемости ассссопределить определить кинетику созидательного монослой образования в культивированных hCMEC / D3 клеток. Хотя другие передовые системы in vitro BBB, такие как системы совместной культуры, микрофлюидные системы, физиологически более актуальны, с значительно улучшенной барьерной функцией15,16,17, hCMEC/D3 Трансвелл установка является простой и надежной моделью для оценки кинетики формирования TJ и быстро экранировать влияние различных препаратов на барьерфункции. В целом значенияP-приложений согласуются для различных гидрофильных растворов в монослойах hCMEC/D3. Например, заявленные значенияp-приложений для различных низкомолекулярных масс solutes (таких как сахароза, маннитол, LY и т.д.) в различных моделях in vitro BBB находятся в порядке 10-4 см/мин5,18,19 , 20. В нашей экспериментальной установки, мозг эндотелиальных клеток посеяны на коллагена покрытием микропористые мембраны для клеточной привязанности и монослой образования, чтобы имитировать барьер in vivo. LY добавил в апической стороне, как ожидается, пройти межклеточные узкие соединения и накапливаются в базолатеральной стороне. Более высокие концентрации LY в базолатеральной стороне указывают на незрелый, не полностью функциональный барьер, в то время как более низкие концентрации отражают ограниченный транспорт из-за наличия функциональных TJ, что приводит к зрелому барьеру.
LY является гидрофильной краситель с различными возбуждения / выбросы пиков и позволяет избежать необходимости радиомаркировки трассировщик молекул, таких как сахароза, маннитол или инулин. Таким образом, значения флуоресценции LY могут быть использованы для непосредственного расчета его параклеточной проницаемости через монослои BBB. Кроме того, по сравнению со многими коммерчески доступные красители, используемые в биомедицинских областях, которые страдают от небольших сдвигов Стокса, таких как флуоресцеин21, Стокс сдвиг LY составляет около 108 нм с достаточным спектральным разделением, что позволяет LY флуоресценции данных, как надежный считывание для определения параклеточной проницаемости. Мы использовали западные blotting как orthogonal метод для того чтобы продемонстрировать изменения в выражении плотного протеина маркера соединения, no zo-1, над временем культуры. Выражение ЗО-1, обнаруженное с помощью западного блоттинга, используется для дополнения данныхприложения LY P и в сочетании эти данные позволяют предположить, что наблюдаемые изменения в значенияхприложения LY P отражают образование монослой с постепенным увеличением выражение плотного маркера соединения, ЗО-1.
Как указывалось ранее, в центре внимания этой работы является демонстрация LY анализ как простой метод для мониторинга формирования слияния монослой с функциональными плотными соединениями. Однако, чтобы продемонстрировать дополнительную полезность разработанного анализа, мы измерилиприложение LY P в наночастицах ДНК-трансфицированных монослойах hCMEC/D3. Нуклеиновые кислоты могут быть конденсированы в полиэлектролитные наночастицы диаметром 100-200 нм с помощью электростатического взаимодействия между положительно заряженными группами полимеров и отрицательно заряженными фосфатными группами нуклеиновых кислот22, 23. Мы ссылаемся на эти комплексы как наночастицы ДНК (ДНК NPs) в нашей работе. Хотя наше намерение состоит в том, чтобы трансфектировать клетки и выразить желаемый белок, мы должны обеспечить, чтобы барьерные свойства монослойов hCMEC/D3 не были скомпрометированы. Наши данные свидетельствуют о том, что стандартный режим трансфекции генов 4 h luciferase не измеримо изменяет проницаемость LY, демонстрирующую полезностьанализа приложения LY P для определения изменений в целостности барьерного барьера TJ.
протокол
1.Общая культура клеток hCMEC/D3
- Реанимация замороженных клеток
ПРИМЕЧАНИЕ: Все поддержания культуры клеток и эксперименты были проведены внутри стерильного капюшона биобезопасности. Культурные носители, добавки и реагенты были приобретены в качестве стерильных продуктов или стерилизованы с помощью фильтрации с помощью мембранного фильтра 0,22 мкм для предотвращения микробного загрязнения.- Добавьте 8,5 мл коллагенового раствора (0,15 мг/мл) в колбу культуры тканей (75 см2 области роста; отныне называют T75) и поместите его в инкубатор (37 градусов по Цельсию, 5% CO2)на 1 ч.
- Удалить раствор коллагена и осторожно промыть колбу стерилизованной фосфат-буферной солей (PBS). Добавьте 15 мл полной среды роста в колбу и оставьте в инкубаторе CO2 на 15 минут.
ПРИМЕЧАНИЕ: Полная среда (окончательная концентрация) содержала эндотелиальный рост клеток Базальный Средний-2 (500 мл) дополненный сывороткой крупного рогатого скота плода (5%), пенициллин-стрептомицин (1%), гидрокортизон (1,4 м/м), кислота аскорбиновая (5 мкг/мл), химически определенный липид концентрата (1/100), HEPES (10 мМ) и основной фактор роста фибробластов (1 нг/мл). - Переместите кривиальный из замороженных клеток hCMEC/D3 из резервуара с жидким азотом и быстро разморозьте флакон в водяной бане 37 градусов по Цельсию (1 мин).
- После того, как только крошечный хлопья льда виден, быстро аспирировать и передать клетки в колбу, содержащую предварительно подогревом среды. Аккуратно встряхните колбу, чтобы позволить смешиванию клеток со средой роста.
- Поместите колбу в инкубатор (37 градусовпо Цельсию, 5% CO 2) и наблюдать за клетками под легким микроскопом через 2 ч, чтобы убедиться, что клетки прикреплены.
- После того, как клетки прикрепляются к нижней части колбы, удалить старый рост среды и добавить 10 мл свежего предварительно подогретого роста среды для замены диметилсульфоксида в старом среде роста24.
- После 24 ч проверьте под легким микроскопом, чтобы наблюдать шпиндель-образные клетки и заменить старую среду роста с предварительно разогретой свежей средой роста.
- Обслуживание культуры ячеек
- Пополнить среды роста через день до 100% слияния. Проверьте клетки под микроскопом, прежде чем удалить старую среду роста, а также после добавления свежей среды роста. Выняйте колбу из инкубатора и исследуете клетки hCMEC/D3 под фазовым контрастным микроскопом, чтобы убедиться, что они выглядят здоровыми.
ПРИМЕЧАНИЕ: Большинство клеток должны быть прикреплены к нижней части колбы, имеют шпиндель-образной морфологии и часто раз, свет преломляется вокруг их мембран также видел. Среда роста должна быть прозрачной (необлачной) и розовато-оранжевого цвета. - Удалите старую среду роста из колбы и перенесите 10 мл предварительно подогретой свежей среды в колбу.
ПРИМЕЧАНИЕ: Среда должна быть добавлена к верхней стороне колбы, а не непосредственно на поверхности клеток, чтобы избежать влияния на вложение клеток. - Включите колбу обратно в горизонтальное положение и осторожно рок несколько раз и проверить hCMEC / D3 клеток под микроскопом, прежде чем вернуть колбу в инкубатор (37 КК, 5% CO2).
- Наблюдайте за клетками под перевернутым световым микроскопом каждый раз до и после обработки клеток, как во время обычной культуры работы, так и во время экспериментов. Запись любых заметных изменений в количестве клеток или морфологии в лабораторной тетрадь.
- Пополнить среды роста через день до 100% слияния. Проверьте клетки под микроскопом, прежде чем удалить старую среду роста, а также после добавления свежей среды роста. Выняйте колбу из инкубатора и исследуете клетки hCMEC/D3 под фазовым контрастным микроскопом, чтобы убедиться, что они выглядят здоровыми.
- Пропуск ячеек
- Инкубировать новую колбу T75 с 8,5 мл коллагенового раствора на 1 ч винкубаторе (37 градусов по Цельсию, 5% CO 2).
- Удалить раствор коллагена и осторожно мыть колбу со стерилизованные PBS. Добавьте 10 мл предварительно разогретого hCMEC/D3 среды к новой колбе и поместите колбу в инкубатор (37 градусов по Цельсию, 5% CO2).
- Выняйте колбу из инкубатора и исследуете клетки hCMEC/D3 под фазовым контрастным микроскопом, чтобы проверить, являются ли клетки 100% сливочные.
- Удалить hCMEC/D3 клеточной среды из колбы, содержащей клетки и мыть hCMEC/D3 клеток с 10 мл PBS.
ПРИМЕЧАНИЕ: FBS добавил к среде роста содержит ингибиторы протеазы, такие как 1-антитрипсин и No2-макроглобулин. Они препятствуют процессу трипсинизации. Таким образом, важно мыть клетки с PBS, чтобы удалить следы FBS, чтобы предотвратить ингибирование процесса трипсизации. - Добавьте 1 мл 0,25% трипсина, содержащего 0,02% ЭДТА, и протрите в течение 2-5 мин в инкубаторе (37 градусов по Цельсию, 5% CO2) (нажмите колбу мягко по бокам, чтобы помочь отслоение).
ПРИМЕЧАНИЕ: Никогда не оставляйте клетки на трипсин / EDTA в течение более 6 мин. - Добавьте 10 мл предварительно разогретого hCMEC/D3 среды, чтобы остановить процесс трипсиизации и повторно приостановить hCMEC/D3 ячейки трубачи вверх и вниз несколько раз. Затем снимите всю клеточную подвеску с колбы в трубку объемом 15 мл.
- Перенесите 1 мл клеточной подвески из трубки 15 мл в новую колбу с предварительно подогретой свежей средой (расщепление клеток 1:10) и верните новую колбу обратно в инкубатор.
ПРИМЕЧАНИЕ: Перед передачей в новую колбу, пипетка подвески ячейки вверх и вниз несколько раз, чтобы свести к минимуму градиенты концентрации клеток.
2. Клеточное покрытие
- Поместите ткани культуры вставки с микропористыми мембранами (размер пор: 0,4 мкм, материал: полиэтилен терефталат (ПЭТ)) в 24-хорошо культуры пластины.
- Добавьте 400 л коллагена i типа I (0,15 мг/мл) в каждую вставку культуры тканей и инкубировать на 1 ч в инкубатор CO2 (37 градусов по Цельсию, 5% CO2). Рок 24-хорошо пластины мягко, чтобы даже распространение коллагена раствора по микропористым мембраны в ткани культуры вставки.
- Удалите коллагеновый раствор и аккуратно промойте микропористую мембрану 0,4 мл 1x буфера PBS.
- Плита hCMEC/D3 клетки с плотностью 50000 клеток / см2 в клетке вставки (15000 клеток в 500 л среднего).
ПРИМЕЧАНИЕ: Для того, чтобы свести к минимуму различия в количестве клеток в каждой вставке культуры ткани, клеточная подвеска была перенакрыта с помощью 10 мл пипетки перед добавлением клеток в вставки. - Поместите 24-колодую пластину с установкой культуры тканей в инкубатор (37 градусов по Цельсию, 5% CO2),чтобы позволить клеточному креплению и пролиферации.
- Инкубировать пластину в течение 7 дней, чтобы клетки достигли 100% сплава. Удалите среду роста через день и перенесите 0,5 мл предварительно разогретых свежих носителей в вставки культуры тканей.
- Повторите процедуру покрытия (шаги 2.2-2.6) на 12-хорошей пластине, 48-хорошей пластине и 96-хорошей пластине. Используйте 12-колодую пластину для западного промотирования, чтобы определить изменения в экспрессии ЗО-1. Используйте 48-колодую пластину для трансфекции ДНК NP. Используйте 96-ну хорошую пластину для атсии, чтобы определить жизнеспособность клеток в трансинфицированных клетках.
3. Кинетика клеточного роста.
- Семена клеток при плотности 50000 клеток / см2 в коллагена покрытием 24-ну хорошо ткани культуры пластины.
- На каждый день эксперимента, удалить среды роста и осторожно мыть клетки дважды с 500 зл и 1x PBS. Затем добавьте 30 кл 0,25% раствор атрипсина, содержащий 0,02% ЭДТА, и оставьте тарелку примерно на 2-5 мин в инкубаторе (37 градусов по Цельсию, 5% CO2).
ПРИМЕЧАНИЕ: Постепенное образование сопливого монослой может повлиять на степень отслоения клеток и необходимо увеличить объемы трипсина/ЭДТА, как указано здесь: 30 Л в течение 1-5 дней после посева, 60 Л в течение 6-7 дней после посева и 100 Л в течение 8-10 дней после посева . - Добавьте либо 470 qL, 440 qL или 400 л среды роста на основе объема трипсина / EDTA решение, добавленное в шаге 3.2 для подготовки 500 л клеточной суспензии в каждой скважине.
- Приостановить клетки пиптинг вверх и вниз в каждом колодце несколько раз и наблюдать клетки под микроскопом, чтобы убедиться, что все клетки приостановлены в среде роста. Если некоторые клетки по-прежнему прикреплены к нижней пластины после pipetting несколько раз, осторожно соскребать клетки с помощью пластиковой клетки скребок для облегчения отслоения клеток.
- Удалить 0,1 мл клеточной суспензии от 500 л клеточной подвески в шаге 3.3 и добавить в трубку 1,5 мл. Затем добавьте 0,1 мл 0,4% Трипан синий раствор в суспензии клетки и хорошо перемешать.
- Очистите гемаситометр 70% изопропиловым спиртом. Добавьте 20 кл.с. смеси со ступени 3,5 с каждой стороны в V-паз е и найдите 16 квадратов под микроскопом. 16 квадратов считаются одной сеткой. Найдите две случайные сетки по обе стороны от гемаситометра и подсчитайте все живые, несиние клетки.
ПРИМЕЧАНИЕ: Клетки, которые появились синий цвет из исключены из подсчета, lt;1% клеток окрашенных синий во все моменты времени. - Рассчитайте плотность клеток (клетки/см2)на основе следующих формул.
Средний q ячеек/сетки (Eq.1)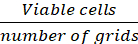
Коэффициент разбавления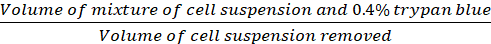 (Eq.2)
(Eq.2)
Плотность клеток (жизнеспособные клетки/см2)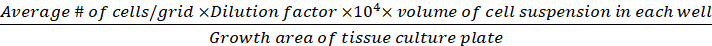
(Eq.3)
Уравнения 1-3. Жизнеспособные ячейки - это количество ячеек, подсчитанных в каждой сетке, количество сеток соответствует количеству сеток, расположенных под микроскопом, объем смеси клеточной подвески и 0,4% Трипан синий объем подготовлен в шаге 3.5, объем клеточной подвески удален объем удалены из 500 л клеточной подвески в шаге 3,5, объем клеточной подвески в каждой скважине является 500 Л клеточной подвески от шага 3.3, область роста ткани культуры пластины является область роста одного колодца в 24-хорошо пластины.
4. Люцифер желтый очевидной проницаемости (LY P приложение ) асссе
- Для определенияприложения LY P на каждый день после посева, следуйте шагам, начиная с 4.3. Для определенияприложения P в трансинфицированных клетках hCMEC/D3 добавьте 8,3 л трансфекционной формулировки (рисунок1),смешанной с 50 злицом полной среды роста и инкубировать для 4 ч. Трансфекционные формулировки описаны в разделе 5.
- После 4 ч трансфекции, осторожно мыть апкальную сторону дважды с помощью стерильного буфера 1x PBS, чтобы удалить любые остаточные трансфекционной смеси. Различные объемы буфера PBS, оставленного после удаления, могут повлиять на концентрацию LY в апической стороне. Позаботьтесь о том, чтобы остаточный буфер PBS в вставках культуры тканей был полностью удален. Тщательно аспирировать остаточные реагенты и средние, чтобы свести к минимуму отслоение клеток.
ПРИМЕЧАНИЕ: Этот шаг пропускается при измерении ежедневной очевидной проницаемости (Pприложение) из hCMEC/D3 клеток. - Удалите среду роста и добавьте 1,5 мл предварительно подогретого (37 градусов по Цельсию) транспортного буфера (25 мМ HEPES, 145 мМ NaCl, 3 мМ KCl, 1 мМ CaCl2, 0,5 мм ММ MgCl2, 1 мМ2PO4, 5 мм глюкозы, pH 7.4) к басолатеральной стороне.
ПРИМЕЧАНИЕ: Объем транспортного буфера во всех базолатеральных отсеках должен быть равным для обеспечения точности расчета коэффициента проницаемости. - Добавьте 58,3 л из 20 растворов мкм LY к апической стороне каждой вставки transwell. Сохраните 50 зл из 20 раствора мкм LY для измерений флуоресценции. После удаления остаточного буфера PBS с аптической стороны полностью добавьте решение LY как можно быстрее, чтобы избежать высыхания ячеек hCMEC/D3. Обеспечьте точные объемы решения LY в апической стороне.
ПРИМЕЧАНИЕ: Чтобы свести к минимуму распад интенсивности LY флуоресценции, воздействие света должно быть ограничено. После того, как порошок LY будет восстановлен, раствор должен храниться при 4 градусах Цельсия, защищенном от света. - Инкубировать в роторную пластину шейкер (37 кв.м., 100 об/мин) в течение 60 мин. Затем удалите 30 л образца LY из каждого апического отсека. Затем перенесите раствор 20 КМ LY и атические боковые образцы на предварительно маркированные трубки и разбавьте образец в 10 раз с помощью транспортного буфера.
ПРИМЕЧАНИЕ: Требуется разбавить 20 мКМ LY фондовых раствор атакжемальных побочных образцов, потому что высокая интенсивность флуоресценции этих образцов может потенциально перегрузки и повреждения флуоресценции детектор флуоресценции микроплиты. - Удалить 500 л из каждого баролатерального отсека и перенести образец на предварительно маркированные трубки.
ПРИМЕЧАНИЕ: Образцы удаляются из отдельного трансвеллы в указанных временных точках. Время точек каждый день после посева, начиная с первого дня до дня 10. - Подготовьте ряд стандартов LY для стандартной кривой (39.00 нм, 78.13 нм, 156.25 нМ, 312 нм, 625 нм, 1250 нм, 2500 нм).
- Добавьте 100 юл каждого стандарта (в дубликате), актикальный и базолатеральный образец к каждой скважине в черной 96-колодской пластине(рисунок 1).
ПРИМЕЧАНИЕ: Черные пластины поглощают свет и уменьшают фон и флуоресценцию кроссовера среди колодцев. - Используйте флуоресценцию микроплиты (набор точек: возбуждение 428 нм, выброс 536 нм) для измерения интенсивности LY флуоресценции для расчета Pприложение. Флуоресценция пластины считыватель используется для этого исследования.
- Рассчитайте значения восстановленияP и %LY, как описано в тексте рукописи.
Уравнение 4. Формула для расчета значенийp-приложений.
Рассчитайте коэффициент очевидной проницаемости (Papp)и восстановление %LY с помощью следующих уравнений. Следует отметить, что значенияприложения P могут быть рассчитаны либо на основе массы25, либо на основе концентрации LY.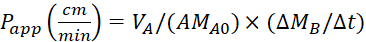 Или
Или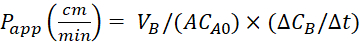
VA - объем в апическом отсеке
VB - объем в баролатеральном отсеке
A - площадь поверхности вставки мембраны Transwell (0,3 см2)
MA0 - начальная масса в апическом отсеке
ММБ/Зт - изменение массы с течением времени в баролатеральном отсеке
CA0 - начальная концентрация в апическом отсеке
КСВ/Зт - изменение концентрации с течением времени в баролатеральном отсеке.
Уравнение 5. Формула для расчета % восстановленияLY.
Восстановление (%)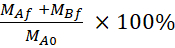
MAf является масса в апический отсек в точке времени окончания, MBf является масса в базолатеральном отсеке в точке конца времени, MA0 является начальной массой в апикальномотсеке . 26 Примечание: Начальная масса рассчитывается на основе объема решения 20 км LY на этапе 4.5. Этот эксперимент всегда проводился с использованием ячеек под проходом No 35 и проводился четыре самостоятельных раза.
5. Истощение кальция
- Удалите среду роста из вставок Transwell и 12-хорошо пластины и осторожно мыть апкальной стороны и 12-хорошо пластины с помощью предварительно подогретого кальция свободной среде (минимальный основной средний орлан Спиннер (S-MEM) среды) для удаления ионов кальция из трансвелл вставки и 12-колодец пластины.
- Добавьте 500 юл или 2 мл предварительно разогретого S-MEM 1xmedium к вставкам или 12-хорошую пластину и инкубировать втечение 24 ч в инкубаторе (37 кв. м, 5% CO 2). После инкубации, удалить S-MEM 1x среды и мыть клетки один раз с помощью предварительно нагревается 1x PBS буфера.
- Следуйте шагам 4.4-4.10, описанным в разделе 4 для лечения LY и последующих шагов. Следуйте шагам 8.1.2-8.2.4, описанным в разделе 8 для западных промотирования и последующих шагов.
6. Трансфекция
- Подготовка наночастиц ДНК (ДНК-НП).
- Разбавить запас раствор омнича-Люк плазмида в 10 мМ ацетат натрия (NaAc) буфер (pH 5.0) и позволяют раствор ДНК стоять в течение 10 мин при комнатной температуре (RT).
ПРИМЕЧАНИЕ: ДНК NP, содержащий преимущественно одиночные молекулы ДНК могут быть подготовлены в концентрациях ДНК 20-40 мкг/мл23. Таким образом, гВИЗ-Люк плазмидный складраствор должен быть разбавлен. Замороженный запас плазмида гВИЗ-Люка должен быть полностью разморожен на льду, чтобы свести к минимуму температурный стресс. Аккуратно вихрь разбавленного сосуды ДНК на 30 с на стандартном вихре скамейки, установленном на позиции ручки 3-5. - Рассчитайте желаемые соотношения N/P, используемые здесь в качестве численного параметра для отражения состава NP.

Уравнение 6. Расчет соотношения N/P: соотношение родинок групп аминов катионных полимеров к фосфатным группам ДНК. Масса катионных полимеров означает общее взвешенное количество катионного полимера; (Масса/Зарядка) катионные полимеры относятся к молекулярному весу катионного полимера (полиэтилнегликоля) 5к-блок-полиаспартамид с 48 диэтиленетриаминами боковых цепочек (PEG-DET)) нормализованы до количества заряженных первичных аминов (48) на циатический полимер ( mol/mol), это значение для нашего полимера 306 Da; Масса ДНК означает общее количество ДНК, используемой в формулировке, полученной путем умножения объема и концентрации в мг/мл; (Масса/Зарядка) ДНК относится к молекулярному весу ДНК, нормализованному к количеству фосфатной группы на двухцепочечную ДНК (325 Да на нуклеобазу).
ПРИМЕЧАНИЕ: Таблица подготовки ДНК NP(Таблица 1) содержит рецепт формулировки для различных образцов, протестированных в наших экспериментах. ДНК NP были подготовлены с использованием техники быстрого титрования. Полимерный раствор PEG-DET был добавлен вдоль стенок трубки, удерживая трубку в горизонтальном положении. Затем трубка была переключена на вертикальное положение, после чего быстро вихрь на максимальной скорости для 10s. ДНК NP было разрешено стоять в течение 30 минут на RT до использования. Правило большого пальца для дозирования ДНК NP составляет 0,5 мкг ДНК для около 1 см2 области роста. Таким образом, для каждой вставки трансвелл /каждый хорошо в 48-ну хорошо пластины / каждый хорошо в 96-лукпластины, подготовить ДНК NP на N / P 10, содержащий 0,157/0,5/0.195 мкг / хорошо гВИЗ-Люк ДНК. - Для образцов, содержащих указанную концентрацию Poloxamer P84 (P84), добавьте P84 к ДНК NP и вихрю на 5 с. Окончательная концентрация P84 в каждой выборке составляет либо 0,01%, либо 0,03% вт.
- Разбавить запас раствор омнича-Люк плазмида в 10 мМ ацетат натрия (NaAc) буфер (pH 5.0) и позволяют раствор ДНК стоять в течение 10 мин при комнатной температуре (RT).
- Трансфекция ДНК NP в 48-колодцевой установке пластины
- Семя клетки с плотностью 50000 клеток / см2 в 48 хорошо пластины и расти до слияния в инкубаторе (37 кв., 5% CO2).
- Для каждой группы лечения смешайте 25 кЛ указанного образца (трансфекционный состав) и 150 л полного среднего роста и 175 л этой смеси к каждой скважине.
- Наблюдайте за клетками hCMEC/D3 под микроскопом, чтобы убедиться, что клетки выглядят здоровыми и на 100% стыковывки во время эксперимента.
- Удалите среду роста из скважин и 175 йЛ трансфекционной смеси для каждой скважины. Затем инкубировать тарелку на 4 ч в инкубаторе (37градусов по Цельсию, 5% CO 2).
- После 4 ч удалите трансфекционную смесь и промойте клетки hCMEC/D3 с предварительно подогретым стерильным буфером 1x PBS.
ПРИМЕЧАНИЕ: Чтобы свести к минимуму случайное отслоение hCMEC/D3 клеток от поверхности пластины/вставки во время стирки, тщательно пипетка достаточно стерильной PBS вдоль стенок скважин и удалить любые наночастицы в остаточной культуры средств массовой информации. - Аккуратно раскачивать тарелку несколько раз и тщательно аспирировать и отбрасывать PBS мыть и добавить 500 зл. hCMEC/D3 предварительно подогретой среды культуры.
- Микроскопически исследовать клетки и записывать наблюдения на морфологии клеток и любых возможных эффектов трансфекции.
- Инкубировать для 24 h в инкубаторе культуры 37 кс, чтобы позволить люциферазы производства. После 24 ч, удалить рост среды полностью и мыть клетки один раз с предварительно подогретых 1x PBS.
- Выщелачить трансинфицированных клеток, добавив 100 л ледяной люциферазы клеточной культуры культуры лиза 1x реагента на хорошо.
- Для измерения содержания белка люциферазы добавьте 20 л клеточного лизата и 100 л люциферазы ассеа-буфера (20 мм глицилглицин (pH 8), 1 мМ MgCl2, 0,1 мМ EDTA, 3,5 мМ DTT, 0,5 мМ ATP, 0,27 мм кофермента AL.
- Прочитайте люминесценцию образца, описанную в шаге 6.2.10 на Luminometer с единым авто-инжектором.
ПРИМЕЧАНИЕ: Люминесценция должна быть интегрирована в течение 10 с перед чтением. - Измерьте общее количество клеточного белка в лизате с помощью набора анализов бисинхониновой кислоты (BCA assay) путем следования протоколу производителя.
- Рассчитайте и выразите экспрессию гена люциферазы как относительные световые единицы (RLU) на общий клеточный белок.
7. Люминесцентный атлет
- Семя клетки с плотностью 50000 клеток / см2 в 96 хорошо пластины и расти до слияния в инкубаторе (37 кв., 5% CO2).
- Трансфектирует клетки с 9,7 л трансфекционной формулы (детали подготовки находятся в разделе 6) и 58,4 л полной среды роста для 4 ч.
- Удалите трансфекционную смесь и осторожно промойте клетки предварительно подогретым буфером PBS 1x дважды, чтобы полностью удалить реагенты обработки.
ПРИМЕЧАНИЕ: Различные объемы остаточного буфера могут разбавить ассационные реагенты СПС в различной степени и потенциально могут повлиять на данные. - Смешайте 75 л свежего предварительно разогретого среднего и ат-атс-реагента атсис в 1:1 разбавления с помощью многоканального пипетка. Убедитесь, что уровень жидкости во всех многоканальных наконечниках пипетки одинаков.
- Поместите тарелку на nutating шейкер в течение 15 минут при комнатной температуре. После 15 минут добавления реагентов, передача 60 зл и l каждого образца в белую 96-колодую пластину.
ПРИМЕЧАНИЕ: Белые пластины лучше отражать выходной свет, чем четкие или черные пластины. - Поп любые пузырьки воздуха с помощью иглы до чтения пластины. Прочитайте пластину на люминометре с 1 с интеграцией времени. Прочитайте пластину в течение 20 минут после добавления АТФа асссиревы реагентов. Сроки имеет решающее значение для сравнения между различными пластинами, потому что люминесценция сигнал преходящий с быстрой скоростью распада.
- Рассчитать процент (%) жизнеспособность клеток с использованием этой формулы: (люминесценция трансинфицированных клеток/люминесценции контроля, необработанных клеток) x 100.
8. Западная промотирование для измерения плотного соединения белка ЗО-1
-
Лиза и протеина
ПРИМЕЧАНИЕ: Все шаги для извлечения белка из клеток должны быть выполнены при 2-8 градусах Цельсия.- Семена клеток при плотности 50000 клеток / см2 в коллагена покрытием 12-ну хорошо ткани культуры пластины.
- На 3-й день, день 5, день 7, день 10 после посева и на 7-й день (клетки предварительно инкубированы с кальцием свободной среде), удалить среду роста и осторожно мыть клетки дважды с 2 мл льда ледяной 1x PBS. Затем добавьте 300 л смеси ледяного 1x ЛИПА лисис буфера, содержащего 3 мкг/мл апротинина в каждой скважине.
ПРИМЕЧАНИЕ: Смесь должна быть свежеприготовлена и храниться на льду. Апротинин используется для ингибирования протеаз, присутствующих в лисатах от деградации белка интерес. - После двух циклов заморозки оттепели (-80 градусов по Цельсию) соскребите клетки с помощью холодного пластикового скребка клеток. Соберите щелочники клеток в микрофуговых трубках. Затем центрифуги труб на 200 х г в течение 30 мин при 4 градусах По Цельсию.
- Соберите супернатант в чистые трубки и поместите их на лед. Измерьте общее количество клеточного белка в лисатах с помощью набора анализов BCA, следуя протоколу производителя.
-
Западная промотирование для обнаружения плотного соединения белка ЗО-1
- Денатурные аликвоты общего количества гомогенатов, содержащих 40 мкг общего белка с буфером 1x Laemmli при 95 градусах по Цельсию, 5 мин и подлежащих электрофорезу в снижении 6-7,5% натрия додецил сульфат полиакриламида гель (SDS-PAGE) (90 V, 10 мин через укладку геля, 120 V через разрешители гели).
ПРИМЕЧАНИЕ: При загрузке образцов или стандартов, не забудьте загрузить медленно и осторожно в каждой полосе, стараясь не сломать колодец в этом процессе. - Перенесите отделенные белки на мембрану нитроцеллюлозы с буфером передачи pH 8.5, который содержит 192 мМ глицин, 25 мм трис базы, 10% метанола и 0,1% SDS (75 V, 110 мин при комнатной температуре).
ПРИМЕЧАНИЕ: Не прикасайтесь к мембране. Используйте 70% изопропанола промывают пластиковые щипцвые для обработки мембраны. Для того, чтобы успешно перенести белок ЗО-1 (МВт 200 кДа) на мембрану, рН должен быть около 8,3-8,5. Если буфер передачи более кислый, чем это, передача не произойдет. Если полосы лестницы видны еще на геле, было бы полезно увеличить время передачи и концентрации SDS. - После мытья мембраны с помощью соления Tris-буфера, содержащего 0.1%Tween 20 (T-TBS), используйте блокирующий раствор (1:1 LiCOR-Odyssey Block: 1x Tris buffered saline) для блокирования мембран в течение 60 мин.
- Аккуратно разрежьте мембрану на две полосы. Инкубировать двумя первичными антителами (моноклональные антитела ЗО-1, разбавление, 1: 900, и глицеральдегид омандрогеназой 3-фосфатной дегидрогеназы (GAPDH) антитела, разбавления, 1: 10000) на ночь при 4 градусах Цельсия. Затем инкубировать мембраны ЗО-1 и GAPDH с осла анти-мыш IgG (разбавление, 1:50,000). После мытья мембран с помощью T-TBS, изображение мембран в 700 канал на 16-битный образ.
- Денатурные аликвоты общего количества гомогенатов, содержащих 40 мкг общего белка с буфером 1x Laemmli при 95 градусах по Цельсию, 5 мин и подлежащих электрофорезу в снижении 6-7,5% натрия додецил сульфат полиакриламида гель (SDS-PAGE) (90 V, 10 мин через укладку геля, 120 V через разрешители гели).
Результаты
Во-первых, мы определили влияние времени культивирования на проницаемость LY для определения очевидной кинетики формирования TJ. Средние значенияприложения LY P с 1-го дня до 10-постов показаны на рисунке 2a. На 1 день, средний Pприложение было 4,25 ?...
Обсуждение
Ключевая роль BBB заключается в предотвращении обмена несущественных ионов и токсичных веществ между системной циркуляции и мозга для поддержания гемостаза нейронной микросреды. Одной из характерных особенностей BBB является способность капиллярных эндотелиальных клеток образовыват?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарны за финансовую поддержку от 2017 Новый следователь премии от Американской ассоциации фармации, Hunkele Dreaded Disease награду от Duquesne университета и школы фармации стартовых средств для лаборатории Manickam. Мы хотели бы поблагодарить лабораторию утечки (Duquesne University) за западную помощь blotting и разрешение на использование их Одиссея 16-битный imager. Мы также хотели бы включить специальную ноту признательность за Kandarp Dave (Manickam лаборатории) за помощь в западной blotting.
Материалы
| Name | Company | Catalog Number | Comments |
| hCMEC/D3 cell line | Cedarlane Laboratories | 102114.3C-P25 | human cerebral microvascular endothelial cell line |
| gWizLuc | Aldevron | 5000-5001 | Plasmid DNA encoding luciferase gene |
| lucifer yellow CH dilithium salt | Invitrogen | 155267 | |
| Transwell inserts with polyethylene terephthalate (PET) track-etched membranes | Falcon | 353095 | |
| Tissue culture flask | Olympus Plastics | 25-207 | |
| 24-well Flat Bottom | Olympus Plastics | 25-107 | |
| Black 96-Well Immuno Plates | Thermo Scientific | 437111 | |
| S-MEM 1X | Gibco | 1951695 | Spinner-minimum essential medium (S-MEM) |
| EBM-2 | Clonetics | CC-3156 | Endothelial cell basal medium-2(EBM-2) |
| phosphate-buffered saline 1X | HyClone | SH3025601 | |
| Collagen Type I | Discovery Labware, Inc. | 354236 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | |
| Cell Culture Lysis 5X Reagent | Promega | E1531 | |
| Beetle Luciferin, Potassium Salt | Promega | E1601 | |
| SpectraMax i3 | Molecular Devices | Fluorescence Plate Reader | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| ZO-1 Polyclonal Antibody | ThermoFisher | 61-7300 | |
| anti-GAPDH antibody | abcam | ab8245 | |
| Alexa Fluor680-conjugated AffiniPure Donkey Anti-Mouse LgG(H+L) | Jackson ImmunoResearch Inc | 128817 | |
| 12-well, Flat Bottom | Olympus Plastics | 25-106 | |
| RIPA buffer (5X) | Alfa Aesar | J62524 | |
| Aprotinin | Fisher BioReagents | BP2503-10 | |
| Odyssey CLx imager | LI-COR Biosciences | for scanning western blot membranes |
Ссылки
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology Of Disease. 37 (1), 13-25 (2010).
- Griep, L. M., et al. BBB on chip: microfluidic platform to mechanically and biochemically modulate blood-brain barrier function. Biomedical Microdevices. 15 (1), 145-150 (2013).
- Camos, S., Mallolas, J. Experimental models for assaying microvascular endothelial cell pathophysiology in stroke. Molecules. 15 (12), 9104-9134 (2010).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow & Metabolism. 28 (2), 312-328 (2008).
- Wolff, A., Antfolk, M., Brodin, B., Tenje, M. In vitro Blood-Brain Barrier Models-An Overview of Established Models and New Microfluidic Approaches. Journal of Pharmaceutical Sciences. 104 (9), 2727-2746 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmaceutics. 10 (1), 289-296 (2013).
- Tornabene, E., Brodin, B. Stroke and Drug Delivery--In vitro Models of the Ischemic Blood-Brain Barrier. Journal of Pharmaceutical Sciences. 105 (2), 398-405 (2016).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Llombart, V., et al. Characterization of secretomes from a human blood brain barrier endothelial cells in-vitro model after ischemia by stable isotope labeling with aminoacids in cell culture (SILAC). Journal of Proteomics. 133, 100-112 (2016).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- Avdeef, A. How well can in vitro brain microcapillary endothelial cell models predict rodent in vivo blood-brain barrier permeability?. European Journal of Pharmaceutical Sciences. 43 (3), 109-124 (2011).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Shao, X., et al. Development of a blood-brain barrier model in a membrane-based microchip for characterization of drug permeability and cytotoxicity for drug screening. Analytica Chimica Acta. 934, 186-193 (2016).
- Walter, F. R., et al. A versatile lab-on-a-chip tool for modeling biological barriers. Sensors and Actuators B: Chemical. 222, 1209-1219 (2016).
- Cecchelli, R., et al. In vitro model for evaluating drug transport across the blood–brain barrier. Advanced Drug Delivery Reviews. 36, (1999).
- Cecchelli, R., et al. Modelling of the blood–brain barrier in drug discovery and development. Nature reviews Drug discovery. 6 (8), 650 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. . The Blood-Brain Barrier. , 307-324 (2003).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability Studies on In vitro Blood–Brain Barrier Models: Physiology, Pathology, and Pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Ren, T. B., et al. A General Method To Increase Stokes Shift by Introducing Alternating Vibronic Structures. Journal of the American Chemical Society. 140 (24), 7716-7722 (2018).
- Pack, D. W., Hoffman, A. S., Pun, S., Stayton, P. S. Design and development of polymers for gene delivery. Nature Reviews Drug Discovery. 4 (7), 581-593 (2005).
- Oupický, D., Konák, C., Ulbrich, K., Wolfert, M. A., Seymour, L. W. DNA delivery systems based on complexes of DNA with synthetic polycations and their copolymers. Journal of Controlled Release. 65, (2000).
- Couraud, P. O. . The hCMEC/D3 CELL LINE: IMMORTALIZED HUMAN CEREBRAL MICROVASCULAR ENDOTHELIAL CELLS As a model of human Blood-Brain Barrier. , (2012).
- Youdim, K. u. r. e. s. h. A., A, A. A. a. N. J. In vitro trans-monolayer permeability calculations: often forgotten assumptions. research focus reviews. 8, (2003).
- Eigenmann, D. E., Xue, G., Kim, K. S., Moses, A. V., Hamburger, M., Oufir, M. Comparative study of four immortalized human brain capillary endothelial cell lines, hCMEC/D3, hBMEC, TY10, and BB19, and optimization of culture conditions, for an in vitro blood-brain barrier model for drug permeability studies. Fluid and Barriers of the CNS. 10 (33), (2013).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Balda, M. S., Anderson, J. M. Two classes of tight junctions are revealed by ZO-1 isoforms. The American Physiological Society. , (1992).
- Brown, R. C., Davis, T. P. Calcium Modulation of Adherens and Tight Junction Function: A Potential Mechanism for Blood-Brain Barrier Disruption After Stroke. Stroke. 33 (6), 1706-1711 (2002).
- Gorodeski, G., Jin, W., Hopfer, U. Extracellular Ca2+ directly regulates tight junctional permeability in the human cervical cell line CaSki. American Journal of Physiology-Cell Physiology. 272 (2), C511-C524 (1997).
- Stuart, R. O., Sun, A., Panichas, M., Hebert, S. C., Brenner, B. M., Nigam, S. K. Critical Role for lntracellular Calcium in Tight Junction Biogenesis. Journal of Cellular Physiology. 159, (1994).
- Tobey, N. A. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. , (2004).
- Tobey, N. A., Argote, C. M., Hosseini, S. S., Orlando, R. C. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. 286, (2004).
- Posimo, J. M., et al. Viability assays for cells in culture. Journal of visualized experiments : JoVE. (83), e50645 (2014).
- Cipolla, M. J., Crete, R., Vitullo, L., Rix, R. D. Transcellular transport as a mechanism of blood-brain barrier disruption during stroke. Frontiers in Bioscience. 9 (3), 777-785 (2004).
- Kreuter, J. Influence of the surface properties on nanoparticle-mediated transport of drugs to the brain. Journal of nanoscience and nanotechnology. 4 (5), 484-488 (2004).
- Markoutsa, E., et al. Uptake and permeability studies of BBB-targeting immunoliposomes using the hCMEC/D3 cell line. European Journal of Pharmaceutics and Biopharmaceutics. 77 (2), 265-274 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены