A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
לוציפר צהוב-מרקר חזק הקרנף מסמן במודל תא של מכשול הדם האנושי-מוח
In This Article
Summary
אנו מציגים שיטת הזריחה כדי להדגים כי לוציפר הצהוב (LY) הוא סמן חזק כדי לקבוע את החדירות הפראוטיות לכאורה של המונטמקים/D3 cell monolayers, מודל בלתי מתורבת של מחסום הדם-מוח האנושי. השתמשנו בקביעה זו כדי לקבוע את הקינטיקה של היווצרות מונאולייר מתורבת בתאי מימן מונולימקים/D3.
Abstract
המכשול המוחי-דם BBB מורכב מתאי האנדותל היוצרים מחסום בין הסירקולציה הסיסטמית למוח כדי למנוע חילופי יונים לא חיוניים וחומרים רעילים. צמתים הדוקים (TJ) לאטום ביעילות את החלל הפאראתאי במונאולאיירס וכתוצאה מכך מכשול שלם. מחקר זה מתאר באופן מבוסס ביותר מבוססת על הקרינה הפלואורסצנטית כי ניתן להשתמש כדי לקבוע מקדם חדירות לכאורה שלה (Papp) ובתורו יכול לשמש כדי לקבוע את הקינטיקה של היווצרות של מונואולאיירס conol, ואת הצומת ההדוק שנוצר שלמות המכשול בבכצ/D3 מונאולאיירס. אנו עוד להדגים כלי נוסף של הספק הזה כדי לקבוע את השלמות הפונקציונלית TJ בתאים מזוהמים. הנתונים שלנו מ-LY Papp האפליקציה מראה כי ההטיות/D3 תאים שנזרע בהתקנה transwell ביעילות להגביל באופן מוגבל הובלה בלבד 7 ימים-הודעה התרבות. ככלי נוסף של התשובה המוצגת, אנו גם להדגים כי ה-DNA ננו-חלקיק הזיהום אינו משנה את התחבורה הקרנף לולי ב-Hmec/D3 monolayers.
Introduction
מחסום דם-מוח (BBB) הוא מכשול ההגנה המגביל את זרם רכיבי הפלזמה לתוך רקמת המוח ומורכב מתאי המוח המתכלים יחד עם תאים תומכים כגון קרום הלב. התפקיד העיקרי של bbb הוא לשמש מחסום כי חותמות את החלל בין דם היקפי מערכת העצבים המרכזית (cn) כדי לשמור על הומוסטאזיס של המיקרוסביבה העצבית1,2. מוחו של נימי המוח מתאים באופן יעיל את מסלול הקרנף באמצעות היווצרות הצמתים הצמודים הבינתאיים (TJs)1. מכשול הגנה זה מאפשר גלוקוז וחומרים מזינים שנבחרו להיכנס למוח בזמן שהוא מונע את רוב היונים, חומרים רעילים ותרופות לעבור דרך מכשול זה צר. מלבד תפקידה המגן, תפקוד המכשול הטבעי של BBB מהווה אתגר חמור בפיתוח מערכות משלוח הסמים מיקוד ה-CN.
במודלים של תרבות תא מתורבת של BBB הם כלים שימושיים ללמוד את הביולוגיה שלה להבין את ההשפעות של טיפול תרופתי על שלמות המכשול TJ. השתמשנו בחוט הטלפון האנושי של מיקרוכלי-הדם של המוח (מימן/D3) כמודל להפריה חוץ-גופית, כיוון שהוא מודל מקובל של שלוש המוחות האנושיים ולאחר מכן פונקציות רבות של bbb האנושי. הימן/D3is אחד מקווי התא הנפוצים ביותר למידול bbb בתוך מבחנה4,5,6,7,8,9. למרות הערכים הנמוכים יחסית של ההתנגדות החשמלית של טראנסדותל, מידה של התכווצות מכשול, קו זה משמר את רוב המאפיינים המוורפולוגיים והפונקציונליים של תאי המוח האנדותל, אפילו כתרבות חד-תרבותית בהעדר תאים גליאל ממקור אורגני6,7. קו הבכצ/D3 cell מבטא מספר סמני bbb כולל מובילים וקולטנים פעילים עד למעבר 35 מבלי להיות בלתי מעורער לפנוטיפים לא יציבים6,7,9 ,10,11. המאפיין הבולט ביותר של קו מימן/D3 cell כמו מודל מבחנה bbb הוא היכולת ליצור tjs5,9,11,12. יש לציין כי למרות מודלים BBB הנגזר בתאי הראה חדירות גבוהות יותר במחקרים רבים בהשוואה לקו הבכצ/D3 cell הם מבטאים כמה סמנים BBB, הם עדיין להתפתח כמו הנפוץ ביותר BBB תא דגם13. חשוב להניח, תא גזע נגזר מודלים BBB להיות מאופיין ביחס מספר מעבר מקסימלי המאפשרים לתאים לשמור על יציבה BBB פנוטיפים14.
שלוש שיטות עיקריות משמשות בדרך כלל כדי לקבוע את שלמות המכשול TJ, כולל מדידה של מקדם הפרפיפיל, המדידה של המקדם חדירות לכאורה (Papp) של מולקולות של מעקב הידרופילי קטן כגון סוכרוז, אינולין, לוציפר צהוב, וכו ' וכתמים של סמנים מולקולריים ידועים של TJs כגון קלודין 5, ZO-1, סגר, וכו '.5. העגלון הוא שיטה פשוטה יחסית וכמותית המודד את ההתנגדות החשמלית ברחבי התא monolayers מתורבת על מצע ממברנה נקבובי5. עם זאת, ערכי העגלון יכולים להיות מושפעים ממשתנים ניסיוניים כגון קומפוזיציה של מדיום התרבות וסוג כלי המדידה. שילוב סביר של גורמים אלה מוביל להפצה רחבה של ערכי העגלון החל מ 2 כדי 1150 Ω ס"מ2 ב הבכצ/D3 קו התאים מתורבת עבור 2-21 ימים13. חיסוני היא שיטה חזותית לקבוע נוכחות של חלבונים TJ על ידי תיוג חלבון ממוקד באמצעות נוגדנים. עם זאת, חיסוני כרוך סדרה של שלבים ניסיוניים, כולל הצורך לתקן/חדירות תאים שעלולים לגרום לפריטים ניסיוניים ואותות פלורסנט עלול לדהות לאורך זמן. הגורמים הנ ל עלול להוביל לשגיאות סובייקטיבית המשפיעים על איכות הנתונים.
המוקד העיקרי של העבודה הזאת הוא להציג באופן ברור מאוד מבוסס חדירות לכאורה לקבוע את הקינטיקה של היווצרות מונאולייר שוטפת בתאי מימן/D3 מתורבתים. למרות שאחרים מתקדמים מערכות מחוץ לתחום, כגון מערכות שיתוף התרבות, מערכות microfluidic, הם מחקה מבחינה פיזיולוגית יותר הרלוונטיות עם פונקציית המכשול משופרת באופן משמעותי15,16,17, הבכצ/D3 transwell להגדיר היא מודל פשוט ואמין כדי להעריך את הקינטיקה של היווצרות TJ במהירות ההשפעה של ניסוחים תרופות שונות על תפקוד המכשול. באופן כללי, ערכי Papp עקביים לפתרונות הידרופיליים שונים בבכצ/D3 monolayers. לדוגמה, ערכי ה -P שדווחו עבור מספר פתרונות המסה המולקולריים הנמוכים (כגון סוכרוז, מאננירול, לולי, וכו ') בדגמים שונים של מודלים מחוץ לגופית הם בסדר של 10-4 ס"מ/min5,18,19 , 20. בכיוונון הנסיוני שלנו, תאי המוח האנדותל הם הזרע על קרום מיקרונקבובי קולגן מצופה עבור תא מצורף היווצרות מונאולייר לחקות את המכשול vivo. The LY הוסיף בצד פסגה צפוי לחצות את הצמתים הצמודים הבינסלולאריים ולהצטבר בצד basolateral. ריכוזים גדולים יותר של LY בצד הbasolateral לציין מכשול בלתי בוגר, לא במלואו פונקציונלי בעוד ריכוזים נמוכים לשקף הובלה מוגבלת בשל נוכחותם של TJs פונקציונלי וכתוצאה מכך מכשול בוגר.
LY הינו צבע הידרופילי עם פסגות עירור/פליטה ברורים וימנע את הצורך למולקולות מעקב רדיויניום כגון סוכרוז, ניטול או אינולין. כך, ערכי הקרינה הפלואורסצנטית של LY יכול לשמש ישירות לחשב באופן ישיר חדירות הקרנף שלה לאורך BBB monolayers. בנוסף, לעומת צבעים זמינים מסחרית רבים המשמשים בתחומים ביו הסובלים משמרות סטוקס קטן כגון fluorescein21, משמרת סטוקס של LY הוא על 108 ננומטר עם הפרדה ספקטרלית מספקת, ובכך מאפשר לנתונים בעלי קרינה פלואורסצנטית כ בדיקה חזקה כדי לקבוע חדירות הקרנף. השתמשנו בכתמים המערביים כטכניקה אורתוגונלית כדי להדגים שינויים בביטוי של חלבון סמן הצומת צר, ZO-1, על זמן התרבות. ZO-1 ביטוי שאותרו באמצעות בלוק המערבי משמש כדי להשלים את הנתונים האפליקציה ly p ובשילוב, נתונים אלה מראים כי השינויים נצפתה בערכים ly papp הוא רפלקטיבית היווצרות של מונאולייר עם עלייה הדרגתית ביטוי של סמן צומת צר, ZO-1.
כפי שציין קודם לכן, המוקד המרכזי של העבודה הזאת הוא להפגין שיטת LY כטכניקה פשוטה כדי לפקח על היווצרות של מונאולייר שוטפת עם צמתים הדוקים ופונקציונליים. עם זאת, כדי להדגים כלי נוסף של הסדר המפותח, אנו מדדו את ה-LY Papp ב-DNA ננו-חלקיק-transmec/D3 monolayers. חומצות גרעין ניתן לדחוס חלקיקי פוליאלקטרוליט עם קוטר של 100-200 ננומטר באמצעות אינטראקציה אלקטרוסטטית בין קבוצות טעונה חיובי של פולימרים וקבוצות פוספט טעונה שלילית של חומצות גרעין22, 23. אנו מתייחסים אלה מתחמי כמו חלקיקי DNA (ה-dna NPs) בעבודתנו. בעוד הכוונה שלנו היא להתאים את התאים ולבטא את החלבון הרצוי, עלינו לוודא שמאפייני המכשול של הבכצ/D3 monolayers אינם נחשפים. הנתונים שלנו מצביעים על תקן 4 h ללוציפראז גן משטר אינו משנה באופן מגוון את חדירות ly להפגין את השירות של LY Papp האפליקציה כדי לקבוע שינויים שלמות המכשול TJ.
Protocol
1. תרבות התאים הכללית/D3
- החייאה של תאים קפואים
הערה: כל הטיפול בתרבות התאים והניסויים בוצעו בתוך מכסה ביולוגי סטרילי. מדיה תרבותית, תוספי מזון וריאגנטים נרכשו כמוצרים סטרילי או מעוקר דרך סינון באמצעות פילטר ממברנה 0.22 יקרומטר כדי למנוע זיהום מחיידקים.- הוסף 8.5 mL של פתרון קולגן (0.15 mg/mL) בבקבוקון תרבות רקמה (75 ס מ2 באזור הצמיחה; התייחס מעתה ואילך כמו T75) ומניחים אותו בחממה (37 ° צ', 5% CO2) עבור 1 h.
- להסיר את התמיסה קולגן בעדינות לשטוף את הבקבוקון עם מלוחים מעוקר מאגור פוספט (PBS). הוסף 15 מ ל של בינונית צמיחה מלאה לבקבוקון ולעזוב את החממה CO2 עבור 15 דקות.
הערה: המדיום המלא (הריכוז הסופי) הכיל תא הצמיחה אנדותל בסיס בינונית-2 (500 mL) בתוספת סרום העוברי העובר (5%), פניצילין-סטרפטומיצין (1%), הידרוקורטיזון (1.4 μM), חומצה אסקורבית (5 μg/mL), ליפיד כימית מוגדר להתרכז (1/100), HEPES (10 מ"מ) ומקדם צמיחה בסיסי בפיברוהפיצוץ (1 ng/mL). - הזיזו בקבוקון של תאי מימן מוקפאים/D3 ממיכל החנקן הנוזלי והפשרת במהירות את המבחנה באמבט מים ב37 ° c (< 1 דקות).
- פעם אחת בלבד רק מתוך פתית קטן של קרח גלוי, במהירות לבשל ולהעביר את התאים לבקבוקון המכיל טרום מחומם מדיום. לנער בעדינות את הבקבוקון כדי לאפשר ערבוב של תאים עם מדיום הצמיחה.
- מניחים את הבקבוקון בחממה (37 ° c, 5% CO2) ולהתבונן בתאים תחת מיקרוסקופ קל לאחר 2 h כדי לוודא כי התאים מחוברים.
- לאחר התאים לצרף את החלק התחתון של בקבוקון, להסיר את בינוני הגדילה הישן ולהוסיף 10 מ ל של בינונית מראש טרי הצמיחה מחדש להחליף dimethylsulfoxide במדיום הצמיחה הישנה24.
- לאחר 24 שעות, בדוק תחת מיקרוסקופ קל כדי להתבונן בתאים בצורת ציר ולהחליף את מדיום הצמיחה הישנה עם בינוני טרום מחומם מחדש הצמיחה.
- תחזוקת תרביות תאים
- לחדש את מדיום הצמיחה כל יום אחר עד 100% המפגש. בדוק את התאים מתחת למיקרוסקופ לפני הסרת בינוני הגדילה הישן גם לאחר הוספת מדיום צמיחה טרייה. הוציא את הבקבוקון מהאינקובטור ובדוק את התאים המקמקים/D3 מתחת למיקרוסקופ הניגודיות של הפאזה כדי לוודא שהם מופיעים בריאים.
הערה: רוב התאים צריכים להיות מחוברים לתחתית הבקבוקון, יש מורפולוגיה בצורת ציר ופעמים רבות, אור שבירה סביב הקרומים שלהם נראה גם. בינוני הגדילה צריך להיות שקוף (לא מעונן) ו ורדרד-כתום בצבע. - הסרת בינוני גדילה הישן מן הבקבוקון ולהעביר 10 מ ל של בינוני מחומם מראש טרי לתוך הבקבוקון.
הערה: יש להוסיף את המדיום לצד העליון של הבקבוקון ולא ישירות על פני השטח של התאים כדי להימנע מלהשפיע על הקובץ המצורף לתא. - החזירו את הבקבוקון למצב אופקי והציבו אותו בעדינות מספר פעמים ובידקו את התאים במיקרוסקופ/D3 בעזרת מיקרוסקופ לפני החזרת הבקבוקון לחממה (37 ° c, 5% CO2).
- שימו לב לתאים תחת מיקרוסקופ אור הפוך בכל פעם לפני ואחרי טיפול בתאים, הן במהלך עבודת תרבות רגילה ובמהלך ניסויים. הקלט שינויים בולטים במספר התאים או במבנה מורפולוגיה במחברת המעבדה.
- לחדש את מדיום הצמיחה כל יום אחר עד 100% המפגש. בדוק את התאים מתחת למיקרוסקופ לפני הסרת בינוני הגדילה הישן גם לאחר הוספת מדיום צמיחה טרייה. הוציא את הבקבוקון מהאינקובטור ובדוק את התאים המקמקים/D3 מתחת למיקרוסקופ הניגודיות של הפאזה כדי לוודא שהם מופיעים בריאים.
- הפסיית תא
- דגירה T75 תרמוס חדש עם 8.5 mL של תמיסת קולגן עבור 1 h בחממה (37 ° צ', 5% CO2).
- להסיר את התמיסה קולגן בעדינות לשטוף את הבקבוקון עם PBS מעוקר. הוסף 10 מ ל של מדיום מחומם מראש/D3 לבקבוקון החדש ומניחים את הבקבוקון בחממה (37 ° c, 5% CO2).
- קחו את הבקבוקון מהאינקובטור ובחנו את התאים המקמקים/D3 מתחת למיקרוסקופ בניגוד פאזה כדי לבדוק אם התאים הם 100% שוטפת.
- הסירו את המדיום הנייד מהבקבוקון המכיל תאים ושטוף את התאים המכילים 10 מ ל של PBS.
הערה: FBS הוסיף למדיום צמיחה מכיל מעכבי פרוטאז כגון α1-antitrypsin ו α2-macroglobulin. אלה מעכבים את תהליך הטריסיזציה. לכן, חיוני לשטוף את התאים עם PBS כדי להסיר עקבות של FBS כדי למנוע עיכוב של תהליך טריסיזציה. - הוסף 1 מ ל של 0.25% טריפסין פתרון המכיל 0.02% EDTA ו טריציזציה עבור 2-5 דקות בחממה (37 ° c, 5% CO2) (הקש על הבקבוקון בעדינות על הצדדים כדי לעזור לניתוק).
הערה: לעולם אל תשאירו את התאים בטריפסין/EDTA במשך יותר מ 6 דקות. - הוסף 10 מ ל של מדיום מחומם מראש/D3, כדי להפסיק את תהליך הטריסינזציה ולהשעות מחדש את התאים באמצעות ליטוף מספר פעמים. לאחר מכן, הסר את השעיית התאים כולו מהבקבוקון לתוך שפופרת של 15 מ ל.
- העבר 1 מ ל של השעיית התא מ 15 מ ל לבקבוקון החדש עם בינוני מחומם מראש טרי (פיצול תאים 1:10) ולהחזיר את הבקבוקון החדש בחזרה לחממה.
הערה: לפני המעבר אל הבקבוקון החדש, פיפטה התא ההשעיה מעלה ומספר פעמים כדי למזער את מעברי הריכוז של התא.
2. ציפוי תאים
- מניחים התרבות רקמה מוסיף עם מיקרונקבובי ממברנות (גודל הנקבוביות: 0.4 μm, חומר: פוליאתילן terאפרון (PET)) לצלחת תרבות 24-היטב.
- הוסף 400 μL של סוג קולגן אני (0.15 mg/mL) בכל תרבות רקמה להוסיף ו מודטה עבור 1 h ב חממה CO2 (37 ° צ', 5% CO2). רוק את הצלחת 24-טוב בעדינות כדי לאפשר אפילו הפצת הפתרון קולגן על קרום מיקרונקבובי של התרבות רקמה מוסיף.
- הסר את התמיסה קולגן בעדינות לשטוף את קרום מיקרונקבובי עם 0.4 mL של מאגר ה-PBS 1x.
- מיכלי הפלטה/D3 תאים עם צפיפות של 50,000 תאים/cm2 בתא מוסיף (15,000 תאים ב 500 μl של בינוני).
הערה: כדי למזער את ההבדלים במספר התאים של כל הוספת תרבות הרקמה, השעיית התא הושעה עם הצינורות 10 מ ל לפני הוספת תאים לתוספות. - מניחים את צלחת 24 הטוב עם הגדרת תרבות רקמות בחממה (37 ° c, 5% CO2) כדי לאפשר תא מצורף והתפשטות.
- מודקת את הצלחת 7 ימים כדי לאפשר לתאים להגיע 100% שליטה. הסר את אמצעי הצמיחה בכל יום אחר והעבר 0.5 mL של מדיה מראש טרי מחומם לתוך מוסיף תרבות רקמות.
- חזור על הליך הציפוי (שלבים 2.2-2.6) על צלחת 12-היטב, 48-צלחת ובכן 96 בצלחת. השתמש בצלחת 12-טוב עבור הכתמים המערביים כדי לקבוע שינויים בביטוי ZO-1. השתמש בצלחת 48-ובכן עבור העברה של DNA NP. השתמש בצלחת 96-ושוב לקביעת הכדאיות של ה-ATP כדי לקבוע את יכולת הקיום של התא בתאים מזוהמים.
3. קינטיקה של צמיחת תאים.
- זרע את התאים בצפיפות של 50,000 תא/ס מ2 ב קולגן מצופה בצלחת תרבות הרקמה 24.
- בכל יום של הניסוי, להסיר את בינונית צמיחה בעדינות לשטוף את התאים פעמיים עם 500 μL של 1x PBS. לאחר מכן, הוסף 30 μL של 0.25% טריפסין פתרון המכיל 0.02% EDTA ולהשאיר את הלוח עבור כ 2-5 דקות בחממה (37 ° c, 5% CO2).
הערה: היווצרות הדרגתי של מונאולייר עשוי להשפיע על היקף הניתוק התאי והכרחי כדי להגדיל את הכרכים של טריפסין/EDTA כפי שמצוין כאן: 30 μL עבור 1-5 ימים לאחר זריעה, 60 μL עבור 6-7 ימים לאחר זריעה ו100 μL עבור 8-10 ימים שלאחר זריעה . - הוסף גם את 470 μL, 440 μL או 400 μL של בינוני גדילה מבוסס על עוצמת הקול של טריפסין/EDTA שנוספו בשלב 3.2 כדי להכין 500 μL של השעיית תאים בכל באר.
- להשעות את התאים על ידי ליטוף למעלה ולמטה בכל היטב מספר פעמים ולהתבונן בתאים תחת מיקרוסקופ כדי לוודא שכל התאים מושעים במדיום הצמיחה. אם תאים מסוימים עדיין מחוברים ללוח לאחר ליטוף מספר פעמים, בעדינות לגרד את התאים באמצעות מגרד תא פלסטיק כדי להקל על התנתקות התא.
- להסיר 0.1 mL של השעיית התא מ 500 μL התא הבולם בשלב 3.3 ולהוסיף שפופרת משנת mL 1.5. אז, להוסיף 0.1 mL של 0.4% הפתרון הכחול של טרילאן להשעיה התא ולערבב היטב.
- נקו את המימקטוטר עם. אלכוהול איזופרופיל 70% הוסף 20 μL של תערובת משלב 3.5 בכל צד ב V-groove ולאתר את 16 הריבועים מתחת למיקרוסקופ. 16 הריבועים נחשבים לרשת אחת. אתר שתי רשתות אקראיות בכל צד של ההאקמיטר וספור את כל התאים החיים שאינם כחולים.
הערה: תאים שהופיעו בצבע כחול מחוץ לספירה, < 1% מהתאים הכחולים מוכתמים בכל נקודות הזמן. - חשב את צפיפות התא (תאים/cm2) בהתבסס על הנוסחאות הבאות.
ממוצע של תאים/רשת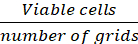 = (Eq .1)
= (Eq .1)
מקדם דילול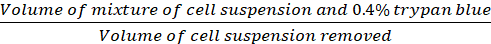 = (Eq .2)
= (Eq .2)
צפיפות תא (תאים קיימא/cm2) =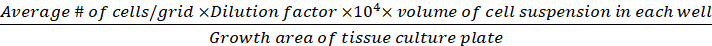
(Eq .3)
משוואות 1-3. תאים קיימא הם מספר התאים הנספרים בכל רשת, מספר רשתות תואמות את מספר הרשתות הממוקמות תחת המיקרוסקופ, נפח של תערובת של ההשעיה התא ו 0.4% טרילאן כחול הוא נפח הכין בשלב 3.5, נפח של השעיית תא הוסר הוא את אמצעי האחסון הוסר מתוך 500 μL תא השעיית בשלב 3.5, נפח ההשעיה של התא בכל באר היא 500 μL התא השעיית משלב 3.3, אזור הצמיחה של צלחת תרבות הרקמה הוא אזור הצמיחה של הבאר יחיד בצלחת 24-באר.
4. לוציפר הצהוב חדירות לכאורה (LY P app ) שיטת
- לקביעת האפליקציה LY P בכל יום שלאחר זריעה, בצע את השלבים החל 4.3. לקביעת האפליקציה P ב-Transfected/D3 תאים, להוסיף 8.3 μl של ניסוח החצייה (איור 1) מעורב עם 50 μl של הצמיחה המלאה בינונית ו-הדגירה של 4 h. מתאר את הניסוחים מתוארים בסעיף 5.
- לאחר העברה של 4 שעות, בעדינות לשטוף את הצד השני של פסגה פעמיים באמצעות מאגר מעוקר 1x PBS כדי להסיר תערובת שיורית הזיהום. כמויות שונות של מאגר PBS שנשאר מאחור לאחר ההסרה יכול להשפיע על הריכוז של LY בצד פסגה. לדאוג להבטיח כי שיורית מאגר PBS בתוך מוסיף תרבות הרקמה מוסר לחלוטין. מאחד בזהירות ריאגנטים שיורית ובינוני כדי למזער את הניתוק התא.
הערה: ניתן לדלג על שלב זה בעת מדידת חדירות לכאורה של כל יום (Papp) של תאים מימן/D3. - הסר את בינוני הצמיחה ולהוסיף 1.5 mL של טרום מחומם (37 ° c) מאגר התחבורה (25 מ"מ HEPES, 145 mM הנאקל, 3 מ"מ KCl, 1 מ"מ CaCl2, 0.5 Mm MgCl2, 1 מ"מ בלבד2פו,5 מ"מ גלוקוז, pH 7.4) בצד basolateral.
הערה: הנפח של מאגר הובלה בכל התאים הבאולםצלעות צריך להיות שווה כדי להבטיח דיוק של חישוב מקדם חדירות. - הוסף 58.3 μL של 20 הפתרון μM LY לצידו האפירשמי של כל הוספת transwell. שמור 50 μL של 20 הפתרון μM LY עבור מדידות פלואורסצנטית. לאחר הסרת מאגר PBS שיורית מהצד פסגה לחלוטין, להוסיף פתרון LY מהר ככל האפשר כדי למנוע ייבוש בתאי מימן/D3. הקפידו על כמויות מדויקות של פתרון LY בצידו האחר.
הערה: כדי למזער את הדעיכה של עוצמת הקרינה הפלואורסצנטית, יש להגביל את חשיפת האור. לאחר שהאבקה של LY מחודשת, יש לאחסן את הפתרון ב -4 ° c, מוגן מפני אור. - דגירה של שייקר צלחת רוטרי (37 ° צ', 100 rpm) עבור 60 דקות. לאחר מכן, להסיר 30 μl של דגימת LY מכל תא פסגה. לאחר מכן להעביר את הפתרון 20 μm LY ואת דגימות צד פסגה לצינורות התווית מראש ולדלל את המדגם 10-קיפול באמצעות מאגר הובלה.
הערה: נדרש כדי לדלל את 20 מניות μm לפתרון המניה ואת הדגימות בצד פסגה כי עוצמת הזריחה גבוהה של דגימות אלה עלול לגרום לעומס יתר ולפגוע גלאי הזריחה של קורא מיקרופלייט זריחה. - הסר 500 μL מתוך כל תא בזלת צלעות ולהעביר את הדגימה לצינורות המסומנות מראש.
הערה: הדגימות מוסרות ממעברים נפרדים בנקודות זמן שצוינו. נקודות הזמן הן כל יום שלאחר זריעה החל ביום 1 עד יום 10. - הכינו סדרה של תקני LY לעיקול סטנדרטי (39.00 nM, 78.13 nM, 156.25 nM, 312 nM, 625 nM, 1250 nM, 2500 nM).
- הוסף 100 μl של כל תקן (בשכפול), מדגם פסגה ובאסולצלעות לכל טוב בצלחת שחור 96-באר (איור 1).
הערה: הצלחות השחורות קולטות אור ומפחיתות את הרקע והצטלבות הקרינה הפלואורסצנטית בין הבארות. - השתמש בקורא מיקרופלייט פלואורסצנטית (נקודות להגדיר: עירור 428 nm, פליטה 536 nm) כדי למדוד את עוצמת הקרינה הפלואורסצנטית לחשב אתהאפליקציהP. קורא צלחת פלואורסצנטית משמש למחקר זה.
- חישוב ערכי השחזורשל P ו -% LY כפי שמתואר בטקסט כתב היד.
משוואה 4. מערך לחישוב ערכיapp .
לחשב את החדירות לכאורה (Papp) מקדם ואת% LY התאוששות באמצעות משוואות הבאות. יש לציין כי הערכים Papp יכול להיות מחושב או מבוסס על המסה25 או ריכוז LY.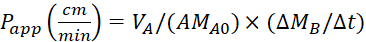 או
או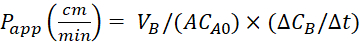
VA -כרך בתוך התא הרשמי
וי.
א-השטח של קרום להוסיף transwell (0.3 ס מ2)
MA0 -המסה הראשונית בתוך תא הקודקוד
ΔMB/Δt-שינוי המסה לאורך זמן בתא הבאסוללי
CA0-הריכוז הראשוני באגף האפירשמי
ΔCB/Δt-השינוי בריכוז לאורך זמן בתוך התא באסיניום.
משוואה 5. כיצד לחשב את% LY התאוששות.
שחזור (%)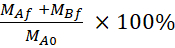
MAf הוא המסה בתא פסגה בנקודת הזמן בסוף, אםBf הוא המסה בתא באסולצלעות בנקודת הזמן בסוף, mA0 הוא המסה הראשונית בתא פסגה. 26 הערה: המסה הראשונית מחושבת על בסיס הנפח של הפתרון 20 μm בשלב 4.5. ניסוי זה נעשה תמיד באמצעות תאים לפי מעבר מספר 35 ובוצע ארבע פעמים עצמאיות.
5. המחסור בסידן
- הסר את בינוני הגדילה מתוך מוסיף transwell הצלחת 12-באר ולשטוף בעדינות את הצד האפל ואת הצלחת 12-באר באמצעות בינונית מחומם מראש ללא סידן (מינימלי חיוני מדיום נשר טווה (S-הגברת) בינונית) כדי להסיר יוני סידן מתוך מוסיף טרנסטוב ו-12 מיטב צלחות.
- הוסף 500 μL או 2 מ ל של טרום מחומם-מנות 1xmedium כדי מוסיף או 12-באר צלחת ו דגירה עבור 24 h בחממה (37 ° c, 5% CO2). לאחר הדגירה, להסיר את בינוני S-הגברת 1x ולשטוף את התאים פעם אחת באמצעות טרום מחמם 1x מאגר PBS.
- בצע את השלבים 4.4-4.10 המתואר בסעיף 4 עבור טיפול LY והשלבים הבאים. בצע את השלבים 8.1.2-8.2.4 שתוארו בסעיף 8 עבור בלוק מערבי והשלבים הבאים.
6. מעבר חצייה
- הכנת חלקיקי דנ א (NPs DNA).
- לדלל את הפתרון של המניה של gWIZ-לוק פלאמיד ב 10 מילימטר אצטט סודיום (NaAc) מאגר (pH 5.0) ולאפשר את פתרון ה-DNA לעמוד 10 דקות בטמפרטורת החדר (RT).
הערה: ה-DNA NP המכיל בעיקר מולקולות DNA אחת ניתן להכין ב ריכוזי DNA 20-40 μg/mL23. כך, הפתרון מניות gWIZ-לוק פלמיד צריך להיות מדולל. המלאי הקפוא gWIZ-לוק פלאמיד צריך להיות מופעד לחלוטין על הקרח כדי למזער את המתח בטמפרטורה. מערבולת בעדינות פתרון מלאי ה-DNA מדולל עבור 30 s על הקבוע שחקן ספסל העליון מוגדר במיקום כפתור 3-5. - חשב את יחסי N/P הרצויים, המשמשים כאן כפרמטר מספרי כדי לשקף את הרכב NP.

משוואה 6. חישוב היחס של N/P: היחס של שומות של קבוצות האמין של פולימרים המסובבים לאלה של קבוצות פוספט של דנ א. המסה של פולימרים משמעותה כמות כוללת של מפולימר הכולל שקלים; (מסה/מטען) פולימרים מתייחסים למשקל המולקולרי של הפולימר המוריק (בלוק) 5k-block-polyaspart עם 48 diethylenetriamine שרשראות צד (יתד-DET)) מנורמל למספר של אמינים הראשי טעונה (48) לכל הפולימרים ( מול), ערך זה עבור הפולימר שלנו הוא 306 Da; המסה של ה-DNA פירושו כמות מוחלטת של ה-DNA בשימוש ניסוח שהושג על ידי הכפלת עוצמת הקול והריכוז ב-mg/mL; (מסה/מטען) ה-dna מתייחס המשקל המולקולרי של דנ א מנורמל למספר של הקבוצה פוספט לכל כפול תקוע dna (325 Da לכל נוקלאוטיסיס).
הערה: ה-DNA NP הכנת הטבלה (טבלה 1) מכיל את המתכון ניסוח עבור דגימות שונות נבדק בניסויים שלנו. DNA NP היו מוכנים באמצעות טכניקת טיטור מהירה. פתרון הפולימר יתד-DET התווסף לאורך קירות הצינור תוך החזקת הצינור במצב אופקי. לאחר מכן הצינור הוחלף למצב אנכי, ואחריו במהירות vortexing במהירות מקסימלית עבור 10s. ה-DNA NP הורשו לעמוד 30 דקות ב-RT לפני השימוש. החוק של האגודל עבור מינון DNA NP הוא 0.5 μg DNA עבור ca. 1 ס מ2 אזור הצמיחה. So, עבור כל הוספה transwell/כל טוב בצלחת 48-באר/כל טוב בצלחת 96-באר, להכין את ה-DNA NP ב N/P 10 המכיל/0.5/0.195 μg/טוב של DNA gWIZ-לוק. - עבור דגימות המכילות ריכוז מצוין של Poloxamer P84 (P84), להוסיף P84 ל-DNA NP ו מערבולת עבור 5 s. הריכוז הסופי של P84 בכל מדגם הוא או 0.01% או 0.03% wt.
- לדלל את הפתרון של המניה של gWIZ-לוק פלאמיד ב 10 מילימטר אצטט סודיום (NaAc) מאגר (pH 5.0) ולאפשר את פתרון ה-DNA לעמוד 10 דקות בטמפרטורת החדר (RT).
- הזיהום של דנ א NP בהתקנת צלחת 48
- זרע את התאים עם צפיפות של 50,000 תא/ס"מ2 ב 48 צלחת הבאר ולגדול עד המפגש בחממה (37 ° c, 5% CO2).
- עבור כל קבוצת טיפול, לערבב 25 μL של המדגם שצוין (ניסוח החצייה) ו-150 μL של הצמיחה המלאה בינונית ו 175 μL של תערובת זו לכל טוב.
- שימו לב לתאי הhmec/D3 שמתחת למיקרוסקופ כדי להבטיח שהתאים ייראו בריאים והם 100% שוטפת בזמן הניסוי.
- להסיר את מדיום הצמיחה מבארות ו 175 μL תערובת הזיהום לכל באר. לאחר מכן, מודקת את הצלחת 4 שעות בחממה (37 ° c, 5% CO2).
- לאחר 4 שעות, הסר את תערובת התרגום ושטוף את התאים המממקים/D3 עם מאגר מחומם מראש של 1x PBS.
הערה: כדי למזער את הניתוק המקרי של תאי הקימקמקים/D3 ממשטח/הוספת משטח במהלך שלבי הכביסה, הצינורות היטב מספיק PBS לאורך קירות הבארות ומסירים את כל החלקיקים שבמדיית התרבות השיורית. - בעדינות לנדנד את הצלחת כמה פעמים ובזהירות למחוק ולהשליך את כביסה PBS ולהוסיף 500 μL של מדיום התרבות הקדם-מחמם/D3.
- בדוק באופן מיקרופיטאי את התאים ותעד תצפיות על מורפולוגיה של תאים ועל כל השפעות אפשריות של העברה.
- מודטה עבור 24 שעות בחממה 37 התרבות תא ° c כדי לאפשר ייצור לוציפראז. לאחר 24 שעות, להסיר בינונית הצמיחה לחלוטין לשטוף את התאים פעם אחת עם הקדם מחומם 1x PBS.
- לאחר התאים מזוהמים על ידי הוספת 100 μl של קרח קר ללוציפראז תרבות התא לליזה 1x מגיב לכל טוב.
- עבור מדידה של התוכן חלבון לוציפראז, להוסיף 20 μL של תא ליפוסט ו-100 μL של מאגר שיטת לוציפראז (20 מ"מ גליציליצין (pH 8), 1 מ"מ MgCl2, 0.1 MM edta, 3.5 מ"מ dtt, 0.5 mm ATP, 0.27 מ"מ co a) לתוך שפופרת בגודל
- קרא את הלויונציה של המדגם המתואר בשלב 6.2.10 על לומימטר עם מזרק אוטומטי אחד.
הערה: האור צריך להיות משולב מעל 10 s לפני הקריאה. - מדוד את הכמות הכוללת של חלבון התאים בתוך הליפוסט באמצעות שיטת החומצה הבינותית (שיטת BCA) בהתאם לפרוטוקול של היצרן.
- לחשב ולבטא ביטוי גנים ללוציפראז כיחידות אור יחסית (rlu) לכל חלבון הסלולר הכולל.
7. שיטת ה-ATP הזורח
- זרע את התאים עם צפיפות של 50,000 תא/ס"מ2 ב 96 צלחת הבאר ולגדול עד המפגש בחממה (37 ° c, 5% CO2).
- העבר את התאים עם 9.7 μL של ניסוח החצייה (פרטי ההכנה נמצאים בסעיף 6) ו 58.4 μL של מדיום צמיחה מלאה עבור 4 h.
- הסר את תערובת הטיהור ולשטוף בעדינות את התאים עם מאגר מראש מחומם של PBS 1x פעמיים כדי להסיר את הטיפול ריאגנטים לחלוטין.
הערה: כמויות שונות של מאגר שיורית עלולות לדלל את היכולות של מאגרי ה-ATP במידה שונה ועלולות להשפיע על הנתונים. - מערבבים 75 μL של מדיום טרי מחומם מראש ושיטת ATP מגיב ב-1:1 דילול באמצעות פיפטה רב-ערוצי. ודא שרמת הנוזל בכל העצות של הצינורות הרב-ערוצית זהה.
- הניחו את הצלחת על משטח של 15 דקות בטמפרטורת החדר. לאחר 15 דקות של הוספת ריאגנטים, להעביר 60 μL של כל מדגם לתוך לבן 96 בצלחת.
הערה: לוחות לבנים עדיף לשקף את אור הפלט מאשר צלחות ברורות או שחורות. - פופ כל בועות אוויר באמצעות מחט לפני קריאת הצלחת. קרא את הלוחית על הלומטר. עם זמן אינטגרציה של 1 לקרוא את הצלחת בתוך 20 דקות לאחר הוספת של שיטת ATP ריאגנטים. התזמון הוא קריטי להשוואה בין צלחות שונות, מכיוון שהאות האור חולף עם קצב דעיכה מהיר.
- חישוב האחוז (%) הכדאיות התאית באמצעות נוסחה זו: (לומינציה של תאים מזוהמים/הזדקנות בקרה, תאים לא מטופלות) x 100.
8. בלוק מערבי למדידת חלבון הצומת הדוק ZO-1
-
פירוק תאים והפקת חלבון
הערה: יש לבצע את כל השלבים להפקת חלבון מתאים ב-2-8 ° c.- זרע את התאים בצפיפות של 50,000 תא/cm2 ב קולגן מצופה העור 12-היטב הרקמה לוחית.
- ביום 3, יום 5, יום 7, יום 10 לאחר זריעה וביום 7 (תאים טרום מודבטים עם סידן בינוני חופשי), להסיר את בינונית צמיחה בעדינות לשטוף את התאים פעמיים עם 2 מ ל של קרח קר 1x PBS. לאחר מכן, להוסיף 300 μL תערובת של קרח קר 1x מאגר הליזה ריפה המכיל 3 μg/mL aprotinin נין בכל באר.
הערה: יש לעשות את התערובת טרייה ולשמור על הקרח. אספנין משמשת כדי לעכב את הנוכחות של הפרוטטים מפני משפילים את חלבון הריבית. - לאחר שני מחזורי הקפאת ההפשרה (-80 ° c), לגרד את התאים באמצעות מגרד תא פלסטיק קר. לאסוף את lysates תא בצינורות microfuge. לאחר מכן, צנטריפוגה את הצינורות ב 200 x g עבור 30 דקות ב 4 ° c.
- לאסוף את supernatant לתוך צינורות נקיים ולמקם אותם על קרח. מדוד את הכמות הכוללת של חלבון תאי ב-lysates באמצעות ערכת הספק BCA על-ידי ביצוע פרוטוקול היצרן.
-
בלוק מערבי לגילוי של חלבון הצומת הדוק ZO-1
- הספרות הכוללת הומומטר הכולל 40 μg של חלבון מוחלט עם מאגר 1x laemmli ב 95 ° צ', 5 דקות ובכפוף לאלקטרופורזה בהפחתת 6-7.5% נתרן dodecyl סולפט אלקטרופורזה ג'ל (sds-PAGE) (90 v, 10 דקות דרך הערמה ג'ל, 120 V עד לפתור ג'לים).
הערה: בעת טעינת הדגימות או התקנים, זכור לטעון לאט ובזהירות לתוך כל נתיב, להיזהר לא לשבור את הבאר בתהליך. - להעביר את החלבונים המופרדים על קרום ניטרוצלולוזה עם מאגר העברת pH 8.5 אשר מכיל 192 mM גליצין, 25 מ"מ בסיס טריס, 10% מתנול ו 0.1% SDS (75 V, 110 דקות בטמפרטורת החדר).
הערה: אל תגעו בקרום. השתמש 70% איזופנול מלקחיים פלסטיק שנשטפו כדי להתמודד עם קרום. כדי להעביר בהצלחה את החלבון ZO-1 (MW 200 kDa) לקרום, ה-pH צריך להיות בסביבות 8.3-8.5. אם מאגר ההעברות הוא יותר חומצי מזה, ההעברה לא תתרחש. אם להקות הסולם גלויות עדיין על ג'ל, זה יעזור להגדיל את זמן ההעברה ואת הריכוז SDS. - לאחר שטיפת הקרום באמצעות מלוחים טריס באגירה המכיל 0.1% רצף 20 (T-TBS), להשתמש בפתרון חסימה (1:1 LiCOR-אודיסיאה לחסום: 1x טריס מלוחים באגירה) כדי לחסום את הקרומים עבור 60 דקות.
- חותכים בזהירות את הקרום לשתי רצועות. דגירה עם שני נוגדנים הראשי (זה-1 נוגדן חד שבטיים, דילול, 1:900, ו גליצראלדהיד 3-פוספט דהידרוגנאז (החוצה) נוגדן, דילול, 1:10,000) לילה ב 4 ° c. לאחר מכן, מעכנות את הקרומים של ZO-1 ומטה עם החמור נגד העכבר IgG (דילול, 1:50,000). לאחר שטיפת הקרומים באמצעות T-TBS, התמונה הקרומים בערוץ 700 על האימנגר 16-bit.
- הספרות הכוללת הומומטר הכולל 40 μg של חלבון מוחלט עם מאגר 1x laemmli ב 95 ° צ', 5 דקות ובכפוף לאלקטרופורזה בהפחתת 6-7.5% נתרן dodecyl סולפט אלקטרופורזה ג'ל (sds-PAGE) (90 v, 10 דקות דרך הערמה ג'ל, 120 V עד לפתור ג'לים).
תוצאות
ראשית, קבענו את ההשפעה של זמן התפירה על חדירות LY לקבוע את הקינטיקה לכאורה של היווצרות TJ. ערכיApp P ממוצע מיום 1 עד 10 הצבת זריעה מוצגים באיור 2a. ביום 1,app ממוצע P היה 4.25 x 10-4 ס"מ/דקה וירד מעט ל 3.32 x 10-4 ס"מ/min ביום 2. ערך Papp ממוצע מעט גדל כדי ...
Discussion
תפקיד מרכזי של BBB הוא למנוע חילופי יונים לא חיוניים וחומרים רעילים בין המחזור הסיסטמי והמוח כדי לשמור על הומוסטאזיס של מיקרואקולוגיה עצבית. אחת התכונות האופייניות של ה-BBB היא היכולת של תאי האנדותל הקפיציאל ליצור צמתים הדוקים (TJs) החותמות ביעילות את תוואי התחבורה של הקרנף. הדגמנו באופן LYap...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
המחברים הם אסירי תודה על התמיכה הפיננסית של 2017 החוקר החדש של האגודה האמריקנית של בית המרקחת, הונקלאי מחלה חשש פרס מאוניברסיטת דוקיין ובית הספר של בית המרקחת כספים הפעלה עבור מעבדת Man,. אנחנו רוצים להודות המעבדה דליפה (האוניברסיטה דוקיין) עבור סיוע מערבי לחסום ומאפשר להשתמש האודיסיאה שלהם 16-bit imager. כמו כן, היינו רוצים לכלול מכתב הערכה מיוחד לקנארפ דייב (מעבדת מאנאיקרוס) לעזרה עם הכתמים המערביים.
Materials
| Name | Company | Catalog Number | Comments |
| hCMEC/D3 cell line | Cedarlane Laboratories | 102114.3C-P25 | human cerebral microvascular endothelial cell line |
| gWizLuc | Aldevron | 5000-5001 | Plasmid DNA encoding luciferase gene |
| lucifer yellow CH dilithium salt | Invitrogen | 155267 | |
| Transwell inserts with polyethylene terephthalate (PET) track-etched membranes | Falcon | 353095 | |
| Tissue culture flask | Olympus Plastics | 25-207 | |
| 24-well Flat Bottom | Olympus Plastics | 25-107 | |
| Black 96-Well Immuno Plates | Thermo Scientific | 437111 | |
| S-MEM 1X | Gibco | 1951695 | Spinner-minimum essential medium (S-MEM) |
| EBM-2 | Clonetics | CC-3156 | Endothelial cell basal medium-2(EBM-2) |
| phosphate-buffered saline 1X | HyClone | SH3025601 | |
| Collagen Type I | Discovery Labware, Inc. | 354236 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | |
| Cell Culture Lysis 5X Reagent | Promega | E1531 | |
| Beetle Luciferin, Potassium Salt | Promega | E1601 | |
| SpectraMax i3 | Molecular Devices | Fluorescence Plate Reader | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| ZO-1 Polyclonal Antibody | ThermoFisher | 61-7300 | |
| anti-GAPDH antibody | abcam | ab8245 | |
| Alexa Fluor680-conjugated AffiniPure Donkey Anti-Mouse LgG(H+L) | Jackson ImmunoResearch Inc | 128817 | |
| 12-well, Flat Bottom | Olympus Plastics | 25-106 | |
| RIPA buffer (5X) | Alfa Aesar | J62524 | |
| Aprotinin | Fisher BioReagents | BP2503-10 | |
| Odyssey CLx imager | LI-COR Biosciences | for scanning western blot membranes |
References
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology Of Disease. 37 (1), 13-25 (2010).
- Griep, L. M., et al. BBB on chip: microfluidic platform to mechanically and biochemically modulate blood-brain barrier function. Biomedical Microdevices. 15 (1), 145-150 (2013).
- Camos, S., Mallolas, J. Experimental models for assaying microvascular endothelial cell pathophysiology in stroke. Molecules. 15 (12), 9104-9134 (2010).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow & Metabolism. 28 (2), 312-328 (2008).
- Wolff, A., Antfolk, M., Brodin, B., Tenje, M. In vitro Blood-Brain Barrier Models-An Overview of Established Models and New Microfluidic Approaches. Journal of Pharmaceutical Sciences. 104 (9), 2727-2746 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmaceutics. 10 (1), 289-296 (2013).
- Tornabene, E., Brodin, B. Stroke and Drug Delivery--In vitro Models of the Ischemic Blood-Brain Barrier. Journal of Pharmaceutical Sciences. 105 (2), 398-405 (2016).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Llombart, V., et al. Characterization of secretomes from a human blood brain barrier endothelial cells in-vitro model after ischemia by stable isotope labeling with aminoacids in cell culture (SILAC). Journal of Proteomics. 133, 100-112 (2016).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- Avdeef, A. How well can in vitro brain microcapillary endothelial cell models predict rodent in vivo blood-brain barrier permeability?. European Journal of Pharmaceutical Sciences. 43 (3), 109-124 (2011).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Shao, X., et al. Development of a blood-brain barrier model in a membrane-based microchip for characterization of drug permeability and cytotoxicity for drug screening. Analytica Chimica Acta. 934, 186-193 (2016).
- Walter, F. R., et al. A versatile lab-on-a-chip tool for modeling biological barriers. Sensors and Actuators B: Chemical. 222, 1209-1219 (2016).
- Cecchelli, R., et al. In vitro model for evaluating drug transport across the blood–brain barrier. Advanced Drug Delivery Reviews. 36, (1999).
- Cecchelli, R., et al. Modelling of the blood–brain barrier in drug discovery and development. Nature reviews Drug discovery. 6 (8), 650 (2007).
- Reichel, A., Begley, D. J., Abbott, N. J. . The Blood-Brain Barrier. , 307-324 (2003).
- Deli, M. A., Ábrahám, C. S., Kataoka, Y., Niwa, M. Permeability Studies on In vitro Blood–Brain Barrier Models: Physiology, Pathology, and Pharmacology. Cellular and Molecular Neurobiology. 25 (1), 59-127 (2005).
- Ren, T. B., et al. A General Method To Increase Stokes Shift by Introducing Alternating Vibronic Structures. Journal of the American Chemical Society. 140 (24), 7716-7722 (2018).
- Pack, D. W., Hoffman, A. S., Pun, S., Stayton, P. S. Design and development of polymers for gene delivery. Nature Reviews Drug Discovery. 4 (7), 581-593 (2005).
- Oupický, D., Konák, C., Ulbrich, K., Wolfert, M. A., Seymour, L. W. DNA delivery systems based on complexes of DNA with synthetic polycations and their copolymers. Journal of Controlled Release. 65, (2000).
- Couraud, P. O. . The hCMEC/D3 CELL LINE: IMMORTALIZED HUMAN CEREBRAL MICROVASCULAR ENDOTHELIAL CELLS As a model of human Blood-Brain Barrier. , (2012).
- Youdim, K. u. r. e. s. h. A., A, A. A. a. N. J. In vitro trans-monolayer permeability calculations: often forgotten assumptions. research focus reviews. 8, (2003).
- Eigenmann, D. E., Xue, G., Kim, K. S., Moses, A. V., Hamburger, M., Oufir, M. Comparative study of four immortalized human brain capillary endothelial cell lines, hCMEC/D3, hBMEC, TY10, and BB19, and optimization of culture conditions, for an in vitro blood-brain barrier model for drug permeability studies. Fluid and Barriers of the CNS. 10 (33), (2013).
- Hubatsch, I., Ragnarsson, E. G. E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Balda, M. S., Anderson, J. M. Two classes of tight junctions are revealed by ZO-1 isoforms. The American Physiological Society. , (1992).
- Brown, R. C., Davis, T. P. Calcium Modulation of Adherens and Tight Junction Function: A Potential Mechanism for Blood-Brain Barrier Disruption After Stroke. Stroke. 33 (6), 1706-1711 (2002).
- Gorodeski, G., Jin, W., Hopfer, U. Extracellular Ca2+ directly regulates tight junctional permeability in the human cervical cell line CaSki. American Journal of Physiology-Cell Physiology. 272 (2), C511-C524 (1997).
- Stuart, R. O., Sun, A., Panichas, M., Hebert, S. C., Brenner, B. M., Nigam, S. K. Critical Role for lntracellular Calcium in Tight Junction Biogenesis. Journal of Cellular Physiology. 159, (1994).
- Tobey, N. A. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. , (2004).
- Tobey, N. A., Argote, C. M., Hosseini, S. S., Orlando, R. C. Calcium-switch technique and junctional permeability in native rabbit esophageal epithelium. American Journal of Physiology-Gastrointestinal and Liver Physiology. 286, (2004).
- Posimo, J. M., et al. Viability assays for cells in culture. Journal of visualized experiments : JoVE. (83), e50645 (2014).
- Cipolla, M. J., Crete, R., Vitullo, L., Rix, R. D. Transcellular transport as a mechanism of blood-brain barrier disruption during stroke. Frontiers in Bioscience. 9 (3), 777-785 (2004).
- Kreuter, J. Influence of the surface properties on nanoparticle-mediated transport of drugs to the brain. Journal of nanoscience and nanotechnology. 4 (5), 484-488 (2004).
- Markoutsa, E., et al. Uptake and permeability studies of BBB-targeting immunoliposomes using the hCMEC/D3 cell line. European Journal of Pharmaceutics and Biopharmaceutics. 77 (2), 265-274 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved