A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
A القائم علي اللوحة فحص الخلايا الخلوية لتقييم الفئران المشيمة الطبيعية خليه القاتل Cytolytic وظيفة
In This Article
Summary
هنا ، ونحن نقدم منهجيه مفصله لعزل وتقييم وظيفة السامة للخلايا من الخلايا القاتلة الطبيعية من مشيمة عن طريق فحص لوحه الملونة. تم اختيار نموذج الفئران الضغط ترويه المنخفضة من الاسكيميه المشيمة لإثبات العزلة بوساطة الأجسام المضادة وتقييم الوظيفة السامة للخلايا من الخلايا القاتلة الطبيعية.
Abstract
ومن المعروف جيدا ان خلايا القاتل الطبيعي الساقطيه (NK) تلعب دورا حاسما في إنشاء والحفاظ علي الحمل العادي. وقد أظهرت الدراسات الحديثة السكان المتغيرة من الخلايا المتداولة و الساقطيه NK في النساء الذين يعانون من مضاعفات الحمل السلبية مثل الإجهاض المتكرر ومقدمات الارتعاج. وقد أظهرت الدراسات من مجموعتنا ان ارتفاع ضغط الدم في الحمل يرتبط مع زيادة عدد الخلايا المنشطة NK في المشيمة استنادا إلى التعبير عن علامات التنشيط السطحية. توفر هذه المخطوطة بروتوكولا مفصلا لتقييم الوظيفة السامة للخلايا من خلايا ناغورني كاراباخ المعزولة عن الاسترضاء في نموذج حيواني شبيه بتسمم الحمل من نقص ترويه المشيمة المستحث جراحيا. يتم وصف الخطوات التالية بالتفصيل: توليد تعليق خليه واحده ، وعزل الخلايا NK ، والتحفيز الحيوي السابق ، المستجيب: الخلية المستهدفة الثقافة المشتركة ، وفحص الخلايا الخلوية.
Introduction
تسمم الحمل هو اضطراب ارتفاع ضغط الدم الذي يتسم به تقييد نمو الجنين ، وتلف الأعضاء النهائية ، والتنشيط المناعي المزمن. يؤدي التنشيط المناعي المزمن لدي النساء اللاتي يعانين من الارتعاج إلى زيادة تداول السايتوكينات التهابيه المشيمة ، وعدم التوازن في الخلايا التائية للخلايا ، وزيادة عدد الخلايا النشطة القاتلة الطبيعية (NK)1. وتبين الدراسات التي نشرت مؤخرا من قبل مختبرنا دورا للخلايا ناغورني كاراباخ في التسبب في بعض من الفيزيولوجيا المرضية المرتبطة بمقدمات الارتعاج في نموذج الفئران الضغط Perfusion الرحمية (RUPP) من الارتعاج. باستخدام التدفق الخلوي لقياس التعبير السطحي لعلامات التنشيط علي خلايا ناغورني كاراباخ ، زاد عدد السكان من خلايا ناغورني كاراباخ المنشطة في الدورة الدموية و مشيمة من الفئران rupp مقارنه مع الفئران الحامل العادي (NP) لوحظ2.
لتاكيد الملاحظات تدفق الخلوية ، أجريت دراسات وظيفية لتقييم النشاط السامة للخلايا من الخلايا NK معزولة من مشيمة من الفئران NP و rupp. هناك العديد من الطرق المتاحة لتقييم وظيفة السامة للخلايا من الخلاياCD8 + T السامة للخلايا والخلايا NK. معيار الذهب للتحليل السام للخلايا وظيفية هو فحص الإفراج عن الكروم3. وتشمل البروتوكولات المتقدمة الأخرى المستخدمة التدفق الخلوي4، الصورة الخلوية5، calcein الإصدار6، والأكثر حداثة التالق7. سيوفر هذا الفيديو بروتوكولا مفصلا بشان استخدام المقايسة الراسخة لنازعه الهيدروجين (LDH) لقياس الوظيفة السامة للخلايا في الخلايا NK باستخدام مجموعه المقايسة الخلوية المتاحة تجاريا LDH.
Protocol
تمت الموافقة علي جميع البروتوكولات من قبل اللجنة المؤسسية للعناية بالماشية والاستخدام في المركز الطبي لجامعه ميسيسيبي. وكانت الرعاية والمناولة للحيوانات في اتفاق مع المعاهد الوطنية للصحة المبادئ التوجيهية لعلاج الحيوانية الاخلاقيه.
1. اللمفاوية خليه العزلة من Placentas
- أزاله المشيمة واحده من الرحم الفئران (الحمل يوم 19) ومكان في 10 مل من الجليد الباردة تلفزيوني8.
- وضع المشيمة واحده علي فلتر 100 μm والجلوس في طبق بيتري التي تحتوي علي 13.5 mL من RPMI و 1.5 mL من الحجم الإجمالي هو 15 مل. استخدام الجانب المسطح من حقنه الغطاس لدفع المشيمة من خلال فلتر في طبق بيتري.
- اعداد أنابيب مخروطيه 3 15 mL لكل الانسجه. أضافه 3 مل من الكثافة المتوسطة التدرج (انظر جدول المواد) إلى كل أنبوب ، ثم تراكب بعناية 5 مل من المشيمة المتجانسة في كل أنبوب.
- الطرد المركزي لمده 25 دقيقه في 300 x g في درجه حرارة الغرفة (RT) مع عدم وجود الفرامل. جمع طبقه بافي رقيقه بيضاء مع ماصه النقل.
ملاحظه: بعد طرد ، 3 طبقات مرئية ، و RPMI الحمراء في الجزء العلوي ، وطبقه بافي الأبيض في الوسط ، والكثافة واضحة طبقه متوسطه التدرج في الجزء السفلي. استخدام ماصه نقل لسحب ما يصل طبقه بافي البيضاء من الأنبوب. الجمع بين طبقه بافي من جميع أنابيب المشيمة نفسها في 1 أنبوب. - أضف 10 مل من RPMI إلى طبقات بافي المدمجة. الطرد المركزي لمده 10 دقيقه ، 300 x g، في 4 °c وتجاهل supernatant.
2. عزل الخلايا القاتلة الطبيعية
- أعاده التعليق بيليه الخلية في 50 μL من الجليد الباردة تلفزيوني
- أضف الجسم المضاد CD3 المسمي البيوتين إلى الخلايا المغلفة وفقا لبروتوكول الشركة المصنعة واخلط جيدا مع الماصة. وضع الأنبوب في أنبوب مدور واحتضان 20 دقيقه في 4 درجه مئوية.
- أضافه 1 مل من RPMI ، الطرد المركزي لمده 10 دقيقه في 400 x g و 4 درجه مئوية ، وتجاهل supernatant.
- أعاده التعليق بيليه في 1 مل من RPMI والجمع بين 150 μL من الخرز المغناطيسي في 1.5 mL أنبوب ميكروالطرد المركزي. وضع أنبوب الطرد المركزي في أنبوب دوار وتدوير اثناء احتضان لمده 30 دقيقه في 4 درجه مئوية.
ملاحظه: سحب المخزن المؤقت الإفراج في هذا الوقت والسماح للوصول إلى RT في مجلس الوزراء السلامة الاحيائيه. - ضع الأنابيب في المغناطيس لمده دقيقه واحده. جمع ماده طافي وحفظ السكان CD3 الخلية في أنبوب 15 مل علي الجليد.
ملاحظه: هذا هو CD3- السكان من الخلايا. - أزاله الأنبوب من المغناطيس وأضافه 1 مل من RPMI. خلط الخلايا والخرز 5 مرات مع ماصه.
- كرر الخطوة 2.5.
- الطرد المركزي CD3- السكان من الخلايا لمده 10 دقيقه في 400 x g و 4 درجه مئوية وتجاهل supernatant. أعاده تعليق الخلية بيليه في 50 μL من الجليد الباردة تلفزيوني
- أضافه الأجسام المضادة المسمية البيوتين CD161a إلى خلايا CD3 وفقا لبروتوكول الشركة المصنعة وتخلط جيدا. وضع أنبوب في المدورة أنبوب واحتضان لمده 20 دقيقه في 4 ° c.
- أضافه 1 مل من RPMI ، الطرد المركزي لمده 10 دقيقه في 400 x g و 4 درجه مئوية ، وتجاهل supernatant. أعاده التعليق بيليه في 1 مل من RPMI والجمع بين 150 μL من الخرز المغناطيسي في 1.5 mL أنبوب ميكروالطرد المركزي.
- وضع أنبوب الطرد المركزي في أنبوب دوار وتدوير اثناء احتضان لمده 30 دقيقه في 4 درجه مئوية.
- ضع الأنابيب في مغناطيس لمده دقيقه واحده. جمع ماده طافي وتجاهلCD3-/cd161a-الخلايا .
- أزاله أنبوب من المغناطيس وأضافه 1 مل من RPMI. خلط الخلايا والخرز 5 مرات مع ماصه.
- كرر الخطوة 2.12.
- أزاله أنابيب الطرد المركزي من المغناطيس وأضافه 1 مل من العازلة RT الإفراج. وضع أنبوب علي المدورة أنبوب وتناوب في حين احتضان لمده 15 دقيقه في RT.
- وضع أنابيب في المغناطيس لمده 1 دقيقه. جمع ماده طافي في أنبوب مخروطي جديد 15 مل علي الجليد.
ملاحظه: هذا هو سكان الخلايا NK. - أزاله أنبوب من المغناطيس وأضافه 1 مل من RPMI RT. اخلط الخلايا والخرز 5 مرات مع الماصة.
- كرر الخطوة 2.16 ، وضع ماده طافي في نفس الأنبوب. تخلط جيدا وتاخذ 20 μL عينه لحساب الخلايا
ملاحظه: ابقي الأنبوب علي الثلج - الطرد المركزي CD3-/cd161 a + الخلايا لمده 10 دقيقه ، 400 x g في 4 درجه مئوية ، ثم أزاله supernatant. أعاده تعليق الخلايا في RPMI (10 ٪ من الطراز الأول ، 1 ٪ القلم/بكتيريا ، 2 نانوغرام/مل آيل-2) والبذور في تركيز 3 × 105 خلايا/بئر في 6-بئر لوحه في 2.5 مل من الخلايا NK تنشيط الخلية. احتضان الخلايا ل 48 h في 37 درجه مئوية ، 5 ٪ CO2 في حاضنه ترطيب.
3. فحص الخلايا الخلوية: استرداد الكريات NK أو YAC1 من الثقافة أو تمرير الخلايا
ملاحظه: يجب اجراء جميع الخطوات تحت غطاء محرك السيارت. يجب ان تبقي جميع أنابيب الخلايا علي الجليد في جميع الأوقات.
- استخدام ماصه pipet-x الزجاج المصلي لجمع الخلايا YAC1 ووسائل الاعلام من قارورة ، ووضع في أنبوب 50 mL علي الجليد ، وتخلط جيدا. خذ 20 μL لحساب الخلايا.
- تدور الخلايا YAC1 لمده 10 دقيقه في 300 x g و 4 ° c. عد الخلايا في حين ان هذه هي الغزل.
- أضافه التريبسين/أدتا إلى كل بئر في خليه ناغورني كاراباخ 6-حسنا لوحه. اضغط علي لوحه ومكان في حاضنه.
- بعد ان حضنت الخلايا مع تريبسين/أدتا ل ~ 5 دقيقه في 37 درجه مئوية ، كشط لوحه/قارورة مع مكشطه لوحه معقمه. أضافه 1 مل من الوسائط الخلية NK لكل بئر.
- جمع الخلايا ووسائل الاعلام مع ماصه pipet-x المصلية وجمع في أنبوب الطرد المركزي 15 مل. خذ 20 μL لحساب الخلايا.
- تدور الخلايا NK لمده 10 دقيقه ، 400 x g في 4 درجه مئوية. حساب عينه من الخلايا من الخطوة 3.5 اثناء هذا طرد.
ملاحظه: عرض لوحات الثقافة تحت المجهر قبل التخلص منها للتاكد من عدم وجود المزيد من الخلايا الانضمام إلى الجزء السفلي من الآبار. وبما ان التجربة تستخدم خلايا ناغورني كاراباخ وخلايا YAC1 ، تاكد من حساب كل واحده علي حده. - عد الخلايا وأعاده التعليق عند التركيزات المحددة في تجارب التحسين لاختبار العدد المناسب من الهدف: نسبه المستجيب. سيتم تحقيق ذلك عن طريق أعاده تعليق بيليه في وسائل الاعلام المقابلة لها لجعل تركيزات الخلية التالية: YAC1 في 4 × 105 خلايا/مل والخلايا NK في 2 × 107 خلايا/مل.
4. فحص السمية الخلوية: بروتوكول الفحص
- استخدام القاع المستديرة ، ومعالجه الثقافة لوحه 96 البئر لاعداد لوحه علي النحو المقترح في الجدول 1. يعرض هذا الجدول عناصر التحكم التجريبية و 3 مجموعات من الاعمده التجريبية NK. ويمكن توسيع هذا إلى ما مجموعه 10 الاعمده التجريبية NK في لوحه 96.
- الطرد المركزي لوحه الفحص في 250 x g ل 4 دقيقه للتاكد من ان الخلايا المستهدفة والهدف هي علي اتصال. احتضان لوحه 96-بئر لمده 5 ساعات في حاضنه غرفه ترطيب في 37 درجه مئوية ، 5 ٪ CO2 لتحقيق اتصال وافر بين الخلايا المستهدفة والمستجيب وتحلل الخلية المستهدفة من قبل الخلايا المستجيبة.
ملاحظه: يمكن إيقاف البروتوكول مؤقتا هنا. - 45 دقيقه قبل الحصاد supernatants ، أضافه 10 μL من 10x تحلل الحل إلى الخلية الهدف الحد الأقصى LDH الآبار الإفراج (ويلز 1E ، 1E ، 1E ، و 1E) ووضع لوحه مره أخرى في غرفه ترطيب.
- بعد اكتمال وقت الحضانة ، والطرد المركزي لوحه في 250 x g لمده 4 دقائق باستخدام pipettor متعددة القناات ، نقل 50 μl قسامات من جميع الآبار إلى جديده 96-بئر مسطحه القاع فحص لوحه.
ملاحظه: لا تلمس الجزء السفلي من الآبار بحيث لا يتم نقل الخلايا إلى لوحه الفحص الطازجة. لا تستخدم الطبق المعالج المثقف كطبق الفحص الطازج. -
جعل الكاشف الفحص.
- بعد الفحص العازل قد وصلت درجه حرارة الغرفة ، أضافه 12 مل من العازلة المقايسة إلى زجاجه واحده مزيج الركيزة. يقلب ويهز برفق حتى يذوب تماما. زجاجه واحده كافيه للوحات 2 96-حسنا.
ملاحظه: يجب حماية العازلة الفحص من الضوء في حين يجري أذابه. اخلطه مباشره قبل الاستخدام.
- بعد الفحص العازل قد وصلت درجه حرارة الغرفة ، أضافه 12 مل من العازلة المقايسة إلى زجاجه واحده مزيج الركيزة. يقلب ويهز برفق حتى يذوب تماما. زجاجه واحده كافيه للوحات 2 96-حسنا.
- أضافه 50 μL من الكاشف المقايسة لجميع الآبار في لوحه الفحص من الخطوة 4.6. تغطيه لوحه مع إحباط لحمايتها من الضوء واحتضان لمده 30 دقيقه في درجه حرارة الغرفة.
ملاحظه: وينبغي تخزين كاشف الفحص المصنوع حديثا في الفريزر. كاشف جيد لمده 8 أسابيع تقريبا. - أضافه 50 μL من الحل التوقف لكل بئر. قراءه لوحه في غضون ساعة واحده بعد أضافه وقف الحل وتسجيل الامتصاص في 490 nm. وترد البيانات التمثيلية في الجدول 2.
5. حساب النتائج
- حساب متوسط قيمه الامتصاص من الآبار الثقافة المتوسطة الخلفية وطرح من جميع قيم الامتصاص للتجربة ، الخلية المستهدفة الإفراج LDH عفويه والخلية المستجيب التلقائي LDH الإفراج عن الآبار.
- حساب متوسط قيم الامتصاص لآبار "التحكم في تصحيح وحده التخزين" والاستقطاع من قيم الامتصاص التي تم الحصول عليها لآبار التحكم في الإصدار LDH الأقصى للخلية الهدف.
- استخدام القيم المصححة من الخطوات 5.1 و 5.2 في الصيغة التالية لحساب النسبة المئوية للخلايا لكل المستجيب: الهدف جيدا.
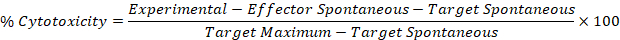
النتائج
تم احتضان خلايا المشيمة NK التي تم الحصول عليها من الفئران NP و rupp ل 5 ح مع الخلايا المستهدفة في اعلام الخاصة بهم بنسبه 50:1 (NK: الهدف). وسجلت الامتصاص عند 490 نانومتر وترد البيانات الاوليه في الجدول 2. وتم حساب الامتصاص المتوسط للخلفية المتوسطة الثقافية والآبار التي تتحكم في تصحيح الحجم. ...
Discussion
وهناك عدد من الملاحظات الرئيسية الهامه للنظر في النتائج المثلي. العقم من الخلايا المستخدمة مهم جدا. بعد جمع المشيمة ، من المهم ان يتم اعداد وعزل خلايا ناغورني كاراباخ في ظل ظروف معقمه في خزانه السلامة الاحيائيه. وعلاوة علي ذلك ، لان جميع الخلايا الإفراج عن LDH علي الاضرار الخلوية ، ينبغي توخ...
Disclosures
ولا يعلن أصحاب البلاغ عن اي تضارب في المصالح ، مالي أو غير ذلك.
Acknowledgements
وقد دعم هذا العمل المعهد الوطني للقلب والرئة والدم التابع للمعاهد الوطنية للصحة تحت المنحة R00HL130456 ، والمعهد الوطني للعلوم الطبية العامة التابع للمعاهد الوطنية للصحة ببموجب القرار P20GM104357 ، ميسيسيبي INBRE ، الممولة من قبل جائزه التنمية المؤسسية (IDeA) من المعاهد الوطنية للعلوم الطبية العامة في المعاهد الوطنية للصحة تحت منحه رقم P20GM103476. والمضمون هو المسؤولية الوحيدة للمؤلفين ولا يمثل بالضرورة الآراء الرسمية للمعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
References
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved