È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un saggio di citotossicità a base di piastre per la valutazione della funzione citolitica della cellula killer naturale del ratto placentare
In questo articolo
Riepilogo
Qui, forniamo una metodologia dettagliata per isolare e valutare la funzione citotossica delle cellule killer naturali da placenta da un saggio di placca colorimetrica. La riduzione della pressione di perfusione uterina modello ratto di ischemia placentare è stato scelto per dimostrare l'isolamento mediato da anticorpi e la valutazione della funzione citotossica delle cellule Natural Killer.
Abstract
È ben noto che le cellule decidue Natural Killer (NK) giocano un ruolo critico nella creazione e nel mantenimento della gravidanza normale. Studi recenti hanno dimostrato una popolazione alterata di cellule NK circolanti e decidue nelle donne che soffrono di complicanze avverse di gravidanza come aborto spontaneo e preeclampsia. Studi del nostro gruppo hanno dimostrato che l'ipertensione in gravidanza è associata ad un aumento della popolazione di cellule NK attivate nella placenta in base all'espressione dei marcatori di attivazione superficiale. Questo manoscritto fornisce un protocollo dettagliato per valutare la funzione citotossica delle cellule NK isolate da placenta in un modello animale di tipo preeclampsia di ischemia placentare indotta chirurgicamente. I seguenti passaggi sono descritti in dettaglio: generazione di sospensione a singola cellula, isolamento delle cellule NK, stimolazione ex vivo, effector: co-coltura cellulare bersaglio e saggio di citotossicità.
Introduzione
La preeclampsia è un disturbo ipertensivo della gravidanza caratterizzato da restrizione della crescita fetale, danno dell'organo finale e attivazione immunitaria cronica. L'attivazione immunitaria cronica nelle donne con preeclampsia porta ad un aumento delle citochine infiammatorie circolanti e placentare, uno squilibrio nelle popolazioni di cellule T CD4+ e un aumento della popolazione di cellule di Natural Killer (NK) attivate1. Studi recentemente pubblicati dal nostro laboratorio dimostrano un ruolo per le cellule NK nel causare alcune della fisiopatologia associata alla preeclampsia nel modello ratto di preeclampsia della pressione di perfusione uterina ridotta (RUPP). Utilizzando la citometria a flusso per misurare l'espressione superficiale dei marcatori di attivazione sulle cellule NK, è stata osservata una maggiore popolazione di cellule NK attivate nella circolazione e nelle placenta dei ratti Rupp rispetto ai ratti normali in gravidanza (NP)2.
Per confermare le osservazioni di citometria a flusso, sono stati condotti studi funzionali per valutare l'attività citotossica delle cellule NK isolate dai placenta dei ratti NP e Rupp. Esistono diversi metodi disponibili per la valutazione della funzione citotossica delle cellule T CD8+ citotossiche e delle cellule NK. Lo standard Gold per l'analisi citotossica funzionale è il saggio di rilascio di cromo3. Altri protocolli sviluppati utilizzati includono citometria a flusso4, citometria a immagine5, calceina rilascio6, e più recentemente bioluminescenza7. Questo video fornirà un protocollo dettagliato sull'utilizzo del saggio di rilascio di lattato deidrogenasi (LDH) ben consolidato per misurare la funzione citotossica delle cellule NK utilizzando un kit di saggio di citotossicità LDH disponibile in commercio.
Protocollo
Tutti i protocolli sono stati approvati dal Comitato istituzionale per la cura e l'uso degli animali presso l'Università del Mississippi Medical Center. La cura e la manipolazione degli animali erano conformi alle linee guida degli istituti nazionali di sanità per il trattamento etico degli animali.
1. isolamento delle cellule dei linfociti da placentas
- Rimuovere una placenta dall'utero del ratto (gestazione giorno 19) e mettere in 10 mL di ghiaccio-freddo PBS8.
- Collocare una placenta su un filtro da 100 μm e sedersi in una capsula di Petri contenente 13,5 mL di RPMI e 1,5 mL di FBS (il volume totale è di 15 mL). Utilizzare il lato piatto di uno stantuffo della siringa per spingere la placenta attraverso il filtro nella capsula di Petri.
- Preparare 3 15 mL di tubi conici per ogni tessuto. Aggiungere 3 mL di mezzo gradiente di densità (vedere la tabella dei materiali) a ciascun tubo, quindi sovrapporre accuratamente 5 ml di placenta omogeneizzata in ogni tubo.
- Centrifugare per 25 min a 300 x g a temperatura ambiente (RT) senza freno. Raccogli il sottile strato di Buffy bianco con una pipetta di trasferimento.
Nota: Dopo la centrifugazione, sono visibili 3 strati, il RPMI rosso nella parte superiore, lo strato di Buffy bianco al centro, e lo strato medio di gradiente di densità chiaro nella parte inferiore. Utilizzare una pipetta di trasferimento per tirare lo strato di Buffy bianco dal tubo. Combinare Buffy strato da tutti i tubi della stessa placenta in 1 tubo. - Aggiungere 10 mL di RPMI a strati di Buffy combinati. Centrifugare per 10 min, 300 x g, a 4 ° c ed eliminare il surnatante.
2. isolamento delle cellule Natural Killer
- Risospendere il pellet cellulare in 50 μL di PBS ghiacciato
- Aggiungere l'anticorpo CD3 con etichetta biotina alle cellule pellettate secondo il protocollo del produttore e mescolare bene con una pipetta. Posizionare il tubo in un rotatore di tubi e incubare 20 minuti a 4 ° c.
- Aggiungere 1 mL di RPMI, centrifugare per 10 min a 400 x g e 4 ° c e scartare il supernatante.
- Risospendere il pellet in 1 mL di RPMI e combinare con 150 μL di perle magnetiche in una provetta da microcentrifuga da 1,5 mL. Collocare il tubo della microcentrifuga in un rotatore di tubi e ruotarlo in incubazione per 30 minuti a 4 ° c.
Nota: Estrarre il tampone di rilascio in questo momento e consentire di raggiungere RT nel cabinet di biosicurezza. - Posizionare i tubi nel magnete per 1 min. Raccogli il supernatante e salva la popolazione di cellule CD3 in un tubo da 15 mL sul ghiaccio.
Nota: Questo è il CD3- popolazione di cellule. - Rimuovere il tubo dal magnete e aggiungere 1 mL di RPMI. Mescolare le cellule e perline 5 volte con una pipetta.
- Ripetere il passaggio 2,5.
- Centrifugare la CD3- popolazione di cellule per 10 min a 400 x g e 4 ° c e scartare surnatante. Risospendere il pellet cellulare in 50 μL di PBS ghiacciato
- Aggiungere anticorpo CD161a con l'etichetta di biotina alle cellule CD3 secondo il protocollo del produttore e mescolare bene. Posizionare il tubo in un rotatore di tubi e incubare per 20 minuti a 4 ° c.
- Aggiungere 1 mL di RPMI, centrifugare per 10 min a 400 x g e 4 ° c e scartare il supernatante. Risospendere il pellet in 1 mL di RPMI e combinare con 150 μL di perle magnetiche in una provetta da microcentrifuga da 1,5 mL.
- Posizionare il tubo della microcentrifuga in un rotatore di tubi e ruotarlo durante l'incubazione per 30 minuti a 4 ° c.
- Posizionare i tubi in un magnete per 1 min. Raccogli supernatante e scartare le cellule CD3-/Cd161a.
- Rimuovere il tubo dal magnete e aggiungere 1 mL di RPMI. Mescolare le cellule e perline 5 volte con una pipetta.
- Ripetere il passaggio 2,12.
- Rimuovere i tubi della microcentrifuga dal magnete e aggiungere 1 mL di tampone RT release. Posizionare il tubo sul rotatore del tubo e ruotare durante l'incubazione per 15 minuti a RT.
- Posizionare i tubi in magnete per 1 min. Raccogli il supernatante in un nuovo tubo conico da 15 mL sul ghiaccio.
Nota: Questa è la popolazione di cellule NK. - Rimuovere il tubo dal magnete e aggiungere 1 mL di RT RPMI. Mescolare le cellule e perline 5 volte con pipetta.
- Ripetere il passaggio 2,16, posizionando il supernatante nello stesso tubo. Mescolare bene e prendere un campione di 20 μL per contare le cellule
Nota: Tenere il tubo sul ghiaccio. - Centrifugare CD3-/Cd161a+ celle per 10 min, 400 x g a 4 ° c, quindi rimuovere il supernatante. Risospendere le cellule in RPMI (10% FBS, 1% PEN/STREP, 2 ng/mL IL-2) e seme ad una concentrazione di 3 x 105 cellule/bene in una piastra 6-well in 2,5 ml di NK cell activation media. Incubare le cellule per 48 h a 37 ° c, 5% CO2 in un incubatore umidificato.
3. saggio di citotossicità: recupero di cellule NK o YAC1 da colture o cellule di passaggio
Nota: Tutti i passaggi devono essere condotti sotto il cofano. Tutti i tubi delle cellule devono essere mantenuti sempre sul ghiaccio.
- Utilizzare un Pipet sierologico di vetro per raccogliere YAC1 cellule e media da pallone, mettere in un 50 mL tubo su ghiaccio, e mescolare bene. Prendere 20 μL per contare le cellule.
- Girare le celle YAC1 per 10 min a 300 x g e 4 ° c. Conta le celle mentre queste girano.
- Aggiungere tripsin/EDTA ad ogni pozzetto in una placca NK a 6-pozzetto. Toccare la piastra e posizionare in incubatore.
- Dopo che le cellule hanno incubato con tripsin/EDTA per ~ 5 min a 37 ° c, raschiare la piastra/pallone con un raschietto piatto sterile. Aggiungere 1 mL di NK cell media ad ogni pozzetto.
- Raccogli le cellule e i media con il Pipet sierologico e raccogli in una provetta da centrifuga da 15 mL. Prendere 20 μL per contare le cellule.
- Girare le cellule NK per 10 min, 400 x g a 4 ° c. Contare il campione di cellule dal passo 3,5 durante questa centrifugazione.
Nota: Visualizzare le piastre di coltura sotto un microscopio prima di scartarli per assicurarsi che non ci siano più cellule aderite al fondo dei pozzi. Poiché l'esperimento utilizza le celle NK e le celle YAC1, assicuratevi di contarli separatamente. - Conta le celle e risospendi alle concentrazioni determinate nelle prove di ottimizzazione per testare il numero appropriato di target: rapporto dell'effettore. Ciò sarà ottenuto risospendendo il pellet nei loro supporti corrispondenti per effettuare le seguenti concentrazioni cellulari: YAC1 a 4 x 105 cellule/ml e cellule NK a 2 x 107 cellule/ml.
4. saggio di citotossicità: protocollo di dosaggio
- Utilizzare un fondo rotondo, coltura trattata 96-pozzetto piastra per impostare la piastra come suggerito nella tabella 1. Questa tabella mostra i controlli sperimentali e 3 set di colonne sperimentali NK. Questo può essere esteso a un totale di 10 colonne sperimentali NK in una piastra 96-well.
- Centrifugare la piastra di saggio a 250 x g per 4 min per essere certi che l'Effettuatore e le cellule bersaglio siano in contatto. Incubare la piastra 96-pozzetto per 5 ore in un incubatore a camera umidificata a 37 ° c, 5% CO2 per raggiungere un ampio contatto tra le cellule bersaglio ed effettrici e la lisi cellulare bersaglio mediante cellule effettrici.
Nota: Il protocollo può essere messo in pausa qui. - 45 min prima della raccolta dei supernatanti, aggiungere 10 μL di soluzione di lisi 10x ai pozzi di rilascio massimo LDH della cellula bersaglio (Wells 1E, 1F, 1G e 1H) e riportare la piastra nella camera umidificata.
- Una volta completato il tempo di incubazione, centrifugare la piastra a 250 x g per 4 min utilizzando una pipetta multicanale, trasferire 50 μl di aliquote da tutti i pozzetti a una piastra di saggio a fondo piatto da 96 pozzetti.
Nota: Non toccare il fondo dei pozzetti in modo che le cellule non vengano trasferite nella piastra di saggio fresca. Non utilizzare un piatto trattato in coltura come piatto di dosaggio fresco. -
Fare reagente di dosaggio.
- Dopo che Assay Buffer ha raggiunto la temperatura ambiente, aggiungere 12 mL di tampone di dosaggio a un flacone di substrato mix. Capovolgere e agitare delicatamente fino a completa dissoluzione. 1 bottiglia è sufficiente per 2 96 piastre di pozzo.
Nota: Tampone di dosaggio deve essere protetto dalla luce durante lo scongelati. Mescolare immediatamente prima dell'uso.
- Dopo che Assay Buffer ha raggiunto la temperatura ambiente, aggiungere 12 mL di tampone di dosaggio a un flacone di substrato mix. Capovolgere e agitare delicatamente fino a completa dissoluzione. 1 bottiglia è sufficiente per 2 96 piastre di pozzo.
- Aggiungere 50 μL di reagente di dosaggio a tutti i pozzetti della piastra di dosaggio dal punto 4,6. Coprire la piastra con un foglio per proteggerla dalla luce e incubare per 30 minuti a temperatura ambiente.
Nota: Il reagente di dosaggio appena fatto deve essere conservato in un congelatore. Il reagente è buono per circa 8 settimane. - Aggiungere 50 μL di soluzione di arresto a ciascun pozzetto. Leggere la lastra entro 1 ora dall'aggiunta della soluzione stop e registrare l'assorbanza a 490 nm. I dati rappresentativi sono riportati nella tabella 2.
5. calcolo dei risultati
- Calcolare il valore medio di assorbanza dai pozzi di background medio di coltura e sottrarre da tutti i valori di assorbanza per sperimentale, cella di destinazione LDH rilascio spontaneo e cella effector pozzi spontanei di rilascio LDH.
- Calcolare i valori medi di assorbanza per i pozzetti di controllo di correzione del volume e sottrarre dai valori di assorbanza acquisiti per i pozzetti di controllo di rilascio LDH massimo della cella di destinazione.
- Utilizzare i valori corretti dai passaggi 5,1 e 5,2 nella seguente formula per calcolare la percentuale di citotossicità per ogni Effettuatore: bene bersaglio.
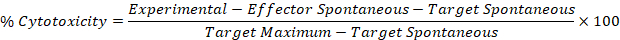
Risultati
Le cellule NK placentare ottenute da ratti NP e RUPP sono state incubate per 5 ore con cellule bersaglio nei rispettivi media con un rapporto di 50:1 (NK: target). L'assorbanza è stata registrata a 490 nm e i dati grezzi sono mostrati nella tabella 2. Sono stati calcolati l'assorbanza media dello sfondo medio di coltura e dei pozzetti di controllo di correzione del volume. Queste medie sono state sottratte dai pozzi appropriati indicati nel protocollo del fabbricante e sono rappresentate nella t...
Discussione
Ci sono una serie di importanti note chiave da considerare per ottenere risultati ottimali. La sterilità delle cellule utilizzate è molto importante. Dopo la raccolta della placenta, è importante che la preparazione e l'isolamento delle cellule NK siano eseguiti in condizioni sterili in un armadietto di biosicurezza. Inoltre, poiché tutte le cellule rilasciano LDH su danno cellulare, si deve prestare attenzione a ottenere un'elevata vitalità delle cellule NK dopo l'isolamento e durante il processo di co-coltura. Un ...
Divulgazioni
Nessun conflitto di interessi, finanziario o di altro tipo, è dichiarato dagli autori.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Heart Lung e Blood Institute degli istituti nazionali di salute sotto sovvenzione R00HL130456, l'Istituto nazionale di scienze mediche generali degli istituti nazionali di salute sotto il premio P20GM104357, e dal Mississippi INBRE, finanziato da un premio di sviluppo istituzionale (IDeA) presso gli istituti nazionali di scienze mediche generali degli istituti nazionali di salute con il numero di sovvenzione P20GM103476. Il contenuto è esclusivamente responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali dei National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
Riferimenti
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon