Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo de citotoxicidad basada en placas para la evaluación de la función citolítica de la célula asesina natural placentaria de rata
En este artículo
Resumen
Aquí, proporcionamos una metodología detallada para aislar y evaluar la función citotóxica de las células asesinas naturales de las en por un ensayo de placa colorimétrica. Se eligió el modelo reducido de la rata de perfusión uterina de isquemia placentaria para demostrar el aislamiento mediado por anticuerpos y la evaluación de la función citotóxica de las células asesinas naturales.
Resumen
Es bien sabido que las células del asesino natural decidua (NK) juegan un papel crítico en el establecimiento y el mantenimiento del embarazo normal. Estudios recientes han demostrado una población alterada de células NK circulantes y deciduales en mujeres que sufren complicaciones adversas en el embarazo como aborto recurrente y preeclampsia. Estudios de nuestro grupo han demostrado que la hipertensión en el embarazo está asociada con un aumento de la población de células NK activadas en la placenta basada en la expresión de marcadores de activación de superficie. Este manuscrito proporciona un protocolo detallado para evaluar la función citotóxica de las células NK aisladas de las en en un modelo animal parecido a la preeclampsia de isquemia placentaria inducida quirúrgicamente. Los siguientes pasos se describen detalladamente: generación de suspensión de célula única, aislamiento de células NK, estimulación ex vivo, efector: cocultivo celular objetivo y ensayo de citotoxicidad.
Introducción
La preeclampsia es un trastorno hipertensivo del embarazo caracterizado por la restricción del crecimiento fetal, el daño al órgano final y la activación inmunitaria crónica. La activación inmunitaria crónica en mujeres con preeclampsia conduce a un aumento de la circulación y citoquinas inflamatorias placentarias, un desequilibrio en las poblaciones de células T CD4+ , y un aumento de la población de las células de Killer natural activado (NK)1. Los estudios recientemente publicados por nuestro laboratorio demuestran un papel para las células NK en la causa de parte de la fisiopatología asociada con la preeclampsia en el modelo de la rata de la presión de perfusión uterina reducida (RUPP) de la preeclampsia. Utilizando citometría de flujo para medir la expresión superficial de los marcadores de activación en las células NK, se observó un aumento de la población de células NK activadas en la circulación y en de las ratas Rupp en comparación con las ratas embarazadas normales (NP)2.
Para confirmar las observaciones de citometría de flujo, se realizaron estudios funcionales para evaluar la actividad citotóxica de células NK aisladas de las en de ratas NP y Rupp. Hay varios métodos disponibles para la evaluación de la función citotóxica de las células T de citotóxicos CD8+ y las células NK. El estándar de oro para el análisis citotóxico funcional es el ensayo de liberación de cromo3. Otros protocolos desarrollados utilizados incluyen citometría de flujo4, citometría de imagen5, calceína Release6, y más recientemente bioluminiscencia7. Este video proporcionará un protocolo detallado sobre el uso del ensayo de liberación de lactato deshidrogenasa (LDH) bien establecido para medir la función citotóxica de las células NK utilizando un kit de ensayo de citotoxicidad LDH disponible comercialmente.
Protocolo
Todos los protocolos fueron aprobados por el Comité institucional de cuidado y uso de animales en el centro médico de la Universidad de Mississippi. El cuidado y el manejo de los animales estaban de acuerdo con las pautas de los institutos nacionales de salud para el tratamiento ético de los animales.
1. aislamiento de células linfocitas de placentas
- Retire una placenta del útero de la rata (día de gestación 19) y colóquelo en 10 mL de PBS8frío-hielo.
- Colocar una placenta en un filtro de 100 μm y sentarse en una placa de Petri que contenga 13,5 mL de RPMI y 1,5 mL de FBS (el volumen total es de 15 mL). Utilice el lado plano de un émbolo de la jeringa para empujar la placenta a través del filtro a la placa de Petri.
- Prepare tubos cónicos de 3 15 mL para cada tejido. Añadir 3 mL de medio degradado de densidad (ver tabla de materiales) a cada tubo, luego superponer cuidadosamente 5 ml de placenta homogeneizada en cada tubo.
- Centrifugar durante 25 min a 300 x g a temperatura ambiente (RT) sin freno. Recoge la fina capa blanca de la Buffy con una Piera de transferencia.
Nota: Después de la centrifugación, se ven 3 capas, el RPMI rojo en la parte superior, la capa blanca de la Buffy en el centro y la capa media de gradiente de densidad clara en la parte inferior. Utilice una Piera de transferencia para extraer la capa blanca de la Buffy del tubo. Combine la capa Buffy de todos los tubos de la misma placenta en 1 tubo. - Añada 10 mL de RPMI a las capas de Buffy combinadas. Centrifugar durante 10 min, 300 x g, a 4 ° c y descartar sobrenadante.
2. aislamiento de las células asesinas naturales
- Resuspendio el pellet de células en 50 μL de PBS helada
- Agregue anticuerpos CD3 con etiqueta de biotina a las células peletizadas según el protocolo del fabricante y mezcle bien con una Piera. Colocar el tubo en un rotador de tubos e incubar 20 min a 4 ° c.
- Añadir 1 mL de RPMI, centrifugar durante 10 min a 400 x g y 4 ° c, y desechar sobrenadante.
- Resuspend pellet en 1 mL de RPMI y combine con 150 μL de perlas magnéticas en un tubo de microcentrífuga de 1,5 mL. Colocar el tubo de microcentrífuga en un rotador de tubos y rotar mientras se incube durante 30 min a 4 ° c.
Nota: Extraiga el búfer de liberación en este momento y permita que llegue a RT en el gabinete de bioseguridad. - Coloque los tubos en el imán durante 1 min. recoja el sobrenadante y Ahorre la población de células CD3 en un tubo de 15 mL sobre hielo.
Nota: Esta es la población CD3 de células. - Extraer el tubo del imán y añadir 1 mL de RPMI. Mezcle las células y las perlas 5 veces con una picada.
- Repita el paso 2,5.
- Centrifugar el CD3- población de células durante 10 min a 400 x g y 4 ° c y desechar sobrenadante. Resuspend el pellet de células en 50 μL de PBS helado
- Agregue el anticuerpo CD161a con etiqueta de biotina a las células CD3de acuerdo con el protocolo del fabricante y mezcle bien. Colocar el tubo en un tubo rotador e incubar durante 20 min a 4 ° c.
- Añadir 1 mL de RPMI, centrifugar durante 10 min a 400 x g y 4 ° c, y desechar sobrenadante. Resuspend pellet en 1 mL de RPMI y combine con 150 μL de perlas magnéticas en un tubo de microcentrífuga de 1,5 mL.
- Coloque el tubo de microcentrífuga en un rotador de tubo y gire mientras se incube durante 30 min a 4 ° c.
- Coloque los tubos en un imán durante 1 min. recoja el sobrenadante y deseche las células CD3-/Cd161a.
- Extraer el tubo del imán y añadir 1 mL de RPMI. Mezcle las células y las perlas 5 veces con una picada.
- Repita el paso 2,12.
- Retire los tubos de microcentrífuga del imán y añada 1 mL de tampón de liberación RT. Coloque el tubo en el tubo rotador y gire mientras se incube durante 15 min en RT.
- Coloque los tubos en el imán durante 1 min. recoja el sobrenadante en un nuevo tubo cónico de 15 mL sobre hielo.
Nota: Esta es la población de células NK. - Extraer el tubo del imán y añadir 1 mL de RT RPMI. Mezcle las células y las perlas 5 veces con la picada.
- Repita el paso 2,16, colocando sobrenadante en el mismo tubo. Mezcle bien y tome una muestra de 20 μL para contar las células
Nota: Mantenga el tubo sobre hielo. - Centrifugar CD3-/Cd161a+ células durante 10 min, 400 x g a 4 ° c, luego retire el sobrenadante. Resuspend las células en RPMI (10% FBS, 1% Pen/Strep, 2 ng/mL IL-2) y la semilla a una concentración de 3 x 105 células/pozo en una placa de 6-well en 2,5 ml de los medios de activación de célula NK. Incubar las células para 48 h a 37 ° c, 5% CO2 en una incubadora humidificada.
3. ensayo de citotoxicidad: recuperar células NK o YAC1 de cultivo o pasar células
Nota: Todos los pasos deben ser conducidos bajo el capó. Todos los tubos celulares deben mantenerse en hielo en todo momento.
- Utilice una Pipet serológica de vidrio para recolectar YAC1 células y medios del matraz, colóquelo en un tubo de 50 mL sobre hielo y mezcle bien. Tomar 20 μL para contar las células.
- Gire las células YAC1 durante 10 min a 300 x g y 4 ° c. Cuente las celdas mientras estas giran.
- Agregue tripsin/EDTA a cada pozo en una placa de 6 pozo de celda NK. Toque la placa y colóquelo en la incubadora.
- Después de que las células hayan incubado con tripsina/EDTA durante ~ 5 min a 37 ° c, raspe la placa/matraz con un raspador de placa estéril. Añada 1 mL de NK cell media a cada pozo.
- Recoja las células y los medios con Pipet serológico y recoja en un tubo centrífugo de 15 mL. Tomar 20 μL para contar las células.
- Gire las células NK durante 10 min, 400 x g a 4 ° c. Cuente la muestra de células del paso 3,5 durante esta centrifugación.
Nota: Vea las placas de cultivo bajo un microscopio antes de desecharlas para asegurarse de que no haya más células adheridas al fondo de los pozos. Dado que el experimento utiliza celdas NK y celdas YAC1, asegúrese de contar cada una por separado. - Recuento de células y resuspendio a las concentraciones determinadas en ensayos de optimización para comprobar el número adecuado de objetivo: relación efector. Esto se logrará volviendo a suspender el pellet en sus medios correspondientes para realizar las siguientes concentraciones celulares: YAC1 a 4 x 105 células/ml y células NK a 2 x 107 células/ml.
4. ensayo de citotoxicidad: Protocolo de ensayo
- Utilice una placa inferior redonda, tratada con cultivo 96-pozo para configurar la placa como se sugiere en la tabla 1. Esta tabla muestra los controles experimentales y 3 conjuntos de columnas experimentales NK. Esto se puede ampliar a un total de 10 columnas experimentales NK en una placa de 96-well.
- Centrifugar la placa de ensayo a 250 x g durante 4 min para estar seguro de que el efector y las células objetivo están en contacto. Incubar la placa de 96-Well durante 5 horas en una incubadora de cámara humidificada a 37 ° c, 5% CO2 para lograr un amplio contacto entre las células diana y efector y la lisis celular Diana por las células efectoras.
Nota: El protocolo se puede pausar aquí. - 45 min antes de los sobrenadentes de cosecha, agregue 10 μL de solución de lisis de 10x a los pozos de liberación máxima de la célula diana (Wells 1E, 1F, 1G y 1H) y coloque la placa de nuevo en la cámara humidificada.
- Una vez finalizado el tiempo de incubación, Centrifugue la placa a 250 x g durante 4 min usando un pipeteador multicanal, transfiera 50 μl desde todos los pozos a una placa de ensayo de 96-pozo plano de fondo fresco.
Nota: No toque la parte inferior de los pozos para que las células no se transfieran a la placa de ensayo fresca. No utilice una placa tratada cultivada como placa de ensayo fresca. -
Hacer reactivo de ensayo.
- Después de que el buffer de ensayo haya alcanzado la temperatura ambiente, añada 12 mL de tampón de ensayo a una botella de sustrato Mix. Invierta y agite suavemente hasta que se disuelva completamente. 1 frasco es suficiente para placas de 2 96-well.
Nota: El buffer del ensayo debe protegerse de la luz mientras se descongele. Mezclar inmediatamente antes de usar.
- Después de que el buffer de ensayo haya alcanzado la temperatura ambiente, añada 12 mL de tampón de ensayo a una botella de sustrato Mix. Invierta y agite suavemente hasta que se disuelva completamente. 1 frasco es suficiente para placas de 2 96-well.
- Añadir 50 μL de reactivo de ensayo a todos los pozos de la placa de ensayo desde el paso 4,6. Cubra la placa con papel de aluminio para protegerla de la luz e incubar durante 30 minutos a temperatura ambiente.
Nota: El reactivo de ensayo recién hecho debe almacenarse en un congelador. El reactivo es bueno durante aproximadamente 8 semanas. - Añadir 50 μL de solución de parada a cada pozo. Leer la placa dentro de 1 hora después de añadir la solución STOP y registrar la absorbancia a 490 nm. Los datos representativos se muestran en la tabla 2.
5. cálculo de resultados
- Calcule el valor medio de absorbancia de los pozos de fondo medio de cultivo y reste de todos los valores de absorbancia para los pozos de liberación de LDH de célula de efecto experimental, liberación espontánea de células diana y célula de efector.
- Calcule los valores medios de absorbancia para los pozos de control de corrección de volumen y reste de los valores de absorbancia adquiridos para los pozos de control de liberación máxima LDH de célula objetivo.
- Utilice los valores corregidos de los pasos 5,1 y 5,2 en la siguiente fórmula para calcular el porcentaje de citotoxicidad para cada efector: bien objetivo.
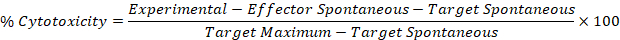
Resultados
Las células NK placentarias obtenidas de ratas NP y RUPP fueron incubadas durante 5 h con células Diana en sus respectivos medios en una proporción de 50:1 (NK: target). La absorbancia se registró en 490 nm y los datos brutos se muestran en la tabla 2. Se calculó la absorbancia media del fondo del medio de cultivo y los pozos de control de corrección de volumen. Estos promedios se restaron de los pozos apropiados indicados en el protocolo del fabricante y se representan en el cuadro 3
Discusión
Hay una serie de notas clave importantes a tener en cuenta para obtener resultados óptimos. La esterilidad de las células utilizadas es muy importante. Después de la recolección de la placenta, es importante que la preparación y el aislamiento de las células NK se realicen en condiciones estériles en un gabinete de bioseguridad. Además, debido a que todas las células liberan LDH sobre el daño celular, se debe tener cuidado para obtener una alta viabilidad de las células NK después del aislamiento y durante el...
Divulgaciones
Ningún conflicto de intereses, financiero o de otro tipo, son declarados por los autores.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de pulmón y sangre del corazón de los institutos nacionales de salud bajo la subvención R00HL130456, el Instituto Nacional de ciencias médicas generales de los institutos nacionales de salud bajo el premio P20GM104357, y por el Mississippi INBRE, financiado por un premio de desarrollo institucional (IDeA) de los institutos nacionales de ciencias médicas generales de los institutos nacionales de salud bajo la concesión número P20GM103476. El contenido es exclusivamente responsabilidad de los autores y no representa necesariamente las opiniones oficiales de los institutos nacionales de salud.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
Referencias
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados