Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un dosage de cytotoxicité à base de plaques pour l’évaluation de la fonction cytolytique des cellules tueuses naturelles du rat placentaire
Dans cet article
Résumé
Ici, nous fournissons une méthodologie détaillée pour isoler et évaluer la fonction cytotoxique des cellules tueuses naturelles de placentas par un dosage de la plaque colorimétrique. Le modèle de rat à pression de perfusion utérine réduit de l’ischémie placentaire a été choisi pour démontrer l’isolement et l’évaluation par médiation des anticorps de la fonction cytotoxique des cellules tueuses naturelles.
Résumé
Il est bien connu que les cellules du tueur naturel (NK) déciduelles jouent un rôle crucial dans l’établissement et le maintien d’une grossesse normale. Des études récentes ont montré une population altérée de cellules NK circulantes et décibiales chez les femmes qui souffrent de complications de grossesse défavorables telles que la fausse couche récurrente et la prééclampsie. Des études de notre groupe ont montré que l’hypertension dans la grossesse est associée à une population accrue de cellules NK activées dans le placenta en fonction de l’expression des marqueurs d’activation de surface. Ce manuscrit fournit un protocole détaillé pour évaluer la fonction cytotoxique des cellules NK isolées des placentas dans un modèle animal de type prééclampsie d’ischémie placentaire induite chirurgicalement. Les étapes suivantes sont décrites en détail: génération de suspension à cellule unique, isolement cellulaire NK, stimulation ex vivo, effecteur: co-culture des cellules cibles et dosage de la cytotoxicité.
Introduction
La prééclampsie est un trouble hypertensif de la grossesse caractérisé par la restriction de croissance fœtale, les lésions des organes finaux et l’activation immunitaire chronique. L’activation immunitaire chronique chez les femmes atteintes de prééclampsie conduit à une augmentation de la circulation et des cytokines inflammatoires placentaires, un déséquilibre dans les cellules CD4+ T populations, et une population accrue de cellules de tueur naturel (NK) activées1. Les études récemment publiées par notre laboratoire démontrent un rôle pour les cellules NK en provoquant une partie de la pathophysiologie associée à la prééclampsie dans le modèle de rat de prééclampsie de la pression de perfusion utérine réduite (RUPP). En utilisant la cytométrie en flux pour mesurer l’expression de la surface des marqueurs d’activation sur les cellules NK, on a observé une augmentation de la population des cellules NK activées dans la circulation et les placentas des rats RUPP comparativement aux rats normaux gravides (NP)2.
Pour confirmer les observations de cytométrie en flux, des études fonctionnelles pour évaluer l’activité cytotoxique des cellules NK isolées des placentas des rats NP et RUPP ont été effectuées. Il existe plusieurs méthodes disponibles pour l’évaluation de la fonction cytotoxique des cellules cytotoxiques de l+ T et des cellules NK. La norme d’or pour l’analyse cytotoxique fonctionnelle est le test de libération du chrome3. D’autres protocoles développés utilisés incluent cytométrie en flux4, cytométrie d’image5, calcéine Release6, et plus récemment bioluminescence7. Cette vidéo fournira un protocole détaillé sur l’utilisation du dosage bien établi de la lactate déshydrogénase (LDH) pour mesurer la fonction cytotoxique des cellules NK à l’aide d’un kit de dosage de cytotoxicité LDH disponible dans le commerce.
Protocole
Tous les protocoles ont été approuvés par le Comité institutionnel de soins et d’utilisation des animaux du centre médical de l’Université du Mississippi. Les soins et la manipulation des animaux étaient conformes aux directives des instituts nationaux de la santé pour le traitement éthique des animaux.
1. isolement des cellules lymphocytes des placentas
- Retirer un placenta de l’utérus du rat (jour de gestation 19) et le placer dans 10 mL de PBS8à froid glacé.
- Placez un placenta sur un filtre de 100 μM et asseyez-vous dans une boîte de Petri contenant 13,5 mL de RPMI et 1,5 mL de FBS (le volume total est de 15 mL). Utilisez le côté plat d’un piston de seringue pour pousser le placenta dans le filtre dans la boîte de Petri.
- Préparer 3 15 mL de tubes coniques pour chaque tissu. Ajouter 3 mL de milieu dégradé de densité (voir tableau des matériaux) à chaque tube, puis recouvrir soigneusement 5 ml de placenta homogénéisé dans chaque tube.
- Centrifuger pendant 25 min à 300 x g à température ambiante (RT) sans frein. Collectez la couche mince de Buffy blanche avec une pipette de transfert.
Remarque: Après centrifugation, 3 couches sont visibles, le RPMI rouge en haut, la couche de Buffy blanche au milieu, et la couche moyenne de gradient de densité claire en bas. Utilisez une pipette de transfert pour tirer vers le haut la couche de Buffy blanche du tube. Combiner la couche Buffy de tous les tubes du même placenta en 1 tube. - Ajouter 10 mL de RPMI aux couches de Buffy combinées. Centrifuger pendant 10 min, 300 x g, à 4 ° c et jeter le surnageant.
2. isolement des cellules tueuses naturelles
- Resuspendre le culot cellulaire dans 50 μL de PBS glacé
- Ajouter l’anticorps de l’étiquette de la biotine sur les cellules granulées selon le protocole du fabricant et bien mélanger avec une pipette. Placer le tube dans un rotateur tubulaire et incuber 20 min à 4 ° c.
- Ajouter 1 mL de RPMI, centrifuger pendant 10 min à 400 x g et 4 ° c, et jeter le surnageant.
- Resuspendre le culot dans 1 mL de RPMI et le combiner avec 150 μL de billes magnétiques dans un tube de microcentrifugation de 1,5 mL. Placer le tube de microcentrifugation dans un rotateur de tube et faire pivoter tout en incubant pendant 30 min à 4 ° c.
Remarque: Retirer le tampon de dégagement à ce moment et permettre d’atteindre RT dans l’armoire de biosécurité. - Placer les tubes dans l’aimant pendant 1 min. collecter le surnageant et sauver la population de la cellule-4 dans un tube de 15 mL sur la glace.
Remarque: Il s’agit de la population de cellules. - Retirer le tube de l’aimant et ajouter 1 mL de RPMI. Mélanger les cellules et les billes 5 fois avec une pipette.
- Répétez l’étape 2,5.
- Centrifuger la population de cellules de 1 à 10 min à 400 x g et 4 ° c et jeter le surnageant. Resuspendre le culot cellulaire dans 50 μL de PBS glacé
- Ajouter l’anticorps CD161a marqué par la biotine aux cellules de la base du protocole du fabricant et bien mélanger. Placer le tube dans un rotateur tubulaire et incuber pendant 20 min à 4 ° c.
- Ajouter 1 mL de RPMI, centrifuger pendant 10 min à 400 x g et 4 ° c, et jeter le surnageant. Resuspendre le culot dans 1 mL de RPMI et le combiner avec 150 μL de billes magnétiques dans un tube de microcentrifugation de 1,5 mL.
- Placer le tube de microcentrifugation dans un rotateur de tube et faire pivoter tout en incubant pendant 30 min à 4 ° c.
- Placer les tubes dans un aimant pendant 1 min. collecter le surnageant et jeter les cellules de la CD -/cd161a.
- Retirer le tube de l’aimant et ajouter 1 mL de RPMI. Mélanger les cellules et les billes 5 fois avec une pipette.
- Répétez l’étape 2,12.
- Retirer les tubes de microcentrifugation de l’aimant et ajouter 1 mL de tampon de dégagement RT. Placer le tube sur le rotateur de tube et faire pivoter tout en incubant pendant 15 min à RT.
- Placer les tubes dans l’aimant pendant 1 min. recueillir le surnageant dans un nouveau tube conique de 15 mL sur la glace.
Remarque: Il s’agit de la population des cellules NK. - Retirer le tube de l’aimant et ajouter 1 mL de RT RPMI. Mélanger les cellules et les perles 5 fois avec la pipette.
- Répétez l’étape 2,16, en plaçant le surnageant dans le même tube. Mélangez bien et prenez un échantillon de 20 μL pour compter les cellules
Remarque: Gardez le tube sur la glace. - Centrifugez les cellules 4-/Cd161a+ pendant 10 min, 400 x g à 4oC, puis enlevez le surnageant. Resuspendre les cellules dans le RPMI (10% FBS, 1% PEN/STREP, 2 ng/mL IL-2) et les semences à une concentration de 3 x 105 cellules/puits dans une plaque de 6 puits dans 2,5 ml de support d’activation de cellules NK. Incuber les cellules pour 48 h à 37 ° c, 5% CO2 dans un incubateur humidifié.
3. dosage de la cytotoxicité: récupération des cellules NK ou YAC1 de la culture ou des cellules de passage
Remarque: Toutes les étapes doivent être conduites sous le capot. Tous les tubes de cellules doivent être maintenus sur la glace en tout temps.
- Utilisez un pipettage sérologique en verre pour collecter les cellules YAC1 et les milieux de la fiole, placez-les dans un tube de 50 mL sur la glace et mélangez bien. Prenez 20 μL pour compter les cellules.
- Faire tourner les cellules YAC1 pendant 10 min à 300 x g et 4 ° c. Comptez les cellules pendant que celles-ci tournent.
- Ajouter la trypsine/EDTA à chaque puits dans une plaque de 6 puits de la cellule NK. Tapotez la plaque et placez-la dans l’incubateur.
- Après que les cellules ont incubé avec Trypsin/EDTA pendant ~ 5 min à 37 ° c, gratter la plaque/fiole avec un grattoir de plaque stérile. Ajouter 1 mL de NK Cell Media à chaque puits.
- Collectez des cellules et des milieux avec une pipette sérologique et collectez-les dans un tube de centrifugation de 15 mL. Prenez 20 μL pour compter les cellules.
- Faire tourner les cellules NK pendant 10 min, 400 x g à 4 ° c. Comptez l’échantillon de cellules de l’étape 3,5 pendant cette centrifugation.
Remarque: Voir les plaques de culture sous un microscope avant de les jeter pour s’assurer qu’il n’y a plus de cellules adhérant au fond des puits. Puisque l’expérience utilise des cellules NK et des cellules YAC1, assurez-vous de compter chacun séparément. - Compter les cellules et les resuspendre aux concentrations déterminées dans les essais d’optimisation pour tester le nombre approprié de ratio cible: effecteur. Ceci sera obtenu en résuspendant le culot dans les milieux correspondants pour faire les concentrations cellulaires suivantes: YAC1 à 4 x 105 cellules/ml et cellules NK à 2 x 107 cellules/ml.
4. dosage de la cytotoxicité: Protocole de dosage
- Utiliser un fond rond, la culture traitée plaque 96-Well pour mettre en place la plaque comme suggéré dans le tableau 1. Ce tableau montre les contrôles expérimentaux et 3 ensembles de colonnes expérimentales NK. Ceci peut être étendu à un total de 10 colonnes expérimentales NK dans une plaque de 96 puits.
- Centrifuger la plaque d’essai à 250 x g pendant 4 min pour être certain que l’effecteur et les cellules cibles sont en contact. Incuber la plaque 96-Well pendant 5 heures dans un incubateur humidifié de chambre à 37 ° c, 5% CO2 pour obtenir un ample contact entre les cellules cibles et effecteurs et la lyse cellulaire cible par les cellules effectrices.
Remarque: Le protocole peut être suspendu ici. - 45 min avant la récolte des surnageants, ajouter 10 μL de solution de lyse 10x dans les puits de libération maximale LDH de la cellule cible (puits 1E, 1F, 1G et 1H) et remettre la plaque dans la chambre humidifiée.
- Une fois le temps d’incubation terminé, Centrifugez la plaque à 250 x g pendant 4 min. à l’aide d’un pipetteur multicanal, transférez 50 μL d’aliquotes de tous les puits vers une plaque d’essai à fond plat de 96 puits fraîche.
Remarque: Ne touchez pas le fond des puits pour que les cellules ne soient pas transférées dans la plaque d’essai fraîche. Ne pas utiliser de plaque de culture traitée comme plaque d’essai fraîche. -
Faire un réactif de dosage.
- Après le tampon de dosage a atteint la température ambiante, ajouter 12 mL de tampon de dosage à une bouteille de substrat Mix. Inversez et secouez doucement jusqu’à dissolution complète. 1 bouteille suffit pour 2 96 plaques de puits.
Remarque: Le tampon de dosage doit être protégé de la lumière tout en étant dégelé. Mélanger immédiatement avant l’utilisation.
- Après le tampon de dosage a atteint la température ambiante, ajouter 12 mL de tampon de dosage à une bouteille de substrat Mix. Inversez et secouez doucement jusqu’à dissolution complète. 1 bouteille suffit pour 2 96 plaques de puits.
- Ajouter 50 μL de réactif de dosage à tous les puits de la plaque d’essai à partir de l’étape 4,6. Recouvrir la plaque d’une feuille de papier pour la protéger de la lumière et incuber pendant 30 min à température ambiante.
Remarque: Le réactif de dosage nouvellement fabriqué doit être stocké dans un congélateur. Le réactif est bon pendant environ 8 semaines. - Ajouter 50 μL de solution d’arrêt à chaque puits. Lire la plaque dans 1 heure après avoir ajouté la solution d’arrêt et enregistrer l’absorbance à 490 nm. Les données représentatives sont présentées dans le tableau 2.
5. calcul des résultats
- Calculez la valeur moyenne de l’absorbance à partir des puits de fond de milieu de culture et soustrayez de toutes les valeurs d’absorbance pour les puits expérimentaux, les cellules cibles spontanées de libération de LDH et les cellules effectrices spontanées de libération de LDH.
- Calculez les valeurs moyennes d’absorbance pour les puits de contrôle de correction de volume et soustrayez des valeurs d’absorbance acquises pour les puits de contrôle de libération maximale de la cellule cible LDH.
- Utilisez les valeurs corrigées des étapes 5,1 et 5,2 dans la formule suivante pour calculer le pourcentage de cytotoxicité pour chaque effecteur: puits cible.
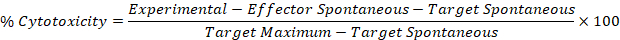
Résultats
Les cellules NK placentaires obtenues à partir de rats NP et RUPP ont été incubées pendant 5 h avec des cellules cibles dans leurs médias respectifs, à un ratio de 50:1 (NK: target). L’absorbance a été enregistrée à 490 nm et les données brutes sont indiquées dans le tableau 2. On a calculé l’absorbance moyenne du fond de milieu de culture et des puits de contrôle de correction de volume. Ces moyennes ont été soustraites des puits appropriés indiqués dans le protocole du fabricant e...
Discussion
Il y a un certain nombre de notes clés importantes à considérer pour des résultats optimaux. La stérilité des cellules utilisées est très importante. Après la collecte du placenta, il est important que la préparation et l’isolement des cellules NK soient effectuées dans des conditions stériles dans un cabinet de biosécurité. En outre, parce que toutes les cellules libèrent LDH sur les dommages cellulaires, il faut prendre soin d’obtenir une grande viabilité des cellules NK après l’isolement et Pend...
Déclarations de divulgation
Aucun conflit d’intérêts, financier ou autre, n’est déclaré par les auteurs.
Remerciements
Ce travail a été appuyé par l’Institut national de cardiopathie et de sang des instituts nationaux de la santé sous la subvention R00HL130456, l’Institut national des sciences médicales générales des instituts nationaux de la santé sous le prix P20GM104357, et par le Mississippi INBRE, financé par un prix de développement institutionnel (IDeA) des instituts nationaux de sciences médicales générales des instituts nationaux de la santé sous le numéro de subvention P20GM103476. Le contenu est uniquement de la responsabilité des auteurs et ne représente pas nécessairement les vues officielles des instituts nationaux de la santé.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
Références
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon